Uji Pemahaman Diri Sifat Koligatif 2 210802 083327
Diunggah oleh
Hendrawan SaputraJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Uji Pemahaman Diri Sifat Koligatif 2 210802 083327
Diunggah oleh
Hendrawan SaputraHak Cipta:
Format Tersedia
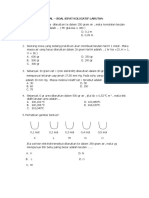
UJI PEMAHAMAN DIRI
SIFAT KOLIGATIF LARUTAN ELEKTROLIT
27. Manakah yang mempunyai titik didih yang lebih tinggi, larutan urea 0,1 M
atau larutan NaCl 0,1 M ? Jelaskan
28. Urutkan larutan2 berikut berdasarkan kenaikan titik didihnya dan titik
bekunya : NaCl 0,1 m; CH3COOH 0,1 m; C6H12O6 0,1 m; BaCl2 0,1 m
31. Larutan 6 gram suatu elektrolit biner dalam 100 gram air membeku pada
−20C. Massa molekul relative zat tersebut adalah 60. Tentukan derajad ionisasi
elektrolit tersebut (Kf air = 1,860C/m)
10. Pada larutan yang mengandung 0,08 mol suatu zat nonelektrolit A dalam
300 gram air dicampurkan 0,1 mol zat nonelektrolit B dalam 500 gram air.
Berapa titik didih campuran kedua larutan tersebut. (Kb air = 0,520C/m)
100,1170C
Latihan 1.5
5. Sebanyak 60 gram urea (Mr=60); 11,7 gram NaCl (Mr=58,5); dan 11,1 gram
CaCl2 (Mr=111) dilarutkan ke dalam 1 liter air. Tentukan titik beku larutan
tersebut. (Kf air =1,860C/m)
35. Suatu larutan infus dalam tiap liter mengandung 0,2 gram CaCl2.2H2O; 0,3
gram KCl; 6 gram NaCl; dan 3,1 gram Na-laktat (NaC3H5O3).
A. Tentikan tekanan osmotic larutan tersebut pada 370C
B. Pada suhu yang sama, tekanan osmotic darah manusia adalah sekitar 7,4
atm. Apakah larutan infus tersebut isotonic, hipotonik, atau hipertonik dengan
darah ? (Ar H=1 C=12 O=16 Na=23 Cl=35,5 R=0,082 L atm mol-1K-1 )
29. Larutan A dibuat dengan melarutkan 4,16 g BaCl2 (Mr=208) ke dalam 2 kg
air. Ba-klorida terdisosiasi sempurna dalam air. Lartuan B dibuat dengan
melarutkan 15 g zat organic nonelektrolit ke dalam 1 kg air. Pada tekanan yang
sama Δtb larutan B = 2Δtb larutan A. Tentukan massa molekul relative zat
organic tesebut. (250)
Anda mungkin juga menyukai
- LKS 1 XII KoligatifDokumen1 halamanLKS 1 XII KoligatifEka Putri LestariBelum ada peringkat
- TITIK BEKU LARUTAN MAGNESIUM HIDROKSIDADokumen9 halamanTITIK BEKU LARUTAN MAGNESIUM HIDROKSIDARhamudie D. LuffyBelum ada peringkat
- LKPD Pertemuan 1Dokumen2 halamanLKPD Pertemuan 1I Gede Nova DigayanaBelum ada peringkat
- SOAL KIMIADokumen2 halamanSOAL KIMIAErica MooreBelum ada peringkat
- Koligatif LarutanDokumen13 halamanKoligatif LarutansalsabilaBelum ada peringkat
- Kimdas Daya Hantar Listrik EncantedDokumen14 halamanKimdas Daya Hantar Listrik EncantedNadya HartasiwiBelum ada peringkat
- Tugas KimiaDokumen108 halamanTugas KimiaAl-Ihzan L.Belum ada peringkat
- PO 7 KIMIA - ALC Indonesia (WWW - Defantri.com)Dokumen10 halamanPO 7 KIMIA - ALC Indonesia (WWW - Defantri.com)Stephen PramatyaBelum ada peringkat
- Penugasan Mandiri Sifat Kligatif Larutan Elektrolit Kls XII 2021Dokumen9 halamanPenugasan Mandiri Sifat Kligatif Larutan Elektrolit Kls XII 2021sastra gunawan paneBelum ada peringkat
- Sifat Koligatif LarutanDokumen81 halamanSifat Koligatif LarutanDevi permata sariBelum ada peringkat
- Soal Sifat Koligatif Larutan 1Dokumen2 halamanSoal Sifat Koligatif Larutan 1Mardianto Ra'bangBelum ada peringkat
- Fixx 222Dokumen6 halamanFixx 222Dinda Ristiani PutriBelum ada peringkat
- Soal Sifat Koligatif (PG)Dokumen5 halamanSoal Sifat Koligatif (PG)Ryuo GamingBelum ada peringkat
- SIFAT KOLIGATIF LARUTANDokumen8 halamanSIFAT KOLIGATIF LARUTANnur syabaniawatiBelum ada peringkat
- Bulanan I Seri 2Dokumen2 halamanBulanan I Seri 2Sondang SimamoraBelum ada peringkat
- Makalah Tekfar Steril p3 FixDokumen12 halamanMakalah Tekfar Steril p3 FixNiluh Komang Tri Andyani0% (1)
- 1 - Soal Koligatif ElektrolitDokumen2 halaman1 - Soal Koligatif ElektrolitLily AndilaBelum ada peringkat
- Sifat Koligatif LarutanDokumen21 halamanSifat Koligatif LarutanAriinal AmiinBelum ada peringkat
- Contoh SoalDokumen6 halamanContoh SoalFatma MaharaniBelum ada peringkat
- Soal Larutan Penyangga Dan Titrasi Asam BasaDokumen2 halamanSoal Larutan Penyangga Dan Titrasi Asam BasaMood BoosterBelum ada peringkat
- Sifat koligatif larutan penurun dan peningkatan titik didih serta bekuDokumen6 halamanSifat koligatif larutan penurun dan peningkatan titik didih serta bekunur SehasariBelum ada peringkat
- LKS. 7 Sifat Koligatif Larutan ElektrolitDokumen2 halamanLKS. 7 Sifat Koligatif Larutan Elektrolitmasjid darulfaizinBelum ada peringkat
- Bab 11 Sifat Koligatif LarutanDokumen10 halamanBab 11 Sifat Koligatif LarutanYoo HooBelum ada peringkat
- Soal Kimia Sifat KoligatifDokumen1 halamanSoal Kimia Sifat KoligatifMario JoelBelum ada peringkat
- Sifat Koligatif LarutanDokumen1 halamanSifat Koligatif LarutanMario JoelBelum ada peringkat
- Extra Lesson - Soal Sifat Koligatif+KunciDokumen5 halamanExtra Lesson - Soal Sifat Koligatif+KunciNadya NabilaBelum ada peringkat
- SOAL ULANGAN HARIAN 1 Kimia XIIDokumen1 halamanSOAL ULANGAN HARIAN 1 Kimia XIITamalia AndestaBelum ada peringkat
- Bank Soal Koligatif LarutanDokumen17 halamanBank Soal Koligatif LarutanNeneng RohayatiBelum ada peringkat
- Soal Uh Sifat Koligatif 2022Dokumen2 halamanSoal Uh Sifat Koligatif 2022Sofi SalsaBelum ada peringkat
- Bahanajar 1595245986Dokumen3 halamanBahanajar 1595245986Faiz YunafBelum ada peringkat
- Berikut ini adalah jawaban untuk soal-soal tersebut:1. c2. d 3. b4. a5. a6. 3,5 atm7. dDokumen37 halamanBerikut ini adalah jawaban untuk soal-soal tersebut:1. c2. d 3. b4. a5. a6. 3,5 atm7. dLaela Wihdatul ArifahBelum ada peringkat
- Titrasi Asam BasaDokumen20 halamanTitrasi Asam BasaDian Ayu LestariBelum ada peringkat
- SIFAT KOLIGATIF LARUTANDokumen2 halamanSIFAT KOLIGATIF LARUTANKusuma JayaBelum ada peringkat
- Soal Sifat Koligatif BSE 1Dokumen2 halamanSoal Sifat Koligatif BSE 1rahmaBelum ada peringkat
- Tugas Bab 6Dokumen3 halamanTugas Bab 6baihakim mustopaBelum ada peringkat
- SOAL UH Sifat KoligatifDokumen3 halamanSOAL UH Sifat KoligatifMrOneBelum ada peringkat
- SIFAT KOLIGATIFDokumen23 halamanSIFAT KOLIGATIFIntan S MentariBelum ada peringkat
- Soal RemedialDokumen2 halamanSoal Remedialkimi0% (1)
- PH KoligatifDokumen1 halamanPH KoligatifLuthfa Evrilia afsantiBelum ada peringkat
- Bab 3Dokumen9 halamanBab 3wahyu setyaningrumBelum ada peringkat
- Soal SKL A dan BDokumen4 halamanSoal SKL A dan Bdede rohayahBelum ada peringkat
- Lampiran 3 (Soal)Dokumen9 halamanLampiran 3 (Soal)havizhahBelum ada peringkat
- Koligatif LarutanDokumen2 halamanKoligatif LarutanmirdaprismaBelum ada peringkat
- Kaligatif LarutanDokumen16 halamanKaligatif LarutanIkbal MaulanaBelum ada peringkat
- Mempelajari Larutan dan KoloidDokumen3 halamanMempelajari Larutan dan KoloidDinda OktianaBelum ada peringkat
- LAPRAK KIMFIS II Ionisasi AsamDokumen9 halamanLAPRAK KIMFIS II Ionisasi AsamAkaneBelum ada peringkat
- HCL CH3COOHlindaDokumen15 halamanHCL CH3COOHlindaLinda Trivana HavanaBelum ada peringkat
- Bab 11 Sifat Koligatif LarutanDokumen5 halamanBab 11 Sifat Koligatif LarutanDaniel BoenfieBelum ada peringkat
- Optimized Titles for Concentration ProblemsDokumen3 halamanOptimized Titles for Concentration ProblemsJessika SinulinggaBelum ada peringkat
- Larutan Elektrolit p3 Kel.e2Dokumen12 halamanLarutan Elektrolit p3 Kel.e2NissBelum ada peringkat
- SOAL KIMIADokumen4 halamanSOAL KIMIAabel HimappkaBelum ada peringkat
- Kimia Klompok 1 LDokumen17 halamanKimia Klompok 1 LAli SamudraBelum ada peringkat
- Soal-Soal Larutan KI1201Dokumen4 halamanSoal-Soal Larutan KI1201Fikka Anastasia100% (2)
- Sifat Koligatif Larutan ElektrolitDokumen5 halamanSifat Koligatif Larutan ElektrolitfannyaliyaBelum ada peringkat
- Soal LarutanDokumen14 halamanSoal LarutanRPL MJPS 3 TasikmalayaBelum ada peringkat
- Uh SKLDokumen1 halamanUh SKLindahdasanaBelum ada peringkat
- Scola - Learning Management SystemDokumen15 halamanScola - Learning Management SystemHendrawan SaputraBelum ada peringkat
- Lansoprazol FixDokumen3 halamanLansoprazol FixHendrawan SaputraBelum ada peringkat
- Luminal RevisiDokumen1 halamanLuminal RevisiHendrawan SaputraBelum ada peringkat
- 14 UmumDokumen14 halaman14 UmumHendrawan SaputraBelum ada peringkat
- Kation Golongan IDokumen4 halamanKation Golongan IHendrawan SaputraBelum ada peringkat
- Petunjuk Prakt Analisis SpektroskopiDokumen6 halamanPetunjuk Prakt Analisis SpektroskopiHendrawan SaputraBelum ada peringkat
- 9 StarsDokumen3 halaman9 StarsHendrawan SaputraBelum ada peringkat
- DETEKSI KATION LOGAM DENGAN REAKSI KIMIADokumen10 halamanDETEKSI KATION LOGAM DENGAN REAKSI KIMIAHendrawan SaputraBelum ada peringkat
- DETEKSI KATION LOGAM DENGAN REAKSI KIMIADokumen10 halamanDETEKSI KATION LOGAM DENGAN REAKSI KIMIAHendrawan SaputraBelum ada peringkat
- Berpindah TanganDokumen1 halamanBerpindah TanganHendrawan SaputraBelum ada peringkat
- Petunjuk Prakt Analisis SpektroskopiDokumen6 halamanPetunjuk Prakt Analisis SpektroskopiHendrawan SaputraBelum ada peringkat
- LuminalDokumen1 halamanLuminalHendrawan SaputraBelum ada peringkat
- Baptisan Yohanes Mempersiapkan Jalan untuk MesiasDokumen33 halamanBaptisan Yohanes Mempersiapkan Jalan untuk MesiasHendrawan SaputraBelum ada peringkat
- 9 StarsDokumen3 halaman9 StarsHendrawan SaputraBelum ada peringkat
- Ucapkanlah Sekali Lagi!Dokumen1 halamanUcapkanlah Sekali Lagi!Hendrawan SaputraBelum ada peringkat
- Uang-John WesleyDokumen7 halamanUang-John WesleyHendrawan SaputraBelum ada peringkat
- 12 - Benzena Dan TurunannyaDokumen3 halaman12 - Benzena Dan TurunannyaHendrawan SaputraBelum ada peringkat
- 4162 Melalui Pertobatan Menuju ImanDokumen28 halaman4162 Melalui Pertobatan Menuju ImanHendrawan SaputraBelum ada peringkat
- 4160 Meletakkan DasarDokumen28 halaman4160 Meletakkan DasarHendrawan SaputraBelum ada peringkat
- Iman dan PerbuatanDokumen22 halamanIman dan PerbuatanHendrawan SaputraBelum ada peringkat
- Buatan Dia Sendiri Dan Dibeli Kembali Oleh-NyaDokumen1 halamanBuatan Dia Sendiri Dan Dibeli Kembali Oleh-NyaHendrawan SaputraBelum ada peringkat
- Puji-Pujian Yang Bersifat MenularDokumen1 halamanPuji-Pujian Yang Bersifat MenularHendrawan SaputraBelum ada peringkat
- Berjuang Untuk Mendapatkan Apa Yang DijanjikanDokumen1 halamanBerjuang Untuk Mendapatkan Apa Yang DijanjikanHendrawan SaputraBelum ada peringkat
- Pertanda Rasa Berterima KasihDokumen1 halamanPertanda Rasa Berterima KasihHendrawan SaputraBelum ada peringkat
- Puji-Pujian Di Tengah Gurun PasirDokumen1 halamanPuji-Pujian Di Tengah Gurun PasirHendrawan SaputraBelum ada peringkat
- MEMPERKUAT KEYAKINANDokumen39 halamanMEMPERKUAT KEYAKINANHendrawan SaputraBelum ada peringkat
- Pengurbanan Yang Sangat MahalDokumen1 halamanPengurbanan Yang Sangat MahalHendrawan SaputraBelum ada peringkat
- Dimerdekakan Oleh Kayu SalibDokumen1 halamanDimerdekakan Oleh Kayu SalibHendrawan SaputraBelum ada peringkat
- Bibir Yang Mengucapkan Terima KasihDokumen1 halamanBibir Yang Mengucapkan Terima KasihHendrawan SaputraBelum ada peringkat