Bilangan Oksidasi
Diunggah oleh
Bastian Neonane0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
11 tayangan4 halamanJudul Asli
BILANGAN OKSIDASI
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
11 tayangan4 halamanBilangan Oksidasi
Diunggah oleh
Bastian NeonaneHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 4
BILANGAN OKSIDASI
A. Kompetensi Dasar:
3.3 Menyetarakan persamaan reaksi redoks.
4.3 Menentukan urutan kekuatan pengoksidasi atau pereduksi
berdasarkan data hasil percobaan.
B. Tujuan :
1. Menentukan bilangan oksidasi unsure atau atom dalam suatu
senyawa.
2. Menjelaskan perkembangan konsep bilangan oksidasi.
3. Menentukan oksidator dan reduktor.
1.Konsep Bilangan oksidasi:
Bilangan positif atau negatif yang diberikan pada suatu atom atau
unsure
dalam suatu senyawa.
Misalnya : KBr = K b.o = +1 dan Br b.o = -1
H2O = H b.o = +1 x 2= +2 dan O b.o = -2
2.Perkembangan konsep bilangan Oksidasi :
a. Pengertian reaksi redoks di tinjau dari penggabungan dan
pelepasan
oksigen.
●Reaksi oksidasi adalah reaksi penggabungan atau pengikatan
oksigen
oleh suatu zat.
Contoh : - 2Cu (s) + O2(g) 2CuO(s)
-C(s) + O2(g) CO2(g)
●Reaksi Reduksi adalah reaksi pelepasan oksigen dari suatu oksida.
Contoh : - CuO(s) H2(g) Cu(s) + H2O (l)
-2FeO(s) + C(s) 2Fe(s) + CO2(g)
b.Pengertian reaksi redoks di tinjau dari serah terima electron.
●Reaksi oksidasi adalah reaksi pelepasan electron.
Contoh : - Mg(s) Mg2+(aq) + 2e
●Reaksi reduksi adalah reaksi penangkapan atau penerimaan
electron.
Contoh : -Zn2+(aq) + 2e Zn(s
-Cl2(g) + 2e 2Cl-(aq)
c. Pengertian reaksi redoks di tinjau dari peningkatan dan penurunan
bilangan oksidasi.
●Reaksi oksidasi adalah reaksi dimana suatu zat mengalami
kenaikkan
bilangan Oksidasi (akibat pelepasan electron).
Contoh : - Mg(s) Mg2+(aq) + 2e
-Zn (s) Zn2+(aq) + 2e
●Reaksi reduksi adalah reaksi dimana suatu zat mengalami
penurunan
bilangan oksidasi ( akibat penangkapan / penerimaan electron).
Contoh : - S(s) + 2 e S2-(aq)
-I2(s) + 2e 2I-(aq)
3.Penentuan Bilangan Oksidasi :
Adapun aturan penentuan bilangan oksidasi sebagai berikut :
1.Spesi yang berbiloks nol untuk :
-Unsur bebas, misalnya : Fe, Na, Cu,Mg, S,K,dst.
-Molekul Unsur,misalnya : O2, H2, N2,Cl2, F2,Br2,I2, O3, P4, dst.
-Molekul netral, misalnya : NaCl, KBr, NaOH, dst.
2. Biloks H = +1, kecuali pada senyawa Hidrida biloks H = -1.
Contoh : HCl Biloks H = +1 .
senyawa Hidrida misalnya NaH,MgH2,CaH2,BaH2,AlH3 biloks H
=-1
3. Biloks O = -2, misalnya H2O biloks O = -2,
kecuali pada :
- senyawa Peroksida biloks O = -1,Misalnya H2O2, Na2O2
biloks =+1 .
- Senyawa Superoksida biloks O = - ½ ,misalnya KO2, RbO2,
CsO2
- Senyawa Oksiflorida biloks O = +2, misalnya OF2 .
4. Biloks Ion logam utama = golongan (IA – IIIA),
contoh: Na+ → Gol. IA, maka biloks ion = +1
Mg2+ → Gol. IIA, maka biloks ion = +2
Al3+ → Gol. IIIA, maka biloks ion = +3
5.Biloks suatu Ion = muatan ionnya.
misalnya : -Fe2+, maka biloks Fe = +2 - PO4-3 , maka biloks PO4
=-3
-Cl- , maka biloks Cl = -1 - C2O42- , maka biloks
C2O4 = -2
-SO4 2- ,maka biloks SO4 = -2
6. Jumlah biloks seluruh atom dalam suatu atom netral = 0.
Contoh :
1. Tentukan bilangan oksidasi dari :
a. C dalam CH4
b. S dalam H2SO4
c . Mn dalam MnO4-
d. Cr dalam Cr2O72-
Jawab :
a.Biloks H = +1 x 4 = +4, maka biloks C = -4.
b.Biloks S = (2 x biloks H ) + ( 1 x biloks S ) + ( 4 x biloks O )
=0
=( 2 x (+1) ) + ( 1 x b.o S ) + ( 4 x (-2 ) =0
= ( +2 ) + (1 x b.o S ) + ( (-8 ) ) = 0
= +2 + ( 1 x b.o S) – 8 = 0, maka biloks S = +6
c.( 1 x biloks Mn) + (4 x biloks O) = muatan ion
(1 x biloks Mn) + (4 x biloks O) = -1
Biloks Mn + (4 x (-2)) = -1
Biloks Mn + ( - 8 ) = -1
Biloks Mn = -1 + 8
Biloks Mn = +7, jadi biloks Mn = +7
d.( 2 x biloks Cr ) + (7 x biloks O ) = -2
( 2 x biloks Cr ) + 7 x ( -2 ) = -2
( 2 x biloks Cr) + ( -14 ) = -2
2 x Cr = -2 + 14 = + 12
Biloks Cr = +12 / 2 = +6, jadi biloks Cr = +6.
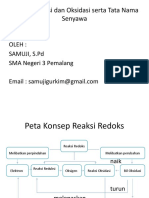
Reaksi redoks adalah reaksi kimia yang melibatkan perubahan
bilangan
oksidasi. Reaksi ini merupakan reaksi gabungan dari setengah
reaksi
reduksi dan setengah reaksi oksidasi.
Reaksi reduksi adalah reaksi penerimaan elektron sehingga terjadi
penurunan bilangan oksidasi, sedangkan reaksi oksidasi adalah
reaksi
pelepasan elektron sehingga terjadi kenaikan bilangan oksidasi.
Spesi yang mengalami oksidasi disebut reduktor dan spesi yang
mengalami reduksi disebut oksidator.
Pada suatu reaksi kimia yang lengkap, reaksi oksidasi selalu
diikuti oleh
reaksi reduksi ,sehingga reaksi yang terjadi disebut reaksi redoks.
Persamaan reaksi redoks dikatakan setara jika jumlah atom dan
jumlah
muatan di ruas kiri sama dengan jumlah atom dan jumlah muatan
di ruas
kanan. Pada dasarnya reaksi redoks berlangsung di dalam pelarut
air
sehingga penyetaraan persamaan reaksi redoks selalu melibatkan
+
ion H
–
dan OH . Terdapat dua metode untuk menyetarakan reaksi redoks,
yaitu dengan cara Perubahan bilangan oksidasi dan cara
setengah reaksi.
Anda mungkin juga menyukai
- Bab 1. Reaksi Reduksi & OksidasiDokumen10 halamanBab 1. Reaksi Reduksi & OksidasiArif FuadiBelum ada peringkat
- X 1 Konsep RedoksDokumen4 halamanX 1 Konsep RedoksdiahBelum ada peringkat
- BAB V. REdoksDokumen6 halamanBAB V. REdoksSafriana SafrianaBelum ada peringkat
- BAB 4. RedoksDokumen20 halamanBAB 4. RedokssuciBelum ada peringkat
- REDOKSDokumen4 halamanREDOKSIsra FahlizaBelum ada peringkat
- REAKSI REDOKS DAN TATA NAMADokumen6 halamanREAKSI REDOKS DAN TATA NAMAHikmatul FithryBelum ada peringkat
- BAB 4. RedoksDokumen22 halamanBAB 4. RedoksfarisBelum ada peringkat
- REAKSI REDOKSDokumen9 halamanREAKSI REDOKSErico HerlambangBelum ada peringkat
- Rx. Redoks DipakaiDokumen38 halamanRx. Redoks DipakaiEko ApriyantoBelum ada peringkat
- Materi Reaksi Redoks 1Dokumen6 halamanMateri Reaksi Redoks 1fitri aniBelum ada peringkat
- ElektrokimiaDokumen20 halamanElektrokimiayeniBelum ada peringkat
- Redoks Kls X 10Dokumen21 halamanRedoks Kls X 10Goesti-Putu Reza-kusumaBelum ada peringkat
- LKS KONSEP REAKSI REDOKS + JawabanDokumen2 halamanLKS KONSEP REAKSI REDOKS + JawabanIra Maya Tri MurningsihBelum ada peringkat
- Materi Reaksi Reduksi-Oksidasi (Redoks)Dokumen16 halamanMateri Reaksi Reduksi-Oksidasi (Redoks)IntanBelum ada peringkat
- Materi Reaksi Oksidasi Dan ReduksiDokumen7 halamanMateri Reaksi Oksidasi Dan ReduksiVICKY FEBRY WULANDARIBelum ada peringkat
- REAKSI REDOKS DAN TATA NAMA SENYAWADokumen62 halamanREAKSI REDOKS DAN TATA NAMA SENYAWAHesti Elsa PramauditaBelum ada peringkat
- 6 Reaksi Reduksi Oksidasi PDFDokumen7 halaman6 Reaksi Reduksi Oksidasi PDFFika Luthfiyana ArfiyantoBelum ada peringkat
- Konsep Redoks Dan Bilangan OksidasiDokumen22 halamanKonsep Redoks Dan Bilangan OksidasiEmi KurniasihBelum ada peringkat
- Reaksi Oksidasi ReduksiDokumen32 halamanReaksi Oksidasi ReduksigitaBelum ada peringkat
- Reaksi Oksidasi Dan ReduksiDokumen16 halamanReaksi Oksidasi Dan ReduksiDavid ArdiantoBelum ada peringkat
- Kimia SoalDokumen15 halamanKimia SoalUmmi Aida Adlina Siregar100% (1)
- Materi Kimia X Seri 17Dokumen5 halamanMateri Kimia X Seri 17Mwoya ige mwoyaBelum ada peringkat
- P13 - RedoksDokumen23 halamanP13 - RedoksichaBelum ada peringkat
- REAKSI REDUKSI Dan OKSIDASIDokumen5 halamanREAKSI REDUKSI Dan OKSIDASISabran SianturiBelum ada peringkat
- Redoks Berdasarkan Bilangan OksidasiDokumen7 halamanRedoks Berdasarkan Bilangan OksidasiKelompok 2 XI MIPA 5 Al KhwarizmiBelum ada peringkat
- Reaksi RedoksDokumen9 halamanReaksi RedoksMuhammad Firdaus Lana Ibnu Su'udBelum ada peringkat
- KimiaDokumen6 halamanKimiaSnowBelum ada peringkat
- Bab.7.Reaksi Reduksi Dan OksidasiDokumen10 halamanBab.7.Reaksi Reduksi Dan OksidasiDzurriya FadillaBelum ada peringkat
- REAKSI REDOKS DALAM KEHIDUPAN SEHARI-HARIDokumen50 halamanREAKSI REDOKS DALAM KEHIDUPAN SEHARI-HARIGina MartaBelum ada peringkat
- RedoksDokumen6 halamanRedoksIrma Nuryta PrisaBelum ada peringkat
- Redoks dalam Kehidupan Sehari-hariDokumen19 halamanRedoks dalam Kehidupan Sehari-hariPandan SafiraBelum ada peringkat
- Reaksi Reduksi Dan Oksidasi nnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnDokumen24 halamanReaksi Reduksi Dan Oksidasi nnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnntuzzBelum ada peringkat
- Redoks ReaksiDokumen3 halamanRedoks ReaksiChalifatulAshilahBelum ada peringkat
- RedoksDokumen13 halamanRedoksZAHRA MAULIDINAXI MIPA336Belum ada peringkat
- Reaksi Reduksi Dan OksidasiDokumen12 halamanReaksi Reduksi Dan OksidasiGita SipayungBelum ada peringkat
- Red-Oks Dan BiloksDokumen4 halamanRed-Oks Dan BiloksDante NathanaelBelum ada peringkat
- Aisyah Farkhiyatus Sholikhah - Resume KimiaDokumen4 halamanAisyah Farkhiyatus Sholikhah - Resume KimiaJamal AkbarBelum ada peringkat
- REDOKSDokumen21 halamanREDOKSliskaBelum ada peringkat
- Reaksi Reduksi OksidasiDokumen60 halamanReaksi Reduksi Oksidasiirzfile100% (1)
- BAB 7 REAKSI REDOKS. Proses Perkaratan BesiDokumen23 halamanBAB 7 REAKSI REDOKS. Proses Perkaratan BesiMelly Tri RahmiBelum ada peringkat
- RX RedoksDokumen11 halamanRX RedoksMuhammad RifqiBelum ada peringkat
- Reaksi RedoksDokumen18 halamanReaksi RedoksAsep SyahrilBelum ada peringkat
- REAKSI REDOKS DAN BILANGAN OKSIDASIDokumen8 halamanREAKSI REDOKS DAN BILANGAN OKSIDASIMiftahul JannahBelum ada peringkat
- Reduksi Oksidasi (Kimia Dasar)Dokumen35 halamanReduksi Oksidasi (Kimia Dasar)Fitria WulandariBelum ada peringkat
- Modul Reaksi Oksidasi Dan ReduksiDokumen12 halamanModul Reaksi Oksidasi Dan ReduksiSerafim pelembatas X IPA 1Belum ada peringkat
- Bab 11-Reaksi Redoks Dan ElektrokimiaDokumen35 halamanBab 11-Reaksi Redoks Dan ElektrokimialuhagustyaniBelum ada peringkat
- Konsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)Dokumen40 halamanKonsep Reaksi Redoks Dan Biloks (Review Materi Kelas 10)BuyungPranajayaBelum ada peringkat
- SOAL REDOKSDokumen4 halamanSOAL REDOKSWiwi FajriatiBelum ada peringkat
- Latihan Soal Redoks Dan StoikiometriDokumen38 halamanLatihan Soal Redoks Dan Stoikiometriabel HimappkaBelum ada peringkat
- KELAS 12 - Redoks Dan Elektrokimia - KorosiDokumen62 halamanKELAS 12 - Redoks Dan Elektrokimia - KorosiFanani LestariBelum ada peringkat
- RedoksDokumen13 halamanRedoksKafabiBelum ada peringkat
- 1.perkembangan Reaksi RedoksDokumen4 halaman1.perkembangan Reaksi RedoksProGram ChannelBelum ada peringkat
- KIMIA - Reaksi Redoks-1Dokumen19 halamanKIMIA - Reaksi Redoks-1elsaandriani884Belum ada peringkat
- REDOKS Dan ElektrokimiaDokumen46 halamanREDOKS Dan ElektrokimiaAnik YolandaBelum ada peringkat
- 1.reaksi RedoksDokumen25 halaman1.reaksi RedoksRARABelum ada peringkat