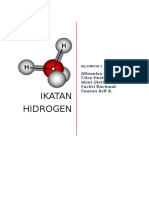
Ikatan Hidrogen
Diunggah oleh
Frengky AfrimirzaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Ikatan Hidrogen
Diunggah oleh
Frengky AfrimirzaHak Cipta:
Format Tersedia
Ikatan hidrogen
Ikatan hidrogen merupakan gaya tarik menarik antara atom H dengan atom lain yang mempunyai keelektronegatifan besar pada satu molekul dari senyawa yang sama. Tarikan antar molekul yang luar biasa kuatnya, dapat terjadi antara molekul-molekul, jika satu molekul mempunyai sebuah atom hidrogen yang terikat pada sebuah atom berelektronegativitas besar, dan molekul sebelahnya mempunyai sebuah atom berelektronegativitas tinggi yang mempunyai sepasang elektron menyendiri. Inti hidrogen, yakni proton ditarik oleh sepasang elektron yang bersebelahan bolak-balik antara kedua atom tersebut. Tarikan antara dua molekul yang menggunakan bersama-sama sebuah proton disebut Ikatan Hidrogen.
Gambaran Ikatan Hidrogen Intra Molekul. Ikatan hidrogen terbentuk hanya pada molekul yang mengandung nitrogen, oksigen ataupun flour.
Animasi diatas menunjukkan molekul kristal air (molekul polar) dalam bentuk liquid. Gaya tarik antara molekul polar yang mengandung hidrogen dengan pasangan elektron bebas dari molekul oksigen. Pada ikatan polar setiap atom hidrogen bermuatan agak positif sehingga dapat menarik elektron. Ikatan hidrogen menyebabkan titik didih dan titik leleh air tinggi bila dibandingkan molekul lain yang kecil tapi molekulnya nonpolar. Hidrogen+ tertarik dengan kuat pada pasangan mendiri yang mana hampir sama jika kamu memulai untuk membentuk ikatan koordinasi (kovalen dativ). Hal ini tidak terjadi sejauh itu, tetapi dayatarik lebih kuat dibandingkan dayatarik dipol-dipol yang biasa.
Ikatan hidrogen memiliki kekuatan sepersepuluh rata-rata ikatan kovalen, dan secara konstan diputushubungkan pada molekul air. Jika kamu mengibaratkan ikatan kovalen antara oksigen dan hidrogen sebagai hubungan pernikahan yang stabil, ikatan hidrogen hanya berstatus teman yang baik. Pada skala yang sama, dayatarik van der Waals hanya menunjukkan perkenalan belaka!
Pengaruh Ikatan Hidrogen Terhadap Titik Didih, Titik Leleh dan Kelarutan Senyawa
Tampak pada gambar diatas bahwa senyawa HF, H2O dan NH3 mempunyai titik didih yang luar biasa tinggi dibanding dengan anggota lainnya. Fakta ini menunjukkan bahwa dalam senyawa tersebut terdapat ikatan hidrogen. Ikatan jenis ini terjadi karena gaya elektrostatik yang khusus antara dipoldipol. Adanya ikatan hidrigen antarmolekul menyebabkan titik senyawa relatif lebih tinggi dibandingkan dengan senyawa lain yang memilki berat molekul sebanding. Titik didih senyaea golongna alkohol lebih tinggi daripada senyawa golongan alkana, demikian juga titik didih air lebih tinggidaripada aseton. Pengaruh ikatan hidrogen terhadap titik leleh tidak begitu besar karena pada wujud padat jarak antarmolekul cukup berdekatan dan yang paling berperan terhadap titik leleh adalah berat molekul zat dan bentuk simetris molekul. Senyawa yang mampu membentuk ikatan hidrogen dalam air akan mudah larut dalam air. Panjang atau pendeknya rantao karbon (gugus alkil-R) memiliki pengaruh terhadap kealrutan senyawa dalam air.
PENENTUAN KEKUATAN IKATAN HIDROGEN Pendahuluan
Ikatan hidrogen merupakan ikatan yang banyak kita jumpai di alam; misalnya ikatan pada protein, DNA, dan air. Adanya ikatan hidrogen menimbulkan sifat-sifat khusus pada senyawa; misalnya -helix pada protein dan double helix pada DNA. Ikatan hidrogen dibentuk pada waktu ikatan polar (misalnya: O-H atau N-H seperti pada Tabel 2.1) mengadakan interaksi dengan atom elektronegatif (misalnya oksigen, flour, atau klor). Interaksi ini dapat digambarkan sebagai berikut :
Tabel 2.1
Ikatan OH NH
Energi Ikatan, kJ/mol 463 391
Tujuan
1. memperlihatkan bahwa kekuatan ikatan hidrogen lebih kecil dibandingkan dengan ikatan kovalen (lihat tabel 2.1). 2. memperlihatkan bahwa ikatan yang terjadi dari suatu reaksi dapat diukur kekuatannya.
Pereaksi dan Alat-alat
- kalorimeter (volume 50 ml) - termometer 0 - 50OC (skala 0,2OC) - bahan isolasi - dua gelas ukur (25 mL) - kloroform, CHCl3 dan aseton (CH3)2CO atau metil etil keton C2H5(CH3)CO
- stopwatch
Prosedur Percobaan
1. Siapkan alat dan bahan yang akan dipakai yaitu kloroform, aseton, gelas ukur 25 ml 2 buah, kalorimeter, dan termometer 0 - 50 OC. 2. Pasanglah kalorimeter 3. Ukurlah 20 mL aseton dengan gelas ukur. 4. Masukkan aseton tersebut kedalam kalorimeter. 5. Kemudian ukurlah kloroform sebanyak 21,8 mL dengan gelas ukur lain setepat mungkin. 6. Setelah 30 detik suhu aseton dalam kalorimeter diamati sampai pada menit ke-4 (setiap kali mengukur suhu lakukan pengadukan ). 7. Ukurlah suhu kloroform sampai pada menit ke-4, tuanglah 21,8 mL kloroform ke dalam kalorimeter. 8. Amati suhu maksimum campuran dengan mencatat suhunya setiap 30 detik hingga menit ke-8 (jangan lupa mengaduk setiap kali mengamati suhu). 9. Agar lebih teliti buatlah kurva antara waktu dengan suhu sehingga diperoleh suhu maksimum yang tepat.
Data
Pengamatan
No. 1 2 3
Waktu(menit) 0 0,5 1,0
Suhu(oC) 29 29 29
Waktu(menit) 4,5 5,0 5,5
Suhu(oC) 39 38 37
4 5 6 7 8 9
1,5 2,0 2,5 3,0 3,5 4,0
29 29 29 29 29 Penambahan Kloroform
6,0 6,5 7,0 7,5 8,0
37 36 35 35 35
Anda mungkin juga menyukai
- IKATAN KIMIADokumen17 halamanIKATAN KIMIACahya50% (2)
- Ikatan H Aseton KloroformDokumen14 halamanIkatan H Aseton KloroformmachicattoBelum ada peringkat
- Free LimeDokumen40 halamanFree LimeFrengky AfrimirzaBelum ada peringkat
- Makalah AirDokumen10 halamanMakalah AirYuliana Purnamasari33% (3)
- Sampling D 4057 - D 5842Dokumen63 halamanSampling D 4057 - D 5842Frengky AfrimirzaBelum ada peringkat
- Siswa SMPDokumen5 halamanSiswa SMPFrengky AfrimirzaBelum ada peringkat
- IKATANHIDROGENDokumen20 halamanIKATANHIDROGENitsmeGYABelum ada peringkat
- Ikatan HidrogenDokumen7 halamanIkatan HidrogenAde Dwi R0% (1)
- Laporan Kimia Fisika Ikatan Hidroge1Dokumen13 halamanLaporan Kimia Fisika Ikatan Hidroge1Rizky Cahya PutraBelum ada peringkat
- IKATAN ANTARDokumen11 halamanIKATAN ANTARlii_yaa100% (2)
- Ikatan HidrogenDokumen11 halamanIkatan HidrogenDian Iswahyu HadiBelum ada peringkat
- Ikatan AntarmolekulDokumen127 halamanIkatan AntarmolekulRiza SeptianaBelum ada peringkat
- Ikatan HidrogenDokumen2 halamanIkatan HidrogenmusrinsalilaBelum ada peringkat
- 2 Ikatan Hidrogen FiksDokumen17 halaman2 Ikatan Hidrogen Fiksalbayssag1Belum ada peringkat
- Makalah IKATAN HIDROGEN Fina Citra Idzni Ojan AcilDokumen26 halamanMakalah IKATAN HIDROGEN Fina Citra Idzni Ojan AcilZahratul HayatiBelum ada peringkat
- Makalah IKATAN HIDROGEN Fina Citra Idzni Ojan AcilDokumen26 halamanMakalah IKATAN HIDROGEN Fina Citra Idzni Ojan AcilNovita YulianiBelum ada peringkat
- Ikatan HidrogenDokumen21 halamanIkatan HidrogenPutri SariBelum ada peringkat
- Ikatan HidrogenDokumen30 halamanIkatan HidrogenRoni Boni PakpahanBelum ada peringkat
- Fis8 GetgelbunyiDokumen18 halamanFis8 GetgelbunyiDwyPuspitaSariBelum ada peringkat
- Makalah Ikatan HidrogenDokumen18 halamanMakalah Ikatan HidrogenRahmad Aidil100% (1)
- Ikatan HidrogenDokumen6 halamanIkatan HidrogenMuhammad Andri100% (1)
- Ikatan HidrogenDokumen4 halamanIkatan HidrogenAliebi LeahBelum ada peringkat
- Makalah Ikatan Kimia Siap Print OkayyyyyyyyyyyyyDokumen27 halamanMakalah Ikatan Kimia Siap Print OkayyyyyyyyyyyyybinnieliciousBelum ada peringkat
- IKATAN HIDROGEN DAN SIFAT FISISDokumen4 halamanIKATAN HIDROGEN DAN SIFAT FISISLee MinsoekBelum ada peringkat
- Titik Leleh dan Faktor yang MempengaruhinyaDokumen16 halamanTitik Leleh dan Faktor yang Mempengaruhinyaannisa nisaBelum ada peringkat
- Ikatan HidrogenDokumen2 halamanIkatan HidrogenGita AnggaraBelum ada peringkat
- Tugas GeotekDokumen6 halamanTugas GeotekAugi ToriasaBelum ada peringkat
- Ikatan HidrogenDokumen4 halamanIkatan HidrogenSatriyo K. PalgunoBelum ada peringkat
- Massa Molekul Relatif AirDokumen3 halamanMassa Molekul Relatif AirErwin SaragihBelum ada peringkat
- Kimia AirDokumen19 halamanKimia AirWei YiBelum ada peringkat
- Ikatan Kovalen Polar Dan Non PolarDokumen6 halamanIkatan Kovalen Polar Dan Non PolarAgam VeruzualesBelum ada peringkat
- Ikatan Hidrogen and Van Der WallsDokumen3 halamanIkatan Hidrogen and Van Der WallsOhyiOhyoDes 24Belum ada peringkat
- Zat CairDokumen31 halamanZat CairTatiana S. PutriBelum ada peringkat
- IKATAN HIDROGEN DAN APLIKASINYADokumen28 halamanIKATAN HIDROGEN DAN APLIKASINYARidya RdyBelum ada peringkat
- IKATAN ANTARMOLEKULERDokumen8 halamanIKATAN ANTARMOLEKULERAdlimatul PutriBelum ada peringkat
- Pengaruh Gaya Antar Molekul Terhadap Sifat Fisis MolekulDokumen15 halamanPengaruh Gaya Antar Molekul Terhadap Sifat Fisis MolekulElvira DeswitaBelum ada peringkat
- Ikatan Hidrogen NewDokumen13 halamanIkatan Hidrogen NewMarlina Jeram SihombingBelum ada peringkat
- Ikatan Hidrogen Merupakan Ikatan Tambahan Berupa Daya Tarik Listrik Antara Atom Hidrogen Dengan Unsur Yang Sangat ElektronegatifDokumen2 halamanIkatan Hidrogen Merupakan Ikatan Tambahan Berupa Daya Tarik Listrik Antara Atom Hidrogen Dengan Unsur Yang Sangat ElektronegatifAditya ArintonBelum ada peringkat
- 03 04 03 Ikatan Hidrogen - ModulDokumen3 halaman03 04 03 Ikatan Hidrogen - ModulEka Aprilya MargaretaBelum ada peringkat
- GAYA INTERMOLEKULERDokumen8 halamanGAYA INTERMOLEKULERsayudibarokahBelum ada peringkat
- Anomali Dan Ik. HidrogenDokumen4 halamanAnomali Dan Ik. HidrogenlalaBelum ada peringkat
- Struktur dan Sifat Molekul AirDokumen5 halamanStruktur dan Sifat Molekul AirAugi ToriasaBelum ada peringkat
- Ikatan KimiaDokumen4 halamanIkatan KimiaIda Ayu Kesuma Dewi100% (1)
- Gaya Antar MolekulDokumen12 halamanGaya Antar MolekulFitrach Abdullah75% (8)
- Ikatan Dan Struktur MolekulDokumen37 halamanIkatan Dan Struktur Molekulmala saputriBelum ada peringkat
- Interaksi MolekulDokumen3 halamanInteraksi MolekulS Karlina SBelum ada peringkat
- Gaya Van Der Waals, Adhesi Dan KohesiDokumen7 halamanGaya Van Der Waals, Adhesi Dan KohesiRizka FebriantiBelum ada peringkat
- Ikatan HidrogenDokumen3 halamanIkatan HidrogenPoppy MinataBelum ada peringkat
- Modul 1 DahliaDokumen22 halamanModul 1 DahliahamdaniBelum ada peringkat
- EnnyDokumen12 halamanEnnyEnhykha SairnunyBelum ada peringkat
- Lap. Ikatan HidrogenDokumen14 halamanLap. Ikatan HidrogenRingga hasimBelum ada peringkat
- Sifat Fisika AldehidDokumen3 halamanSifat Fisika AldehidNisa MardiyahBelum ada peringkat
- TEORI MOLEKULDokumen34 halamanTEORI MOLEKULBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Gaya Antar MolekulDokumen15 halamanGaya Antar Molekulaulia chaniaBelum ada peringkat
- STOIKIOMETRIDokumen148 halamanSTOIKIOMETRIMuna LasenaBelum ada peringkat
- IKATAN HIDROGEN DALAM AIRDokumen8 halamanIKATAN HIDROGEN DALAM AIRDewiBelum ada peringkat
- H2-IKATANDokumen31 halamanH2-IKATANNurwinda Adha100% (1)
- GAYA ANTARMOLEKUL (2. Ikatan Hidrogen) - 1Dokumen4 halamanGAYA ANTARMOLEKUL (2. Ikatan Hidrogen) - 1dharuredsBelum ada peringkat
- Alkohol PaperDokumen12 halamanAlkohol PaperlistraBelum ada peringkat
- IKATAN HIDROGEN DALAM AIRDokumen3 halamanIKATAN HIDROGEN DALAM AIRLili AndiniBelum ada peringkat
- IKATAN KIMIADokumen35 halamanIKATAN KIMIADian Rahmawati100% (1)
- Ikatan KimiaDokumen4 halamanIkatan KimiapangiastikaBelum ada peringkat
- BAB I ProposalDokumen1 halamanBAB I ProposalFrengky AfrimirzaBelum ada peringkat
- Laporan HPLCDokumen10 halamanLaporan HPLCFrengky AfrimirzaBelum ada peringkat
- METABOLISME8Dokumen34 halamanMETABOLISME8duststoriesBelum ada peringkat
- AKREDITASIDokumen3 halamanAKREDITASIFrengky AfrimirzaBelum ada peringkat
- Penggunaan Pewarna Alami Daun Sirih GadiDokumen7 halamanPenggunaan Pewarna Alami Daun Sirih GadiFrengky AfrimirzaBelum ada peringkat
- Percobaan II Unsur Unsur Alkali TanahDokumen17 halamanPercobaan II Unsur Unsur Alkali TanahFrengky AfrimirzaBelum ada peringkat
- Metabolisme LipidDokumen17 halamanMetabolisme LipidMuhammad IqbalBelum ada peringkat
- Program TahunanDokumen3 halamanProgram TahunanFrengky AfrimirzaBelum ada peringkat
- Bab IDokumen2 halamanBab IFrengky AfrimirzaBelum ada peringkat
- Pantun NasehatDokumen4 halamanPantun NasehatC LeouBelum ada peringkat
- KorosiDokumen9 halamanKorosiFrengky AfrimirzaBelum ada peringkat
- RPP Teks Prosedur 35.45Dokumen11 halamanRPP Teks Prosedur 35.45Frengky AfrimirzaBelum ada peringkat
- Alkali TanahDokumen12 halamanAlkali Tanahtimah24Belum ada peringkat
- Tabel Analisis SKLDokumen13 halamanTabel Analisis SKLFrengky Afrimirza100% (1)
- Dokumen - Tips - Penetapan Kadar KarbohidratDokumen12 halamanDokumen - Tips - Penetapan Kadar KarbohidratGelasan Meong IIBelum ada peringkat
- Aktivasi EFIN KelompokDokumen6 halamanAktivasi EFIN KelompokAgus SalimBelum ada peringkat
- Analisis Timbal Dan Klorida (Otw)Dokumen26 halamanAnalisis Timbal Dan Klorida (Otw)Frengky AfrimirzaBelum ada peringkat
- Laju ReaksiDokumen2 halamanLaju ReaksiFrengky Afrimirza100% (1)
- Manfaat Kelapa Untuk KesehatanDokumen3 halamanManfaat Kelapa Untuk KesehatanFrengky AfrimirzaBelum ada peringkat
- SEJARAH ALFRED WERNERDokumen20 halamanSEJARAH ALFRED WERNERFrengky AfrimirzaBelum ada peringkat
- Tugas Praktek KewirausahaanDokumen14 halamanTugas Praktek KewirausahaanFrengky AfrimirzaBelum ada peringkat
- Laporan Kop 14,15,16Dokumen7 halamanLaporan Kop 14,15,16Frengky AfrimirzaBelum ada peringkat
- Struktur Organisasi KelasDokumen1 halamanStruktur Organisasi KelasFrengky AfrimirzaBelum ada peringkat
- REAKSI KIMIA DAN REDOKSDokumen24 halamanREAKSI KIMIA DAN REDOKSFrengky AfrimirzaBelum ada peringkat
- Perangkat Wali KelasDokumen6 halamanPerangkat Wali KelasFrengky AfrimirzaBelum ada peringkat
- Perangkat Wali KelasDokumen6 halamanPerangkat Wali KelasFrengky AfrimirzaBelum ada peringkat
- Perangkat Wali KelasDokumen6 halamanPerangkat Wali KelasFrengky AfrimirzaBelum ada peringkat