Obat Degenerasi SSP
Diunggah oleh
Anhi RamdhaniDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Obat Degenerasi SSP
Diunggah oleh
Anhi RamdhaniHak Cipta:
Format Tersedia
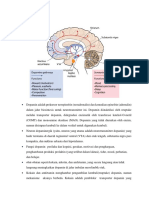
OBAT-OBAT PENYAKIT DEGENERASI SUSUNAN SARAF PUSAT
PENYAKIT PARKINSON Parkinson : - Bradikinesia (gerakan yang lamban) - Rigiditas otot - Tremor pada saat istirahat (yang biasanya menghilang saat melakukan gerakan volunter) - Kelainan postur tubuh yang dapat menyebabkan gait maupun jatuh Penyebab utama parkinsonisme idiopatik Patofisiologi Defisit utama yang terjadi dalam penyakit Parkinson ialah hilangnya neuron di substansia nigra pars kompakta sebagai penyediaan inervasi dopaminergik ke daerah striatum (kaudatus dan putamen). Biosintesis Dopamin. Dopamin sebgai katekolamin disintesis dalam terminal neuron dopaminergik yang asalnya dari tirosin. Tirosin ini ditransportkan melewati Blood Brain Barrier melalui proses aktif (gambar 22-3 dan 22-4). Rata-rata langkah pembatasan
sintesis dopamin ini ialah melalui konversi L-tyrosine menjadi Ldihiydroxylphenylalanine (L-DOPA), yang dikatalisa oleh enzim tyrosine hydroxylase yang berada di neuron katekolaminergik. LDOPA berulang-ulang dikonversi menjadi dopamin melalui Laminoacid decarboxlase aromatik. Pada terminal saraf dopaminergik, dopamin diambil oleh vesikel dengan cara transpor protein; proses ini diblok oleh reserpine sehingga resepin dapat menyebabkan deplesi dopamin. Pelepasan dopamine dari terminal saraf terjadi melalui eksositosis vesikel presinaps di mana proses ini dipicu oleh depolarisasi sehingga Ca2+ dapat masuk. Ketka dopamin sudah berada di celah sinaps, aksinya dapat dihentikan melalui reuptake dopamin oleh membran pembawa protein, suatu proses yang dilawan oleh obat-obatan seperti kokain. Cara lain ialah produk degradasi metabolik dopamin yakni oleh MAO dan Catechol-oacid methyltransferase (COMT) yang akan menghasilkan 2 buah 3,4-dehydroxyphenylacetic (DOPAC) dan 3-methoxy-4-hydroxyphenylacetic acid (HVA). Pada manusia HVA merupakan produk primer dari metabolisme dopamin (Coiper et al.,1996). Reseptor Dopamin. Aksi dopamin di otak diperantarai oleh reseptor protein dopamin (gambar 22-5). Dengan penggunaan teknik farmakologis, terdapat dua tipe reseptor dopamin. Reseptor
D1 akan menstimulasi sintesis second messenger cyclic AMP intrasel dan reseptor D2 menghambat sintesis cAMP serta mengurangi Ca2+ current dan mengaktivasi receptor-operated K+ current. Aplikasi genetika molekuler dalam studi reseptor dopamin telah mengungkapkan bentuk reseptor dopamin yang lebih kompleks dibanding yang sebelumnya diketahui. Saat ini, terdapat lima reseptor dopamin yang diketahui keberadaannya (lihat Jarvie dan Caron, 1993, dan bab 12). Reseptor dopamin memiliki keunggulan struktural tertentu, termasuk kehadiran 7 segmen helikal yang mampu memperketat membran sel. Adanya struktural ini memasukkan reseptor dopamin ke dalam superfamili dari reseptor protein dalam 7 regio transmembran, di mana di dalamnya termasuk reseptor neural penting seperti reseptor -adrenergik, reseptor olfaktoris, dan pigmen visual rhodopsin. Semua anggota superfamili ini beraksi melalui pengikat protein nukleotida guanin (G Protein; lihat bab 2). Kelima resepor dopamin ini dapat dibagi ke dalam dua grup atas dasar farmakologis dan strukturalnya (gambar 22-5). Protein D 1dan D5 memiliki ekor terminal karboksi entrasel yang panjang dan merupakan anggota khas D1; mereka menstimulasi pembentukan cAMP dan hidrolisis phosphatidyl inositol. Reseptor D2, D3, dan D4 sebagai loop intrasel ketiga yang besar dan berada di kelas D 2. Mereka menurunkan formasi cAMP dan memodulasi tegangan K+
dan Ca2+. Masing-masing dari kelima reseptor dopamin ini memiliki pola ekspresi anatomi yang berbeda di otak. Protein D 1 dan D2 yang berlimpah pada striatum merupakan reseptor sebagian besar terletak di terpenting sehubungan dengan penyebab dan terapi dari penyakit Parkinson. Protein D4dan D5 ektrastriatal, sementara ekspresi D3 rendah di daerah kaudatus dan putamen tetapi lebih berlimpah pada nukleus aeumheus dan tuberkel olfaktoris. Mekanisme persarafan Parkinsonisme. Usaha-usaha telah dilakukan dalam mencari pengertian mengenai bagaimana hilangnya input dopaminergik ke neuron neostriatum dapat menimbulkan gejala klinik Parkinson (untuk tinjauan lihat Albin et al. 1989; Mink dan Thach, 1993; dan Widiman dan De Long, 1993). Ganglia basal dapat dilihat sebagai modulatory side loop yang meregulasi jalannya informasi dari korteks serebral ke motor neuron medula spinalis (gambar 22-6). Neostriatum adalah bagian ganglia basal yang menerima input dari berbagai area di korteks. Sebgaian besar neuron yang berada di striatum merupakan neuron proyeksi yang menginervasi struktur ganglia basal lainnya. Terdapat sebuah grup neuron kecil yang penting yaitu interneuron yang menyambungkan antar neuron di striatum namun tidak memproyeksikan saraf-saraf di luar daerahnya. Asetilkolin sama halnya seperti neuropeptida digunakan sebgaai transmiter oleh
interneuron striatal. Arus keluar striatum melanjutkan diri melalui dua rute yang berbeda dikenal sebagai jalur langsung dan jalur tidak langsung. Jalur langsung dibentuk oleh neuron-neuron di striatum yang bersambungan langsung dengan ke empat keluaran basal ganglia, substansia nigra pars reticulata (SNpr) dan globus palidus medial (MGP); relai ke ventroanterior dan ventrolateal thalamus, yang menyediakan input eksitatoris ke korteks. Neurotransmiter dan kedua perhubungan tersebut adalah gammaaminobutyric acid (GABA), yang bersifat inhibitoris, sehingga efek murni dari stimulasi jalur direk dalam level striatum ialah untuk meningkatkan outflow eksitatoris dari thalamus ke korteks. Jalur indirek terbentuk dari neuron-neuron striatal yang memproyeksikan globus palidus lateral (LGP). Struktur ini pada akhirnya kaan mempersarafi Nukleus Subthalamus (STN), yang menyebabkan tersedianya tempat outflow ke SNpr dan MGP. Seperti halnya jalur direk, dua perhubungan yang pertama Projeksi striatum ke LGP atau LGP ke STN- menggunakan transmisi inhibitoris GABA; namun, perhubungan utama/terakhir projeksi dari STN ke SNpr dan MGP adalah merupakan jalur eksitatoris glutamanergik. Dan hasil efek keseluruhan atas stimulasi jalur indirek sebatas level striatum yaitu pengurangan outflow eksitatoris dari thalamus ke korteks serebri. Kunci utama mengetahui fungsi basal ganglia dihubungkan dengan gejala yang
timbul pada penyakit Parkinson akibat kurangnya neuron dopaminergik ialah efek diferential dopamin pada jalur direk dan indirek (gambar 22-7). Neuron dopaminergik substansia nigra pars compakta (SNpc) mensarafi seluruh bagian striatum; namun, neuron target di striatal memiliki ekspresi tipe-tipe reseptor dopamin yang berbeda. Ekspresi utama untuk jalur direk ialah Protein reseptor dopamin D1 yang eksitatoris sementara ekspresi untuk jalur indirek ialah D2 tipe inhibitoris. Selanjutnya, dopamin yang dilepaskan dari striatal cenderung akan meningkatkan aktivitas jalur direk dan mengurangi aktivitas jalur indirek, sementara deplesi dopamin pada penyakit Parkinson menyebabkan efek yang sebaliknya. Efek yangterjadi akibat kuangnya input dopamin pada Parkinson yaitu meningkatkan aktivitas inhibisi outflow SNpr dan MGP ke thalamus serta mengurangi eksitasi korteks motorik. Modal dari fungsi basal ganglia ini memiliki implikasi yang penting dalam pembuatan serta penggunaan obat farmakologis untuk penyakit Parkinson: Pertama untuk mengembalikan keseimbangan sistem dengan cara menstimulasi reseptor dopamin, dengan memanfaatkan efek komplementer dari reseptor D 1 dan D2 dengan pertimbangan adanya efek samping yang dapat terjadi akibat resepor D3, D4, dan D5. Kedua, mengganti dopamin bukan merupakan satu-satunya pendekatan dalam terapi Parkinson. Obat-
obat yang menghantar reseptor kolinergik telah lama digunakan dalam mengobati Parkinsonisme. Meskipun mekanisme aksinya belum sepenuhnya dimengerti namun tampaknya efek kerjanya ialah pada level neuron proyeksi striatal yang secara normal menerima input kolinergik dari interneuron kolinergik striatal. Tak ada ob yang berguna untuk mengobati Parkinsonisme yang cara kerjanya berdasarkan aksi reseptor GABA dan glutamat, meskipun keduanya juga memiliki peran penting di dalam ganglia basalis. Meski demikian, keduanya menjanjikan untuk pengembangan obat (Greenamyre and OBrien, 1991). Penanganan Penyakit Parkinson Obat medikasi yang umumnya dipakai untuk terapi penyakit Parkinson dirangkum dalam tabel 22-1. Levadopa. Levadopa (L-DOPA, LORODOPA, DIOPAR, L-3,4dihydroxyphenylalanine), merupakan prekursor metabolik untuk dopamin, merupakan agen tunggal yang paling efektif dalam pengobatan Parkinson. Levadopa sendiri bekerja lamban, efek terapi maupun efek samping merupakan hasil dari dekarboksilasi levadopa menjadi dopamin. Jika digunakan secara oral, levadopa diabsorbsi oleh usus halus dengan jalan sistem transport aktif untuk asam amino aromatik. Konsentrasi obat ini di dalam plasma biasanya berada antara 0,5 sampai 2 jam setelah dosis oral. Paruh
hidup di dalam plasma rendah (1 sampai 3 jam). Rata-rata dan tingkat absorbsi levadopa bergantung pada waktu rata-rata pengosongan lambung, pH keasaman lambung, dan jangka waktu di mana obat tersebut terpapar dengan enzim-enzim degradasi di lambung dan mukosa intestinal. Kompetisi absorbsinya di usus halus dngan asam-asam amino menyebabkan efek tertentu dalam absorbsi levadopa; levadopa yang diberi bersama-sama dengan waktu makan akan menunda penyerapan dan mengurangi konsentrasinya dalam plasma. Pemasukan obat ini ke SSP melalui sawar darah otak juga menggunakan proses akti oleh carrier asam amino aromatik, dan kompetisi antara protein dan levadopa juga berlangsung pada level ini. Levadopa dikonversi menjadi dopamin melalui cara dekarboksilasi, terutama di antara terminal-terminal presinaptik neuron dopaminergik pada striatum Dopamin yang diproduksi bertanggung jawab terhadap efektivitas dari obat. Setelah pelepasannya, maka ia akan ditransport kembali ke terminal dopaminergik melalui mekanisme uptake presinaptik atau oleh aksi metabolisme MAO dan COMT (Mouradian dan Chase, 1994). Dalam praktek modern, levadopa selalu dikombinasikan dengan Lamino acid decarboxylated seperti carbidopa atau benserazide. Levadopa yang diberikan secara tunggal akan didekarboksilasi oleh enzim mukosa usus dan oleh daerah perifer lainnya, akibatnya
hanya sedikit obat yang tidak berubah yang dapat mencapai sirkulasi otak dan mungkin kurang dari 1% yang dapat mempenetrasi SSP. Hal lain yang terjadi ialah levadopa yang berdar dalam sirkulasi sudah mengalami konversi perifer akan menghasilkan efek-efek yang tidak diinginkan, biasanya muntah. Inhibisi dekarboksilasi perifer akan menyebabkan peningkatan fraksi levadopa yang tidak dimetabolisir dan mampu melewati sawar darah otak dan akan mengurangi efek samping gastrointestinal. Pada kebanyakan individu, dosis per hari sebanyak 75 mg carbidopa sudah cukup untuk mencegah terjadinya nausea. Oleh karena alasan ini, obat yang paling sering diresepkan untuk Carbidopa/Levadopa (SINEMET, ATAMET) ialah bentuk 25/100, di mana isinya adalah 25 mg carbidopa dan 100 mg levadopa. Dengan formulasi ini, jadwal pemberian tiga tablet atau lebih sudah cukup untuk menginhibisi dekarboksilase. Sangat jarang seseorang membutuhkan dosis besar carbidopa untuk minimalisasi efek samping gastrointestinal, juga dengan pemberian carbidopa suplemental (LODOSYN) sendiri dapat bermanfaat. Terapi Levadopa dapat berefek dramatis kepada tanda dan gejala parkinson. Perbaikan terhadap tremor, rigiditas, dan bradikinesia dapat sempurna apabila pemberian terapi dalam awal perjalanan penyakit Parkinson. Pada Parkinson awal, efek levadopa yang
menguntungkan dapat melampaui paruh hidup obat di plasma, oleh karena sistem dopamin nigrostriatal memiliki kapasitas penyimpanan dopamin prinsip untuk menghindari penggunaan levadopa jangka panjang ialah karena dalam penggunaan jangka panjang kemampuan penyimpanan dopamin berangsur menghilang juga status motor pasien akan berfluktuasi dramatis setiap dosis pemberian levadopa. Masalah yang terjadi ialah adanya fenomena wearing off di mana pemberian dosis efektif levadopa akan memperbaiki mobilitas untuk beberapa waktu sampai 1-2 jam, tetapi rigiditas dan akinesia akan kembali selama interval dosis. Meningkatkan dosis dan frekuensi pemberian dapat memperbaiki situasi ini, tetapi hal ini juga terbatas oleh karena terbentuknya diskinesia, eksesif serta gerakan-gerakan abnormal. Diskinesia dapat dilihat lebih sering jika konsentrasi levadopa tinggi di dalam plasma, meski pada individu tertentu diskinesia ataupun distonia dapat terpicu apabila konsentrasinya meningkat maupun menurun. Pergerakan-pergerakan ini menjadi tidak menyenangkan dan menghambat sama halnya seperti rigiditas dan akinesia pada Parkinson. Pada tahap lebih lanjut, penderita dapat berfluktuasi dari menjadi off, tanpa efek menguntungkan pada terapi atau menjadi on tetapi dengan munculnya diskinesia yang menghambat, di mana situasi ini disebut fenomena on/off.
Bukti terkini menemukan bahwa terjadinya induksi fenomena on/off dan diskinesia bisa oleh karena proses adaptasi terhadap variasi kadar levadopa antara otak dan plasma yang berbeda. Proses adaptasi ini terlihat kompleks termasuk di dalamnya alterasi terhadap ekspesi reseptor dopamin tapi bukan hanya itu saja namun juga terjadi perubahan downstream sampai ke neuron post sinaps striatal termasuk perubahan/terjadinya modifikasi reseptor NMDA glutamat (Mouradian dan Chase, 1994; Chase, 1998). Saat kadar levadopa dipertahankan dengan cara menggunakan infus intravena, maka terjadinya diskinesia dan fluktuasi dapat berkurang drastis, sehingga perbaikan klinis dapat dipertahankan untuk beberapa hari berselang meskipun sudah menggunakan dosis oral levadopa. (Mouradian et al.,1990; Chae et al.,1994). Terdapat formulasi sustained release yang berisi carbidopa/levadopa dalam bentuk erodable wax matrix (SINAMEX CR) yang dipasarkan sebagai usaha untuk menghasilkan kadar plasma levadopa yang lebih stabil secara oral dibandingkan carbidopa/levadopa yang standar. Formula ini sangat membantu pada kasus-kasus tertentu namun absorbsi dari formula ini tidak sepenuhnya dapat diprediksi. Teknik lain yang dipergunakan untuk mencegah fenomena on/off ialah dengan cara menghitung jumlah dosis total carbidopa/levadopa dalam sehari kemudian membaginya dalam jumlah yang sama besar untuk setiap dua jam pemberian.
Pertanyaan penting yang belum terjawab pada pemberian levadopa pada Parkinson ialah apakah pengobatan ini dapat mengubah arah perjalanan penyakit dibandingkan hanya mengobati gejala (Agit et al.,1998). Dua aspek yang dilihat dalam pengobatan levadopa dan outcome PD dipermasalahkan di sini. Pertama, apabila produksi radikal bebas yang berasal dari metabolisme dopamin adalah penyebab matinya saraf nigrostriatal, maka penambahan levadopa ditakutkan akan mempercepat proses ini (Olanow, 1990) walaupun bukti-bukti kuat terjadinya hal ini belum ada. Kedua, akan terjadi efek yang tidak diinginkan seperti on/off dan wearing off fenomena pada pasien yang diterapi memakai levadopa, tetapi tidak diketahui jika penundaan terapi dengan levadopa akan menghambat kemunculan efek ini (Fahn, 1999). Atas ketidakpastian ini, kebanyakan praktisi telah mengadopsi pendekatan pragmatik, yaitu menggunakan levadopa hanya ketika gejala Parkinson menyebabkan gangguan fungsional. Selain terjadinya fluktuasi motoris dan nausea, terdapat juga efek samping lain yang dapat terjadi pada pengobatan levadopa. Umumnya efek samping yang terjadi yaitu adanya induksi halusinasi dan konfusi. Efek samping ini biasanya muncul pada orang lanjut usia serta pada mereka yang mengalami disfungsi kognitif pre-eksisting dan hal ini sering menghambat terapi yang adekuat untuk gejala-gejala Parkinsonian. Agen antipsikotis
konvensional seperti fenotiazin sangat efektif melawan psikosis akibat levadopa, namun obat ini dapat memperburuk penyakit Parkinsonisme mungkin oleh karena kerja obat ini pada reseptor D2. Cara baru saat ini ialah dengan menggunakan agen-agen antipsikotik atipikal, dim ana agen ini tidak memperburuk Parkinsonisme (lihat bab 20). Agen yang efektif ini ialah Clozapine dan Quetiapine(Friedman dan Factor, 2000). Dekarboksilasi perifer atas levadopa serta pelepasan dopamin ke dalam sirkulasi dapat mengaktivasi reseptor-reseptor dopamin dalam pembuluh darah sehingga menyebabkan hipotensi ortostatik. Dopamin yang bekerja pada reseptor-reseptor dan -adrenergik dapat menginduksi terjadinya aritmia jantung terlebih pada pasienpasien yang memiliki gangguan konduksi sebelumnya. Pemberian levadopa bersama-sama dengan inhibitor MAO non-spesifik seprti Phenelzine dan Tranylcypromine akan menyebabkan aksentuasi kerja levadopa serta presipitasi krisis hipertensi dan hiperpireksia: inhibitor MAO non-spesifik harus dihentikan 14 hari sebelum pemberian levadopa (catatan bahwa larangan ini tidak terjasuk inhibitor subtipe spesifik MAO-B Selegine karena dalam diskusi sebelumnya, dapat diberi secara aman meski dikombinasikan dengan levadopa). Efek withdrawal dari levadopa maupun pengobatan-pengobatan dopaminergik lainnya dapat menyebabkan
neuroleptic melignant syndrome umumnya terjadi setelah pengobatan antagonis dopamin (Keyser dan Rodnitzky, 1991). Reseptor-reseptor agonis dopamin. Obat alternatif yang digunakan selain levadopa ialah obat-obat agonis langsungterhadap reseptor dopamin striatal. Hal ini adalah metode pendekatan baru yang memiliki beberapa keuntungan oleh karena hasil konversi enzimatik dari obat-obat ini lebih efektif kerjanya daripada levadopa untuk pengobatan penyakit Parkinson tahap lanjut. Levadopa mengaktivasi seluruh tipe reseptor dopamin otak sedangkan obat-obat agonis reseptor dopamin relatif lebih selektif terhadap tipe reseptor dopamin tertentu. Obat-obat agonis reseptor dopamin memiliki jangka kerja lebih lama daripada levadopa dan hal ini sangat berguna sehubungan dengan dosis yang menyebabkan fluktuasi status motorik. Jika terbukti hipotesis pembentukan radikal bebas akibat metabolisme dopamin dpat menyebabkan kematian neuron itu benar, maka agonis reseptor dopamin mestinya mampu mengurangi pelepasan dopamin endogen sama halnya yang terjadi dengan pemebrian levadopa eksogen (Goetz, 1990). Terdapat 4 macam obat-obat agonis reseptor dopamin: Bromocriptine (PARLODEL) dan Pergolide (PERMAX); dan yang lebih baru Ropinirole (REQUIP) dan Pramipexole (MIRAPEX). Bromocriptine dan Pergolide adalah derivat ergot
dan memiliki spektrum terapi serta efek samping yang hampir sama. Bromocriptine adalah agonis kuat reseptor dopamin D2 dan antagonis parsial reseptor D1 sedangkan Pergolide merupakan agonis kuat kedua jenis reseptor. Ropinirole dan Pramipexole (gambar 22-8) memiliki selektivitas hanya bekerja pada reseptor D2 (lebih spesifik: bekerja pada reseptor D2 dan D3) dan sma sekali kurang beraktifitas pada reseptor D1. Keempat macam obat ini diserap dengan baik jika diberikan secara oral. Lama kerja agonis dopamin biasanya lebih lama dibandingkan dnegan lama kerja dari levadopa. Agonis dopamin ini juga efektif untuk mengobati penderita yang telah terkena fenomena on/off. Keempat obat ini juga menghasilkan halusinosis atau kebingungan, hal ini sama dengan pada pemberian levadopa, dan juga dapat memperburuk hipotensi ortostatik. Obat yang baru dan obat yang lama memiliki perbedaan yang paling mendasar yaitu untuk toleransi serta kecepatan titrasinya. Pemberian awal bromokriptine atau pergolide dapat menyebabkan hipertensi berat, oleh karena itu, keduanya diberikan dalam dosis rendah. Derivat ergot dapat merangsang mual dan kelelahan pada pemberian awal. Gejalagejala ini biasanya terselubung tetapi untuk terjadinya dibutuhkan penyesuaian peningkatan dosis perlahan-lahan dalam seminggu atau kurang. Ropinirole dan Pramipexole dapat diberikan awal lebih cepat, memperoleh dosis terapi dalam seminggu atau kurang.
Ropinirole dan Pramipexole kurang menyebabkan gangguan gastrointestinal dibanding derivat ergot, namun obat ini dapat memproduksi/menciptakan nausea dan kelelahan. Meski obat baru ini sudah diterima luas di Amerika Serikat, namun data-data efek jangka panjang dari obat ini masih kurang. Efek samping yang dilaporkan dari obat pramipexole dan ropinirole ialah terjadinya gangguan tidur dan adanya serangan tidur tiba-tiba saat melakukan aktivitas sehari-hari (Frucht ex al.,1999). Efek ini tidak biasanya terjadi, tetapi harus bijaksana untuk mengganti dengan terapi lain apabila gejala-gejala ini muncul. Pengenalan obat Pramipexole dan Ropinirole mengubah penggunaan klinik. Agonis-agonis dopamin pada penyakit Parkinson. Toleransi yang baik terhadap agonisagonis selektif ini menyebabkan peningkatan penggunaan obat ini sebagai terapi awal penyakit Parkinson dibanding menjadi tambahan dari pemberian Levadopa. Perubahan ini disebabkan oleh dua faktor: 1. Keyakinan bahwa agonis dopamin kurang menginduksi efek on-off maupun diskinesia sehubungan dengan durasi kerja obat yang lebih lama. 2. Kewaspadaan bahwa levadopa berpengaruh atas stres oksidatif, sehingga mempercepat hilangnya neuron dopaminergik. Penting diketahui bahwa hal ini merupakan penemuan dlam eksperimentasi laboratorium sehingga hanya terdapat bukti-bukti yang terbatas mengenai efeknya terhadap penderita. Dua percobaan klinik terkontrol yang
membandingkan antara levadopa dan pramipexole atau ropinirole untuk terapi awal penyakit Parkinson mengungkapkan bahwa terjadi pengurangan fluktuasi rata-rata motorik penderita pada pemberian agonis sehingga semakin mendongkrak obat ini untuk dipergunakan dalam klinis (Parkinson Study Group, 2000; Rascol et al,. 2000). Inhibitor COMT. Kelas obat yang akhir-akhir ini telah dikembangkan untuk mengobati Parkinson ialah inhibitor enzim Catechol-O-Methyltransferase (COMT). COMT dan MAO bertanggung jawab atas katabolisme levadopa dan dopamin. COMT mentransferkan grup metil dari donor S-adenosyl-Lmethionine serta memproduksi senyawa 3-O-methyl DOPA (dari levadopa) yang tidak aktif secara farmakologis, dan juga senyawa 3-methoxytyramine (dari dopamine) (gambar 22-9). Sebagai konsumsi oral, maka hampir 99% obat tersebut dikatabolisir dan tidak menjangkaui otak. Mayoritas obat ini dikonversi asam amino-L-dekarboksilase aromatik (AAD) menjadi dopamin yang menyebabkan nausea dan hipotensi. Pemberian AAD seperti misalnya carbidopa akan mengurangi terbentuknya dopamin namun menambah jumlah fraksi levadopa yang dimetilasi oleh COMT. Cara kerja inhibitor COMT yaitu dengan memblok konversi levadopa menjadi 3-O-
metil DOPA di perifer, meningkatkan paruh hidup levadopa dalam plasma juga setiap dosis yang mencapai SSP (Goetz, 1998). Ada dua inhibitor COMT tersedia di Amerika Serikat, tolcapone (TASMAR) dan entacapone (COMTAN). Kedua agen ini telah mengalami double blind trial dengan adanya pengurangan gejala klinik wearing off pada penderita yang diberikan levadopa Carbidopa (Parkinson Study Group, 1997; Kurbh et al.,1997). Meskipun besarnya efek klinis maupun mekanisme aksinya serupa, namun keduanya dibedakan atas farmakokinetis dan efek samping yang ditimbulkannya. Tolcapone relatif bekerja jangka panjang, diberi dua sampai tiga kali sehari, dan kerja dari Entacapone ialah cukup singkat, sekitar 2 jam sehingga biasanya diberikan secara simultan dalam setiap dosis levadopa/carbidopa. Kerja entacapone ialah inhibisi COMT di perifer. Efek samping yang biasanya timbul sama dengan pada mereka yang memakai levadopa/carbidopa sendiri, yaitu nausea, hipotensi ortostatik, dan vivid dreams, konvulsi serta halusinasi. Efek samping yang penting yang dapat terjadi karena obat tolcapone adalah hepatotoksisitas. Dalam percobaan klinis, sampai 2% pasien yang diterapi akan mengalami kenaikan serum alanin transferase dan aspartat transaminase; setelah dipasarkan, ditemukan tiga kasus fatal terjadinya kegagalan hepatik fulminan. Sekarang ini, tolcapone hanya bisa diberikan apabila terapi lain tidak berespon dan harus
dilakukan penmantauan terhadap kemungkinan cedera hepatik. Entracapone tidak menimbulkan hepatotoksisitas dan juga tidak membutuhkan pemantauan khusus. Selegeline. Dua isoenzim MAO mengoksidasi monoamino. Meski kedua isoenzim (MAO-A dan MAO-B) berada di perifer, juga monoamin inaktif asalnya dari intestinal, tapi dominasi isoenzim MAO-B berada di striatum dan bertanggung jawab atas kebanyakan metabolisme oksidatif dopamin di striatum. Dalam dosis yang rendah sampai moderat, (10 mg/hari atau kurang) selegeline (ELDEPRYL) merupakan inhibitor selektif MAO-B, dapat menyebabkan inhibisi yang reversibel enzim tersebut (Olanow, 1993). Tidak seperti inhibitor MAO non spesifik (seperti phenelzine, tranylcypromine, dan isocarboxacide), selegiline diberikan bersama levadopa. Selegiline juga tidak menyebabkan potensiasi letal terhadap aksi katekolamine pada pasien yang mendapatkan inhibitor MAO non spesifik yang didapatkan secara tidak langsung yaitu melalui amina simptomatik seperti tiramine yang dapat ditemukan di bahan makanan seperti keju dan anggur tertentu. Pemberian selegiline dengan dosis yang lebih tinggi dari 10 mg per hari dapat menyebabkan inhibisi MAO-A dan hal tersebut harus dihindarkan.
Selegiline telah digunakan beberapa tahun terakhir untuk mengobati simtomatik penyakit Parkinson meskipun efek terapinya hanya sedang saja. Kegunaan selegiline diduga menghambat perombakan dopamin yang berada di striatum. Karena belakangan ini banyak ketertarikan peran radikal bebas dan stres oksidatif, maka pada patogenesis parkinson, diduga kemampuan selegiline dalam menghambat metabolisme dopamin dapat memberikan sifat neuroprotektif. Peran protektif selegiline pada idiopatik parkinson telah dievaluasi berkala pada beberapa multisenter; penelitian ini membuktikan efek simtomatik selegiline pada parkinson, namun pada follow-up jangka panjang ditemukan kegagalan obat ini untuk menghambat hilangnya neuron-neuron dompaminergik (Parkinson Study Group, 1993). Selegiline dapat ditoleransi oleh pasien dengan parkinson yang ringan. Pada pasien dengan Parkinson lebih lanjut, selegiline dapat menonjolkan reaksi efek sampingnya pada motorik serta kognitif penderita. Metabolit selegiline termasuk di dalamnya adalah amfetamin dan metamfetamin dapat menyebabkan ansietas, insomnia, dan efek samping lainnya. Yang menarik, dapat ditemukan pada selegiline dapat menyebabkan terjadinya stupor, rigiditas, dan agitasi serta hipertermi setelah diberikan bersamasama dengan meperidine; dasar dari interaksi ini belum pasti. Juga ditemukan laporan adanya efek samping antara pemberian
selegiline bersama-sama dengan antidepresan trisiklik dan anatara selegiline dan inhibitor serotonin-reuptake. Antagonis Reseptor Muskarinik. Obat antagonis reseptor moskarinik asetilkolin telah umum digunakan dalam mengobati Parkinson sebelum ditemukannya levadopa. Dasar biologis aksi terapi dari obat ini belum dimengerti sepenuhnya. Tampaknya aksi obat ini di neostriatum melalui reseptor yang biasanya memperantarai respons inervasi kolinergik intrinsik, di mana inervasi ini berasal terutama dari interneuron konergik di striatal. Beberapa reseptor-reseptor kolinergik muskarinik telah dapat dicloning (Bab 7 dan 12); seperti reseptor dopamin, maka protein ini memiliki 7 domain transmembran yang terhubung dnegan sistem mesengger sekunder protein G. Lima subtipe reseptor muskarinik yang telah diidentifikasi dengan empat reseptor dari kelimanya dapat ditemukan di striatum meskipun lokasi distribusinya berbeda-beda (Hersch et al., 1994). Beberapa obat dengan fungsi antikolinergik yang sering digunakan pada Parkinson ialah trihexyphenidyl (ARTANE, 2 sampai 4 mg, tiga kali sehari), benztropine mesylate (COGENTIN, 1 sampai 4 mg, dua kali per hari) dan diphenhydramine hydrochloride (BENADRYL, 25 sampai 50 mg, 3 sampai 4 kali per hari). Semua obat ini memiliki aksi anti parkinson yang terutama berguna dalam terapi Parkinson
awal atau sebagai tambahan dalam pengobatan dopamimetik. Efek samping dari obat ini adalah hasil dari kerja antikolinergiknya. Kebanyakan masalah yang terjadi ialah efek sedasi dan konfusi menta, biasanya pada orang lanjut usia. Mereka juga dapat menyebabkan konstipasi, retensi urine, dan mengaburkan penglihatan karena sikloplegia; obat ini harus digunakan dengan hati-hati pada penderita glaucoma sudut sempit. Amantadine. Amantadine (SYMMETREL), adalah agen antivirus yang digunakan sebagai profilaksis untuk mengobati influenza A (lihat Bab 50), namun memiliki aksi antiparkinsonian juga. Mekanisme kerja dari amantadine belum jelas. Diduga bahwa obat ini mungkin mengalihkan pelepasan dopamin atau re-uptakenya; sifat antikolinerginya juga memberikan kegunaan dalam aksi terapi. Amantadine dan senyawa yang mirip yaitu memantadine memiliki aktivitas pada reseptor glutamat NMDA yang juga berperan dalam aksi antiparkinson (stoof et al., 1992). Dalam kasus apapun, efek dari amantadine pada Parkinson bersifat sedang. Obat ini biasanya digunakan untuk terapi awal Parkinson ringan. Obat ini juga dapat membantu sebagai tambahan pada pasien yang mendapat levadopa dosis bervariasi. Amantadine bisanya diberikan dalam besar dosis 100 mg dua kali sehari dan biasanya dapat ditoleransi dengan baik. Dizzines, letargi, efek antikolinergik, dan
gangguan tidur, juga nausea serta vomiting dapat ditemukan, namun apabila hal ini terjadi biasanya efeknya ringan saja dan reversibel. PENYAKIT ALZHEIMER Tinjauan Klinis. Alzhemir menyebabkan gangguan kemampuan kognitif yang bertahap namun perjalanannya tidak dapat ditanggung-tanggung menjadi buruk. Gangguan dalam ingatan jangka pendek biasanya menandakan gejala klinis awal, sementara kemampuan untuk mengingat memori masa lalu relatif masih dipertahankan. Dalam perjalanannya, tambahan gangguan kognitif dapat terjadi, salah satunya ialah gangguan dalam kemampuan berhitung, kemampuan visuospatial, dan gangguan penggunaan perangkat ataupun objek yang biasanya digunakan penderita (apraksia ideomotor). Tingkat kewaspadaan penderita tidak terganggu hingga kondisi dari penyakit ini sudah dalam tahap lanjut, atau apabila terjadi kelemahan motorik, meskipun kontraktur ototlah sebagai penyebab paling umum dari tahap lanjut penyakit ini. Kematian, biasanya terjadi oleh karena komplikasi akibat imobilitas penderita misalnya karena pneumonia atau embolisme paru yang biasanya terjadi dalam 6 sampai 12 tahun sejak kemunculan awal dari penyakit ini. Mendiagnosis Alzheimer
harus didasarkan oleh penilaian klinis yang seksama dan didukung dengan hasil pemeriksaan laboratorium yang cukup untuk dapat membedakan penyakit ini dengan penyakit lainnya yang menyerupai Alzheimer; sekarang ini, tidak ada test langsung yang dapat membuktikan penyakit ini. Patofisiologi. Alzheimer dikenali oleh adanya atropi dari korteks serebral dan hilangnya neuron-neuron di korteks maupun subkorteks. Penanda patologis dari penyakit ini adlah plak senilis, yang berbentuk sferis oleh karena akumulasi protein -amiloid beserta proses degenerasi saraf, dan juga neurofibrillary tangles, terdiri dari filamn-filamen heliks dan protein-protein lainnya (arnold et al., 1991; Arriagada et al.,1992; Braak dan Braak, 1994). Meski jumlah kecil dari plak senilis dan neurofibrillary tangles ini dapat diamati baik pada individu berintelektual biasa, namun plak dan tangles ini ditemukan lebih banyak pada Alzheimer, dan tangles yang benyak lebih berhubungan dengan beratnya gangguan kognitif. Pada Alzeimer tingkat lanjut, plak senilis dan neurofibrillary tangles cukup banyak. Mereka berada di hipokampus dan daerah asosiasinya di korteks, sementara daerahdaerah seperti korteks visual dan korteks motorik tidak terganggu. Kejadian ini akan berkorespondensi dengan gejala-gejala klinik berupa gangguan ingatan dan pemahaman abstrak, tanpa terjadinya
gangguan penglihatan serta pergerakan. Faktor-faktor yang mendasari gangguan ini tidak diketahui. Neurochemistry. Gangguan neurokimia yang muncul pada Alzheimer telah dipelajari secara intensif (Johnston, 1992). Analisis langsung dari isi neurokimia dalam korteks serebri menunjukkan pengurangan substansi transmiter yang paralel dengan hilangnya neuron; tarjadi serangan serta defisiensi asetilkolin yang disproporsional. Dasar anatomis dari defisit kolinergik ini ialah atrofi dan degenerasi dari neuron kolinergik subkortikal, khususnya yang berada di basal forebrain (nukleus basalis Meynert), neuron inilah yang memberikan inervasi kolinergik ke seluruh bagian korteks serebral. Defisiensi selektif dari asetilkolin pada Alzheimer seperti atropin dapat menginduksi status konfusi yang membentuk adalnya demensia pada Alzheimer ini, sehingga terdapat hipotesis kolinergik yang mengatakan bahwa defisiensi asetilkolin adalah penting pada pembentukan gejalagejala Alzheimer (Perry, 1986). Meski konsep ini sebagai sindrom defisiensi kolinergik Parkinson menunjukkan kaitan yang berguna, sangatlah penting diperhatikan bahwa pada defisit penyakit Alzheimer kejadiannya lebih kompleks yang melibatkan sistem neurotransmiter komleks termasuk serotonin, glutamat, dan neuropeptida, dan pada Alzheimer terjadi destruksi korteks dan
hipokampal yang menerima input kolinergik dan bukan hanya rusaknya saraf-saraf kolinergik saja. Peranan -Amiloid. Kehadiran agregat -Amiloid selalu
ditemukan pada Alzheimer. Sampai saat ini, belum ada penjelasan yang dapat menerangkan mengapa protein amiloid terhadap perjalanan penyakit ataukah hanya produk perantara saja dalam terjadinya kematian saraf. Aplikasi dari genetika molekular sedikit membantu kita atas pertanyaan di atas. -Amiloid yang diisolasi dari otak terdiri atas 42 sampai 43 macam asam amino. Informasi yang dibawa protein ini ialah perintah kloning protein prekursor amiloid (APP), suatu protein yang lebih besar ukurannya terdiri dari 700 asam amino yang diekspresikan oleh neuron otak yang banyak diekspresikan oleh saraf otak pada individu normal maupun pada penderita Alzheimer. Fungsi APP tidak diketahui meskipun dapat dilihat secara struktural bahwa APP berfungsi sebagai reseptor permukaan sel untuk ligan tertentu yang belum teridentifikasi. Produksi -Amiloid dari APP kemungkinan oleh karena cleavage proteolitik abnormal terhadap enzim BACE ( site APP-cleaving enzyme). Hal ini di masa depan dapat dimanfaat menjadi target terapi (Vassar et al., 1999). Analisis struktur gen APP pada pedigree menunjukkan turunan autosomal dominan pada Alzheimer pada keluarga tertentu,
ditemukan mutasi dari regio pembentukan -Amiloid pada APP, sedangkan pada keluarga lain, mutasi dari protein melibatkan juga mutasi dari APP (selkoe, 1998). Hasil ini menunjukkan adanya abnormalitas dari APP maupun mutasinya dapat menyebabkan Alzheimer. Kebanyakan kasus Alzheimer yang tidak familial, dan abnormalitas struktur APP maupun protein lain yang terlibat di dalamnnya belum ditinjau secara konsisten pada kasus-kasus Alzheimer yang menyebar secara sporadik. Seperti disebutkan sebelumnya, protein alel apo E dapat mempengaruhi terjadinya Alzheimer. Hal ini disimpulkan bahwa memodifikasi metabolisme APP dapat mengubah arah kasus Alzheimer baik secara familial maupun sporadiknya, namun tidak satupun strategi klinis sudah dibuat. (whyte et al., 1994).
Terapi penyakit Alzheimer. Pendekatan besar telah dilakukan dalam menterapi Alzheimer dengan usaha untuk menguatkan fungsi kolinergik pada otak (Johnston, 1992). Pendekatan awal ialah dengan menggunakan prekursor sintesis asetilkolin, seperti choline chloride dan phosphatidyl choline (lechitin). Meski suplementasi ini secara umum mampu ditoleransi, percobaan random membuktikan dapat ditemukan adanya kegagalan. Injeksi intraserebroventrikular agonis kolinergik seperti bethanacol tampaknya dapat menguntungkan, meskipun hal ini membtuhkan
implantasi operasi untuk reservoir yang menghubungkan ruang subaraknoid dan untuk kebutuhan praktis lainnya. Strategi yang lebih berhasil ialah dengan menggunakan inhibitor asetilkolinesterase (AchE), suatu enzim katabolik untuk asetil kolin (lihat bab 8). Physostigmine, suatu inhibitor reversibel AchE kerja cepat memberikan efek respon pada binatang percobaan, dan beberapa pelajaran tertentu menunjukkan perbaikan ringan memori akibat pemberian fisostigmin ini. Penggunaan fisostigmin harus dibatasi oleh karena waktu paruhnya singkat dan bertendensi menyebabkan gejala ekses kolinergik sistemik meski pada pemberian dosis terapi. Empat inhibitor dari AchE saat ini diakui oleh United States Food and Drug Administration untuk mengobati penyakit Alzheimer ialah tacrine (1,2,3,4 tetrahydro-9-aminoacridine; COGNEX), donepezil (ARICEPT) (Mayeux dan Sano, 1999). Rivastigmine (EXCELON), dan galantamine (REMINYL). Takrin bersifat poten, menghambat AchE dengan aksi sentralnya (Freeman dan Dowson, 1991). Studi mengenai pemberian takrin oral yang dikombinasikan dengan lesitin menunjukkan takrin pada pengukuran kinerja memori, namun perbaikan terbaik yang dapat diamati ialah melalui kombinasi lesitin dan trakrium (Chatellier dan Lacomblez, 1990). Efek samping dari Tachrine dapat terjadi; sakit perut, anoreksia, nausea, vomiting, dan diare ditemukan pada
satu diantara 3 penderita yang menerima terapi. Dan peningkatan kadar serum transaminase pada 50% penderita. Oleh karena efekefek signifikannya, takrin tidak digunakan secara luas pada praktek klinik. Donepezil adalah inhibitor selektif AchE pada SSP yang berefek minimal pada Ache jaringan perifer. Donepezil dapat memperbaiki keadaan klinis kognitif penderita (Roger dan Friedhoff, 1988) dan memiliki paruh hidup yang lama (lihat Appendiks II), sehingga dapat diberikan dosis satu kali sehari. Rivastigmine dan Galantamine diberikan dua kali per hari dan menghasilkan perbaikan klinis kognitif yang sama dengan Donepezil. Efek samping dari donepezil, rivastigmine, dan galantamin hampir sama namun lebih sering terjadi pada penderita yang diberikan takrin; hal ini meliputi nausea, diare, vomiting, dan insomnia. Donepezil rivastigmine, dan galantamine tidak menyebabkan hepatotoksisitas. Obat yang saat ini sedang dalam pengembangan dalam pengobatan Alzheimer ialah agen antikolinesterase. Memantine, sebuah antagonis reseptor NMDA menunjukkan hal yang menjanjikan dalam memperlambat perjalanan penyakit Alzheimer pada penderita yang penyakitnya cukup serius. Antioksidan, agen antiinflamasi serta estrogen telah dipelajari, namun tidak ada satupun yang menunjukkan kemanjuran. Identifikasi APP dan enzim-enzim yang terlibat pada pembentukan protein ini telah
membuka kesempatan dalam pengembangan
antiagregat, suatu
vaksin -Amiloid, dan pengalihan perkembangan APP, yang dapat mewakili generasi selanjutnya dalam terapi Alzheimer.
PENYAKIT HUNGTINGTON Tinjauan Klinis. Hungtington diturunkan secara dominan dan merupakan kelainan yang dikenal timbul secara bertahap suatu inkoordinasi motorik serta penurunan kognitif pada umur pertengahan hidup manusia. Timbul gejala-gejala tersembunyi berupa gerakan-gerakan singkat dan kasar dari ekstremitas, tubuh, wajah, dan leher (khorea) maupun perubahan personalitas penderita ataupun kedua-duanya. Inkoordinasi motorik dan gerakan mata yang cepat merupakan tanda-tanda awal. Jika onset dari penyakit berkembang sebelum umur 20 maka gejala khorea yang terjadi bisa saja tidak menonjol, malahan lebih didominasi oleh bradikinesia dan distonia. Seiring dengan perkembangannya, gerakan involunter menjadi semakin berat, disartria dan disfagia terbentuk, dan keseimbangan tubuh akan terganggu. Kelainan kognitif akan bermanifestasi awalnya berupa kelambanan proses mental dan sulitnya dalam mengatur suatu kerja kompleks. Memori juga akan terpengaruh, namun penderita yang terkena jarang kehilangan memori akan keluarga, teman, dan bila terjadi
suatu kejadian yang tiba-tiba. Penderita biasanya menjadi iritabel, cemas, dan depresi. Bisa saja terjadi paranoia dan status delusional namun hal ini jarang terjadi. Hasil akhir dari penyakit Hungtington ini biasanya fatal; dalam kurun waktu 15 sampai 30 tahun, penderita menjadi lumpuh total dan tidak mampu berkomunikasi, sehingga dibutuhkan perawatan seumur hidup; kematian biasanya disebabkan oleh karena komplikasi imobilitas penderita (Hayden, 1981; Harper, 1991,1992).
Patologi
dan
Patofisiologi.
Hungtington
ditandai
dengan
hilangnya neuron yang jelas terlihat pada bagian kaudatus/putamen otak (Vonsattel et al., 1985). Atropi dari bagian ini berlangsung dalam urutan tertentu, pertama menyerang bagian ekor nukleus kaudatus kemudian terus berjalan ke anterior, dari medial-dorsal ke lateral-ventral. Daerah-daerah lain dari otak juga terkena, meski tidak terlalu berat; analisis morfometrik menunjukkan adanya saraf-saraf yang kurang di korteks serebri, hipotalamus, dan talamus. Meski di daerah striatum, degenerasi saraf oleh karena Hungtington ini bersifat selektif. Interneuron dan terminal aferen biasanya tersisa sementara neuron proyeksi striatal (neuron medium spiny) terkena. Hal ini menyebabkan penurunan konsentrasi GABA striatal, sementara somatostatin dan konsentrasi
dopamin tetap dipertahankan (Ferrante et al., 1987; Reiner et al., 1988). Kerentanan selektifitas juga timbul menimbulkan kecurigaan klinik dari Hungtington, yaitu terbentuknya khorea. Dalam kebanyakan kasus yang onsetnya pada orang dewsa, neuron medium spiny yang meproyeksikan LGP dan SNpr (jalur tidak langsung/indirek) tampaknya berpengaruh lebih awal dibandingkan neuron-neuron yang memproyeksikan MGP (jalur langsung/direk; Albin et al., 1990, 1992). Gangguan disproporsional dari jalur tidak langsung akan meningkakan eksitatoris dari neokorteks, mengakibatkan pembentukan gerkaan involunter seperti khorea (gambar 22-10). Pada beberapa individu, rigiditas dibanding khorea adalah tanda klinis yang predominan; hal ini biasanya terjadi pada kasus-kasus dengan onset juvenil. Pada kasus ini neuron striatal menyebabkan peningkatan jalur direk maupun indirek dan menyebabkan gangguan di dalamnya. Genetik. Hungtington merupakan kelainan autosomal dominan dengan penetrans yang hampir lengkap. Rata rata umur di mana onset dari penyakit ini terjadi ialah antara 35 sampai 45 tahun, namun range ini bervariasi dari awalnya umur dua sampai pertengahan 80an. Meski penyakit ini sama-sama dapat diturunkan baik melalui ayah maupun ibu, lebih dari 80% gejala yang
terbentuk sebelum umur 20 tahun berasal dari turunan ayah. Hal ini merupakan contoh antisipasi, atau tendensi umur dari onset penyakit menurun pada tiap generasi, yang juga dapat diamati baik pada penyakit degenerasi saraf lainnya yang bermekanisme genetik sama. Homozigot untuk Hungtington menunjukkan karakteristik identik atas Hungtington atipikal heterozigot, menunjukkan bahwa kromosom yang tidak terpengaruh tidak akan melemahkan simtomatologi penyakit. Dengan ditemukannya defek genetik yang bertanggung jawab terhadap Hungtington, mutasi-mutasi de novo yang menyebabkan Hungtington biasanya tidak biasa; tetapi jelaslah sekarang bahwa penyakit ini dapat timbul dari orang tua yang tidak terkena Hungtington, khususnya ketika seseorang membawa suatu alel intermediat, seperti yang akan dijelaskan berikut. Penemuan dari mutasi genetik yang bertanggung jawab pada penyakit Hungtington adalah produk dari kerja keras sepuluh tahun pada kerja sama kolaboratif. Pada tahun 1993 suatu regio dekat telomer dari kromosom 4 ditemukan mengandung trinukleotida polimorfik (CAG)n yang muncul kembali secara signifikan pada setiap individu dengan Hungtington (Hungtingtons Disease Collaborative Research Group, 1993). Ekspansi dari pengulangan trinukleotida ini merupakan alterasi genetik yang bertanggung jawab atas penyakit Hungtington. Range pengulangan lebar CAG
pada individu normal ialah antara 9 sampai 34 triplets, dengan pengulangan jarak median pada kromosom 19. Lebar yang berulang dari Hungtington bervariasi dari 40 sampai 100. Lebar yang berulang dari 35 sampai 39 mewakilkan alel-alel intermediat; beberapa dari individu membentuk penyakit Hungtington di usia lanjut, sementara yang lainnya tidak. Lebar berulang ini dikorelasikan secara terbalik dengan umur munculnya onset penyakit. Semakin muda onset penyakit, maka semakin tinggi kemungkinan pengulangan angka. Korelasi ini sangat kuat pada individu dengan onset sebelum 30 tahun; pada onset di atas 30 tahun korelasi ini semakin lemah. Kemudian, jarak berulang tidak dapat berfungsi sebagai prediktor adekuat atas umur onset ini pada kebanyakan penderita. Kerja subsekuan menunjukkan bahwa penyakit neurodegeneratif lainnya juga berasal dari ekspansi pengulangan CAG, termasuk di dalamnya ialah ataksia spinoserebelar herediter dan penyakit Kennedy, suatu kelainan turunan yang langka dari neuron motoris (Paulson dan Fischbeck, 1996). Selektivitas. Mekanisme di mana ekspansi pengulangan
trinukelotida menuntunpada keadaan klinis maupun patologis dari Hungtington tidak diketahui. Mutasi Hungtington terlertak di antara gen IT15. gen IT15 itu sendiri sangat besar (10 kilobase) dan
mengenkode suato protein kira-kira 348.000 dalton atau 3144 asam amino. Pengulangan trinukleotida, yang mengenkode asam amino glutamin, muncul pada ujung 5 dari IT15 dan diikuti oleh pengulangan lebih pendek dari (CCG)n yang mengenkode asam amino prolin. Protein bernama hungtingtin, tidak membentuk protein lainnya, dan fungsi normal dari protein ini belum diketahui. Tikus dengan knockout genetik hungtingtin meninggal lebih awal pada kehidupan embrioniknya, jadi dapat dikatakan hungtingtin ini memiliki fungsi sel yang esensial; protein termutasi mendapatkan fungsi barunya atau sifat-sifat yang tidak terdapat pada protein normal. Gen Hungtington diekspresikan secara luas ke seluruh tubuh. Kadar yang tingi dari ekspresi ini terdapat di otak, pankreas, intestinal, otot, liver, adrenal, dan testis. Pada otak, ekspresi IT15 tidak tampak berkorelasi dengan kerentanan saraf; meski striatum paling berat terkena, neuron di semua regio dari otak akan mengekpresikan kadar yang sama dari IT15 mRNA (Landwehrmeyer et al., 1995). Kemampuan mutasi Hungtington untuk menghasilkan degenerasi saraf tertentu meski ekspresi universal gen di antara neuron mungkin dapat dihubungkan dengan mekanisme metabolik atau eksototoksik. Selama beberapa tahun, telah dikatakan bahwa penderita Hungtington bisanya kurus, terduga kemunculan dari gangguan sistemik dari metabolisme
energi. Pada binatang, agonis dari subtipe NMDA reseptor asam amino eksitatoris dapat menyebabkan patologi yang mirip dengan yang terlihat pada Hungtington ketika mereka diinjeksikan pada striatum (Beal et al., 1986). Lebih menarik lagi, terdapat fakta bahwa inhibitor kompleks II dari rantai respiratori mitokondria juga memproduksi lesi striatal mirip Hungtington bahkan ketika diberikan secara sistematik (Beal et al., 1993). Lebih lanjut, patologi ini dapat dikurangi oleh reseptor antagonis NMDA, diduga bahwa hal ini adalah contoh dari gangguan metabolik yang menyebabkan peningkatan cedera saraf eksitotoksik. Pembelajaran menggunakan MRI spektroskopi telah memberikan bukti langsung dari penyimpangan metabolisme energi in vivo pada Hungtington (Jenkins et al., 1993). Kemudian, hubungan antara ekpresi luas darigen abnormal protein IT15 pada hungtington dan selektivitas dari saraf ini pada penyakit dapat timbul akibat interaksi defek luas pada metabolisme energi dengan sifat intrinsik dari neuron striatal, termasik kapasitas dan kebutuhan untuk metabolisme eksudatif sama halnya kemunculan dari tipe reseptor glutamat. Hipotesis ini memiliki sejumlah implikasi terapi yang penting. Tidak biasanya bahwa kemungkinan pada masa akan datang untuk mengoreksi defek genetik pada penderita Hungtington, namun dapat saja terjadi pembentukan agen yang mengubah fungsi metabolik atau
pemberian perlindungan terhadap cedera eksitotoksik dan oleh karena itu menangkap atau memodifikasi arah perjalanan penyakit. Terapi simptomatik penyakit Hungtington. Terapi simptomatis praktis dari Hungtington menekankan pada pengobatan yang selektif (Shoulson, 1992). Tidak terdapat pengobatan yang dapat memperlambat perjalanan dari penyakit ini, dan kebanyakan dari pengobatan dapat menggangu fungsi akibat dari efek sampingnya. Terapi yang dibutuhkan dapat diberikan pada penderita yang depresi, iritabel, paranoid, dan cemas berlebihan, atau psikotik. Depresi dapat diobati dengan antidepresan standar dengan keberadaan dari obat ini bersama antikolinergik dapat mengeksaserbasi korea. Fluoxetine (bab 19) juga diketahui efektif melawan depresi. Paranoia, keadaan delusional, dan psikosis biasanya membutuhkan terapi dengan obat antipsikotik, tetapi dosis yang dibutuhkan biasanya lebih rendah darpiada yang biasanya digunakan dalam kelainan psikiatrik primer. Agen-agen ini juga mengurangi fungsi kognitif dan mengganggu mobilitas dan juga dapat digunakan dalam dosis rendah dan dapat langsung dihentikan apabila gejala psikiatrik telah teratasi.. Pada individu dengan Hungtington yang predominan rigid, clozapine (bab 20) maupun karbamazepin dapat lebih efektif menterapi paranoia dan psikosis.
Kelainan gerakan pada Hungtington per se biasanya jarang disembuhkan dengan terapi farmakologis. Pada mereka dengan amplitudo korea yang besar yang dapat menyebabkan jatuh maupun cedera, agen dopamin deplesi seperti tetrabenazine atau reserpine (bab 33) dapat dicoba, meski penderita harus terus dimonitor akan adanya hipotensi dan depresi. Agen antipsikotik dapat pula digunakan, tetapi hal ini kadang tidak dapat memperbaiki fungsi keseluruhan oleh karena mereka mengurangi kordinasi motoris halus dan meningkakan rigiditas. Kebanyakan penderita Hungtington menunjukkan perburukan gerakan involunter sebagai hasil dari ansietas atau stress. Dalam situasisituasi ini penggunaan sedatif atau ansiolitik benzodiazepine yang bijaksana dapat berguna. Pada kasus-kasus onset juvenil di mana rigiditas dibandingkan korea didominasi, agonis dopamin memiliki kesuksesan bervariasi dalam memperbaiki rigiditas. Individu ini juga kadang membentuk mioklonus dan kejang yang dapat diberi klonazepam, asam valproat, atau antikonvulsan lainnya. SKLEROSIS LATERAL AMIOTROPIK Tinjauan Klinik dan Patologi. ALS merupakan kelainan motor neuron dari kornu ventral medula spinalis dan neuron korteks pembawa input aferen. Perbandingan antara pria dan wanita yang terkena kira-kira 1,5:1 (Kurtzke, 1982). Kelainan ini ditandai
dengan kelemahanyang berkembang cepat, atropi otot dan fasikulasi, spastisitas, diartria, disfagia, dan kompromi respiratori. Fungsi sensorik umumnya tidak terganggu sama halnya dengan fungsi kognitif, autonomik, dan aktivitas okulomotoris. ALS biasanya bersifat progresif dan fatal dengan kematian pasien akibat kompromi respirasi dan pneumonia setelah 2 sampai 3 tahun lamanya, meski kadang-kadan ditemukan pasien yang dapat bertahan hidup lebih lama dari itu. Patologi ALS berhubungan langsung dengan apa yang ditemukan di klinik: Ditemukan hilangnya neuron motoris medula spinalis dan batang otak yang memproyeksikan otot lurik (meski saraf okulomotor tidak terganggu) juga hilangnya neuron motoris piramidal besar pada lapisan V dari korteks motorik yang berasal dari traktus descendens kortikospinal. Dalam kasus-kasus turunan, kolumna Clarke dan kornu dorsalis kadang-kadang juga terkena (Caroscio et al., 1987; Rowlan, 1994). Etiologi. Sekitar 10% kasus ALS bersifat turunan (FALS), biasanya dengan pola autosomal dominan (Jackson dan Bryan, 1998). Mutasi yang bertanggung jawab dalam hal ini belum ditemukan, tetapi terdapat subset penting dari pasien FALS yang mengalami mutasi gen dari enzim superoxide dismutase (SOD1) (Rosen et al., 1993). Mutasi protein ini berperan pada sekitar 20%
kasus FALS. Kebanyakan dari mutasi ini merupakan pengalihan dari asam amino tunggal, namun dengan lebih dari 30 alel berbeda. Tikus transgenik yang mengekspresikan mutasi SOD1 manusia membentuk degenerasi progresif dari saraf motoriknya yang hampir sama terjadi pada manusia. Hal ini memberikan model binatang untuk diteliti lebih lanjut dan juga untuk percobaan farmasi. Menariknya, kebanyakan dari mutasi SOD1 yang dapat menyebabkan timbulnya penyakit ini tidak mengurangi kapasitas dari enzim yang bekerja untuk menjalankan fungsi utama yaitu katabolisme dari radikal toksik superoksida. Dan pada kasus penyakit Hungtington, mutasi dari SOD1 dapat membentuk suatu toksik gain of function alamiah yang masih belum jelas. Lebih dari 90% kasus ALS bersifat sporadik dan tidak berhubungan dengan abnormalitas SOD1 maupun abnormalitas gen. Penyebab dari hilangnya neuron motoris pada ALS yang sporadik ini masih belum diketahui tetapi teori mencurigai adanya suatu autoimunitas, eksototoksisitas, dan radikal bebas yang toksik, serta infeksi virus ( Rowland, 1994; Cleveland, 1999). Kebanyakan dari ide ini kurang didukung data yang ada, namun bukti bahwa reuptake glutamat bisa saja abnormal pada penyakit ini, menyebabkan akumulasi glutamat dan cedera eksitotoksik (Rothstein et al., 1992). Satu-satunya terapi yang diakui untuk ALS yaitu riluzole yang berdasarkan pengamatan kami.
Spastisitas dan Refleks Spinal. Spastisitas merupakan komponen penting dalam temuan klinisALS, yaitu adanya kehadiran spastisitas sering menyebabkan nyeri dan ketidaknyamanan serta pengurangan mobilitas yang sebelumnya diawali oleh kelemahan. Lebih lanjut, spastisitas adalah bagian dari ALS yang disetujui diberikan terapi. Spastisitas didefenisikan sebagai peningkatan tonus otot ditandai dengan tahanan awal terhadap pemindahan pasif dari tungkai pada sendi diikuti oleh relaksasi tiba-tiba (hal ini disebut juga fenomena pisau lipat). Spastisitas adalah merupakan suatu hasil hilangnya input descendens motor neuron spinal, dan karakter dari spastisitas ini bergantung pada jalur sistem saraf mana yang terkena (Davidoff, 1990). Keseluruhan pengulangan gerakan dapat dihasilkan langsung pada level medula spinalis; hal ini diluar jangkauan bab kali ini. Refleks regang tendon monosinaptik mungkin merupakan hal yang paling sederhana peran mekanisme spinal pada spastisitas. Spindel aferen Ia primer diaktivasi ketika otot teregang cepat, bersinaps langsung pada motor neuron akan meregangkan otot, menyebabkan kontraksi dan tahanan dari gerakan. Suatu kolateral dari sinaps aferen primer Ia pada Ia-coupled interneuron yang menginhibisi motor neuron yang menginervasi otot yang antagonis menyebabkan kontraksidari otot menjadi tidak bertujuan. Upper motor neuron dari serebral
korteks (neuron piramidal) menekan refleks spinal dan lower motor neuron secara tidak langsung dengan cara mengaktivasi interneuron inhibitoris medula spinalis. Neuron piramidal menggunakan glutamat sebagai neurotransmiter. Ketika pengaruh piramidal dikeluarkan, maka refleks dilepaskan dari inhibisi dan menjadi lebih aktif, menyebabkan hiperrefleks. Jalur descending lainnya dari batang otak termasuk rubro-, retikulo-, dan jalur vestibulospinal dan jalur descending katekolamin juga mempengaruhi aktifitas refleks spinal. Ketika hanya jalur piramidal yang terpengaruh, tonus ekstensor di kake dan tonus fleksor pada lengan meningkat. Ketika jalur vestibulospinal dan katekolamin terganggu, peningkatan fleksi dari seluruh ekstremitas diamati dan stimualsi kutan yang ringan akan menghambat spasme seluruh tubuh. Pada ALS, jalur piramidal terganggu dengan adanya preservasi relatif dari jalur descending lainnya, menyebabkan adanya refleks tendon dalam yang hiperaktif, kordinasi motoris halus yang terganggu, peningkatan tonus ekstensor tungkai, dan peningkatan tonus fleksor di lengan. Refleks gag juga sering menjadi overaktif. Terapi ALS dengan Riluzole. Riluzole (2-amino-6-
[trifluorometoksi]benzotiazol; RILUTEK) adalah obat dengan kerja yang kompleks pada sistem saraf (Bryson et al., 1996);
wagner dan Landis, 1997). Riluzole diserap secara oral dan berikatan kuat dengan protein. Menyebabkan metabolisme ektensif di hati oleh baik mediasi hidroksilasi oleh sitokrom P450 maupun oleh glukoronidasi. Waktu paruhnya ialah sekitar 12 jam. Penelitian in vitro menunjukkan bahwa riluzole memiliki efek presinaptik maupun post sinaptik. Obat ini menghambat pelepasan glutamat, namun juga memblok postsinaptik NMDA- serta reseptor glutamat tipe kainate dan menghambat kanal sodium voltage dependent. Beberapa efek dari riluzole in vitro diblok oleh toksin pertusis, menyebabkan interaksi obat dengan protein G yang terikat dengan reseptor. Dalam percobaan klinis, riluzole memiliki efek yang sedang namun murni dalam perpanjangan hidup dari pasien ALS. Dalam percobaan klinik besar yang melibatkan 1000 orang pasien lebih, durasi median dari survival bertambah sekitar 60 hari (Lacomblez et al., 1996). Dosis yang disarankan ialah 50 mg setiap 12 jam yang diminum satu atau dua jam setelah makan. Riluzole biasanya ditoleransi dengan baik, meski nausea atau diare dapat terjadi. Kadang riluzole dapat menghasilkan cedera hepatik dengan elevasi dari serum transaminase sehingga perlu dilakukan kontrol berkala pada pemberian obat ini. Meski dari besarnya efek riluzole pada ALS ini kecil, namun hal ini merepresentasikan terapi yang signifikan pada pengobatan penyakit dibandingkan semua jenis terapi-terapi lain sebelumnya.
Terapi simtomatik spastisitas. Obat yang paling berguna untuk terapi simtomatik dari spastisitas akibat ALS adalah baclofen (LIORESAL) yaitu suatu agonis GABAB. Dosis inisial sebesar 5 sampai 10 mg per hari disarankan, tetapi dosis ini dapat ditingkatkan sampai sebanyak 200 mg per hari jika dibutuhkan. Jika rasa lelah muncul (weakness), dosis obat ini harus diturunkan. Untuk menambah pengobatan oral, baclofen juga dapat diberikan via pompa implant ataupun lewat kateter intratekal. Pendekatan dengan cara ini meminimalisir reaksi efek samping obat, khususnya efek sedasinya, namun tetap memberikan resiko ancaman depresi SSP dan harusnya digunakan oleh dokter yang telah terlatih dalam pemberian terapi intratekal. Tizanidine (ZANFLEX) adalah suatu agonis dari reseptor 2-adrenergik pada SSP. Obat ini mengurangi spastisitas otot dan diduga beraksi meningkatkan inhibisi presinap neuron motoris. Tizanidine banyak digunakan dalam terapi spastisitas pada multiple sklerosis atau post stroke, namu obat ini juga dapat digunakan efektif pada penderita ALS. Terapi inisiasi diberikan dalam dosis rendah 2 sampai 4 mg saat sebelum istirahat dan dititrasi secara gradual meningkat. Drowsiness, astenia, dan dizzines dapat membatasi pemberian dosis. Benzodiazepines (lihat bab 17), seperti clonazepam (KLONIPIN) efektif sebagai antispasmodik, tetapi obat ini
menyebabkan depresi pernapasan pada penderita ALS tahap lanjut. Dantrolene (DANTRIUM) juga terbukti di Amerika Serikat untuk mengobati spasme otot. Dalam kontrasnya pada agen yang telah dibahas sebelumnya, dantrolene beraksi langsung pada serabut otot skelet, menyebabkan fluks ion kalsium melewati retukulum sarkoplasma. Oleh karena dapat menyebabkan eksaserbasi kelemahan otot, maka obat ini tidak digunakan pada ALS, namun obat ini efektif dalam mengatasi spastisitas oleh karena stroke atau cedera medula spinalis dan dalam hipertermia maligna. Dantrolene dapat menyebabkan hepatotoksisitas, jadi sangatlah penting untuk melakukan tes fungsi hati sebelum dan selama pemberian terapi obat ini.
PROSPEK Meski perkembangan pada teapi simtomatik dari kelainan degenerasi saraf, khususnya Parkinson, dapat memperbaiki kehidupan dari banyak pasien, namun tujuan utam dari penelitian saat ini ialah untuk menghasilkan terapi yang dapat mencegah, menghambat, atau membalikkan kematian sel saraf. Area yang menjanjikan dari pengembangan obat adalah pada mekanisme pada beberapa kelainan: eksotitoksisitas, defek metabolisme energi, dan
stres oksidatif. Antagonis glutamat memiliki potensi tinggi, namun penggunaannya dibatasi oleh aktivitas nonselektif relatif dari agenagen yang ada. Meningkatkan pengetahuan atas struktur dan fungsi subtipe reseptor glutamat dapat menghasilkan agen-agen yang lebih selektif dan berguna. Reduksi farmakologis dari stres oksidatif juga kemungkinan dapat dilakukan dengan mudah meskipun hasil-hasil yang mengecewakan pada percobaan awal klinis pada pemberian tokoferol dan selegiline. Faktor-faktor pertumbuhan neuron juga merupakan area yang penting untuk pengembangan obat. Beberapa faktor yang mempromosikan diferensiasidari neuron dan pembentukan dari koneksi neuron selama pembentukan telah dapat diidentifikasi, dan hal ini dapat terbukti berguna untuk memperlambat ataupun membalikkan kematian sel saraf. Pendekatan yang saat ini lebih langsung dan tersedia untuk membalikkan hilangnya neuron ialah transplantasi neuron melalui pembedahan; hal ini dpat diselesaikan pada penyakit Parkinson dengan tingkat kesuksesan sedang dan telah disodorkan sebagai terapi yang dapat dipakai untuk kondisi penyakit lainnya misalnya Alzheimer. Sebagai tambahan atas pendekatan utama tadi, maka terapi yang lebih spesifik atas berbagai penyakit bervariasi ini harusnya dapat lebih mudah diperoleh karena adanya pekembangan pengetahuan akan etiologi penyakit. Contohnya, ditemukannya peran dari -amiloid pada
Alzheimer membuat studi dari agen-agen yang ditujukan untuk mengubah sintesis -amiloid atau mencegah akumulasinya; sama seperti ini, ditemukannya gen Hungtington menyebabkan munculnya ide strategi terapi baru untuk penyakit ini.
Anda mungkin juga menyukai
- DopaminDokumen5 halamanDopaminputrishabrinaBelum ada peringkat
- Laporan Kasus I Katarak MaturDokumen15 halamanLaporan Kasus I Katarak Maturz3r0m2n100% (4)
- Artritis Reumatoid JuvenilDokumen22 halamanArtritis Reumatoid JuvenilAnhi RamdhaniBelum ada peringkat
- Terapi ParkinsonDokumen14 halamanTerapi ParkinsonnellieauthorBelum ada peringkat
- Dopamin PathwayDokumen22 halamanDopamin PathwayfelmiBelum ada peringkat
- Neurotransmitter FungsiDokumen21 halamanNeurotransmitter FungsiNida SBelum ada peringkat
- TugasDokumen17 halamanTugasdora yolandaBelum ada peringkat
- Perkinson DiseaseDokumen5 halamanPerkinson Disease075. Hortensa MukudjeyBelum ada peringkat
- Jurnal Levodopa ParkinsonDokumen13 halamanJurnal Levodopa ParkinsonAmanda FaradillahBelum ada peringkat
- Tentang DopaminDokumen5 halamanTentang Dopaminmikael pabilangBelum ada peringkat
- Refarat LevodopaDokumen14 halamanRefarat LevodopaPalneuro UnsriBelum ada peringkat
- Ulasan Komprehensif Jurnal (Mekanisme Kerja Obat)Dokumen94 halamanUlasan Komprehensif Jurnal (Mekanisme Kerja Obat)Gustria ErnisBelum ada peringkat
- Hubungan Skizofrenia Dengan Kadar DopaminDokumen16 halamanHubungan Skizofrenia Dengan Kadar DopaminHanis Malek100% (1)
- Metamfetamin, Dopamin Dan PsikotikDokumen71 halamanMetamfetamin, Dopamin Dan PsikotikDany H. LudongBelum ada peringkat
- Agonis Reseptor-Wps OfficeDokumen7 halamanAgonis Reseptor-Wps OfficehayyatBelum ada peringkat
- Parkinson RasagilineDokumen18 halamanParkinson RasagilineSarah ChaidirBelum ada peringkat
- PARKINSONDokumen44 halamanPARKINSONRamadhani Fithra Subhiya-ChaniagoBelum ada peringkat
- Refarat Peranan Neurotransmiter Dopamin Pada ManusiaDokumen4 halamanRefarat Peranan Neurotransmiter Dopamin Pada ManusiaMarta TaTa SalemberBelum ada peringkat
- OBAT PARKINSONDokumen12 halamanOBAT PARKINSONCitra RahayuBelum ada peringkat
- Dobutamin SGDokumen25 halamanDobutamin SGnugraha sultanBelum ada peringkat
- Anti ParkinsonDokumen24 halamanAnti ParkinsonNadanNadhifahBelum ada peringkat
- Anestesi - Dopamin DobutaminDokumen24 halamanAnestesi - Dopamin DobutaminArdelia MithakarinaBelum ada peringkat
- Obat Penyakit ParkinsonDokumen12 halamanObat Penyakit Parkinsonamoet_122Belum ada peringkat
- Pengobatan Penyakit ParkinsonDokumen25 halamanPengobatan Penyakit ParkinsonVito OeiBelum ada peringkat
- Skizofrenia Dan DopaminDokumen4 halamanSkizofrenia Dan DopaminRahajeng AdzahanaBelum ada peringkat
- DopaminergicDokumen59 halamanDopaminergicwulandariBelum ada peringkat
- Dopamin dan NeurotransmiterDokumen7 halamanDopamin dan NeurotransmiterArinaBelum ada peringkat
- SISTEM SARAF PUSAT ANTIPARKINSON Kel7Dokumen2 halamanSISTEM SARAF PUSAT ANTIPARKINSON Kel7Wulan ZahryBelum ada peringkat
- Bagus PambudiDokumen10 halamanBagus PambudiAhmad NazharBelum ada peringkat
- 5 Jaras Dopamin NeurotransmitterDokumen5 halaman5 Jaras Dopamin NeurotransmitterReksayudha PradipoBelum ada peringkat
- CLOZAPINEDokumen4 halamanCLOZAPINEIrenLayBelum ada peringkat
- MAKALAH PARKINSONDokumen44 halamanMAKALAH PARKINSONUrsula Herfina Tri KusumastutiBelum ada peringkat
- Terapi Penyakit ParkinsonDokumen19 halamanTerapi Penyakit ParkinsonNi Putu Ratna SariBelum ada peringkat
- TrifluoperazineDokumen3 halamanTrifluoperazineRan HiliaryBelum ada peringkat
- Kuliah Obat Anti ParkinsonDokumen35 halamanKuliah Obat Anti ParkinsonMujriah TahirBelum ada peringkat
- OBAT ANTIPSIKOTIKDokumen38 halamanOBAT ANTIPSIKOTIKJamalul AdilBelum ada peringkat
- NeurotransmitterDokumen10 halamanNeurotransmitterMuhammad Iqbal AnandBelum ada peringkat
- Makalah Farmakologi Molekuler - Suherni Malik - 23018051Dokumen11 halamanMakalah Farmakologi Molekuler - Suherni Malik - 23018051atanasiusBelum ada peringkat
- MEKANISME ANTIPSIKOTIKDokumen2 halamanMEKANISME ANTIPSIKOTIKBy SAXTIBelum ada peringkat
- Farmakologi Diazepam dalamDokumen3 halamanFarmakologi Diazepam dalamThifanny KhairunnisaBelum ada peringkat
- Mekanisme NeurotransmiterDokumen3 halamanMekanisme NeurotransmiterSyafira Nurul HasnaBelum ada peringkat
- Obat Pada Penyakit ParkinsonDokumen14 halamanObat Pada Penyakit ParkinsonMuhammad AsyrafBelum ada peringkat
- Dopamin dan Perannya dalam Sistem Saraf PusatDokumen10 halamanDopamin dan Perannya dalam Sistem Saraf PusatShahnazBelum ada peringkat
- Farmakologi Obat Obat Penyakit ParkinsonDokumen34 halamanFarmakologi Obat Obat Penyakit ParkinsonZakiya Kamila MuhamadBelum ada peringkat
- Patofisiologi ParkinsonDokumen2 halamanPatofisiologi ParkinsonRiyanti Januani AnggiaBelum ada peringkat
- Laporan BiokimiaDokumen20 halamanLaporan BiokimiaMusdal RBelum ada peringkat
- Pengantar SSPDokumen46 halamanPengantar SSPabitrendy14Belum ada peringkat
- EFEK ARIPIPRAZOLE PADA JALUR MESOLYMBICDokumen2 halamanEFEK ARIPIPRAZOLE PADA JALUR MESOLYMBICLiya SuwarniBelum ada peringkat
- Referat Ganglia BasalisDokumen20 halamanReferat Ganglia BasalisAyu Isyana WardhaniBelum ada peringkat
- Farmakoterapi ParkinsonDokumen32 halamanFarmakoterapi Parkinsonemma shabirBelum ada peringkat
- ANTIPSDokumen8 halamanANTIPSRomi WijiantoBelum ada peringkat
- Parkinson terapi tatalaksanaDokumen4 halamanParkinson terapi tatalaksanaMuhammad ArdiansyahBelum ada peringkat
- DopaminDokumen5 halamanDopaminKhadijah NurkhalizahBelum ada peringkat
- Dopamin Dan Reseptor DopaminergikDokumen24 halamanDopamin Dan Reseptor DopaminergikFajri Romadhon100% (1)
- Patofisiologi HHPDokumen21 halamanPatofisiologi HHPErwan Wijaya Putra SianiparBelum ada peringkat
- Hormon Medula AdrenalDokumen21 halamanHormon Medula AdrenalTeuku Arief MaulanaBelum ada peringkat
- QefrqefwqDokumen6 halamanQefrqefwqivan_adeputraBelum ada peringkat
- Diani Katarak PDFDokumen26 halamanDiani Katarak PDFalhamwahyudinBelum ada peringkat
- Konsensus Pengelolaaln Dan Pencegahan Diabets Melitus Tipe 2 Di Indonesia 2006Dokumen58 halamanKonsensus Pengelolaaln Dan Pencegahan Diabets Melitus Tipe 2 Di Indonesia 2006aidinasrul91% (22)
- Respina 2013Dokumen2 halamanRespina 2013Anhi RamdhaniBelum ada peringkat
- SRT KematianDokumen15 halamanSRT KematianlogadasanrajaBelum ada peringkat
- 1 - 22 - 209berita Terkini-Pemberian Antibiotik Jangka Pendek Untuk ISK Pada PriaDokumen1 halaman1 - 22 - 209berita Terkini-Pemberian Antibiotik Jangka Pendek Untuk ISK Pada PriaAnhi RamdhaniBelum ada peringkat
- OPTIMIZED TITLEDokumen37 halamanOPTIMIZED TITLEMardiansyah Dicka100% (2)
- InfanticideDokumen12 halamanInfanticidedido10thBelum ada peringkat
- Petunjuk Praktis Terapi Insulin Pada Pasien Diabetes MelitusDokumen41 halamanPetunjuk Praktis Terapi Insulin Pada Pasien Diabetes Melitusaidinasrul100% (28)
- Perkonsil No. 1 Tahun 2010 TTG REGISTRASI DOKTER PROGRAM INTERNSIPDokumen9 halamanPerkonsil No. 1 Tahun 2010 TTG REGISTRASI DOKTER PROGRAM INTERNSIPdr.Hansen.SHBelum ada peringkat
- OPTIMIZED TITLEDokumen37 halamanOPTIMIZED TITLEMardiansyah Dicka100% (2)
- 1 - 07 - 209perbedaan Karakteristik Lanjut Usia Yang Tinggal Di Keluarga Dengan Di Panti Di Jakarta BaratDokumen8 halaman1 - 07 - 209perbedaan Karakteristik Lanjut Usia Yang Tinggal Di Keluarga Dengan Di Panti Di Jakarta BaratAditya PamungkasBelum ada peringkat
- 16 - 206berita Terkini-Kasus Terbaru Resistensi Neisseria Gonorrhoeae Di Kanada-Resistensi Cefixime Semakin MeluasDokumen1 halaman16 - 206berita Terkini-Kasus Terbaru Resistensi Neisseria Gonorrhoeae Di Kanada-Resistensi Cefixime Semakin MeluasAnhi RamdhaniBelum ada peringkat
- JambanDokumen26 halamanJambanAnhi RamdhaniBelum ada peringkat
- Resep Aneka AyamDokumen39 halamanResep Aneka Ayamemdi2702Belum ada peringkat
- GM 131 Slide Manajemen Kesehatan Masyarakat 2Dokumen16 halamanGM 131 Slide Manajemen Kesehatan Masyarakat 2Anhi RamdhaniBelum ada peringkat
- 21 - 210berita Terkini-Obat Parkinson Baru Yang MenjanjikanDokumen1 halaman21 - 210berita Terkini-Obat Parkinson Baru Yang MenjanjikanAnhi RamdhaniBelum ada peringkat
- Penyuluhankesehatangigimulutsalam 131108103147 Phpapp02Dokumen19 halamanPenyuluhankesehatangigimulutsalam 131108103147 Phpapp02erwansyah1990Belum ada peringkat
- Promosi KesehatanDokumen3 halamanPromosi KesehatanAnhi RamdhaniBelum ada peringkat
- Makalah AkalasiaDokumen37 halamanMakalah AkalasiaAnonymous sQA8kDgBelum ada peringkat
- Alat KontrasepsiDokumen20 halamanAlat KontrasepsiFebriyana SalehBelum ada peringkat
- Referat Radikulopati LumbalDokumen38 halamanReferat Radikulopati LumbalAnhi RamdhaniBelum ada peringkat
- Alat KontrasepsiDokumen20 halamanAlat KontrasepsiFebriyana SalehBelum ada peringkat
- Penatalaksanaan Hipertensi Pada StrokeDokumen8 halamanPenatalaksanaan Hipertensi Pada StrokeMartvera SusilawatiBelum ada peringkat
- Sindrom Stevens JohnsonDokumen40 halamanSindrom Stevens JohnsonAnhi RamdhaniBelum ada peringkat
- Manfaat AsiDokumen4 halamanManfaat AsiFebbyola Sendi MoniagaBelum ada peringkat
- KEDOKTERANDokumen3 halamanKEDOKTERANAnhi RamdhaniBelum ada peringkat
- SLE-Tips-Diagnosis-dan-PengobatanDokumen19 halamanSLE-Tips-Diagnosis-dan-PengobatanAnhi RamdhaniBelum ada peringkat