Kel.9 - Sifat Periodik Unsur - Pendidikan Matematika
Diunggah oleh
FutridesyDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kel.9 - Sifat Periodik Unsur - Pendidikan Matematika
Diunggah oleh
FutridesyHak Cipta:
Format Tersedia
Tugas Kelompok
Nama Anggota : 1. Putri Istiqomah (193010206018)
2. Futridesy Angraini (193010206020)
3. Florentino Soverdi Balun (193020206036)
4. Tasya Florensia (193020206042)
5. M.Ragil Abri Yandi (193030206064)
Mata Kuliah : Kimia Dasar
Dosen Pengampu : Dra. Ruli Meiliawati, M.Pd.
Diskusi Sifat-sifat Keperiodikan Unsur
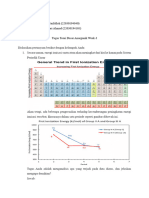
1. Jari-jari atom adalah ...
Jawab :
Jari-jari atom adalah jarak dari inti atom sampai kulit elektron terluar. Jari-jari atom
adalah jarak dari inti atom ke orbital elektron terluar yang stabil dalam suatu atom
dalam keadaan setimbang.
2. Sifat jari-jari atom dalam suatu golongan dan dalam satu periode...
Jawab :
Sifat jari-jari atom dalam suatu golongan dan dalam satu periode, sebagai berikut :
a. Dalam satu golongan dari atas ke bawah jari-jari atom semakin besar.
b. Dalam satu periode dari kiri ke kanan, jari-jari atom semakin kecil.
Penjelasan:
a. Dalam satu golongan dari atas ke bawah, kulit atom bertambah (ingat jumlah kulit
= nomor periode), sehingga jari-jari atom juga bertambah besar.
b. Dari kiri ke kanan, jumlah kulit tetap tetapi muatan inti (nomor atom) dan
jumlah elektron pada kulit bertambah. Hal tersebut mengakibatkan gaya tarik-
menarik antara inti dengan kulit elektron semakin besar sehingga jari-jari atom
makin kecil.
3. Keelektronegatifan adalah...
Jawab :
Keelektronegatifan adalah suatu bilangan yang menyatakan kecenderungan suatu
unsur menarik elektron dalam suatu molekul senyawa.
4. Sifat keeletronegatifan dalam satu golongan dan satu periode...
Jawab :
Sifat keeletronegatifan dalam satu golongan dan satu periode, sebagai berikut :
a. Dalam satu golongan dari atas ke bawah keelektronegatifan semakin berkurang.
b. Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah.
Penjelasan:
Tidak ada sifat tertentu yang dapat diukur untuk menetukan/membandingkan
keelektronegatifan unsur-unsur. Energi ionisasi dan afinitas elektron berkaitan dengan
besarnya daya tarik elektron. Semakin besar daya tarik elektron semakin besar energi
ionisasi, juga semakin besar (semakin negatif) afinitas elektron. Jadi, suatu unsur
(misalnya fluor) yang mempunyai energi ionisasi dan afinitas elektron yang besar
akan mempunyaikeelektronegatifan yang besar. Semakin besar keelektronegatifan,
unsur cenderung makin mudah membentuk ion negatif. Semakin kecil
keelektronegatifan, unsur cenderung makin sulit membentuk ion negatif, dan
cenderung semakin mudah membentuk ion positif.
5. Sifat logam adalah...
Jawab :
Secara kimia sifat logam dikaitkan dengan keelektropositifan, yaitu kecenderungan
atom melepas elektron membentuk ion positif. Jadi sifat logam akan bergantung pada
energi ionisasi. Makin besar energi ionisasi, makin sukar bagi atom untuk melepas
elektron dan makin berkurang sifat logamnya.
Ditinjau dari konfigurasi elektron, unsur – unsur logam cenderung melepaskan
elektron (memiliki energi ionisasi yang kecil), sedangkan unsur-unsur bukan logam
cenderung menangkap elektron (memiliki keelektronegatifan yang besar).
6. Dalam satu periode sifat logam unsur...
Jawab :
Dalam satu periode, dari kiri ke kanan sifat logam berkurang, sedangkan sifat
nonlogam bertambah.
Dalam satu golongan, dari atas ke bawah bertambah, sedangkan sifat non logam
berkurang.
7. Afinitas Elektron adalah...
Jawab :
Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral dalam
wujud gas pada waktu menerima satu elektron sehingga terbentuk ion negatif.
8. Sifat afinitas elektron dalam satu golongan dan satu periode...
Jawab :
a. Dalam satu golongan dari atas ke bawah afinitas elektron semakin kecil.
b. Dalam satu periode dari kiri ke kanan afinitas elektron semakin besar.
Penjelasan:
Apabila ion negatif yang terbentuk stabil, energi dibebaskan dinyatakan dengan tanda
negatif (-). Apabila ion negatif yang terbentuk tidak stabil, energi diperlukan/diserap
dinyatakan dengan tanda positif (+). Kecenderungan dalam afinitas elektron lebih
bervariasi dibandingkan dengan energi ionisasi.
Anda mungkin juga menyukai
- LK 1 Modul 1 ProfesionalDokumen6 halamanLK 1 Modul 1 Profesionalsilvi nafidah0% (1)
- Pemb. 6 Sifat Sifat Periodik Unsur Klas XDokumen9 halamanPemb. 6 Sifat Sifat Periodik Unsur Klas XnurwindaBelum ada peringkat
- Sifat Periodik2Dokumen26 halamanSifat Periodik2hanzallaodeBelum ada peringkat
- 10 IPA 4 - Hand Out - Keperiodikan UnsurDokumen8 halaman10 IPA 4 - Hand Out - Keperiodikan UnsurDipa Halomoan DamanikBelum ada peringkat
- Sifat Keperiodikan UnsurDokumen3 halamanSifat Keperiodikan UnsurAldy NugrahaBelum ada peringkat
- Sifat Keperiodikan Unsur Adalah Sifat-Sifat Yang Berubah Secara Beraturan Sesuai DenganDokumen3 halamanSifat Keperiodikan Unsur Adalah Sifat-Sifat Yang Berubah Secara Beraturan Sesuai Denganhilmi_nUFlBelum ada peringkat
- Sifat Periodik SDRHNDokumen12 halamanSifat Periodik SDRHNHanindi FajrinaBelum ada peringkat
- Sifat Keperiodikan UnsurDokumen9 halamanSifat Keperiodikan UnsurRhine ArdiBelum ada peringkat
- Bahan Ajar Sifat Periodik UnsurDokumen8 halamanBahan Ajar Sifat Periodik UnsurFadilla Qinthara ZahraniBelum ada peringkat
- Makalah Unsur PeriodikDokumen9 halamanMakalah Unsur Periodikyogi iyaiyalahBelum ada peringkat
- Materi Sifat Periodik UnsurDokumen10 halamanMateri Sifat Periodik UnsurtanzilataqiaBelum ada peringkat
- SifatDokumen3 halamanSifatFemmy Yanti ABelum ada peringkat
- Sifat Unsur PeriodikDokumen15 halamanSifat Unsur PeriodikAde TriBelum ada peringkat
- Sifat Periodik UnsurDokumen20 halamanSifat Periodik UnsurSisyeNoyaBelum ada peringkat
- Tugas Mata Kuliah Kimia Dasar I Baru-1Dokumen9 halamanTugas Mata Kuliah Kimia Dasar I Baru-1Dhika PutriciaBelum ada peringkat
- Sifat Keperiodikan Unsur (KIMIA)Dokumen23 halamanSifat Keperiodikan Unsur (KIMIA)MFurqanulIkramBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurIsmi Mu'affifahBelum ada peringkat
- LKPD Sifat Periodik UnsurDokumen7 halamanLKPD Sifat Periodik UnsurFTC •IqbalBelum ada peringkat
- Sifat UnsurDokumen30 halamanSifat UnsursamuelexaudyBelum ada peringkat
- Sistem Periodik Unsur - KIMIA KELAS XDokumen6 halamanSistem Periodik Unsur - KIMIA KELAS XTabitha Maudy Charoline Ginting100% (1)
- Keteraturan Jari2 Afinitas DLLDokumen11 halamanKeteraturan Jari2 Afinitas DLLkdkhimuraBelum ada peringkat
- Materi Kimia Kelas XDokumen6 halamanMateri Kimia Kelas XYokoSimanjuntakBelum ada peringkat
- Sifat Sifat Unsur PeriodikDokumen5 halamanSifat Sifat Unsur Periodikhrfmartin 45Belum ada peringkat
- Keperiodikan UnsurDokumen58 halamanKeperiodikan UnsurNur FadiaBelum ada peringkat
- Pptsifatkeperiodikanunsur 131201003300 Phpapp01Dokumen12 halamanPptsifatkeperiodikanunsur 131201003300 Phpapp01bintangfitrahidayatBelum ada peringkat
- Sifat PeriodikDokumen4 halamanSifat PeriodikNurul Ayu MuliawatiBelum ada peringkat
- X - Kimia - KD 3.4 - SIFAT-SIFAT PERIODIK UNSURDokumen12 halamanX - Kimia - KD 3.4 - SIFAT-SIFAT PERIODIK UNSURRima MelatiBelum ada peringkat
- X Kimia KD-3.4 FinalDokumen7 halamanX Kimia KD-3.4 FinalRizki SetiawanBelum ada peringkat
- Sifat Periodik UnsurDokumen3 halamanSifat Periodik UnsurYaqinBelum ada peringkat
- Sifat-Sifat Periodik UnsurDokumen11 halamanSifat-Sifat Periodik UnsurAnggun Teh PamegetBelum ada peringkat
- Sifat Periodik UnsurDokumen9 halamanSifat Periodik UnsurGusdwi DwipaBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen49 halamanStruktur Atom Dan Sistem Periodik UnsurFianita SalmaBelum ada peringkat
- Periodisitas Sifat UnsurDokumen7 halamanPeriodisitas Sifat Unsurferrer_madridis7629Belum ada peringkat
- LKPDDokumen14 halamanLKPDAristha ArsyBelum ada peringkat
- Media - Presentasi SPUDokumen12 halamanMedia - Presentasi SPUWahyu UswaBelum ada peringkat
- SPU KesatuDokumen4 halamanSPU KesatuFawzia AuliaBelum ada peringkat
- LK 1 Modul 1 Profesional EditDokumen6 halamanLK 1 Modul 1 Profesional Editellsha septyawantiBelum ada peringkat
- Materi Olimpiade KimiaDokumen9 halamanMateri Olimpiade KimiaDummy CipawBelum ada peringkat
- Resume Sifat-Sifat Keperiodikkan UnsurDokumen13 halamanResume Sifat-Sifat Keperiodikkan UnsurA NahulBelum ada peringkat
- Sifat-Sifat Keperiodikan UnsurDokumen8 halamanSifat-Sifat Keperiodikan UnsurAhmad FaisallBelum ada peringkat
- Rencana Pelaksanaan Pembelajaran SpuDokumen5 halamanRencana Pelaksanaan Pembelajaran Spuhera hmBelum ada peringkat
- Sifat-Sifat UnsurDokumen29 halamanSifat-Sifat UnsurLilia Rahma HasrangBelum ada peringkat
- Sifat Periodik UnsurDokumen5 halamanSifat Periodik UnsurSri Laras SetiasihBelum ada peringkat
- Kimsek 4Dokumen7 halamanKimsek 4RaniBelum ada peringkat
- 040 - Moh Threewahyu Saifulloh - Tugas TDA Week-3 - PKB22Dokumen6 halaman040 - Moh Threewahyu Saifulloh - Tugas TDA Week-3 - PKB22Egi 100PKB22Belum ada peringkat
- SDokumen3 halamanSZarah Rizki SyahadatinBelum ada peringkat
- Bab II Sifat-Sifat UnsurDokumen22 halamanBab II Sifat-Sifat UnsurLm PradinotoBelum ada peringkat
- Sifat Keperiodikan Unsur Kelompok 3Dokumen14 halamanSifat Keperiodikan Unsur Kelompok 3MulyawatiBelum ada peringkat
- Makalah Sistem PeriodikDokumen19 halamanMakalah Sistem PeriodikRina AngrianiBelum ada peringkat
- Srihayuni - 20036075 - Resume Minggu 5 - SSADokumen6 halamanSrihayuni - 20036075 - Resume Minggu 5 - SSASrihayuniBelum ada peringkat
- PJJ 7 Sifat-Sifat Periodik UnsurDokumen3 halamanPJJ 7 Sifat-Sifat Periodik UnsurPatri MallisaBelum ada peringkat
- PJJ 7 Sifat-Sifat Periodik UnsurDokumen3 halamanPJJ 7 Sifat-Sifat Periodik UnsurPatri MallisaBelum ada peringkat
- Materi Kimia Sifat Sifat Periodik UnsurDokumen1 halamanMateri Kimia Sifat Sifat Periodik UnsurArchangel SodyBelum ada peringkat
- K3do BHTW VMRF NCDJ Guc6 rT8f L2vp Jdri Yz2g MPNM CDNT 8v8g IIDokumen14 halamanK3do BHTW VMRF NCDJ Guc6 rT8f L2vp Jdri Yz2g MPNM CDNT 8v8g IIM.Hindri .PBelum ada peringkat
- Sistem PeriodikDokumen30 halamanSistem PeriodikHengky FirmansyahBelum ada peringkat
- Kimia Anorganik Jari-Jari AtomDokumen8 halamanKimia Anorganik Jari-Jari Atomfaiz rizkyBelum ada peringkat
- Soal Sifat Keperiodikan Unsur Dan Pembahasannya SoalDokumen5 halamanSoal Sifat Keperiodikan Unsur Dan Pembahasannya Soalyulli elveni qomariyahBelum ada peringkat
- Tugas KBM2 - FUTRIDESY ANGRAINI (193010206020)Dokumen16 halamanTugas KBM2 - FUTRIDESY ANGRAINI (193010206020)FutridesyBelum ada peringkat
- Ti1 - Futridesy Angraini - Konsep Dasar Ilmu KimiaDokumen4 halamanTi1 - Futridesy Angraini - Konsep Dasar Ilmu KimiaFutridesyBelum ada peringkat
- LKPD TrapesiumDokumen8 halamanLKPD TrapesiumFutridesyBelum ada peringkat
- Surat Pinjam Tempat Eco Village SPRP GKE SAMARIA 2021Dokumen1 halamanSurat Pinjam Tempat Eco Village SPRP GKE SAMARIA 2021FutridesyBelum ada peringkat
- E-Lkpd Aritmatika Sosial Kelas 7Dokumen7 halamanE-Lkpd Aritmatika Sosial Kelas 7FutridesyBelum ada peringkat
- Rangkuman PresentasiDokumen7 halamanRangkuman PresentasiFutridesyBelum ada peringkat
- 1 Pertanyaan Untuk Pemecahan MasalahDokumen2 halaman1 Pertanyaan Untuk Pemecahan MasalahFutridesyBelum ada peringkat
- Makalah SPMDokumen5 halamanMakalah SPMFutridesyBelum ada peringkat
- Futridesy Angraini 193010206020 UasadmDokumen11 halamanFutridesy Angraini 193010206020 UasadmFutridesyBelum ada peringkat
- Bentuk Persamaan Parabol1Dokumen6 halamanBentuk Persamaan Parabol1FutridesyBelum ada peringkat
- LKM 1 Biologi Dasar Futridesy AngrainiDokumen6 halamanLKM 1 Biologi Dasar Futridesy AngrainiFutridesyBelum ada peringkat
- Pertanyaan Untuk Pemecahan MasalahDokumen2 halamanPertanyaan Untuk Pemecahan MasalahFutridesy100% (1)