Kelainan Pengosongan Lambung Pada Penderita Diabetes Mellitus
Diunggah oleh
Farrah C Ramadhani0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
25 tayangan7 halamanjurnal acu
Judul Asli
Kelainan Pengosongan Lambung pada Penderita Diabetes Mellitus
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inijurnal acu
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
25 tayangan7 halamanKelainan Pengosongan Lambung Pada Penderita Diabetes Mellitus
Diunggah oleh
Farrah C Ramadhanijurnal acu
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 7
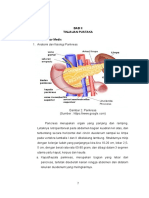
Kelainan Pengosongan Lambung pada Penderita Diabetes Mellitus
Diabetes mellitus merupakan penyakit sistemik yang dapat menyebabkan
disfungsi berbagai organ tubuh. Diabetes mellitus juga dikaitkan dengan kelainan
pengosongan lambung, termasuk keterlambatan pengosongan lambung secara
sementara, pengosongan lambung yang cepat sementara, keterlambatan
pengosongan lambung secara terus menerus (gastroparesis), dan pengosongan
lambung yang cepat secara terus-menerus. Perubahan sementara dalam
pengosongan lambung merupakan respon kontraregulasi dan tidak memerlukan
pengobatan. Keterlambatan pengosongan lambung dikaitkan dengan abdominal
symptoms dan dianggap sebagai penyebab penyakit parah. Namun, pengosongan
lambung yang cepat juga dikaitkan dengan gejala yang sama. Sedangkan
keterlambatan dalam pengosongan lambung dapat menyebabkan kesulitan dalam
mengontrol glukosa pada pasien yang menerima terapi insulin, sedangkan
pengosongan lambung yang cepat memainkan peranan penting dalam genesis dan
perkembangan dari diabetes mellitus tipe 2. Pengobatan terhadap pengosongan
lambung yang cepat muncul sebagai target penting untuk manajemen
hiperglikemia postprandial.
Laju pengosongan lambung menunjukkan pengeluaran nutrisi ke dalam
usus. Saluran pencernaan mengeluarkan 1 sampai 4 kkal makanan homogen per
menit,terlepas dari komposisi karbohidrat, protein, dan lemak, ke dalam
duodenum melalui aktivitas motoric dari lambung, diatur oleh mekanisme
neurohumoral akibat stimulasi reseptor-reseptor di duodenum.
Diabetes menyebabkan pola pengosongan lambung yang abnormal dengan
melibatkan perubahan pada aktivitas motorik. Perubahan ini disebabkan oleh
disfungsi saraf vagovagal, melalui sel interstisial Cajal (sel intermediet antara
sistem saraf otonom saluran cerna dan sel otot polos, yang mencetuskan kontraksi
dan mengontrol motilitas saluran cerna) dan otot polos. Perubahan mendadak
kadar gula darah mempengaruhi aktivitas neuron vagus (merangsang lambung
untuk mengeluarkan hormone gastrin, hormone gastrin akan merangsang
pengeluaran insulin, pengeluaran insulin mempermudah metabolism glukosa)
merangsang glukosa atau menghambatbat glukosa di lambung dan menyebabkan
perubahan pengosongan lambung. Hiperglikemia persisten mempengaruhi elemen
molekuler neuron, sel otot polos, dan sel interstisial Cajal melalui stres oksidatif
dan bagian dari makrofag M1 (proinflamasi) dan M2 (prohealing, atau perbaikan)
yang terpolarisasi. Metabolit ini mungkin memiliki efek kompleks pada fungsi
seluler. Mereka dapat menginduksi perubahan transkripsi protein dan microRNA
(miRNA),dengan perubahan konsekuen dari fenotip seluler menjadi
hiperkontraktil atau hipokontraktil sel otot polos.
Gejala perut bagian atas menyerupai dispepsia fungsional karena
keterlambatan pengosongan lambung. Namun, gejala serupa juga dikaitkan
dengan pengosongan lambung yang cepat, menunjukkan bahwa gastroparesis
mungkin bukan penyebab gejala. Gejalanya mungkin karena aktivasi paralel
reseptor sensorik yang disebabkan oleh perubahan inflamasi di dinding lambung.
Oleh karena itu, tindakan untuk mempercepat pengosongan lambung mungkin
tidak meredakan gejala dan dapat memperburuk hiperglikemia.
Review artikel ini merangkum patofisiologi kelainan pengosongan
lambung pada diabetes mellitus dan alasan terapi. Manajemen gastroparesis
simtomatik saat ini dibahas secara luas.
Perubahan Metabolik yang Mempengaruhi Pengosongan Lambung
Glukosa memasuki sel terutama melalui transporter glukosa (GLUT) dan
protein transpor natrium-glukosa (SGLT). Glukokinase mengubah glukosa
intraseluler menjadi glukosa-6-fosfat, yang mengalami glikolisis, suatu proses
yang mengarah pada produksi ATP dan spesies oksigen reaktif (radikal
bebas) di mitokondria. Stres oksidatif (jumlah radikal bebas terlalu banyak)
ringan menyebabkan peningkatan regulasi enzim NADPH oksidase 4
(NOX4), yang menyebabkan stres oksidatif sedang. Selain itu, stres oksidatif
sedang, bersama dengan produk oksidasi lipid, produk akhir glikasi lanjutan,
dan karbonil reaktif, mengubah protein matriks ekstraseluler dan
meningkatkan adhesi dan aktivasi makrofag. Tergantung pada sinyal lokal
tertentu, makrofag mac10 mengalami polarisasi ke M1 atau makrofag M2,
menghasilkan sejumlah sitokin. Stres oksidatif dan sitokin dapat bertindak
melalui faktor transkripsi untuk memodifikasi protein pensinyalan secara
langsung atau melalui regulasi miRNA. RNA noncoding ini adalah regulator
pasca-transkripsi penting dari ekspresi gen. Mereka dapat mengikat target
messenger RNA untuk menekan translasi menjadi protein seluler dan
menyebabkan perubahan yang nyata pada fenotipe seluler. Akibatnya,
miRNA muncul sebagai target terapi yang penting.
Perubahan metabolik yang berbeda masing-masing menghasilkan
perubahan seluler spesifik yang menghasilkan kelainan pengosongan
lambung yang berbeda. Perubahan segera pada tingkat glukosa plasma
mengaktifkan sirkuit motorik vagal (vagus), yang mengakibatkan kelainan
pengosongan lambung sementara. Hiperglikemia kronis dalam hubungannya
dengan stres oksidatif dan polarisasi makrofag memiliki efek khas pada
transmisi neuromuskular, sel interstisial Cajal, dan otot polos, tergantung
pada jenis polarisasi makrofag dan tingkat stres oksidatif dan inflamasi. Stres
oksidatif sedang mengganggu transmisi neuromuskular, menyebabkan
peningkatan jumlah sel interstisial Cajal, dan mengubah otot polos menjadi
fenotipe hiperkontraktil. Selain itu, stres oksidatif sedang meningkatkan
polarisasi makrofag ke tipe M2 atau M1. Polarisasi ke makrofag M2 menekan
makrofag M1 dan respon inflamasinya dan mengakibatkan hilangnya
neurotransmisi yang parah, hilangnya sel interstisial Cajal, dan konversi otot
polos menjadi fenotipe hipokontraktil (lihat Lampiran Tambahan).
Keterlambatan Pengosongan Lambung Sementara
Hiperglikemia postprandial merupakan karakteristik intoleransi glukosa
pada diabetes mellitus. Hiperglikemia akut memperlambat pengosongan
lambung dari makanan yang dapat dicerna selama proses pencernaan dan
residu (sisa) makanan yang tidak dicerna selama periode puasa. Perlambatan
pengosongan lambung menekan hiperglikemia postprandial dan berfungsi
sebagai umpan balik negatif. Perlambatan pengosongan lambung disebabkan
oleh penurunan tonus lambung proksimal dan penekanan kontraksi bagian
antral lambung. Hiperglikemia juga menekan kontraksi kuat dari kompleks
motorik yang migrasi interdigestif (diantara waktu makan), mengakibatkan
pengosongan lambung yang lambat selama proses pencernaan dan periode
interdigestif (puasa).
Gambar 1. Hiperglikemi akut penyebab keterlambatan pengosongan
lambung
Hiperglikemia akut memicu neuron yang menstimulasi glukosa dari aferen
vagus di nodose ganglion (NG) dan nukleus traktus solitarius, yang
merupakan bagian dari sirkuit motorik vagus yang menghambat kerja
lambung (GIVMC/Gastric Inhibitor Vagal Motor Cicuit). Mereka megandung
transporter glukosa (GLUT, tipe tidak terdefinisi) dan transporter natrium-
glukosa (SGLT). Hiperglikemia menyebabkan peningkatan cepat kadar
glukosa intraseluler. Glukokinase mengubah glukosa menjadi glukosa-6-
fosfat, yang mengalami glikolisis untuk menghasilkan asam piruvat, yang
mengarah pada produksi ATP di mitokondria. ATP menghambat Kanal
kalium (KATP) yang sensitif terhadap ATP, menyebabkan depolarisasi, dan
memicu neuron aferen untuk merangsang GIVMC. Namun, efek stimulasi
hiperglikemia dihentikan karena hiperglikemia juga menyebabkan penurunan
regulasi glukokinase. Aktivasi GIVMC melepaskan inhibitory transmitter
(nitrit oksida [NO], ATP, dan vasoactive intestinal polypeptide [VIP]), yang
menurunkan kontraktilitas otot polos dan menyebabkan disfungsi sel
interstisial Cajal, dengan kelainan gelombang lambat yang dihasilkan. Ach
menunjukkan asetilkolin, neuron katekolaminergik CCe dari jalur eksitatori,
neuron katekolaminergik CCi dari jalur inhibitor, neuron kolinergik Ce dari
jalur eksitatori, neuron kolinergik Ci dari jalur inhibitor, nukleus motorik
dorsal dari vagus, neuron yang memproduksi asam gamma-aminobutirat
(GABAergic/neurotransmitter yang menghambat sinyal otak tertentu),
GEVMC (Gastric Excitatory Vagal Motor Circuit), neuron non-adrenergik
non-kolinergik NANC, neuron proopiomelanocortin POMC, dan neuron
preproglukagon PPG.
Seperti yang ditunjukkan pada Gambar 1, hiperglikemia merangsang
neuron yang sensitif terhadap konsentrasi glukosa di aferen vagus dengan
menekan saluran kalium sensitif terhadap ATP (KATP/ATP sensitive
Potassium Channels). Stimulasi sirkuit motorik vagus menghambat kerja
lambung yang dapat mempengaruhi gelombang lambat dari gelombang
listrik, serta otot polos. Hiperglikemia akut dapat mengganggu gelombang
lambat dengan mempengaruhi sel interstisial mienterik Cajal, menyebabkan
takigastria terisolasi (peningkatan siklus aktivitas listrik di lambung, dengan
frekuensi >3,6 siklus per menit [cpm]), meskipun kadar glukosa yang tinggi
tidak secara langsung mempengaruhi sel interstisial Cajal. Takigastria dan
kelainan gelombang lambat lainnya diduga menyebabkan berkurangnya
kontraksi antrum, namun, gelombang lambat tidak berkorelasi dengan
kontraksi mekanis. Kadar glukosa yang tinggi merangsang sirkuit motorik
vagus menghambat lambung, Stimulasi yang menghambat kontraksi dan
mengatasi kontraksi yang dimediasi oleh hiperglikemia dari otot polos yang
terisolasi. Keterlambatan pengosongan lambung sementara akibat
hiperglikemia akut merupakan fenomena kontraregulasi dan tidak
memerlukan pengobatan. Sifat sementara dari efek hiperglikemia dikaitkan
dengan penurunan regulasi glukokinase.
Pengosongan Lambung secara Cepat Sementara
Hipoglikemia akut menyebabkan pengosongan lambung secara cepat.
Hipoglikemi iatrogenic adalah komplikasi umum dan serius dari pemberian
(pengobatan) insulin. Hipoglikemi akut menyebabkan aktivasi dari GEVMC
(Gastric Excitatory Vagal Motor Circuit), yang menginervasi eksitatori
kolinergik ke otot polos lambung, meningkatkan aktivitas kontraktil dan
dengan demikian menyebabkan pengosongan lambung secara cepat. GEVMC
juga berhubungan dengan sel alfa yang menghasilkan glukagon, neuron
orexigenic (merangsang nafsu makan), jalur simpatoadrenal, dan dengan
neuron hipotalamus yang terlibat dalam respons kontraregulasi terhadap
hipoglikemi. Kadar glukosa darah dibawah normal memicu aktivitas
parasimpatis dan sekresi glukagon. Penurunan kadar glukosa lebih rendah
memicu aktivitas simpatik.
Aktivasi GEVMC disebabkan oleh stimulasi neuron yang memproduksi
asam gamma-aminobutirat (GABAergic) yang mengeskspresikan GLUT2 di
dalam nucleus traktus solitarius. Hipoglikemi menyebabkan penurunan kadar
glukosa intraseluler dan menurunkan kadar ATP intraseluler, menyebabkan
penurunan aktivitas Na+/K+ ATPase dan depolarisasi membrane (Gambar 2).
Respon terhadap hipoglikemi akut adalah sementara karena peningkatan
regulasi glukokinase yang cepat dan penggunaan sumber energi lainnya selain
glukosa. Pengosongan lambung yang cepat sementara adalah bagian dari
respon kontraregulasi dan tidak harus diobati. Pada hipoglikemi berulang,
perubahan ini dapat berfungsi sebagai mekanisme perlindungan terhadap
hipoglikemi terkait kegagalan otonom dan gangguan kesaradan terhadap
hipoglikemi, yang berpotensi mengancam jiwa.
Pengosongan Lambung secara Cepat Persisten
Sebelumnya, pengosongan lambung yang cepat dan persisten tidak
dianggap serius sebagai komplikasi dari diabetes mellitus. Hampir 20%
pasien dengan diabetes mellitus tipe 1 atau tipe 2 yang tidak terkontrol
dengan baik, berlangsung lama, terlepas dari ada atau tidak adanya gejala
perut bagian atas, memiliki pengosongan lambung yang cepat bahkan pada
tahap akhir penyakit. Sindrom Dumping, dengan gejala mual postprandial,
kembung, pusing, kemerahan, palpitasi, sakit perut, kram, borborygmi (bising
usus), dan diare, terjadi setelah operasi bypass lambung. Namun, gejala
seperti itu tidak terjadi pada pasien dengan gangguan lambung secara
keseluruhan. Gejala abdomen bagian atas tidak dapat dibedakan dengan
dispepsia fungsional atau gastroparesis. Sekitar 20 hingga 37% pasien dengan
diabetes dan gejala abdominal bagian atas mengalami pengosongan lambung
yang cepat. Angka ini serupa dengan pasien dengan diabetes lama, baik
mereka memiliki gejala abdominal bagian atas atau tidak (Tabel 1), yang
menunjukkan bahwa gejala abdominal bagian atas tidak secara spesifik
berhubungan dengan pengosongan lambung yang cepat. Gangguan ini dapat
merespon terapi insulin intensif pada pasien diabetes tipe 1.
Pengosongan lambung yang cepat memiliki efek intoleransi glukosa, dan
berkaitan dengan genesis dan penyebaran diabetes mellitus tipe 2. Koreksi
dari pengosongan lambung yang cepat dengan cara manipulasi diet dan terapi
farmakologis yang merupakan pusat manajemen dari hiperglikemia
postprandial. Kekurangan amylin atau leptin dikaitkan dengan hiperglikemia
kronis dan pengosongan lambung yang cepat. Terapi seperti metformin,
amylin analogues treatment, dan Glukagon Like Peptide-1 (GLP-1) agonis
dapat mengurangi kecepatan pengosongan lambung.
Anda mungkin juga menyukai
- Manajemen Perioperatif Pasien Dengan Diabetes MellitusDokumen18 halamanManajemen Perioperatif Pasien Dengan Diabetes MellitusmardilasariBelum ada peringkat
- Metabolisme Karbohidrat Dan Diabetes Mellitus Adalah Dua Mata Rantai Yang Tidak Dapat DipisahkanDokumen16 halamanMetabolisme Karbohidrat Dan Diabetes Mellitus Adalah Dua Mata Rantai Yang Tidak Dapat DipisahkanDeviAuliaBelum ada peringkat
- Metabolisme Karbohidrat Dan DiabetesDokumen9 halamanMetabolisme Karbohidrat Dan DiabetesRpadma BpBelum ada peringkat
- Patofisiologi Diabetes MelitusDokumen9 halamanPatofisiologi Diabetes MelitusTasyaBelum ada peringkat
- Intracrine NoerDokumen13 halamanIntracrine Noerm3lzaBelum ada peringkat
- Research Paper DM T1Dokumen20 halamanResearch Paper DM T1Ayu citraBelum ada peringkat
- Patofisiologi Diabetes MelitusDokumen4 halamanPatofisiologi Diabetes MelitusbubiBelum ada peringkat
- Diabetes MelitusDokumen32 halamanDiabetes MelitusElizabeth StokesBelum ada peringkat
- PPT DR Angel Kel 6Dokumen23 halamanPPT DR Angel Kel 6anggasudinBelum ada peringkat
- PBL Blok 21Dokumen42 halamanPBL Blok 21Jefry HanensiBelum ada peringkat
- Skenario 1 Blok EndokrinDokumen39 halamanSkenario 1 Blok EndokrinTetty PrasetyaBelum ada peringkat
- H Gangguan PankreasDokumen27 halamanH Gangguan PankreasSri HantikaBelum ada peringkat
- Diabetes Mellitus Pada AnakDokumen29 halamanDiabetes Mellitus Pada AnakKanisius Rarih Persada82% (11)
- Patofisiologi DMDokumen5 halamanPatofisiologi DMNadia Gina AnggrainiBelum ada peringkat
- Hormon PankreasDokumen8 halamanHormon PankreasZulfahmi Musllim100% (1)
- Patofisiologi Diabetes MellitusDokumen12 halamanPatofisiologi Diabetes MellitusBram Wongso100% (1)
- PP Pemeriksaan Kadar Glukosa 2.1 2024Dokumen10 halamanPP Pemeriksaan Kadar Glukosa 2.1 2024Steven RadityaBelum ada peringkat
- Mekanisme InsulinDokumen9 halamanMekanisme InsulinEdwin Prakoso100% (1)
- Laporan Pendahuluan Keperawatan Gerontik Dengan DM (Diabetes Miletus) Di Ruangan Teratai Panti Sosial Tresna Werdha Pagar Dewa Kota BengkuluDokumen29 halamanLaporan Pendahuluan Keperawatan Gerontik Dengan DM (Diabetes Miletus) Di Ruangan Teratai Panti Sosial Tresna Werdha Pagar Dewa Kota BengkuluErollah OktoberoBelum ada peringkat
- Tipus Ikan GuppyDokumen4 halamanTipus Ikan GuppyMuhammad LukmanBelum ada peringkat
- LAPORAN PRAKTIKUM AntidiabetesDokumen12 halamanLAPORAN PRAKTIKUM Antidiabetesiffat nursalihaBelum ada peringkat
- Askep DM Pada AnakDokumen30 halamanAskep DM Pada Anakaliyah mahmudah100% (2)
- DM Lenny - Minar FinalDokumen29 halamanDM Lenny - Minar FinalAngel NikiyuluwBelum ada peringkat
- Makalah Kegawatdaruratan MetabolikDokumen16 halamanMakalah Kegawatdaruratan MetabolikYulika Nopita SariBelum ada peringkat
- DM Nurul MDokumen29 halamanDM Nurul MNurul Mutmainnah SyukurBelum ada peringkat
- Pengaturan Metabolisme Glukosa Oleh InsulinDokumen3 halamanPengaturan Metabolisme Glukosa Oleh InsulinElman D. FirdausBelum ada peringkat
- SGD Modul Hormon Dan Metabolisme LBM 5Dokumen15 halamanSGD Modul Hormon Dan Metabolisme LBM 5NihayahBelum ada peringkat
- Fisiologi Dan Biokimia Sistem EndokrinDokumen13 halamanFisiologi Dan Biokimia Sistem EndokrindoublejaydBelum ada peringkat
- Patofisiologi Resistensi InsulinDokumen11 halamanPatofisiologi Resistensi InsulinTaufiqurrohman Insect100% (1)
- LP DM GangrenDokumen18 halamanLP DM GangrenNurul Fahmi Rizka LailyBelum ada peringkat
- LP Fransisca Aditia PutriDokumen9 halamanLP Fransisca Aditia PutriLidwina SantiBelum ada peringkat
- LAPORAN PRAKTIKUM FRDokumen10 halamanLAPORAN PRAKTIKUM FREko WahyudiBelum ada peringkat
- Proses Pembentukan Sekresi InsulinDokumen40 halamanProses Pembentukan Sekresi InsulinninahBelum ada peringkat
- Diabetes MelitusDokumen76 halamanDiabetes MelitusGalih Arief Harimurti WawolumajaBelum ada peringkat
- Laporan Praktikum PDFDokumen25 halamanLaporan Praktikum PDFRatuzulfaBelum ada peringkat
- Hormon Insulin Dan GlukagonDokumen17 halamanHormon Insulin Dan GlukagonJëłãńğ Bäjăpåņâ75% (4)
- Maharani - (A1j118033)Dokumen6 halamanMaharani - (A1j118033)Nina100% (1)
- Metabolisme Tubuh (Glukosa)Dokumen26 halamanMetabolisme Tubuh (Glukosa)Arie FandyBelum ada peringkat
- Laporan AntidiabetesDokumen12 halamanLaporan Antidiabetesriskinurvita21Belum ada peringkat
- Struktur Dan Mekanisme Endokrin PankreasDokumen10 halamanStruktur Dan Mekanisme Endokrin PankreasCalvin AuguriusBelum ada peringkat
- Bab IiDokumen34 halamanBab IiAgus FurwantoBelum ada peringkat
- Resistensi Insulin PD DM Tipe 2 - CDK KalbeDokumen4 halamanResistensi Insulin PD DM Tipe 2 - CDK Kalberika100% (1)
- Bab 2Dokumen15 halamanBab 2Cherly Silvia ErichaBelum ada peringkat
- Laporan Pendahuluan Diabetes MelitusDokumen22 halamanLaporan Pendahuluan Diabetes MelitusSantri Handayani100% (2)
- 1 5 Streptozotocin (STZ)Dokumen5 halaman1 5 Streptozotocin (STZ)faril92Belum ada peringkat
- LP DM YulianiDokumen29 halamanLP DM YulianiNi Kadek Dwi ApriantiBelum ada peringkat
- Insulin, Glukogen Dan OksitosinDokumen14 halamanInsulin, Glukogen Dan OksitosinFalles Raintung T100% (1)
- Surat Pernyataan KronologisDokumen1 halamanSurat Pernyataan KronologiskafiBelum ada peringkat
- Contoh Kasus KasusDokumen5 halamanContoh Kasus KasusFarrah C RamadhaniBelum ada peringkat
- DokumenDokumen13 halamanDokumenFarrah C RamadhaniBelum ada peringkat
- Sap Pneumonia AnakDokumen16 halamanSap Pneumonia AnakFarrah C RamadhaniBelum ada peringkat
- DokumenDokumen6 halamanDokumenFarrah C RamadhaniBelum ada peringkat
- Latar Belakang - 012221Dokumen2 halamanLatar Belakang - 012221Farrah C RamadhaniBelum ada peringkat
- Comparison of The Effects of Target Controlled Propofol Infusion and General Anesthesia With Desflurane On Postoperative Cognitive Functions in Controlled Hypotensive Anesthesia - 020227Dokumen24 halamanComparison of The Effects of Target Controlled Propofol Infusion and General Anesthesia With Desflurane On Postoperative Cognitive Functions in Controlled Hypotensive Anesthesia - 020227Farrah C RamadhaniBelum ada peringkat
- Cover CBD 2Dokumen38 halamanCover CBD 2Farrah C RamadhaniBelum ada peringkat
- Latar Belakang - 033925Dokumen3 halamanLatar Belakang - 033925Farrah C RamadhaniBelum ada peringkat
- Critical Appraisal Jurnal Reading Farrah Forensik - 101752Dokumen5 halamanCritical Appraisal Jurnal Reading Farrah Forensik - 101752Farrah C RamadhaniBelum ada peringkat
- Contoh Pengkajian AnastesiDokumen3 halamanContoh Pengkajian AnastesiFarrah C RamadhaniBelum ada peringkat
- Kata Pengantar, Daftar IsiDokumen2 halamanKata Pengantar, Daftar IsiDeeINdraHusainBelum ada peringkat
- Manajemen Klinis Eksostosis Alveolar - 120449Dokumen2 halamanManajemen Klinis Eksostosis Alveolar - 120449Farrah C RamadhaniBelum ada peringkat
- Cover CBD MataDokumen1 halamanCover CBD MataFarrah C RamadhaniBelum ada peringkat
- Hemoroid InternaDokumen40 halamanHemoroid InternaIndra YaniBelum ada peringkat
- Faktor Resiko Dismenore PrimerDokumen4 halamanFaktor Resiko Dismenore PrimerFarrah C RamadhaniyBelum ada peringkat
- Patofisiologi Spondilitis TBDokumen6 halamanPatofisiologi Spondilitis TBFarrah C RamadhaniBelum ada peringkat
- Cover CBD PPHDokumen2 halamanCover CBD PPHFarrah C RamadhaniBelum ada peringkat
- Cover CBD Mata Bedah UmumDokumen1 halamanCover CBD Mata Bedah UmumFarrah C RamadhaniBelum ada peringkat
- Referat KOLANGITISDokumen31 halamanReferat KOLANGITISrizasatryaBelum ada peringkat
- Kata Pengantar Stase BedahDokumen3 halamanKata Pengantar Stase BedahFarrah C RamadhaniBelum ada peringkat
- KATA PENGANTAR-pphDokumen4 halamanKATA PENGANTAR-pphFarrah C RamadhaniBelum ada peringkat
- Bagian KuDokumen1 halamanBagian KuFarrah C RamadhaniBelum ada peringkat
- Yuk Kenalan Dengan COVIDDokumen1 halamanYuk Kenalan Dengan COVIDFarrah C RamadhaniBelum ada peringkat
- Fisiologi Kelenjar TiroidDokumen8 halamanFisiologi Kelenjar TiroidFarrah C RamadhaniBelum ada peringkat
- Electroconvusif TherapyDokumen4 halamanElectroconvusif TherapyFarrah C RamadhaniBelum ada peringkat
- HemostasisDokumen1 halamanHemostasisFarrah C RamadhaniBelum ada peringkat
- Epidemiologi TetanusDokumen3 halamanEpidemiologi TetanusFarrah C RamadhaniBelum ada peringkat
- Jenis Jenis Bencana Di Tempat WisataDokumen13 halamanJenis Jenis Bencana Di Tempat WisataFarrah C RamadhaniBelum ada peringkat