Logam Alkali Tanah
Diunggah oleh
seven0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
19 tayangan13 halamanKimia
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniKimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
19 tayangan13 halamanLogam Alkali Tanah
Diunggah oleh
sevenKimia
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 13
LOGAM ALKALI TANAH
KIMIA SMA XII
1. Mengetahui logam Alkali Tanah di Alam
2. Mengetahui sifat-sifat logam Alkali Tanah
3. Mengetahui senyawa-senyawa Logam Alkali Tanah
Logam Alkali Tanah banyak tersebar di air laut dan
mineral dalam bentuk senyawa dengan bilangan
oksidasi +2
Bebatuan dan mineral mengandung unsur alkali
tanah yang umumnya berupa senyawa karbonat,
silikat, atau sulfat.
Contoh unsur: Berilium sebagai mineral Beril;
Magnesium sebagai Mineral Magnesit, Dolomit,
dan Asbestos
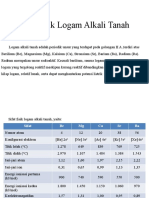
SIFAT UMUM LOGAM ALKALI TANAH
Sifat umum Be Mg Ca Sr Ba
Nomor Atom 4 12 20 38 56
Konfigurasi Elektron [He] 2s2 [Ne] 3s2 [Ar] 4s2 [Kr] 5s2 [Xe] 6s2 • Semua logam Alkali
tanah merupakan logam
Titik Leleh (oc) 1.278 649 839 769 725
yang tergolong reaktif
Titik Didih (oc) 2.970 1.107 1.484 1.384 1.643 meskipun kurang reaktif
Jari-jari atom (Å) 1,12 1,60 1,97 2,15 2,22 dibandingkan logam
Jari-jari Ion (Å) 0,31 0,65 0,99 1,13 1,35 alkali,
Energi Ionisasi pertama • Mempunyai kilap logam,
900 740 590 550 500
(KJ/mol) • Relatif lunak,
Energi Ionisasi kedua (KJ/mol) 1.800 1.450 1.150 1.060 970
• Dapat menghantarkan
panas dan listrik dengan
Keelektronegatifan 1,57 1,31 1,00 0,95 0,89 baik
Potensial Elektrode (Volt)
-1,85 -2,37 -2,87 -2,89 -2,90
M2+ + 2e- M
Massa jenis (g/mL) 1,86 1,75 1,55 2,6 3,6
SIFAT KIMIA LOGAM ALKALI TANAH
Kereaktifannya semakin bertambah dari Be ke Ba. Be sama dengan unsur alkali
tanah yang kurang reaktif bahkan tidak bereaksi dengan air
BEBERAPA REAKSI UNSUR ALKALI TANAH
1.Reaksi logam alkali tanah dengan air
Be tidak bereaksi dengan air sedagkan logam Mg bereaksi sangat lambat. Ca, Sr, Ba bereaksi sangat
cepat seperti reaksi antar logam Na dan air.
Contohnya : Ca(s) + 2H2O(l) Ca(OH)2(aq) + H2(g).
2. Reaksi logam alkali tanah dengan halogen
logam alkali tanah (kecuali Be) bereaksi cepat dengan halogen mementuk garam halida. Sehingga
gaya polarisasi ion Be2+ terhadap pasangan elektron halogen (kecuali F-), maka BeCl2 berikatan
kofalen sedangkan alkali tanah yang lain berikatan ion.
Contoh : Mg(s) + Cl2(g) MgCl2(s)
3. Reaksi logam alkali tanah dengan oksigen
Akan membentuk oksida (Mo). Ba dapat membentuk perosida
(BaO2) jika oksigen yang direaksikan berlebih.
2Mg(s) + O2(g) 2MgO(s)
Ba(s) + O2(g)(berlebihan) BaO2(s)
4. Warna nyala
Warna nyala senyawa logam alkali tanah dapat digunakan untuk identifikasi awal adanya logam
alkali tanah dalam suatu bahan.
Be dan Mg memberikan warna spektrum pada daerah gelombang elektromagnet sehingga pada
pembakaran magnesium hanya akan menimbulkan warna nyala yang sangat terang.
Ca memberikan warna merah jingga, Sr merah ungu, dan Ba kuning kehijauan.
SENYAWA-SENYAWA LOGAM ALKALI TANAH
a. Oksida dan hidroksida logam alkali tanah
b. Halida alkali tanah
c. Kelarutan senyawa alkali tanah
PEMISAHAN LOGAM ALKALI TANAH DAN KEGUNAAN
• Berilium
Berilium diperoleh dari reduksi BeCl2ndengan logam Ca atau Mg. Reaksi yang terjadi
adalah :
BeCl2(s) + Ca(s) Be(s) + CaCl2(s)
Berilium digunakan sebagai logam panduan dengan tembaga untuk membuat pegas yang
tahan karat.
b) Magnesium
Logam magnesium dipisahkan melalui elektrolisis lelehan MgCl2 yang dicampur dengan
sedikit CaCl2 dan NaCl untuk menurunkan titik lelehnya. Magnesium merupakan logam
berwarna abu-abu mengilap, ringan dan rapuh,sebenarnya mudah mengalami korosi, tetapi
lapisan oksidanya akan melindungi logam didalamnya.
c) KALSIUM, STRONSIUM, DAN BARIUM.
Kalsium, stronsium dan barium hanya dibuat dalam jumlah yang sedikit dan diperoleh melalui reduksi halidanya
dengan logam Na.
CaCl2(l) + 2Na(s) Ca(l) + 2NaCl(l)
Kalsium dalam bentuk logamnya jarang digunakan, tetapi dalam bentuk senyawanya banyak digunakan dalam
kehidupan sehari-hari.
Bita: penotelin itu apa? Berpengaruh apa pada reaksi tadi?
Azizah:
• perbedaan alkali dengan alkali tanah?
• Logam alkali tanah lebih keras dari alkali karena memiliki dua elektron valensi.
• Kerapatannya lebih tinggi, titik lebur lebih tinggi.
• Berbilangan oksidasi +2 (bandingkan data energi bebas untuk reaksi logam kalsium dengan asam
menghasilkan ca+ dan ca2+ ) walaupun energi ionisasi kedua untuk ion alkali tanah lebih tinggi dari
yang pertama. Kelarutan dalam air relatif lebih sukar, khususnya yang memiliki anion berbilangan
oksidasi -2
Aisy n: hubungan kereaktifan alkali dengan letak diunsur periodik?
• Viii a, setelah ditambah 2 elektron pada lapisan kulit s paling luar. Contohnya: konfigurasi elektron pada
magnesium (mg) yaitu : 1s2 2s2 2p6 3s2 atau (ne) 3s2. Ikatan yang dimiliki kebanyakan senyawa logam
alkali tanah adalah ikatan ionik. Karena, elektron paling luarnya telah siap untuk di lepaskan, agar
mencapai kestabilan.
Unsur alkali tanah memiliki reaktifitas tinggi, sehingga tidak ditemukan dalam bentuk monoatomik, unsur
ini mudah bereaksi dengan oksigen, dan logam murni yang ada di udara, membentuk lapisan luar pada
oksigen.
Kereaktifan bergantung pada kecenderungan unsur untuk melepas atau menarik elektron. Dalam satu
periode (dari kiri ke kanan), mula-mula kereaktifan menurun, tapi akan semakin bertambah hingga
Bila: apa itu pyrotechnic dan amfoter?
• Suatu spesies amfoterik ialah suatu molekul atau ion yang dapat bereaksi sebagai asam serta
sebagai basa. Kata ini berasal dari kata yunani amphoteroi,yang berarti “keduanya”. Banyak logam
(seperti seng, timah, timbal, aluminium, dan berilium) membentuk oksida atau hidroksida
amfoter. Amfoterisme bergantung pada keadaan oksidasi dar oksidanya.
• Salah satu spesies amfoter adalah molekul-molekul amfiprotik, yang dapat baik menyumbang
ataupun menerima sebuah proton (h+).
• Pyrotechnics adalah sebuah signal visual yang dapat digunakan untuk mengirim
pesan SOS (safe our soul). Pesan yang dapat memancing perhatian kapal kapal disekitar bahwa
suatu keadaan emergency atau marabahaya sedang terjadi dan seseorang sedang
membutuhkan pertolongan segera.
Ima: kapankah alkali tanah terjadi kesadaahan?
Putri: Mg bereaksi sangat lambat, apa buktinya?
Rania: knapa magnesium oksida yang digunakan untuk melapisi tanur yang menggunakan
temperatur tinggi?
Anda mungkin juga menyukai
- Alkali Tanah-1Dokumen23 halamanAlkali Tanah-1djangwaris channelBelum ada peringkat
- Alkali Dan Alkali TanahDokumen21 halamanAlkali Dan Alkali Tanah31. Rose DianaBelum ada peringkat
- Alkali TanahDokumen9 halamanAlkali Tanahhafidhrahadiyan2100% (1)
- Alkali Tanah BahanDokumen10 halamanAlkali Tanah Bahananisa rahmiBelum ada peringkat
- AlkaliDokumen10 halamanAlkaliKhintan MaharaniBelum ada peringkat
- Materi CBRDokumen7 halamanMateri CBRDian CandraBelum ada peringkat
- Logam Alkali TanahDokumen10 halamanLogam Alkali TanahBaiq Nopita Handra EniBelum ada peringkat
- Laporan Sifat Unsur KimiaDokumen19 halamanLaporan Sifat Unsur KimiaAswar100% (2)
- Alkali TanahDokumen21 halamanAlkali TanahIzzah Nur AnnisaBelum ada peringkat
- Logam AlkaliDokumen31 halamanLogam Alkalicuco alayBelum ada peringkat
- Kelompok IDokumen46 halamanKelompok IRisnaAmalia IskandarSyahBelum ada peringkat
- Presentasi Alkali Dan Alkali Tanah (Yang Dipresentasikan)Dokumen28 halamanPresentasi Alkali Dan Alkali Tanah (Yang Dipresentasikan)Dini AlfitriBelum ada peringkat
- Golongan IIADokumen9 halamanGolongan IIAAllensius Karelsta Harefa100% (1)
- OPTIMALKAN UNTUK DOKUMEN KIMIADokumen37 halamanOPTIMALKAN UNTUK DOKUMEN KIMIAAnas IlhamBelum ada peringkat
- Bahan Ajar Kimia UnsurDokumen22 halamanBahan Ajar Kimia UnsurAnik nur rokhmahBelum ada peringkat
- Pembuatan Logam Alkali TanahDokumen3 halamanPembuatan Logam Alkali TanahYeni Dwija Cahyanti67% (3)
- LKM 2 Golongan Ii ADokumen22 halamanLKM 2 Golongan Ii AAlvira MelindaBelum ada peringkat
- REAKSI LOGAM ALKALIDokumen5 halamanREAKSI LOGAM ALKALIwidigda rizkiBelum ada peringkat
- Sifiat Sifat Gol 2 ADokumen5 halamanSifiat Sifat Gol 2 Amuhammadhaykal105Belum ada peringkat
- UNSUR ALKALIDokumen9 halamanUNSUR ALKALISilvia WulandariBelum ada peringkat
- Logam Alkali Kel. 5Dokumen25 halamanLogam Alkali Kel. 5citraBelum ada peringkat
- Golongan IaDokumen11 halamanGolongan IaimnotuglyBelum ada peringkat
- Sifat Fisik Logam Alkali TanahDokumen3 halamanSifat Fisik Logam Alkali TanahVania Aurellia EvandraBelum ada peringkat
- LOGAM ALKALI TANAHDokumen17 halamanLOGAM ALKALI TANAHClassico SmakatBelum ada peringkat
- OPTIMAL UNTUK GOLONGAN IIADokumen26 halamanOPTIMAL UNTUK GOLONGAN IIAsarahBelum ada peringkat
- Golongan AlkaliDokumen22 halamanGolongan AlkaliArifinBelum ada peringkat
- Handout Alkali TanahDokumen5 halamanHandout Alkali TanahNabillaBelum ada peringkat
- Alkali TanahDokumen10 halamanAlkali TanahalfyanitaBelum ada peringkat
- Alkali TanahDokumen27 halamanAlkali TanahJani Papanya NajibaBelum ada peringkat
- Logam Alkali TanahDokumen9 halamanLogam Alkali TanahJane GerciaBelum ada peringkat
- KimiaDokumen14 halamanKimiasastrioliverzt3617100% (1)
- Alkali TanahDokumen13 halamanAlkali TanahMuhammad IqbalBelum ada peringkat
- Sifat Dan Reaksi Gol. AlkaliDokumen7 halamanSifat Dan Reaksi Gol. AlkaliDefi ElfridaBelum ada peringkat
- Makalah Kimia UnsurDokumen9 halamanMakalah Kimia UnsurAula Ayu rohmahBelum ada peringkat
- Alkali Dan Alkali TanahDokumen18 halamanAlkali Dan Alkali TanahAyu FadhilahBelum ada peringkat
- 2 S 2 Gboksjk 5 K 9 IzjDokumen21 halaman2 S 2 Gboksjk 5 K 9 Izjarismasela47Belum ada peringkat
- KELARUTAN GARAM ALKALI TANAHDokumen7 halamanKELARUTAN GARAM ALKALI TANAHauliaBelum ada peringkat
- Kimia Unsur LogamDokumen38 halamanKimia Unsur LogamNur RochmahBelum ada peringkat
- Laporan KimiaDokumen6 halamanLaporan KimiaFixs ReyBelum ada peringkat
- Unsur Alkali Dan Alkali Tanah(s)Dokumen22 halamanUnsur Alkali Dan Alkali Tanah(s)herlambangadjiwBelum ada peringkat
- ALKALI TANAH UNSURDokumen18 halamanALKALI TANAH UNSURcindypitalokaBelum ada peringkat
- Kimia Anorganik Alkali TanahDokumen20 halamanKimia Anorganik Alkali TanahSri GustiantyBelum ada peringkat
- Kimia Logam Alkali TanahDokumen23 halamanKimia Logam Alkali TanahCynthia AdijayaBelum ada peringkat
- ALKALI TANAHDokumen20 halamanALKALI TANAHAyu ABelum ada peringkat
- Handout AlkaliDokumen8 halamanHandout AlkaliNabillaBelum ada peringkat
- Alkali Dan Alkali TanahDokumen21 halamanAlkali Dan Alkali TanahTika Santika Dewi100% (1)
- Alkali TanahDokumen14 halamanAlkali TanahDian MutiaBelum ada peringkat
- Makalah Kimia Kel 2Dokumen13 halamanMakalah Kimia Kel 2Doni Eka SaputraBelum ada peringkat
- Sistem Periodik UnsurDokumen21 halamanSistem Periodik Unsurisrenna ratu100% (1)
- Unsur Alkali SMADokumen24 halamanUnsur Alkali SMAsBelum ada peringkat
- RPP Alkali TanahDokumen16 halamanRPP Alkali Tanahlaras kurniawatiBelum ada peringkat
- LKM 2 Rosa Niya - 2013023066 - Kimia UnsurDokumen13 halamanLKM 2 Rosa Niya - 2013023066 - Kimia UnsurRosa NiyaBelum ada peringkat
- Sistem Periodik UnsurDokumen23 halamanSistem Periodik Unsuralysa mayadaBelum ada peringkat
- Logam Alkali TanahDokumen34 halamanLogam Alkali TanahJesica Christin LadoBelum ada peringkat
- Kelompok 1 PPT Kimia Unsur AlkaliDokumen28 halamanKelompok 1 PPT Kimia Unsur AlkaliRahmila AzhariBelum ada peringkat
- Terima kasih atas pertanyaan dan jawabannya. Saya belajar banyak tentang sifat dan kegunaan unsur logam alkali tanah dari diskusi iniDokumen15 halamanTerima kasih atas pertanyaan dan jawabannya. Saya belajar banyak tentang sifat dan kegunaan unsur logam alkali tanah dari diskusi iniTryanda FerdyansyahBelum ada peringkat
- Makalah Alkali TanahDokumen20 halamanMakalah Alkali TanahEka PutraBelum ada peringkat
- Anorganik IIDokumen102 halamanAnorganik IIRoqyal RABelum ada peringkat
- KesimpulanDokumen1 halamanKesimpulansevenBelum ada peringkat
- Munculnya Pedangan Kaki Lima Di Kawasan Gunung Anyar Terbentuk Dari Kurangnya Lahan Produktif Yang Menguntungkan Secara Ekonomis Bagi para Pedagang Kaki LimaDokumen1 halamanMunculnya Pedangan Kaki Lima Di Kawasan Gunung Anyar Terbentuk Dari Kurangnya Lahan Produktif Yang Menguntungkan Secara Ekonomis Bagi para Pedagang Kaki LimasevenBelum ada peringkat
- Meningkatnya Pendapatan Pedagang Kaki Lima Mempengaruhi Gaya Hidup Dan Tingkat KonsumusiDokumen2 halamanMeningkatnya Pendapatan Pedagang Kaki Lima Mempengaruhi Gaya Hidup Dan Tingkat KonsumusisevenBelum ada peringkat
- Meningkatnya Pendapatan Pedagang Kaki Lima Mempengaruhi Gaya Hidup Dan Tingkat KonsumusiDokumen2 halamanMeningkatnya Pendapatan Pedagang Kaki Lima Mempengaruhi Gaya Hidup Dan Tingkat KonsumusisevenBelum ada peringkat
- Kebutuhan Dan Keinginan KlienDokumen1 halamanKebutuhan Dan Keinginan KliensevenBelum ada peringkat