Spektrofotometri Uv-Vis
Diunggah oleh
Ihans23Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Spektrofotometri Uv-Vis
Diunggah oleh
Ihans23Hak Cipta:
Format Tersedia
Ratih Aryani, S.Si., Apt.
Part 4
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
1. Eksitasi molekul
Bila molekul mengabsorpsi cahaya, maka akan terjadi
penambahan energi eksitasi yang disebabkan oleh :
Rotasi molekul (R)
Vibrasi molekul (S)
Perpindahan elektron terluar dari tingkat energi dasar
(E
o
) ke tingkat energi yang lebih tinggi (E
) , dan
Ionisasi
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Teori orbital molekul
Atom-atom yang berikatan akan membentuk suatu molekul.
Ikatan yang terjadi dapat berupa ikatan dan
1. Ikatan (terjadi pada ikatan tunggal (jenuh))
ikatan tunggal dengan atom yang sama CC
ikatan tunggal namun memiliki atom heterogen (O, N,
Halogen/X) contoh : alkohol (ROH), air (HOH)
2. Ikatan
ikatan rangkap tidak jenuh C=C, C=C, N=N
ikatan rangkap terkonjugasi co: Benzena
gugus karbonil C=O, dan gugus azo (N=N)
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
2. Spektrum absorpsi
Absorpsi suatu senyawa tergantung pada panjang
gelombang
Kurva yang menggambarkan secara grafik absorbansi
(serapan/ A) terhadap panjang gelombang yang
diabsorpsi dinamakan kurva absorpsi.
Faktor yang dapat mempengaruhi spektrum absorpsi :
Gugus kromofor
Lingkungan elektronik
Sistem terkonjugasi
Pelarut yang digunakan
Gugus ausokrom
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Gugus kromofor
gugus fungsional atau ikatan dalam suatu molekul yang
mengabsorpsi pada daerah ultra violet atau sinar tampak.
Contoh : ikatan rangkap C=C (etilen/190 nm), C=C
(asetilida/175 nm), C=N (Nitril/160 nm), NH
2
(amin/195 nm).
Lingkungan elektronik
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Sistem terkonjugasi
Suatu keadaan dimana ikatan tunggal antara atom
dipisahkan satu sama lain dengan satu ikatan rangkap
(tidak jenuh).
Contoh :
C C=CC=CC=C
Energi yang dibutuhkan untuk eksitasi akan berkurang
absorpsi cahaya akan bergeser ke daerah panjang
gelombang yang lebih besar.
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Pelarut yang digunakan
efek batokromik
efek hipsokromik
semakin polar suatu pelarut efek batokromik akan
semakin besar.
Gugus ausokrom
gugus yang mengandung pasangan elektron bebas yang
bila diikat oleh gugus kromofor dapat mengakibatkan
pergeseran panjang gelombang maksimum.
Contoh : OH, NH
2
, NHR, Cl dan NR
2
Spektroskopi Absorpsi pada Daerah
Ultra violet dan Sinar tampak
Gugus ausokrom
adanya gugus ausokrom dapat menimbulkan efek
batokromik
contoh : pada benzena ( mak= 255 nm) + gugus ausokrom
(gugus OH pada fenol) (mak =270 nm)
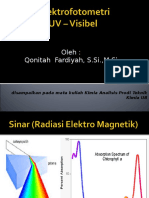
Spektrofotometri UV-Vis
Sinar Ultraviolet (UV) adalah sinar yang berada pada
daerah panjang gelombang 10-400 nm
UV dekat (10-200 nm)
UV jauh (200-400 nm)
Sinar tampak (visible) adalah sinar polikromatis yang
dengan bantuan alat tertentu (prisma) dapat diuraikan
menjadi beberapa sinar monokromatis dengan
berbagai panjang gelombang, berada pada panjang
gelombang (400-800 nm)
Spektrofotometri UV-Vis
Spektrofotometri merupakan teknik analisis yang
berhubungan dengan penggunaan cahaya untuk
mengukur konsentrasi bahan kimia.
PRINSIP :
Instrumen
Spektrofotometer mengukur transmitan (%T) atau absorbansi (A)
suatu cuplikan sebagai suatu fungsi panjang gelombang
1. Sumber sinar
Memberikan energi yang diabsorbsi suatu cuplikan sehingga terjadi
eksitasi.
Spektrofotometer UV : Lampu deuterium
Spektrofotometer Vis : Lampu wolfram
2. Selektor
Memilih panjang gelombang yang diinginkan
Monokromator berupa prisma atau kisi (gratting) menguraikan
cahaya polikromatis menjadi cahaya monokromatis pada panjang
gelombang yang diinginkan.
Instrumen
3. Sel atau Kuvet
Wadah larutan yang akan dianalisis dan terbuat dari bahan transparan.
4. Chopper (pada double beam) memisahkan sinar monokromatis yang
berasal dari monokromator. Sebagian menuju sel yang berisi blanko dan
sebagian lagi menuju sel yang berisi larutan cuplikan.
5. Detektor
Alat yang dapat merubah energi cahaya menjadi energi listrik atau isyarat
listrik.
Detektor Phototube (PT) atau Photo Multiplier Tube (PMT)
6. Rekorder
Menterjemahkan isyarat listrik yang berasal dari detektor.
Menunjukkan besarnya serapan (absorbansi) yang ditunjukan oleh molekul-
molekul yang tereksitasi.
Spektrofotometer Singlebeam
(cahaya tunggal)
Spektrofotometer Doublebeam
(cahaya rangkap)
Spektrofotometer
Instrumen
Spektrofotometer jenis doublebeam memiliki keuntungan
dibanding jenis monobeam, yaitu :
1. Memungkinkan untuk mencatat secara otomatis serapan (A)
ataupun transmitansi (%T) suatu cuplikan sebagai fungsi
panjang gelombang.
2. Perubahan intensitas sinar yang dilepaskan lampu sumber sinar
dapt diatasi
3. Memungkinkan dilakukan koreksi terhadap kesalahan yang
disebabkan adanya fluktuasi sinar yang dipancarkan oleh
sumber sinar.
4. Dapat diketahui ada atau tidaknya gugus fungsi tertentu,
misalnya gugus karbonil, aromatik, nitro, diena terkonjugasi
dalam satu molekul senyawa organik, sehingga sangat baik
untuk analisis kualitatif senyawa dengan gugus fungsi tersebut.
Aplikasi Spektroskopi UV-Vis
Analisis Kualitatif
Memprediksi jenis/ golongan senyawa
Pengukuran spektrofotometri menggunakan alat
spektrofotometer yang melibatkan energi elektronik yang
cukup besar pada molekul yang dianalisis, sehingga
spektrofotometer UV-Vis lebih banyak dipakai untuk analisis
kuantitatif dibandingkan kualitatif
Analisis kuantitatif
Menentukan kandungan senyawa dalam sampel
Konsentrasi dari analit di dalam larutan bisa ditentukan dengan
mengukur absorban pada panjang gelombang tertentu dengan
menggunakan hukum Lambert-Beer (Rohman, 2007)
Analisis Kualitatif
Analisis kualitatif pada spektrofotometri UV-Vis berdasarkan :
Kurva absorpsi
Melalui kurva absorpsi yang teridiri dari jumlah, letak, serapan,
panjang gelombang maksimum ( mak) dapat memberikan
petunjuk adanya gugus kromofor dan ausokrom (substituen)
yang ada pada suatu senyawa.
Absorptivitas molar ()
Nilai absorptivitas dapat digunakan untuk identifikasi suatu
senyawa.
Perbandingan absorptivitas molar suatu molekul pada 2
panjang gelombang yang berbeda selalu tetap walaupun
konsentrasinya berubah-ubah.
Analisis Kualitatif
Absorptivitas molar ()
Analisis Kualitatif
Analisis Kualitatif
Perhitungan maksimum berdasarkan aturan Wood Ward-
Fisher
Sistem Diena
Harga dasar diena bukan siklis/heteroanuler = 217 nm
Harga dasar diena homoanuler = 253 nm
Tambahan substituen alkil = + 5 nm
Adanya ikatan rangkap exosiklis = + 5 nm
Perpanjangan ikatan rangkap terkonjugasi = + 30 nm
Analisis Kualitatif
Sistem Dienon
Harga dasar dienon lingkar enam atau asiklik = 215 nm
Harga dasar dienon lingkar lima = 202 nm
Harga dasar aldehid = 207 nm
Penambahan substituen alkil pada posisi = + 10 nm
= +12 nm
atau lebih besar = +18 nm
Penambahan komponen butadiena = + 39 nm
Contoh :
Contoh :
Analisis Kuantitatif
Berdasarkan pada Hk. LambertBeer, dimana
banyaknya sinar yang diabsorpsi tergantung dari
konsentrasi larutan dan panjang gelombang sinar
(lebar kuvet).
Menyatakan hubungan linieritas antara absorban
dengan konsentrasi larutan analit dan berbanding
terbalik dengan transmitan.
Analisis Kuantitatif
Keterangan : T = Transmitan
A = Absorban
I = intansitas sinar yang diteruskan
Io = intensitas yang dilewatkan semula
Analisis Kuantitatif
Absorbansi (A) dapat dinyatakan dalam 2 persamaan :
1. Bila konsentrasi dinyatakan dalam suatu molar
(mol/liter)
A = .b.c
dimana :
A = absorban
= absorptivitas molar (liter/mol.cm)
b = tebal kuvet (cm)
c = konsentrasi larutan (mol/liter atau molar)
Keterangan : T = Transmitan
A = Absorban
I = intansitas sinar yang diteruskan
Io = intensitas yang dilewatkan semula
Analisis Kuantitatif
Absorbansi (A) dapat dinyatakan dalam 2 persamaan :
2. Bila konsentrasi dinyatakan dalam persen b/v (g/100 ml)
Keterangan :
= Ekstingsi spesifik (ml/g.cm)
b = tebal kuvet (cm)
c = konsentrasi larutan (g/100 ml)
Analisis Kuantitatif
Syarat penggunaan Hk. Lambert Beer
Konsentrasi : hk. Beer baik untuk lar. yang encer 0.01M
Zat pengabsorpsi tidak boleh berdisosiasi, bereaksi dengan
pelarut yang menghasilkan produk yang berbeda dengan
zat yang dianalisis.
Hk. Beer hanya berlaku untuk sinar monokromatik
Larutan sampel harus jernih
Analisis Kuantitatif
Penyimpangan Hk. Lambert Beer
Penyimpangan Positif
Penyimpangan ke arah lebih besarnya nilai serapan (A)
Penyimpangan Negatif
Penyimpangan ke arah lebih kecilnya nilai serapan (A)
Penyimpangan dapat disebabkan oleh :
1. Perubahan kimia
zat mengalami reaksi disosiasi (penyimpangan
negatif/positif)
larutan mengandung elektrolit dengan konsentrasi besar
(negatif)
perubahan pH larutan (penyimpangan negatif/positif)
Analisis Kuantitatif
Penyimpangan dapat disebabkan oleh :
2. Perubahan fisika
pelarut ikut mengabsorpsi sinar (penyimpangan negatif)
3. Kesalahan pada alat
sinar yang digunakan tidak benar-benar monokromatis
(penyimpangan negatif)
TAHAPAN PENENTUAN KADAR SAMPEL
SECARA SPEKTROFOTOMETRI
1. Penentuan panjang gelombang maksium (max)
Definisi: panjang gelombang yang mempunyai absorbansi
maksimal,
Dilakukan dengan membuat kurva hubungan antara
absorbansi dengan panjang gelombang dari suatu larutan
baku pada konsentrasi tertentu
Panjang gelombang max memiliki kepekaan maksimal
karena terjadi perubahan absorbansi yang paling besar
Pada panjang gelombang max bentuk kurva absorbansi
memenuhi hukum Lambert-Beer
TAHAPAN PENENTUAN KADAR SAMPEL
SECARA SPEKTROFOTOMETRI
Hal yang perlu diperhatikan pada penentuan max sbb :
Absorban yang terbaca pada spektrofotometer hendaknya
antara 0,2 sampai 0,8 atau 15% sampai 70% jika dibaca
sebagai transmitans.
2. Penentuan Operating Time (OT)
untuk mengetahui waktu pengukuran yang stabil yaitu saat
sampel bereaksi sempurna dengan reagen warna . Waktu
kerja ditentukan dengan mengukur hubungan antara waktu
pengukuran dengan absorbansi larutan
TAHAPAN PENENTUAN KADAR SAMPEL
SECARA SPEKTROFOTOMETRI
3. Pembuatan Kurva Larutan Baku Linier
Untuk memperoleh persamaan larutan baku dalam
penentuan kadar sampel
Tahapan yang diperlukan sbb :
Dibuat seri larutan baku dari zat yang akan dianalisis
dengan berbagai konsentrasi.
Masing-masing absorbansi larutan dengan berbagai
konsentrasi diukur pada max
Membuat Kurva Larutan Baku yang merupakan hubungan
antara konsentrasi (sumbu y) dan absorbansi (sumbu x).
TAHAPAN PENENTUAN KADAR SAMPEL
SECARA SPEKTROFOTOMETRI
Bila hukum Lambert-Beer terpenuhi maka kurva baku berupa
garis lurus.
Paling sedikit menggunakan 5 rentang konsentrasi yang
meningkat yang dapat memberikan serapan linier
Kemiringan atau slope adalah nilai e (absorptivitas molar).
Nilai R antara 0,70 1,00 (pertanda terbentuk garis lurus
linear pada rentang konsentrasi yang dibuat)
Apabila persyaratan pembuatan kurva baku di atas tidak
terpenuhi maka penyimpangan dari garis lurus biasanya dapat
disebabkan oleh: (i) kekuatan ion yang tinggi, (ii) perubahan
suhu, dan (iii) reaksi ikutan terjadi.
TAHAPAN PENENTUAN KADAR SAMPEL
SECARA SPEKTROFOTOMETRI
4. Penentuan Kadar Sampel
Penentuan kadar sampel metode regresi linier yaitu metode
parametrik dengan variabel bebas (konsentrasi sampel) dan
variabel terikat (absorbansi sampel) menggunakan
persamaan garis regresi Kurva Larutan Baku.
Konsentrasi sampel dapat dihitung berdasarkan persamaan
kurava baku tersebut (Rohman, 2007).
Penetapan kadar
Penetapan kadar secara spektrofotometri dapat dilakukan
dengan beberapa cara, yaitu :
Berdasarkan nilai dari zat yang akan ditentukan
kadarnya.
Membandingkan serapan pada cuplikan dengan serapan
pada larutan standar (pembanding) yang konsentrasinya
mendekati konsentrasi cuplikan.
Penetapan kadar
Menggunakan kurva kalibrasi
Dengan mengukur serapan (absorbansi) dari serangkaian
larutan standar dengan konsentrasi berbeda-beda, kemudian
dibuat grafik hubungan antara serapan dengan konsentrasi
Dengan memplot serapan dari cuplikan pada kurva kalibrasi,
maka konsentrasi zat dalam cuplikan dapat ditentukan.
Y
X
Absorbansi (A)
Konsentrasi (ppm) atau g/ml (c)
Slop kemiringan = b =.c
A = .b.c
Y = bX + a, dimana Y =A X=c a = .b
Latihan Soal
Kapsul kloramfenikol sebanyak 1,5 mg, dilarutkan dalam
aquadest hingga 12,5 ml. kemudian larutan ini ditempatkan
dalam sel spektrofotometer dengan tebal kuvet 0,5 cm.
kemudian disinari dengan sinar ultra violet dengan panjang
gelombang 278 nm. Berapakah serapannya (absorbansi),
bila pada 278 adalah 288 ?
Latihan Soal
Serbuk klorfeniramin maleat sebanyak 50,0 mg dilarutkan
dalam aquadest hingga 100,0 ml. kemudian dipipet 10,0 ml
larutan tersebut kedalam labu takar dan ditambahkan
aquadest hingga 100,0 ml. Kemudian 10,0 ml larutan
tersebut dipipet kembali dan diencerkan dengan aquadest
hingga 50,0 ml. Kemudian larutan tersebut ditempatkan
dalam sel spektrofotometer yang tebalnya 1 cm. Kemudian
diukur serapannya pada panjang gelombang maksimum (
mak) 262 nm memberikan serapan 0.142. Bila diketahui
klorfeniramin maleat pada 262 nm = 147. tentukan
kemurnian dari serbuk klorfeniramin maleat tersebut !
Latihan Soal
Larutan PCT ditentukan kadarnya secara spektrofotometri
UV. Pengukuran dilakukan pada panjang gelombang
maksimum 242 nm. Memberikan hasil pengukuran sebagai
berikut :
Hitung kadar PCT dalam cuplika (ppm) !
Larutan Serapan
Blanko 0.05
Pembanding 30 ppm 0.50
Cuplikan X ppm 0.45
Latihan Soal
Pada penentuan kadar vitamin c dalam krim tabir surya
ditentukan secara spektrofotometri UV. Pengukuran dilakukan
pada panjang gelombang maksimum 265 nm dengan membuat
kurva kalibrasi pada serangkaian larutan pembanding dengan
konsentrasi sebagai berikut :
Larutan vitamin c Pembanding
Konsentrasi Absorbansi
2 0.2151
3 0.3203
4 0.4254
6 0.6365
8 0.8518
Latihan Soal
Krim vitamin c ditimbang sebanyak 0,01 gram kemudian
diencerkan hingga 100 ml memberikan serapan 0.2474, tentukan
kadar vitamin c dalam krim tabir surya !
Anda mungkin juga menyukai
- Atom Dan Molekul Suatu Tinjauan UlangDokumen80 halamanAtom Dan Molekul Suatu Tinjauan UlangDesrita Ayu Tangdialla100% (1)
- Instrumen Analisis Farmasi SpektroskopiDokumen64 halamanInstrumen Analisis Farmasi SpektroskopiSarah AmeliaBelum ada peringkat
- AspirinDokumen5 halamanAspirinDiah Syafitri UnesBelum ada peringkat
- Farmakognosi 4-5Dokumen62 halamanFarmakognosi 4-5arsyadrambeBelum ada peringkat
- IrDokumen25 halamanIrbluemackerelBelum ada peringkat
- Coulometri 3Dokumen17 halamanCoulometri 3Nastiti Nur IndriyaniBelum ada peringkat
- Reaksi-Reaksi Aldehid Dan KetonDokumen38 halamanReaksi-Reaksi Aldehid Dan KetonarinkurniaBelum ada peringkat
- ANFISKO Spektrofotometri IR Dispersif & FTIR-kelompok 3Dokumen65 halamanANFISKO Spektrofotometri IR Dispersif & FTIR-kelompok 3effan cahyati jBelum ada peringkat
- Pembuatan Kurva KalibrasiDokumen14 halamanPembuatan Kurva KalibrasiShelby Febriyani RahayuBelum ada peringkat
- Asam PikratDokumen10 halamanAsam Pikratanisa salsabilaBelum ada peringkat
- Aspirin SejarahDokumen2 halamanAspirin SejarahNungkii Nilasarii100% (1)
- Laporan Reaksi Pembuatan Alkena Dengan Dehidrasi Alkohol IstiDokumen12 halamanLaporan Reaksi Pembuatan Alkena Dengan Dehidrasi Alkohol Istifebiola silvia ningsihBelum ada peringkat
- Makalah - Titrasi Asam-BasaDokumen8 halamanMakalah - Titrasi Asam-Basasonicblow2100% (1)
- Fenomena Antar Permukaan-1Dokumen17 halamanFenomena Antar Permukaan-1Oky Paradila Sandi100% (1)
- Tugas Fitokimia TerpenoidDokumen4 halamanTugas Fitokimia TerpenoidNabilahAhmadBamu'minBelum ada peringkat
- Spek Tro Flu or Ore SensiDokumen19 halamanSpek Tro Flu or Ore SensiCacaCizhukhaBelum ada peringkat
- Percobaan 8Dokumen10 halamanPercobaan 8Atikatul MutmainahBelum ada peringkat
- Laporan Praktikum Kimia Organik Modul 1Dokumen3 halamanLaporan Praktikum Kimia Organik Modul 1Oktaviandri SaputraBelum ada peringkat
- DiskoneksiDokumen27 halamanDiskoneksiFina RepitiyanaBelum ada peringkat
- Makalah Wawasan NusantaraDokumen18 halamanMakalah Wawasan NusantaraAnita Wijayanti100% (1)
- Penentuan Panjang Gelombang Maksimum Dan PDFDokumen19 halamanPenentuan Panjang Gelombang Maksimum Dan PDFaida amyliaBelum ada peringkat
- Sintesis OrganikDokumen5 halamanSintesis OrganikKhimayatur Rosyida ArfiiBelum ada peringkat
- Asam PikratDokumen8 halamanAsam PikratSarah Sholihatul AmaliaBelum ada peringkat
- Asidi Alkali Iodo IodiDokumen18 halamanAsidi Alkali Iodo IodiredhoBelum ada peringkat
- Aplikasi KromatografiDokumen77 halamanAplikasi KromatografiZacharielBelum ada peringkat
- Contoh Senyawa Seskuiterpen TrisiklikDokumen3 halamanContoh Senyawa Seskuiterpen TrisiklikAmelia SoyataBelum ada peringkat
- SemanggiDokumen44 halamanSemanggicee_prasetyoBelum ada peringkat
- FormaldehidaDokumen6 halamanFormaldehidaJeo FitraBelum ada peringkat
- Zakiatun Azma Amani - Penetapan Kadar Asam Benzoat Dalam KecapDokumen9 halamanZakiatun Azma Amani - Penetapan Kadar Asam Benzoat Dalam KecapZAKIA100% (1)
- Asam PikratDokumen10 halamanAsam Pikratanisa salsabilaBelum ada peringkat
- Aplikasi Spektrofotometri IRDokumen56 halamanAplikasi Spektrofotometri IRrianiBelum ada peringkat
- Dasar Teori Tambahan TLCDokumen11 halamanDasar Teori Tambahan TLCSarah Swasti PBelum ada peringkat
- Laporan Praktikum Spktrofotometri Uv-VisDokumen12 halamanLaporan Praktikum Spktrofotometri Uv-VisDewa AriBelum ada peringkat
- Praktikum SublimasiDokumen17 halamanPraktikum SublimasiYuliana LethisyaBelum ada peringkat
- Makalah Kalkon Kelompok 7 1Dokumen13 halamanMakalah Kalkon Kelompok 7 1Ernha Ceka GeminiBelum ada peringkat
- Diktat Spektroskopi MassaDokumen29 halamanDiktat Spektroskopi MassaErlina AzmiBelum ada peringkat
- 9-10. Kuliah SBO 2015 (Retrosintesis)Dokumen47 halaman9-10. Kuliah SBO 2015 (Retrosintesis)REYNER AURELINUS MAXIMUS 2018Belum ada peringkat
- TUGAS Riviwe JurnalDokumen37 halamanTUGAS Riviwe JurnalDony Dwi PrastiyoBelum ada peringkat
- Tugas I RDokumen1 halamanTugas I RAlvin BrianBelum ada peringkat
- Spektroskopi Emisi NyalaDokumen5 halamanSpektroskopi Emisi NyalafitzakiyyahBelum ada peringkat
- Aprilia Syafrani - Kimia Organik II - Pemurnian AlkoholDokumen9 halamanAprilia Syafrani - Kimia Organik II - Pemurnian AlkoholAprilia SyafraniBelum ada peringkat
- Soal Latihan Kromatografi GasDokumen7 halamanSoal Latihan Kromatografi GasSABRINA PUTRI MAHARANI 2022Belum ada peringkat
- Maserasi PDFDokumen6 halamanMaserasi PDFTinno Wijaya50% (2)
- LAPORAN Alginat PDFDokumen15 halamanLAPORAN Alginat PDFHenySuryamarevita100% (1)
- Gravimetri 1Dokumen15 halamanGravimetri 1eva indriyaniBelum ada peringkat
- Kimia Organik Senyawa AromatikDokumen17 halamanKimia Organik Senyawa AromatikRetno Dwi HartantiBelum ada peringkat
- STEROID - Klasifikasi - Biosintesis - Tata NamaDokumen16 halamanSTEROID - Klasifikasi - Biosintesis - Tata Namasyaripatul haniBelum ada peringkat
- Kimia Analisis Kuantitatif-QDokumen47 halamanKimia Analisis Kuantitatif-QMalik FaisalBelum ada peringkat
- Spektrofotometri UV VisDokumen41 halamanSpektrofotometri UV VisElfhyElfridaPasaribuBelum ada peringkat
- Laporan PratikumDokumen38 halamanLaporan PratikumMartin MitchellBelum ada peringkat
- Daftar Lengkap Asam Amino Esensial Dan Non EsensialDokumen11 halamanDaftar Lengkap Asam Amino Esensial Dan Non EsensialpikaBelum ada peringkat
- Isolasi PiperinDokumen3 halamanIsolasi PiperinAhmad FauzyyBelum ada peringkat
- Esofhagus (Kerongkongan)Dokumen5 halamanEsofhagus (Kerongkongan)Novi SetyaningsihBelum ada peringkat
- Analisis Dua KomponenDokumen6 halamanAnalisis Dua KomponenSuci RomayantiBelum ada peringkat
- BAB II Efek Toksik Pada Sistem RespirasiDokumen9 halamanBAB II Efek Toksik Pada Sistem RespirasiemnovericiBelum ada peringkat
- Maul Acara V AnstruDokumen13 halamanMaul Acara V AnstruputriBelum ada peringkat
- Analisa Instrumen PCT Dan KafeinDokumen10 halamanAnalisa Instrumen PCT Dan Kafeinselly tanjungBelum ada peringkat
- 1 Spektro UV-VisDokumen34 halaman1 Spektro UV-VisLilis TuslinahBelum ada peringkat
- Analisis Spektro UV VISDokumen75 halamanAnalisis Spektro UV VISWindu Hasta BayuBelum ada peringkat
- Spektrofotometri Uv-Visibel Dan FlorometriDokumen62 halamanSpektrofotometri Uv-Visibel Dan FlorometriWendy Prastiya SutejoBelum ada peringkat
- Metode ElektrokimiaDokumen38 halamanMetode ElektrokimiaIhans23Belum ada peringkat
- COULOMETRIDokumen59 halamanCOULOMETRIIhans23Belum ada peringkat
- PENDAHULUANDokumen24 halamanPENDAHULUANIhans23Belum ada peringkat
- COULOMETRIDokumen59 halamanCOULOMETRIIhans23Belum ada peringkat
- COULOMETRI1Dokumen13 halamanCOULOMETRI1Ihans23Belum ada peringkat
- Kuliah Termo IiDokumen34 halamanKuliah Termo IiIhans23Belum ada peringkat
- Tit Rime TriDokumen27 halamanTit Rime TriLinda ArdiyantiBelum ada peringkat