Mekanisme Kerja Vitamin C Pada Sepsis
Diunggah oleh
Septina AnggiDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Mekanisme Kerja Vitamin C Pada Sepsis
Diunggah oleh
Septina AnggiHak Cipta:
Format Tersedia
Mekanisme kerja vitamin C pada sepsis: Askorbat memodulasi sinyal redoks dalam endotelium
John X. Wilson
Abstrak Tingkat sirkulasi vitamin C (askorbat) rendah pada pasien dengan sepsis. Masukan parenteral dari askorbat meningkatkan konsentrasi vitamin pada plasma dan jaringan dan dapat menurunkan morbiditas. Dalam model hewan sepsis, injeksi intravena askorbat meningkatkan kelangsungan hidup dan melindungi beberapa fungsi mikrovaskuler, yaitu, aliran darah kapiler, barier permeabilitas mikrovaskuler, dan responsifitas arteriol terhadap vasokonstriktor dan vasodilator. Efek dari askorbat parenteral pada fungsi mikrovaskular adalah cepat dan persisten. Askorbat cepat terakumulasi dalam sel endotel mikrovaskuler, menangkap oksigen reaktif, dan berperan melalui tetrahydrobiopterin untuk merangsang produksi nitrit oksida oleh sintase nitrit oksida endotel. Satu alasan utama durasi panjang dalam perbaikan fungsi mikrovaskuler adalah bahwa sel-sel mempertahankan tingkat askorbat yang tinggi, yang mengganggu jalur sinyal sensitif redoks untuk mengurangi induksi septik dari NADPH oksidase dan sintase nitrit oksida yang terinduksi.Pengamatan ini konsisten dengan hipotesis tentang fungsi mikrovaskuler pada sepsis dapat diperbaiki oleh masukan parenteral askorbat sebagai terapi adjuvant.
Kata Kunci Arteriol; asam askorbat; aliran darah; kapiler; inflamasi; permeabilitas mikrovaskuler; nitrit oksida; peroksinitrit; tetrahidrobiopterin
1. Pendahuluan Vitamin C (asam askorbat) dipecah pada pH fisiologis untuk membentuk askorbat, sebuah fase redoks dari vitamin yang paling banyak ditemukan dalam sel [1]. Sudah diketahui bahwa askorbat berperan secara fisiologis sebagai reduktan dan enzim kofaktor. Tujuan dari review ini adalah untuk menguji bukti terakhir bahwa askorbat dapat memodulasi mekanisme intraseluler yang menyebabkan disfungsi mikrovaskuler pada penyakit-penyakit berat seperti sepsis. Sindrom klinis dari sepsis tidak hanya merupakan proses tunggal penyakit yang homogen namun merupakan gabungan dari berbagai penyakit [2]. Sepsis dapat terjadi
1
sebagai akibat dari tindakan pembedahan, pneumonia, infeksi jaringan lunak yang terkait dengan keganasan atau penyakit vaskular perifer, atau penyebab lain. Sindrom sepsis timbul mulai dari sindrom respon inflamasi sistemik hingga sepsis tingkat berat (disfungsi akut sekunder organ karena infeksi) dan syok septik (sepsis berat ditambah hipotensi yang tidak kembali dengan resusitasi cairan) [2,3]. Sindrom tersebut merupakan penyebab utama kematian pada unit perawatan seluruh dunia. Terapi utama termasuk resusitasi cairan untuk mengembalikan tekanan rata-rata sirkulasi, terapi antibiotik, dan pengendalian sumber infeksi untuk menghilangkan penyebab sepsis, vasopresor atau kombinasi inotropik-vasopresor untuk mencegah syok, pengontrolan gula darah, profilaksis untuk trombosis vena dalam, dan profilaksis ulkus stress untuk mencegah perdarahan saluran cerna bagian atas [3]. Meskipun demikian, walaupun dengan manajemen medis terbaik, mortalitas tetap tinggi. Pada sepsis, respon pasien terhadap bakteri dan produk bakteri seperti endotoksin (misal, lipopolisakarida [LPS] Escherichia coli), dan produk intraseluler yang dilepaskan dari jaringan yang rusak [2]. Respon itu termasuk perubahan pada fungsi mikrovaskuler yang terdiri dari: (i) penurunan densitas kapiler perfusi dan peningkatan proposi kapiler non-perfusi; (ii) peningkatan permeabilitas kapiler (seperti kehilangan fungsi barier) yang menyebabkan pembentukan edema dan hiperdemia; dan (iii) hiporesponsifitas arterioler terhadap vasokonstriktor dan vasodilator [4-16]. Jika perubahan tersebut hanya terlokalisasi pada jaringan yang rusak, hal itu dapat menguntungkan bagi pasien dengan cara mengurangi perdarahan dari pembuluh darah yang rusak, mengirimkan mediator antimikroba dan sel fagositik ke lokasi infeksi, atau mencegah penyebaran substansi toksik [2]. Namun perubahan pada sepsis yang menyebar dan terjadi secara sistemik dikenali sebagai disfungsi mikrovaskuler karena menyebabkan hipoksia, disfungsi mitokondria dan deplesi ATP yang mempercepat kegagalan organ, meski pada pasien yang teresusitasi dengan oksigenasi darah arteri dan cardiac output yang adekuat [17]. Tentu saja disfungsi mikrovaskuler merupakan prediktor signifikan dari kematian, dan sepertiga dari pasien dengan sepsis berat meninggal karena kegagalan organ [10]. Efektivitas terapeutik dari antibiotik menurun seiring dengan peningkatan jumlah infeksi oleh karena multidrug resistant bacteria. Lebih jauh lagi, patogen yang dibunuh oleh antibiotik dapat melepaskan produk toksik dalam jumlah besar (misal: LPS) [18]. Oleh karena itu, terapi adjuvan dengan sasaran disfungsi mikrovaskuler dapat lebih bermanfaat bagi pasien sepsis.
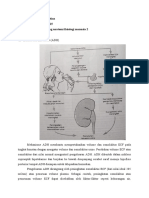
2. Tingkat vitamin C pada pasien dengan penyakit berat dan model eksperimental yang relevan Konsentrasi askorbat dan leukosit plasma di bawah normal merupakan tanda yang sering terjadi pada pasien dengan penyakit berat pada umumnya dan pasien dengan sepsis pada khususnya [19-25]. Lebih jauh lagi, kadar askorbat plasma berbanding terbalik dengan kegagalan organ multipel [19] dan berbanding lurus dengan tingkat survival [21]. Satu alasan untuk deplesi askorbat pada pasien penyakit berat di rumah sakit mungkin berasal dari rendahnya kadar vitamin dalam nutrisi parenteral, karena degradasi askorbat dan asam dehidroaskorbik (dehydroascorbic acid/ DHA) yang terjadi selama persiapan dan penyimpanan [26,27]. Penyebab lain dari deplesi vitamin C adalah peningkatan kebutuhan terhadap askorbat [22,28]. Jumlah vitamin C yang tersedia dalam preparasi multivitamin nutrisi parenteral standar (sekitar 200 mg/hari) tidak adekuat untuk menormalkan kadar vitamin C plasma pada pasien penyakit berat, meskipun sudah dimasukkan selama 7 hari [29]. Alasan peningkatan kebutuhan dapat berasal dari peningkatan oksidasi askorbat oleh kelebihan reactive oxygen species (ROS). Dengan berperan sebagai penangkap ROS dan kofaktor enzim, askorbat dioksidasi menjadi radikal bebas, yang kemudian berdismutasi untuk membentuk DHA. Seperti yang digambarkan pada Gb.1, askorbat dibawa ke dalam sel endotel oleh sodiumdependent vitamin C transporter2 (SVCT2) khusus, sedangkan DHA dikeluarkan oleh glucose transporters (GLUTs) dan direduksi menjadi askorbat. Efluks askorbat dari sel endotelial dapat dipengaruhi oleh mekanisme kalsium, namun secara normal sel mempertahankan konsentrasi askorbat intraseluler lebih tinggi daripada konsentrasi ekstraseluler [1,30-33]. Secara keseluruhan, sistem transport menyebabkan sel endotelial dengan cepat mengakumulasi level milimolar askorbat yang mengganggu fungsi intraseluler atau dilepaskan secara teratur ke cairan ekstraseluler. Sitokin inflamasi (TNF-alfa, IL-1beta) menghambat pengangkutan askorbat ke dalam sel endotelial yang secara spontan mengeluarkan SVCT2 [34]. Mekanisme ini dapat menurunkan askorbat intraseluler selama sepsis. Alasan kedua mengapa askorbat intraseluler dapat menurun adalah kontrol yang buruk dari glukosa plasma, yang menyebabkan episode hiperglikemik pada pasien dengan sepsis [3]. Hiperglikemik akut menyebabkan defisiensi askorbat dalam sel endotel dan mengganggu vasodilatasi endotelium pada subyek orang sehat [35]. Efek tersebut merupakan konsekuensi dari inhibisi kompetitif oleh glukosa terhadap pengambilan DHA ke dalam sel endotel, karena gangguan vasodilatasi dapat diatasi dengan askorbat intravena (2 g bolus [ref.36]; infus 3
mg/min [ref.37]). Penyebab potensial ketiga penurunan askorbat intraseluler adalah terlalu banyaknya jumlah ROS yang mengoksidasi askorbat menjadi DHA dan bersifat ireversibel. LPS meningkatkan konsentrasi askorbat dalam kelenjar adrenal, hati, ginjal dan hati [38]. Fenomena ini tidak memerlukan SVCT2, karena tidak ada hubungan antara efek LPS dan defisiensi SVCT2 (mencit heterozigot SVCT2 +/-) pada konsentrasi askorbat di organorgan tersebut [38]. Pada kebanyakan tipe sel yang telah dipelajari, penambahan dan pengurangan DHA ekstraseluler menjadi askorbat tidak dipengaruhi oleh LPS. Sebaliknya, LPS dan nitrit oksida meningkatkan ekspresi GLUT1 pada kultur sel endotel [39,40]. Sepsis meningkatkan kecepatan di mana DHA ekstraseluler dikeluarkan dan dikurangi menjadi askorbat pada berbagai tipe sel [38,41] (meskipun tidak semua, karena sepsis menghambat pemasukan DHA pada kultur astrosit [42]. Sel endotel merespon LPS dengan meningkatkan ekspresi glukosa-6-fosfat
dehidrogenase, enzim utama siklus pentosa (jalur heksosa monofosfat) yang memproduksi NADPH [43]. Induksi glukosa-6-fosfat dehidrogenase oleh LPS dapat meningkatkan suplai NADPH untuk konversi DHA menjadi askorbat. Pada jaringan dengan kapiler non-perfusi, hipoksia dapat menghambat hypoxia-inducible factor (HIF) prolil-hidroksilase (PHD) dan secara tetap meningkatkan ekspresi HIF (Gb.2). HIF-1 meningkatkan ekspresi transporter GLUT1 dan GLUT3, enzim glikolisis, dan beberapa gen inflamasi [44,45]. Hipoksia menstimulasi uptake DHA melalui GLUT1 [46]. Energi pengurangan yang meningkat terkait dengan hipoksia dapat meningkatkan kapasitas reduksi DHA menjadi askorbat di dalam sel.
3. Percobaan klinis vitamin C pada pasien penyakit berat Seperti yang telah dijelaskan sebelumnya, sepsis dihubungkan dengan peningkatan produksi ROS dan peroksinitrit yang menurunkan jumlah molekul antioksidan dan mengoksidasi protein dan lipid. ROS juga mengganggu aktivasi dan ekspresi protein sensitif-redoks yang mengubah distribusi aliran darah kapiler, permeabilitas kapiler (seperti fungsi barier kapiler), dan responsifitas arterioler terhadap vasokonstriktor dan vasodilator (Gb 1 dan 2). Oleh karena itu, pasien dengan sepsis mengambil manfaat dari terapi adjuvan yang mencegah peningkatan jumlah ROS, terutama di intraseluler. Askorbat parenteral dapat menjadi intervensi yang memberikan manfaat tersebut.
Memasukkan askorbat secara parenteral daripada secara oral meningkatkan efek konsentrasi askorbat plasma dan fungsi mikrovaskuler [1]. Singkatnya, pemasukan askorbat melalui jalur oral dan intravena (500 mg/hari selama 30 hari) pada orang yang sama dibandingkan, hanya askorbat intravena yang meningkatkan fungsi arterioler dependen endotelium yang diindikasikan oleh vasodilatasi oleh karena aliran darah [47]. Masukan askorbat secara parenteral dapat menurunkan morbiditas dan mortalitas pada pasien dengan penyakit berat yang mengalami sepsis atau memiliki resiko menjadi sepsis. Pada percobaan plasebo terkontrol, double-blind, randomized terhadap 216 pasien penyakit berat, mortalitas dalam 28 hari menurun pada pasien yang menerima kombinasi askorbat dan vitamin E melalui infus intravena dibandingkan dengan pasien yang tidak menerima terapi tersebut [48]. Percobaan random kedua dengan 595 pasien bedah dengan penyakit berat menemukan bahwa kombinasi askorbat (1000 mg q8h dengan injeksi intravena) dan vitamin E (1000 IU q8h dengan pipa naso- atau orogastrik), dimulai dalam waktu 24 jam setelah cidera traumatik atau operasi berat, menurunkan resiko relatif edema pulmo dan kegagalan organ multipel [49]. Kedua percobaan tersebut tidak didesain untuk memisahkan peran askorbat dan vitamin E. Meskipun demikian, percobaan random ketiga mengobservasi penurunan morbiditas pasien luka bakar berat yang menerima askorbat dosis sangat tinggi (1.584 mg/kg/hari) secara parenteral [50]. Relevansi utama terhadap fungsi barier mikrovaskuler, terapi askorbat dihubungkan dengan penurunan signifikan pembentukan edema, volume cairan resusitasi, dan disfungsi respirasi [50].
4. Efek vitamin C terhadap survival pada sepsis eksperimental Model hewan untuk sindrom sepsis memiliki informasi fundamental tentang manfaat potensial dan mekanisme aksi askorbat. Deplesi awal askorbat menurunkan tingkat survival pada mencit yang diinjeksi bakteri patogen [51]. Secara konsisten, dddmasukan parenteral askorbat mencegah hipotensi dan edema pada hewan yang diinjeksi LPS [5,6,11] dan meningkatkan aliran darah kapiler, responsifitas arterioler, tekanan darah arteri, fungsi liver, dan tingkat survival pada sepsis eksperimental [4,12-15,52]. Di antara model klinis yang relevan dari sepsis polimikrobial adalah punktur dan ligasi sekal (Cecal ligation and puncture/CLP) dan injeksi feses ke dalam peritoneum (feces injection into peritoneum/FIP). Serupa dengan perubahan yang diamati di pasien sepsis, CLP pada hewan meningkatkan marker stres oksidatif dan menurunkan konsentrasi askorbat dalam plasma dan jaringan [4,12,14]. Injeksi askorbat (200 mg/kg, i.v)
meningkatkan survival pada mencit dengan CLP [15]. Tingkat survival dalam 24 jam post-CLP berturut-turut adalah 9% dan 65% pada mencit yang diinjeksi kontrol dan diinjeksi askorbat. Efek protektif tidak berperan pada penghambatan replikasi bakteri di sumber infeksi, karena jumlah unit koloni bakteri pada cairan peritoneal setelah CLP tidak berbeda antara mencit yang diinjeksi kontrol dengan yang diinjeksi askorbat [15]. Pada mencit FIP, survival dalam 24 jam adalah 19% setelah injeksi salin sebagai kontrol namun menjadi 50% setelah injeksi askorbat intravena (10 mg/kg, i.v.) [13]. 5. Defisit perfusi kapiler 5.1 Respon cepat terhadap askorbat Injeksi askorbat intravena dapat melindungi beberapa fungsi mikrovaskuler, seperti, aliran darah kapiler, barier permeabilitas kapiler, dan responsifitas arterioler terhadap vasokonstriktor dan vasodilator. Injeksi askorbat intravena mencegah dan memperbaiki maldistribusi aliran darah kapiler pada model sepsis. Efek askorbat parenteral adalah cepat dan persisten. Bagian ini membahas mengenai mekanisme yang mendasari onset respon terhadap terapi askorbat. Inflamasi sistemik menyebabkan penghentian aliran darah di beberapa kapiler. Pada sepsis klinis, pola distribusi aliran darah kapiler membaik pada pasien yang bertahan hidup namun tidak membaik pada yang tidak dapat bertahan [10]. Aliran darah kapiler yang membaik selama resusitasi cairan dihubungkan dengan pencegahan kegagalan organ secara terpisah dengan perubahan hemodinamik tubuh[53]. Serupa dengan sepsis klinis, CLP dan FLP menurunkan densitas kapiler perfusi dan meningkatkan proporsi kapiler non-perfusi pada otot skelet mencit dan tikus, di samping masukan cairan untuk volume resusitasi untuk mencegah syok [4,12,13]. Pada pasien dengan penyakit berat, vasodilator meningkatkan proporsi kapiler perfusi untuk beberapa waktu [54]. Apakah vasodilatasi oleh askorbat terjadi dan merupakan penyebab langsung perbaikan aliran darah kapiler pada sepsis klinis tidak diketahui secara pasti. Meskipun begitu, tidak adanya peningkatan pada kecepatan aliran (diukur dengan laju endap darah) ditemukan pada kapiler setelah injeksi askorbat yang mengembalikan jumlah normal kapiler perfusi pada otot skelet tikus sepsis [13]. Oleh karena itu, bukti dari penelitian sepsis ekspreimental menunjukkan perbaikan aliran darah kapiler tidak dicapai melalui efek vasodilator dari askorbat. Justru, alasan mengapa aliran darah berhenti pada beberapa kapiler bisa disebabkan
oleh defisiensi nitrit oksida pada sel endotel dan platelet. Tentu saja, nitrit oksida muncul sebagai bagian penting untuk mempertahankan patensi pembuluh mikro, dan pemberian lokal nitrit oksida memperbaiki aliran darah kapiler pada mencit sepsis (6 jam post FIP) [13]. Penurunan ketersediaan nitrit oksida pada sel endotel dan platelet pasien dengan sepsis dapat dihubungkan dengan ROS. Sepsis meningkatkan aktivitas NADPH oksidase yang mensintesis ROS pada pembuluh darah dan kultur sel endotel mikrovaskuler [16,33,55]. Tentu saja, aktivitas NADPH oksidase merupakan dasar untuk stimulasi produksi superoksida pada sel endotel mikrovaskuler yang diinkubasi dengan reaksi sepsis (kombinasi LPS dan interferon-gamma [IFN-gamma]; LPS + IFNgamma) [33,55]. Produksi superoksida yang dipercepat dideteksi dalam 2 jam pada sel yang mendapat paparan awal LPS + IFN gamma [33]. ROS yang berasal dari hasil NADPH oksidase mengganggu aliran darah kapiler selama sepsis, dengan mendesak subunit NADPH oksidase, gp91phox (Nox2) atau secara farmakologis menghambat enzim yang diperlukan untuk memperbaiki maldistribusi aliran darah yang disebabkan oleh FIP pada mencit [13]. ROS mengoksidasi tetrahidrobiopterin, yang pada bentuk reduksinya merupakan kofaktor sintesis enzimatik nitrit oksida. Hilangnya tetrahidrobiopterin (karena reaksi oksidasi) melepaskan nitrit oksida sintase endotel (eNOS) pada sel endotel dan platelet, sehingga enzim ini akan cenderung mensintesis superoksida daripada nitrit oksida [56]. Pemberian lokal tetrahidrobiopterin memperbaiki aliran darah kapiler selama sepsis pada mencit liar namun tidak pada mencit eNOS -/- [13]. Pengamatan ini mendukung hipotesis bahwa tetrahidrobiopterin menstimulasi aktivitas eNOS untuk meningkatkan produksi nitrit oksida dan mengembalikan maldistribusi aliran darah kapiler pada sepsis. Dibandingkan dengan kontrol, injeksi askorbat secara bolus intravena pada 0, 1, 6 atau 24 jam setelah onset reaksi sepsis meningkatkan distribusi aliran darah kapiler pada otot skelet tikus CLP [4,12]. Sebagai contoh, injeksi askorbat (10 mg.kg) dalam 6 jam setelah onset dari reaksi sepsis mengembalikan maldistribusi aliran pembuluh darah dalam 10 menit [13]. Perbaikan cepat distribusi aliran darah oleh askorbat selama sepsis tergantung pada eNOS karena peristiwa ini terjadi pada tikus tipe liar dengan sintase neuronal nitric oxide (nNOS-/-) dan inducible nitric oxide (iNOS-/-) namun tidak terjadi pada tikus eNOS-/-.Efek stimulasi askorbat terhadap level nitrit oksida di dalam sel endotel dihubungkan melalui berbagai mekanisme. Pertama, seperti yang ditunjukkan pada Gb.1, askorbat mencegah dan membalikkan
oksidasi tetrahidrobiopterin, meningkatkan jumlah tetrahidrobiopterin dan menaikkan sintesis nitrit oksida tergantung tetrahidrobiopterin oleh eNOS, di mana peranan ini tidak dapat dilakukan oleh N-asetilsistein [7,57,58]. Kedua, askorbat menangkap superoksida dan ROS lain yang dapat bereaksi dengan nitrit oksida [55] (Gb.2). Berhentinya aliran darah pada kapiler septik dapat merupakan akibat dari interaksi antara leukosit, platelet dan sel endotel kapiler. ROS mengaktivasi jalur sinyal redoks intraseluler untuk meningkatkan adesi leukosit dan platelet ke endotelium [59]. Konsisten dengan fakta, adesi platelet distimulasi dan dihambat, berturut-turut oleh superoksida lokal dan nitrit oksida selama sepsis eksperimental [59]. ROS yang berasal dari endotel dan platelet juga meningkatkan agregasi platelet [60]. Pembentukan bekuan darah dalam pembuluh mikro setelah adesi dan agregasi platelet mungkin dapat menyebabkan berhentinya liran darah saat inflamasi sistemik. Injeksi 2 g askorbat intravena mengurangi agregasi platelet oleh nitrit oksida pada pasien protrombotik karena gagal jantung kronis [61]. Mekanisme yang mendasarinya dapat berasal dari efek askorbat yang menghambat ekspresi dan aktivasi NADPH oksidase, dengan demikian mencegah penurunan jumlah nitrit oksida [13,33]. Melihat hal itu, askorbat juga memiliki efek antiagregasi yang serupa pada pasien protrombotik karena sepsis.
5.2 Respon persisten terhadap askorbat Defisit perfusi kapiler pada sepsis eksperimental dapat dikurangi paling tidak selama 12 dan 47 jam dengan dosis askorbat berturut-turut 10 dan 76 mg/kg [4,12,13]. Dengan demikian, efek mikrovaskuler askorbat parenteral menetap selama beberapa jam setelah kadar askorbat plasma kembali ke normal [13]. Satu alasan mengapa efek tersebut memiliki durasi yang panjang adalah karena sel mempertahankan konsentrasi askorbat intraseluler tetap tinggi apabila dibandingkan dengan askorbat ekstraseluler [33]. Alasan kedua mengapa respon mikrovaskuler menetap terhadap askorbat adalah karena vitamin mengganggu ekspresi gen, seperti yang akan didiskusikan selanjutnya. Sel yang bertahan di bawah kondisi kultur standar sering tidak mengandung askorbat karena askorbat dan DHA sama-sama hilang dari medium dan dirusak selama preparasi dan penyimpanan media kultur. Di dalam sel endotel mikrovaskuler yang tidak mengandung askorbat, LPS + IFN-gamma secara cepat meningkatkan aktivitas NADPH oksidase [33,55]. NADPH oksidase endotel mensintesis superoksida intraseluler, yang bereaksi membentuk ROS yang lain (misal: dismutasi
superoksida membentuk hidrogen peroksida) yang kemudian mempengaruhi efek sinyal redoks yang memanjang [62]. Baik LPS + IFN-gamma atau hidrogen peroksida eksogen menstimulasi sinyal Jak2/Stat1/IRF1 dan meningkatkan ekspresi protein subunit NADPH oksidase [33,55]. Sehingga reaksi sepsis mengawali mekanisme awal untuk meningkatkan NADPH oksidase yang menghasilkan ROS. Inkubasi sel endotel mikrovaskuler dengang askorbat menaikkan konsentrasi askorbat intraseluler dan mencegah induksi oleh LPS + IFN-gamma atau hidrogen peroksida dari aktivitas NADPH oksidase endotel [33]. Askorbat juga menghambat induksi subunit enzim p47phox [33]. Efek terakhir diperantarai oleh jalur sinyal Jak2/Stat1/IRF1 karena askorbat menghambat aktivasi jalur ini oleh LPS + IFN-gamma atau hidrogen peroksida [33] (Gb 2). Selektivitas ditunjukkan oleh fakta di mana askorbat menghambat sintesis superoksida oleh NADPH oksidase sel endotel [33] namun tidak pada leukosit neutrofil [63-66]. Efek yang memanjang dari askorbat pada fungsi mikrovaskuler bisa melibatkan supresi dari ekspresi gen, yang tergantung pada HIF-1 (Gb 2). Askorbat berperan melalui kofaktor PHD, besi, untuk meningkatkan aktivitas enzim dan dengan demikian menghambat induksi dan stabilisasi HIF-1 alfa dengan hipoksia [44]. Lebih jauh lagi, inhibisi NADPH oksidase endotel oleh askorbat [33] dan penangkapan oksidan oleh askorbat dapat mempertahankan aktivitas PHD. Hal ini karena oksidan seperti ROS turunan NADPH oksidase, menghambat aktivitas PHD [67]. Penurunan konsentrasi HIF-1 oleh askorbat menghambat ekspresi gen sensitif HIF-1, seperti GLUT1 dan iNOS [14,15,45,55]. Aktivasi koagulasi selama sepsis adalah penyebab potensial lain gangguan aliran darah kapiler, yang mungkin dimodulasi secara berangsur-angsur oleh askorbat. ROS meningkatkan ekspresi molekul adesi dan faktor jaringan di permukaan platelet dan sel endotel [60]. Pembentukan selanjutnya dari komplek faktor jaringan dan faktor VII menyebabkan pembentukan trombin yang mengaktifkan NADPH oksidase. Mekanisme balik positif ini bisa menstimulasi pembentukan mikrotrombi [60] dan penghancurannya adalah mekanisme penting dari askorbat untuk memperbaiki distribusi aliran darah dan mempertahankan tingkat survival. Injeksi inhibitor jalur faktor jaringan meningkatkan survival pada model CLP sepsis [68], yang efeknya mirip dengan yang dicapai oleh injeksi askorbat [15]. Peran penting lain askorbat ditunjukkan oleh observasi di mana superoksida menstimulasi ekspresi molekul adesi intraseluler permukaan sel 1 (cell surface
10
intracellular adhesion molecule 1/ ICAM-1) di dalam sel endotel mikrovaskuler [62]. ICAM-1 memperantarai adesi leukosit ke endotelium dan dengan demikian dapat mengganggu mikrosirkulasi. Karena askorbat menghambat produksi superoksida dalam sel endotel mikrovaskuler yang dipaparkan pada reaksi sepsis [33], penelitian lebih lanjut diperlukan untuk menentukan apakah vitamin dapat menghambat leukosit di pembuluh mikro.
6. Vitamin C dan peningkatan permeabilitas endotel pada sepsis Peningkatan permeabilitas endotelium terjadi pada berbagai organ selama sepsis, menyebabkan ekstravasasi plasma dan pembentukan edema. Hal ini menyebabkan disfungsi respirasi, penurunan volume darah, dan progresi penyakit hingga tahap syok septik. Masukan parenteral askorbat menurunkan pembentukan edema pada pasien dengan luka bakar serius [50] sama baiknya dengan hewan dengan luka bakar atau hewan yang diinjeksi LPS [5,69,70]. Askorbat juga mengurangi peningkatan permeabilitas kapiler yang disebabkan oleh LPS secara in vitro [71]. Satu penyebab hilangnya fungsi barier pada sepsis bisa berasal dari apoptosis sel endotel [2]. Sehingga, peran askorbat dalam menghambat apoptosis sel endotel dan menstimulasi proliferasinya sama-sama bermanfaat [72-75]. Peran lain dari askorbat pada permeabilitas endotel melibatkan nitrit oksida, superoksida, dan peroksinitrit. Produksi nitrit oksida basal oleh eNOS diperlukan untuk mempertahankan fungsi barier endotel (misal untuk mempertahankan permeabilitas paraseluler endotel terhadap rendahnya protein plasma) [76]. Efek protektif nitrit oksida berkurang selama respon inflamasi karena produksi simultan dari superoksida. Nitrit oksida bereaksi dengan superoksida untuk membentuk peroksinitrit, yang menyebabkan peroksidasi lipid, oksidasi grup sulfhidril, dan nitrasi residu tirosin pada protein. Dalam keadaan tertentu, nitrasi protein fosfatase tipe 2 dan protein sitoskeletal oleh peroksinitrit merupakan faktor kunci terjadinya disfungsi barier mikrovaskuler [77,78]. Sumber utama superoksida kemungkinan adalah NADPH oksidase endotel serta eNOS dan iNOS yang terlepas. Bukti dari peran serta iNOS terlihat pada intervensi genetik maupun farmakologis yang menghambat enzim ini juga menurunkan kebocoran plasma pada sepsis eksperimental [79]. Dengan menangkap superoksida, menghambat ekspresi protein p47phox dan iNOS, dan menghambat sintesis superoksida dengan melepaskan ikatan eNOS dan iNOS, askorbat menurunkan pembentukan peroksinitrit. Ditambah lagi, askorbat menurunkan produk oksidasi yang dibentuk oleh reaksi peroksinitrit dengan
11
protein sel [80]. Peran askorbat ini dapat dimasukkan sebagai salah satu cara menghambat edema pada pasien dengan penyakit berat dan pada model eksperimental [5,50,69,71]. Mekanisme yang mendasari induksi iNOS oleh sepsis dan penghancurannya oleh askorbat dapat dijelaskan. Oksidan yang timbul dari aktivitas NADPH oksidase (seperti hidrogen peroksida yang dibentuk oleh dismutasi dari superoksida) meningkatkan induksi iNOS dalam pembuluh darah dan sel endotel septik [15,33,77]. iNOS mensintesis banyak sekali nitrit oksida, yang pada akhirnya bereaksi dengan superoksida dan menghasilkan produk peroksinitrit yang berlebihan. Askorbat menghambat induksi iNOS oleh reaksi sepsis dalam pembuluh darah secara in vivo dan pada kultur sel endotel [14,15,81]. Supresi NADPH oksidase yang diperantarai askorbat, paling tidak pada satu bagian, menghambat ekspresi iNOS [55]. Ketika stimulasi oleh LPS + IFN gamma, NADPH oksidase memproduksi ROS yang mengaktifkan jalur aktivasi induksi iNOS, JNK-AP1 dan Jak2-IRF1, dan askorbat menghambat aktivasi ini [55].
7. Hiporesponsifitas alveolar terhadap vasokonstriktor Hipotensi pada pasien sepsis dapat disebabkan oleh gangguan fungsi miokardial dan oleh hilangnya respon arterioler terhadap vasokonstriktor. Askorbat parenteral dapat mengatasi masalah terakhir, karena infus askorbat dapat mengembalikan respon arterioler terhadap vasokonstriktor (norepinefrin, angiotensin, vasopresin) pada subyek manusia yang memiliki penyakit inflamasi atau yang telah diinjeksi dengan LPS [9,82]. Hasil yang sama didapatkan pada model hewan sepsis. Contohnya, peningkatan heterogenitas aliran darah kapiler diikuti dengan munculnya hipotensi arteri pada tikus CLP [12]. Respon vasokonstriksi arterioler dan tekanan darah arteri terhadap norepinefrin dan angiotensin II dihambat pada mencit dalam 6 jam post-CLP [14,15]. Askorbat intravena dan defisiensi gen iNOS (mencit iNOS -/-) sama-sama efektif dalam mencegah gangguan responsifitas arterioler yang disebabkan oleh CLP [13-15]. Responsifitas arterioler dan tekanan darah arterial lebih tinggi di tikus CLP yang diinjeksi askorbat intravena, dibandingkan dengan yang diinjeksi dengan salin, di mana parameter ini diukur pada 18-24 jam post injeksi [4,12].
8. Hiporesponsifitas arterioler terhadap vasodilator Sel endotel mengatur responsifitas arterioler terhadap vasodilator melalui nitrit oksida yang berasal dari eNOS dan prostasiklin yang berasal dari prostaglandin endoperoksida H2 sintase-1 (PGHS) [83]. Nitrit oksida memasuki sel otot polos arterioler
12
dan mengaktifkan guanilil siklase soluble, dan kemudian menaikkan cGMP intraseluler. Prostasiklin menstimulasi adenilil siklase untuk menaikkan cAMP intraseluler. Baik cGMP dan cAMP kemudian memperantarai relaksasi otot polos. Meskipun begitu, reaksi septik meningkatkan produksi superoksida, yang bereaksi dengan nitrit oksida untuk membentuk peroksinitrit yang menginaktifasi PGHS endotel, yang kemudian tidak dapat lagi mensintesis prostasiklin. Superoksida dan oksida lain yang berasal dari NADPH oksidase (misal hidrogen peroksida dan peroksinitrit) bisa juga menurunkan tingkat seluler efektif dari nitrit oksida yang dibutuhkan untuk aktivase guanilil siklase [83]. Responsifitas arterioler terhadap vasodilator dihambat oleh infus LPS pada subyek manusia dan sepsis yang diinduksi CLP pada hewan [7,8,16]. Infus askorbat atau tetrahidrobiopterin menghambat inhibisi respon vasodilatasi endotel oleh LPS (ditandai dengan perubahan aliran darah lengan bawah) terhadap asetilkolin pada subyek orang sehat [7,8]. Efek askorbat ini dihubungkan dengan peningkatan konsentrasi tetrahidrobiopterin plasma [7]. Askorbat dapat mempertahankan level normal nitrit oksida yang berasal dari eNOS dan prostasiklin yang berasal dari PGHS dengan menekan ekspresi NADPH oksidase, menangkap ROS, dan meningkatkan konsentrasi tetrahidrobiopterin dalam sel endotel arteriol. Askorbat parenteral secara signifikan meningkatkan responsifitas arterioler terhadap vasodilator pada beberapa penyakit. Sebagai contoh, saat N-asetilsistein (48 mg/menit) atau askorbat (18 mg/menit) diinfuskan ke dalam arteri pada subyek orang dengan hipertensi esensial, hanya terapi askorbat yang meningkatkan vasodilatasi oleh asetilkolin [58]. Baru-baru ini, topik responsifitas terhadap vasodilator pada sepsis klinis menjadi kontroversial. Kienbaum et al. [84] melaporkan bahwa pengaruh asetilkolin menurun pada resistensi vaskuler lengan bawah (aliran darah lengan bawah/tekanan arteri rata-rata) tidak berbeda pada pasien sepsis dan kontrol. Meskipun begitu, karena pasien sepsis pada awalnya memiliki resistensi vaskuler lebih rendah, penurunan resistensi vaskuler yang disebabkan oleh infus asetilkolin mungkin tidak bermakna pada pasien tersebut. Penelitian pada subyek orang sehat sebelum dan selama endotoksemia eksperimental, hiporesponsifitas arterioler terhadap asetilkolin ditemukan pada 4-6 jam setelah pemberian LPS, saat di mana sitokin sirkulasi berada pada konsentrasi tertinggi [8]. Maka, hiporesponsifitas arterioler terhadap vasodilator yang sensitif terhadap askorbat dapat bervariasi dengan lama atau keparahan penyakit selama progresi sindrom sepsis.
13
9. Masalah yang belum terpecahkan yang membutuhkan penelitian lebih lanjut Tidak ada penelitian yang membandingkan askorbat dan DHA untuk penatalaksanaan sepsis. Uptake maksimal lebih tinggi untuk DHA daripada askorbat pada hampir seluruh tipe sel mamalia, saat diamati pada kondisi tanpa glukosa[1]. Namun glukosa menghambat pengambilan DHA ke dalam sebagian besar sel, termasuk sel endotel [35], dan hiperglikemia yang sering terjadi pada sepsis [3] dapat menurunkan ambilan seluler dan efek terapeutik DHA. Keamanan askorbat parenteral memerlukan penelitian lebih lanjut. Penelitian tentang askorbat intravena pada pasien dengan keganasan melaporkan bahwa injeksi 1,5 g askorbat/kg berat badan tiga kali dalam seminggu dapat ditoleransi dengan baik [85]. Meskipun begitu, askorbat dimetabolisme menjadi oksalat, yang berakumulasi sebagai kristal kalsium oksalat yang nefrotoksik (nefrolitiasis) pada ginjal subyek yang rentan, seperti yang dilaporkan pada beberapa studi terakhir [86]. Perhatian lain adalah askorbat memberikan elektron kepada logam transisional (misal besi), yang kemudian mengkatalisa sintesis hidrogen peroksida. Injeksi intravena askorbat berulang 750-7500 mg/hari selama 6 hari tidak mempengaruhi perubahan pro-oksidan dalam plasma pada orang sehat [87]. Namun pada pasien pembedahan, injeksi intravena 2 g askorbat 2 jam sebelum operasi besar meningkatkan perubahan oksidatif lipid plasma pada sampel darah vena selama fase iskemik dari pembedahan [88].
10. Kesimpulan Penelitian lebih lanjut dibutuhkan untuk memastikan keamanan dan efek terapi askorbat pada pasien dengan sepsis. Namun, bukti terakhir mendukung hipotesis bahwa fungsi mikrovaskuler dapat meningkat pada sepsis dengan pemberian askorbat secara parenteral sebagai terapi adjuvan.
Referensi 1. Wilson JX. Regulation of vitamin C transport. Annu. Rev. Nutr 2005;25:105125. [PubMed: 16011461] 2. Marshall JC. Sepsis: rethinking the approach to clinical research. J. Leukoc. Biol 2008;83:471482. [PubMed: 18171697] 3. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, Reinhart K, Angus DC, Brun-Buisson C, Beale R, Calandra T, Dhainaut JF, Gerlach H, Harvey M, Marini JJ, Marshall J, Ranieri M, Ramsay G, Sevransky J, Thompson BT,
14
Townsend S, Vender JS, Zimmerman JL, Vincent JL, International Surviving Sepsis Campaign Guidelines Committee; American Association of Critical-Care Nurses; American College of Chest Physicians; American College of Emergency Physicians; Canadian Critical Care Society; European Society of Clinical Microbiology and Infectious Diseases; European Society of Intensive Care Medicine; European Respiratory Society; International Sepsis Forum; Japanese Association for Acute Medicine; Japanese Society of Intensive Care Medicine; Society of Critical Care Medicine; Society of Hospital Medicine; Surgical Infection Society; World Federation of Societies of Intensive and Critical Care Medicine. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit. Care Med 2008;36:296327. [PubMed: 18158437] 4. Armour J, Tyml K, Lidington D, Wilson JX. Ascorbate prevents microvascular dysfunction in the skeletal muscle of the septic rat. J. Appl. Physiol 2001;90:795803. [PubMed: 11181585] 5. Dwenger A, Pape HC, Bantel C, Schweitzer G, Krumm K, Grotz M, Lueken B, Funck M, Regel G. Ascorbic acid reduces the endotoxin-induced lung injury in awake sheep. Eur. J. Clin. Invest 1994;24:229235. [PubMed: 8050451] 6. Feng NH, Chu SJ, Wang D, Hsu K, Lin CH, Lin HI. Effects of various antioxidants on endotoxininduced lung injury and gene expression: mRNA expressions of MnSOD, interleukin-1beta and iNOS. Chin. J. Physiol 2004;47:111120. [PubMed: 15612528] 7. Mittermayer F, Pleiner J, Schaller G, Zorn S, Namiranian K, Kapiotis S, Bartel G, Wolfrum M, Brugel M, Thiery J, Macallister RJ, Wolzt M. Tetrahydrobiopterin corrects Escherichia coli endotoxininduced endothelial dysfunction. Am. J. Physiol. Heart Circ. Physiol 2005;289:H1752H1757. [PubMed: 15964928] 8. Pleiner J, Mittermayer F, Schaller G, MacAllister RJ, Wolzt M. High doses of vitamin C reverse Escherichia coli endotoxin-induced hyporeactivity to acetylcholine in the human forearm. Circulation 2002;106:14601464. [PubMed: 12234948] 9. Pleiner J, Mittermayer F, Schaller G, Marsik C, MacAllister RJ, Wolzt M. Inflammation-induced vasoconstrictor hyporeactivity is caused by oxidative stress. J. Am. Coll. Cardiol 2003;42:16561662. [PubMed: 14607455] 10. Sakr Y, Dubois MJ, De Backer D, Creteur J, Vincent JL. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock. Crit. Care Med 2004;32:1825 1831. [PubMed: 15343008]
15
11. Shen KP, Lo YC, Yang RC, Liu HW, Chen IJ, Wu BN. Antioxidant eugenosedin-A protects against lipopolysaccharide-induced hypotension, hyperglycaemia and cytokine immunoreactivity in rats andmice. J. Pharm. Pharmacol 2005;57:117125. [PubMed: 15639000] 12. Tyml K, Li F, Wilson JX. Delayed ascorbate bolus protects against maldistribution of microvascularblood flow in septic rat skeletal muscle. Crit. Care Med 2005;33:1823 1828. [PubMed: 16096461] 13. Tyml K, Li F, Wilson JX. Septic impairment of capillary blood flow requires nicotinamide adeninedinucleotide phosphate oxidase but not nitric oxide synthase and is rapidly reversed by ascorbatethrough an endothelial nitric oxide synthasedependent mechanism. Crit. Care Med 2008;36:23552362. [PubMed: 18596627]\ 14. Wu F, Wilson JX, Tyml K. Ascorbate inhibits iNOS expression and preserves vasoconstrictorresponsiveness in skeletal muscle of septic mice. Am. J. Physiol. Regul. Integr. Comp. Physiol2003;285:R50R56. [PubMed: 12637347] 15. Wu F, Wilson JX, Tyml K. Ascorbate protects against impaired arteriolar constriction in sepsis byinhibiting inducible nitric oxide synthase expression. Free Radic. Biol. Med 2004;37:12821289.[PubMed: 15451067] 16. Yu HP, Lui PW, Hwang TL, Yen CH, Lau YT. Propofol improves endothelial dysfunction andattenuates vascular superoxide production in septic rats. Crit. Care Med 2006;34:453460. [PubMed:16424728] 17. Carr JE, Singer M. Cellular energetic metabolism in sepsis: the need for a systems approach.Biochim. Biophys. Acta 2008;1777:763771. [PubMed: 18482575] 18. Holzheimer RG. Antibiotic induced endotoxin release and clinical sepsis: a review. J. Chemother2001;13:159172. [PubMed: 11936361] 19. Borrelli E, Roux-Lombard P, Grau GE, Girardin E, Ricou B, Dayer J, Suter PM. Plasmaconcentrations of cytokines, their soluble receptors, and antioxidant vitamins can predict thedevelopment of multiple organ failure in patients at risk. Crit. Care Med 1996;24:392397. [PubMed:8625625] 20. Doise JM, Aho LS, Quenot JP, Guilland JC, Zeller M, Vergely C, Aube H, Blettery B, Rochette L.Plasma antioxidant status in septic critically ill patients: a decrease over time. Fundam. Clin.Pharmacol 2008;22:203209. [PubMed: 18353115] 21. Galley HF, Davies MJ, Webster NR. Ascorbyl radical formation in patients with sepsis: effect ofascorbate loading. Free Radic. Biol. Med 1996;20:139143. [PubMed: 8903690]
16
22. Long CL, Maull KI, Krishnan RS, Laws HL, Geiger JW, Borghesi L, Franks W, Lawson TC,Sauberlich HE. Ascorbic acid dynamics in the seriously ill and injured. J. Surg. Res 2003;109:144148. [PubMed: 12643856] 23. Metnitz PG, Bartens C, Fischer M, Fridrich P, Steltzer H, Druml W. Antioxidant status in patientswith acute respiratory distress syndrome. Intensive Care Med 1999;25:180185. [PubMed:10193545] 24. Rumelin A, Humbert T, Luhker O, Drescher A, Fauth U. Metabolic clearance of the antioxidantascorbic acid in surgical patients. J. Surg. Res 2005;129:4651. [PubMed: 16085104] 25. Schorah CJ, Downing C, Piripitsi A, Gallivan L, Al-Hazaa AH, Sanderson MJ, Bodenham A. Totalvitamin C, ascorbic acid, and dehydroascorbic acid concentrations in plasma of critically ill patients.Am. J. Clin. Nutr 1996;63:760765. [PubMed: 8615361] 26. Dupertuis YM, Ramseyer S, Fathi M, Pichard C. Assessment of ascorbic acid stability in differentmultilayered parenteral nutrition bags: critical influence of the bag wall material. JPEN J. Parenter.Enteral. Nutr 2005;29:125130. [PubMed: 15772391] 27. Knafo L, Chessex P, Rouleau T, Lavoie JC. Association between hydrogen peroxidedependentbyproducts of ascorbic acid and increased hepatic acetyl-CoA carboxylase activity. Clin. Chem2005;51:14621471. [PubMed: 15951314] 28. Baines M, Shenkin A. Lack of effectiveness of short-term intravenous micronutrient nutrition inrestoring plasma antioxidant status after surgery. Clin. Nutr 2002;21:145 150. [PubMed: 12056787] 29. Luo M, Fernandez-Estivariz C, Jones DP, Accardi CR, Alteheld B, Bazargan N, Hao L, Griffith DP,Blumberg JB, Galloway JR, Ziegler TR. Depletion of plasma antioxidants in surgical intensive careunit patients requiring parenteral feeding: effects of parenteral nutrition with or without alanylglutamine dipeptide supplementation. Nutrition 2008;24:3744. [PubMed: 18065204] 30. Best KA, Holmes ME, Samson SE, Mwanjewe J, Wilson JX, Dixon SJ, Grover AK. Ascorbate uptakein pig coronary artery endothelial cells. Mol. Cell Biochem 2005;271:4349. [PubMed: 15881654] 31. Davis KA, Samson SE, Best K, Mallhi KK, Szewczyk M, Wilson JX, Kwan CY, Grover AK. Ca2+-mediated ascorbate release from coronary artery endothelial cells. Br. J. Pharmacol 2006a;147:131139. [PubMed: 16331296]
17
32. Davis KA, Samson SE, Wilson JX, Grover AK. Hypotonic shock stimulates ascorbate release fromcoronary artery endothelial cells by a Ca2+-independent pathway. Eur. J. Pharmacol 2006b;548:3644. [PubMed: 16962579] 33. Wu F, Schuster DP, Tyml K, Wilson JX. Ascorbate inhibits NADPH oxidase subunit p47phoxexpression in microvascular endothelial cells. Free Radic. Biol. Med 2007;42:124131. [PubMed:17157199] 34. Seno T, Inoue N, Matsui K, Ejiri J, Hirata KI, Kawashima S, Yokoyama M. Functional expression of sodium-dependent vitamin C transporter 2 in human endothelial cells. J. Vasc. Res 2004;41:345351. [PubMed: 15340249] 35. Price KD, Price CSC, Reynolds RD. Hyperglycemia-induced ascorbic acid deficiency promotesendothelial dysfunction and the development of atherosclerosis. Atherosclerosis 2001 2001;158:112. 36. Mullan BA, Ennis CN, Fee HJ, Young IS, McCance DR. Pretreatment with intravenous ascorbic acidpreserves endothelial function during acute hyperglycaemia (R1). Clin. Exp. Pharmacol. Physiol2005;32:340345. [PubMed: 15854139] 37. Ceriello A, Esposito K, Piconi L, Ihnat MA, Thorpe JE, Testa R, Boemi M, Giugliano D. Oscillatingglucose is more deleterious on endothelial function and oxidative stress than mean glucose in normalsand type 2 diabetic patients. Diabetes 2008;57:13491354. [PubMed: 18299315] 38. Kuo SM, Tan CH, Dragan M, Wilson JX. Endotoxin increases ascorbate recycling and concentrationin mouse liver. J. Nutr 2005;135:24112416. [PubMed: 16177205] 39. Paik JY, Lee KH, Ko BH, Choe YS, Choi YY, Kim BT. Nitric oxide stimulates 18FFDG uptake inhuman endothelial cells through increased hexokinase activity and GLUT1 expression. J. Nucl. Med2005;46:365370. [PubMed: 15695798] 40. Spolarics Z, Stein DS, Garcia ZC. Endotoxin stimulates hydrogen peroxide detoxifying activity inrat hepatic endothelial cells. Hepatology 1996;24:691696. [PubMed: 8781344] 41. May JM, Huang J, Qu ZC. Macrophage uptake and recycling of ascorbic acid: response to activationby lipopolysaccharide. Free Radic. Biol. Med 2005;39:1449 1459. [PubMed: 16274880] 42. Wilson JX, Dragan M. Sepsis inhibits recycling and glutamate-stimulated export of ascorbate byastrocytes. Free Radic. Biol. Med 2005;39:990998. [PubMed: 16198226]
18
43. Spolarics Z. Endotoxemia, pentose cycle, and the oxidant/antioxidant balance in the hepatic sinusoid.J. Leukoc. Biol 1998;63:534541. [PubMed: 9581796] 44. Stolze IP, Mole DR, Ratcliffe PJ. Regulation of HIF: prolyl hydroxylases. Novartis Found. Symp2006;272:1525. [PubMed: 16686427] 45. Vissers MC, Gunningham SP, Morrison MJ, Dachs GU, Currie MJ. Modulation of hypoxia-induciblefactor-1 alpha in cultured primary cells by intracellular ascorbate. Free Radic. Biol. Med2007;42:765772. [PubMed: 17320759] 46. McNulty AL, Stabler TV, Vail TP, McDaniel GE, Kraus VB. Dehydroascorbate transport in humanchondrocytes is regulated by hypoxia and is a physiologically relevant source of ascorbic acid in thejoint. Arthritis Rheum 2005;52:26762685. [PubMed: 16142743] 47. Eskurza I, Monahan KD, Robinson JA, Seals DR. Effect of acute and chronic ascorbic acid on flowmediateddilatation with sedentary and physically active human ageing. J. Physiol 2004;556:315324. [PubMed: 14754992] 48. Crimi E, Liguori A, Condorelli M, Cioffi M, Astuto M, Bontempo P, Pignalosa O, Vietri MT, MolinariAM, Sica V, Della Corte F, Napoli C. The beneficial effects of antioxidant supplementation in enteralfeeding in critically ill patients: a prospective, randomized, double-blind, placebo-controlled trial.Anesth. Analg 2004;99:857863. [PubMed: 15333422] 49. Nathens AB, Neff MJ, Jurkovich GJ, Klotz P, Farver K, Ruzinski JT, Radella F, Garcia I, Maier RV.Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients. Ann.Surg 2002;236:814822. [PubMed: 12454520] 50. Tanaka H, Matsuda T, Miyagantani Y, Yukioka T, Matsuda H, Shimazaki S. Reduction ofresuscitation fluid volumes in severely burned patients using ascorbic acid administration: arandomized, prospective study. Arch. Surg 2000;135:326331. [PubMed: 10722036] 51. Gaut JP, Belaaouaj A, Byun J, Roberts LJ II, Maeda N, Frei B, Heinecke JW. Vitamin C fails toprotect amino acids and lipids from oxidation during acute inflammation. Free Radic. Biol. Med2006;40:14941501. [PubMed: 16632110] 52. Kim JY, Lee SM. Vitamins C and E protect hepatic cytochrome P450 dysfunction induced bypolymicrobial sepsis. Eur. J. Pharmacol 2006;534:202209. [PubMed: 16483564] 53. Trzeciak S, McCoy JV, Dellinger RP, Arnold RC, Rizzuto M, Abate NL, Shapiro NI, Parrillo JE, Hollenberg SM, on behalf of the Microcirculatory Alterations in
19
Resuscitation and Shock (MARS)Investigators. Early increases in microcirculatory perfusion during protocol-directed resuscitationare associated with reduced multiorgan failure at 24 h in patients with sepsis. Intensive Care Med2008;34:22102217. [PubMed: 18594793] 54. Spronk PE, Ince C, Gardien MJ, Mathura KR, Oudemans-van Straaten HM, Zandstra DR.Nitroglycerin in septic shock after intravascular volume resuscitation. Lancet 2002;360:13951396.[PubMed: 12423989] 55. Wu F, Tyml K, Wilson JX. iNOS expression requires NADPH oxidase-dependent redox signaling inmicrovascular endothelial cells. J. Cell. Physiol 2008;217:207214. [PubMed: 18481258] 56. Landmesser U, Dikalov S, Price SR, McCann L, Fukai T, Holland SM, Mitch WE, Harrison DG.Oxidation of tetrahydrobiopterin leads to uncoupling of endothelial cell nitric oxide synthase inhypertension. J. Clin. Invest 2003;111:12011209. [PubMed: 12697739] 57. Kim HJ, Lee SI, Lee DH, Smith D, Jo H, Schellhorn HE, Boo YC. Ascorbic acid synthesis due to Lgulono-1,4-lactone oxidase expression enhances NO production in endothelial cells. Biochem.Biophys. Res. Commun 2006;345:16571662. [PubMed: 16737683] 58. Schneider MP, Delles C, Schmidt BM, Oehmer S, Schwarz TK, Schmieder RE, John S. Superoxidescavenging effects of N-acetylcysteine and vitamin C in subjects with essential hypertension. Am.J. Hypertens 2005;18:11111117. [PubMed: 16109326] 59. Tailor A, Cooper D, Granger DN. Platelet-vessel wall interactions in the microcirculation. ddMicrocirculation 2005;12:275285. [PubMed: 15814436] 60. Herkert O, Djordjevic T, BelAiba RS, Gorlach A. Insights into the redox control of blood coagulation:role of vascular NADPH oxidase-derived reactive oxygen species in the thrombogenic cycle.Antioxid. Redox Signal 2004;6:765776. [PubMed: 15242558] 61. Ellis GR, Anderson RA, Chirkov YY, Morris-Thurgood J, Jackson SK, Lewis MJ, Horowitz JD,Frenneaux MP. Acute effects of vitamin C on platelet responsiveness to nitric oxide donors andendothelial function in patients with chronic heart failure. J. Cardiovasc. Pharmacol 2001;37:564570. [PubMed: 11336107] 62. Li JM, Fan LM, Christie MR, Shah AM. Acute tumor necrosis factor alpha signaling via NADPHoxidase in microvascular endothelial cells: role of p47phox
20
phosphorylation and binding to TRAF4.Mol. Cell. Biol 2005;25:23202330. [PubMed: 15743827] 63. Carr AC, Frei B. Human neutrophils oxidize low-density lipoprotein by a hypochlorous aciddependentmechanism: the role of vitamin C. J. Biol. Chem 2002;383:627636. 64. Chatterjee M, Saluja R, Kumar V, Jyoti A, Jain GK, Barthwal MK, Dikshit M. Ascorbate sustainsneutrophil NOS expression, catalysis, and oxidative burst. Free Radic. Biol. Med 2008;45:10841093. [PubMed: 18675339] 65. Ellis GR, Anderson RA, Lang D, Blackman DJ, Morris RH, Morris-Thurgood J, McDowell IF,Jackson SK, Lewis MJ, Frenneaux MP. Neutrophil superoxide aniongenerating capacity, endothelialfunction and oxidative stress in chronic heart failure: effects of short- and long-term vitamin Ctherapy. J. Am. Coll. Cardiol 2000;36:1474 1482. [PubMed: 11079645] 66. Sharma P, Raghavan SA, Saini R, Dikshit M. Ascorbate-mediated enhancement of reactive oxygenspecies generation from polymorphonuclear leukocytes: modulatory effect of nitric oxide. J. Leukoc.Biol 2004;75:10701078. [PubMed: 15039465] 67. Goyal P, Weissmann N, Grimminger F, Hegel C, Bader L, Rose F, Fink L, Ghofrani HA, SchermulyRT, Schmidt HH, Seeger W, Hanze J. Upregulation of NAD(P)H oxidase 1 in hypoxia activateshypoxia-inducible factor 1 via increase in reactive oxygen species. Free Radic. Biol. Med2004;36:12791288. [PubMed: 15110393] 68. Opal SM, Palardy JE, Parejo NA, Creasey AA. The activity of tissue factor pathway inhibitor inexperimental models of superantigen-induced shock and polymicrobial intra-abdominal sepsis. Crit.Care Med 2001;29:1317. [PubMed: 11176151] 69. Dubick MA, Williams C, Elgjo GI, Kramer GC. High-dose vitamin C infusion reduces fluidrequirements in the resuscitation of burn-injured sheep. Shock 2005;24:139144. [PubMed:16044084] 70. Sakurai M, Tanaka H, Matsuda T, Goya T, Shimazaki S, Matsuda H. Reduced resuscitation fluidvolume for second-degree experimental burns with delayed initiation of vitamin C therapy (beginning6 h after injury). J. Surg. Res 1997;73:24 27. [PubMed: 9441788] 71. Dimmeler S, Brinkmann S, Neugebauer E. Endotoxin-induced changes of endothelial cell viabilityand permeability: protective effect of a 21-aminosteroid. Eur. J. Pharmacol 1995;287:257261.[PubMed: 8991799]
21
72. Recchioni R, Marcheselli F, Moroni F, Pieri C. Apoptosis in human aortic endothelial cells inducedby hyperglycemic condition involves mitochondrial depolarization and is prevented 12404184] 73. Rssig L, Hoffmann J, Hugel B, Mallat Z, Haase A, Freyssinet JM, Tedgui A, Aicher A, Zeiher AM,Dimmeler S. Vitamin C inhibits endothelial cell apoptosis in congestive heart failure. Circulation2001;104:21822187. [PubMed: 11684628] 74. Saeed RW, Peng T, Metz CN. Ascorbic acid blocks the growth inhibitory effect of tumor necrosisfactor-alpha on endothelial cells. Exp. Cell Biol. (Maywood) 2003;228:855865. 75. Schor AM, Schor SL, Allen TD. Effects of culture conditions on the proliferation, morphology andmigration of bovine aortic endothelial cells. J. Cell Sci 1983;62:267 285. [PubMed: 6619206] 76. Cirino G, Fiorucci S, Sessa WC. Endothelial nitric oxide synthase: the Cinderella of inflammation?Trends Pharmacol. Sci 2003;24:9195. [PubMed: 12559774] 77. Neumann P, Gertzberg N, Vaughan E, Weisbrot J, Woodburn R, Lambert W, Johnson A. Peroxynitritemediates TNF-alpha-induced endothelial barrier dysfunction and nitration of actin. Am. J. Physiol.Lung Cell. Mol. Physiol 2006;290:L674 L684. [PubMed: 16284212] 78. Wu F, Wilson JX. Peroxynitrate-dependent activation of protein phosphatase type 2A mediatesmicrovascular endothelial barrier dysfunction. Cardiovasc. Res 2009;81:38 45. [PubMed:18791203] 79. Hollenberg SM, Guglielmi M, Parrillo JE. Discordance between microvascular permeability andleukocyte dynamics in septic iNOS-deficient mice. Crit. Care 2007;11:R125. [PubMed: 18062823] 80. Kirsch M, de Groot H. Ascorbate is a potent antioxidant against peroxynitrite-induced oxidationreactions. Evidence that ascorbate acts by re-reducing substrate radicals produced by peroxynitrite.J. Biol. Chem 2000;275:1670216708. [PubMed: 10748119] 81. Shen KP, Liou SF, Hsieh SL, Chen IJ, Wu BN. Eugenosedin-A amelioration of lipopolysaccharideinducedup-regulation of p38 MAPK, inducible nitric oxide synthase and cyclooxygenase-2. J.Pharm. Pharmacol 2007;59:879889. [PubMed: 17637181] by N-acetyl-lcysteine.Metabolism 2002;51:13841388. [PubMed:
22
82. Ferlitsch A, Pleiner J, Mittermayer F, Schaller G, Homoncik M, Peck-Radosavljevic M, Wolzt M.Vasoconstrictor hyporeactivity can be reversed by antioxidants in patients with advanced alcoholiccirrhosis of the liver and ascites. Crit. Care Med 2005;33:20282033. [PubMed: 16148476] 83. Frein D, Schildknecht S, Bachschmid M, Ullrich V. Redox regulation: a new challenge forpharmacology. Biochem. Pharmacol 2005;70:811823. [PubMed: 15899473] 84. Kienbaum P, Prante C, Lehmann N, Sander A, Jalowy A, Peters J. Alterations in forearm vascularreactivity in patients with septic shock. Anaesthesia 2008;63:121 128. [PubMed: 18211441] 85. Hoffer LJ, Levine M, Assouline S, Melnychuk D, Padayatty SJ, Rosadiuk K, Rousseau C, RobitailleL, Miller WH Jr. Phase I clinical trial of i.v. ascorbic acid in advanced malignancy. Ann. Oncol.2008in press 86. Nasr SH, Kashtanova Y, Levchuk V, Markowitz GS. Secondary oxalosis due to excess vitamin Cintake. Kidney Int 2006;70:1672. [PubMed: 17080154] 87. Muhlhofer A, Mrosek S, Schlegel B, Trommer W, Rozario F, Bhles H, Schremmer D, Zoller WG,Biesalski HK. High-dose intravenous vitamin C is not associated with an increase of pro-oxidativebiomarkers. Eur. J. Clin. Nutr 2004;58:11511158. [PubMed: 15054428] 88. Bailey DM, Raman S, McEneny J, Young IS, Parham KL, Hullin DA, Davies B, McKeeman G,McCord JM, Lewis MH. Vitamin C prophylaxis promotes oxidative lipid damage during surgicalischemia-reperfusion. Free Radic. Biol. Med 2006;40:591600. [PubMed: 16458189]
23
Gambar 1. Askorbat intraseluler memodulasi efek reaksi sepsis pada fungsi sel endotel mikrovaskuler. Kotak paling besar menunjukkan sebuah sel endotel mikrovaskuler, sementara panah dengan garis tegas menandakan stimulasi dan panah bergaris putus-putus menandakan inhibisi. Reaksi sepsis meningkatkan NADPH oksidase (Nox) dan aktivitas sintase inducible nitric oxide (iNOS), yang meningkatkan jumlah ROS dan peroksinitrit (ONOO-). ROS dan ONOOmengganggu aliran darah kapiler, fungsi barier kapiler, dan respon arterioler terhadap vasokonstriktor dan vasodilator. Askorbat (Asc) dan asam dehidroaskorbik (DHA) memasuki sel melalui sodium-dependent vitamin C transporter 2 (SVCT2) dan glucose transporter 1
24
(GLUT1), berturut-turut, dan DHA direduksi menjadi Asc. Asc intraseluler dengan cepat menangkap ROS dan ONOO- saat menstimulasi sintase endothelial nitric oxide (eNOS) yang bergantung tetrahidrobiopterin (BH4), untuk meningkatkan konsentrasi nitrit oksida (NO) lokal. Asc juga menurunkan aktivitas Nox, menghambat induksi enzim subunit p47phox, dan memblok induksi iNOS.
25
Gambar 2 Askorbat intraseluler (Asc) memodulasi jalur sinyal sensitif redoks dalam sel endotel mikrovaskuler selama sepsis. Kotak paling besar mewakili sel endotel mikrovaskuler, sedangkan tanda panah bergaris solid menandakan stimulasi dan tanda panah bergaris putusputus menandakan inhibisi. Lipopolisakarida (LPS) dan sitokin seperti interferon gamma (IFN gamma) menstimulasi jalur sinyal yang merangsang ekspresi NADPH oksidase (Nox) subunit p47phox, sintase inducible nitric oxide (iNOS), dan mediator inflamasi yang lain. Hipoksia meningkatkan hypoxia-inducible factor 1 (HIF-1), dengan menghambat HIF-1 prolil-hidroksilase (PHD), yang kemudian menginduksi ekspresi gen terkait sepsis. Asc menghambat aktivasi jalur Jak2-Stat1-IRF1 dan meningkatkan aktivitas PHD. Lebih jauh lagi Asc meregulasi konsentrasi nitrit oksida (NO) lokal dengan cara menangkap superoksida dan peroksinitrit (ONOO-). IKK; NFB. Askorbat tidak mempengaruhi IKB kinase (IKK) dan
26
faktor nuklear B yang juga memediasi induksi iNOS dalam sel endotel mikrovaskuler yang terpapar LPS dan IFN gamma.
Anda mungkin juga menyukai
- Gudisashock IdDokumen11 halamanGudisashock Idberita updateBelum ada peringkat
- LP AsitesDokumen20 halamanLP AsitesMega WijayaBelum ada peringkat
- OxytocinDokumen5 halamanOxytocinDwi agustinaBelum ada peringkat
- Resume Perawatan Pasien Asidosis - Dede Aris Herdiansyah 09190000130Dokumen9 halamanResume Perawatan Pasien Asidosis - Dede Aris Herdiansyah 09190000130Aris HerdiansyahBelum ada peringkat
- Tata Laksana Syok SeptikDokumen27 halamanTata Laksana Syok Septikwimbydr100% (9)
- LP Syok Sepsis Atika PutriDokumen24 halamanLP Syok Sepsis Atika PutriAtika Putri Ayu0% (1)
- Asidosis LaktatDokumen21 halamanAsidosis LaktatLim Xian NioBelum ada peringkat
- Rahmatang. 1904023. Asidosis MetabolikDokumen28 halamanRahmatang. 1904023. Asidosis MetabolikTedy Buana PutraBelum ada peringkat
- Tinjauan Pustaka SepsisDokumen13 halamanTinjauan Pustaka SepsisRaisBelum ada peringkat
- MAKALAH KEGAWATDARURATAN SYOK - Diana DoraDokumen23 halamanMAKALAH KEGAWATDARURATAN SYOK - Diana Doradiana doraBelum ada peringkat
- Laporan Pendahuluan Sepsis Septik ,, IirDokumen13 halamanLaporan Pendahuluan Sepsis Septik ,, IirOdhi AngellBelum ada peringkat
- Erika Gustira, Kasus Syok Septik, Ruangan CvcuDokumen44 halamanErika Gustira, Kasus Syok Septik, Ruangan CvcuDevi AfrizaBelum ada peringkat
- Terjemahan Jurnal Laktat Pada Pasien Sakit KritisDokumen14 halamanTerjemahan Jurnal Laktat Pada Pasien Sakit Kritisfatimah syamBelum ada peringkat
- LP Syok SepsisDokumen22 halamanLP Syok SepsisTitik Tri Ardiani100% (1)
- Syok SeptikDokumen6 halamanSyok Septikkiki melindaBelum ada peringkat
- MODSDokumen30 halamanMODSKila EbaBelum ada peringkat
- MAKALAH Management ShockDokumen20 halamanMAKALAH Management Shockroy wilsonBelum ada peringkat
- Icu SeminarDokumen34 halamanIcu SeminarFebri engahuBelum ada peringkat
- AskepDokumen26 halamanAskepwinatha noreenBelum ada peringkat
- GabunganDokumen13 halamanGabunganDede IskandarBelum ada peringkat
- Tugas Ujian CBDDokumen3 halamanTugas Ujian CBDFredy Rodeardo MaringgaBelum ada peringkat
- Syok SeptikDokumen23 halamanSyok SeptikNovel AyuBelum ada peringkat
- LP Kep - Gadar MisbaDokumen341 halamanLP Kep - Gadar MisbaRabiatul Sakinah GumayBelum ada peringkat
- (Refarat) Pengaruh Sepsis Terhadap KardiovaskulerDokumen22 halaman(Refarat) Pengaruh Sepsis Terhadap Kardiovaskulerirwoons70Belum ada peringkat
- Pertemuan 2Dokumen15 halamanPertemuan 2Daffa AdhitamaBelum ada peringkat
- Laporan Tutorial Acidosis Kelompok 1aDokumen23 halamanLaporan Tutorial Acidosis Kelompok 1aAnonymous Y8NVhPyABelum ada peringkat
- Askep Syok Septik 2Dokumen10 halamanAskep Syok Septik 2Bunga InnashofaBelum ada peringkat
- Referat AnestesiDokumen16 halamanReferat AnestesiNanaBelum ada peringkat
- Tatalaksana SyokDokumen20 halamanTatalaksana SyokOcha HubungBelum ada peringkat
- Refarat Syok KardiogenikDokumen20 halamanRefarat Syok KardiogenikisaduatigaBelum ada peringkat
- Mekanisme KolestassiDokumen23 halamanMekanisme KolestassiAlvino Maulana AzmyBelum ada peringkat
- SepsisDokumen40 halamanSepsisyessica96Belum ada peringkat
- LP Dan Askep SepsisDokumen35 halamanLP Dan Askep SepsisAl Ach ArifBelum ada peringkat
- Askep Sepsis TiwieDokumen19 halamanAskep Sepsis TiwieIpcln CikarangBelum ada peringkat
- LP Dan Askep SepsisDokumen33 halamanLP Dan Askep SepsisHermin OktaviaBelum ada peringkat
- Laporan Pendahuluan Syok SeptikDokumen17 halamanLaporan Pendahuluan Syok SeptikZahraBelum ada peringkat
- ShockDokumen10 halamanShockgasomedic85Belum ada peringkat
- Ipm Kardiologi OsceDokumen93 halamanIpm Kardiologi OsceAndre ReynaldoBelum ada peringkat
- LP Kep - Gadar MisbaDokumen341 halamanLP Kep - Gadar MisbaNestri SusiantiBelum ada peringkat
- Pedoman Penatalaksanaan Asites Pada SirosisDokumen24 halamanPedoman Penatalaksanaan Asites Pada SirosisciciBelum ada peringkat
- Syok SepticDokumen10 halamanSyok SepticdewiBelum ada peringkat
- LP SyokDokumen13 halamanLP SyokAnisa FitriBelum ada peringkat
- Ni Wayan Manik A S - KLP 2B - Profesi 2019 Program ADokumen51 halamanNi Wayan Manik A S - KLP 2B - Profesi 2019 Program AManik ArditaBelum ada peringkat
- Makalah Case 4 Tropmed Tutorial C2Dokumen13 halamanMakalah Case 4 Tropmed Tutorial C2Qara Syifa FBelum ada peringkat
- Laporan Pendahuluan SyokDokumen19 halamanLaporan Pendahuluan Syoksergio salsinhaBelum ada peringkat
- Tatalaksana Syok-Anestesi..Dokumen17 halamanTatalaksana Syok-Anestesi..ammang_bs88% (8)
- Terapi Selenium Pada Pasien SepsisDokumen10 halamanTerapi Selenium Pada Pasien SepsisAndrias OzBelum ada peringkat
- Syok SeptikDokumen13 halamanSyok SeptikAnzila Atfi Nur HabibahBelum ada peringkat
- Syok SepsisDokumen6 halamanSyok SepsisPriskila ElisabethBelum ada peringkat
- LAPORAN PENDAHULUAN KadDokumen24 halamanLAPORAN PENDAHULUAN KadAna Septianadi FahulpaBelum ada peringkat
- Mineral Dan ElektrolitDokumen30 halamanMineral Dan ElektrolitMuhammad AsyrafBelum ada peringkat
- LP Syok SepsisDokumen38 halamanLP Syok Sepsisradenwulan100% (4)
- Surviving Sepsis CampaignDokumen29 halamanSurviving Sepsis CampaignayudevitaBelum ada peringkat
- Kel 10 Syok Neurogenik Dan HemoragikDokumen25 halamanKel 10 Syok Neurogenik Dan HemoragikHeru WiyonoBelum ada peringkat