Dasar Teori Kation Gol II
Diunggah oleh
Ni Komang Ayu WidyantariHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Dasar Teori Kation Gol II
Diunggah oleh
Ni Komang Ayu WidyantariHak Cipta:
Format Tersedia
Dasar Teori
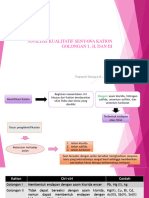
Kation golongan II tidak bereaksi dengan asam klorida, tetapi membentuk endapan
dengan pereaksi H2S atau thioasetamida dalam suasana asam mineral encer. Ion-ion
golongan ini adalah merkurium (II), bismut (III), kupri (II), kadmium (II),tembaga (II),
arsenit (III), arsenit (IV), stibium (III), stibium (V), timah (III), dantimah (IV).
Kation-kation golongan kedua menurut tradisi dibagi menjadi dua sub-golongan, sub-
golongan tembaga dan sub-golongan arsenik. Dasar dari pembagian ini adalah kelarutan
endapan sulfida dalam amonium polisulfida. Sementara sulfida dari sub-golongan tembaga
tidak larut dalam reagen ini. Sedangkan sulfida dari sub- golongan arsenik melarut dengan
membentuk garam tio.
Sub-golongan tembaga terdiri dari merkuri(II), timbal(II), bismut(III), tembaga(II)
dan kadmium(II). Meskipun bagian terbesar ion timbal(II) diendapkan dengan asam klorida
encer bersama ion-ion lain dari golongan I. Pengendapan ini agak kurang sempurna
disebabkan oleh kelarutan timbal(II) klorida yang relatif tinggi. Maka dalam pengerjaan
analisis sistematik ion-ion timbal masih akan tetap ada ketika kita bertugas mengendapkan
golongan kation kedua. Klorida, nitrat, dan sulfat dari kation-kation sub-golongan tembaga
sangat mudah larut dalam air. Sulfida, hidroksida dan karbonatnya tidak larut. Beberapa
kation dari sub-golongan tembaga (merkuri(II), tembaga(II) dan kadmium(II)) cenderung
membentuk kompleks (amonia, ion sianida, dll) Sub-golongan arsenik terdiri dari ion
arsenik(III), arsenik(V), stibium(III), stibium(V), timah(II) dan timah(IV). Ion-ion ini
mempunyai sifat amfoter, oksidanya membentuk garam baik dengan asam maupun dengan
basa. Jadi, arsenik(III) oksida dapat dilarutkan dalam asam klorida 6M dan terbentuk kation
arsenik(III).
Anda mungkin juga menyukai
- Pemisahan Kation Gol 2Dokumen13 halamanPemisahan Kation Gol 2Meitri Wulandari KoharBelum ada peringkat
- KATION Golongan 2Dokumen6 halamanKATION Golongan 2Lex JonxBelum ada peringkat
- Kation II Klpok 4Dokumen15 halamanKation II Klpok 4ZahraBelum ada peringkat
- Identifikasi Kation Golongan II (Teori)Dokumen8 halamanIdentifikasi Kation Golongan II (Teori)AdeFriscaDianaII100% (4)
- Identifikasi Kation Golongan II TeoriDokumen8 halamanIdentifikasi Kation Golongan II TeoriFajril RifkiBelum ada peringkat
- KATION Golongan 2Dokumen7 halamanKATION Golongan 2Ody xBelum ada peringkat
- Kation Golongan IDokumen13 halamanKation Golongan IDWIBelum ada peringkat
- 09-Pemisahan Dan Identifikasi Kation Golongan IIDokumen3 halaman09-Pemisahan Dan Identifikasi Kation Golongan IIAl LubizBelum ada peringkat
- Bab IDokumen13 halamanBab IMoch Khoirul UmamBelum ada peringkat
- Laporan Analisis Kation AnionDokumen10 halamanLaporan Analisis Kation AnionDeni St-setia Van HoutenBelum ada peringkat
- Analisis Kation Golonggan IIDokumen25 halamanAnalisis Kation Golonggan IISri SumartiniBelum ada peringkat
- Golongan 2Dokumen10 halamanGolongan 2Beby HapsariBelum ada peringkat
- Makalah Kation Dan AnionDokumen29 halamanMakalah Kation Dan AnionCahaya PratamaBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- Kation Golongan 1Dokumen4 halamanKation Golongan 1BiiebBelum ada peringkat
- Analisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiDokumen3 halamanAnalisa Kualitatif Adalah Proses Dalam Mendeteksi Keberadaan Suatu Unsur Kimia Dalam Sampel Yang Tidak DiketahuiYoon Hye MyeongBelum ada peringkat
- Laporan Praktikum Kation Dan AnionDokumen23 halamanLaporan Praktikum Kation Dan AnionFatimah Jufri50% (4)
- Materi KA1 Minggu 1Dokumen28 halamanMateri KA1 Minggu 1Arnes TataBelum ada peringkat
- Pemisahan Dan Uji Konfirmasi Kation Golongan II - Catatan Kuliah MeyDokumen10 halamanPemisahan Dan Uji Konfirmasi Kation Golongan II - Catatan Kuliah MeyGoran Sulano100% (1)
- Kation Golongan IIDokumen22 halamanKation Golongan IIHesti apriana putriBelum ada peringkat
- JJXJDKSMXDokumen15 halamanJJXJDKSMXAufa QaysBelum ada peringkat
- Pemisahan Kation Jane Ila NunukDokumen22 halamanPemisahan Kation Jane Ila Nunukjane nizar rahmanBelum ada peringkat
- Identifikasi Kation Golongan 1 Dan 2Dokumen4 halamanIdentifikasi Kation Golongan 1 Dan 2Indra KurniawanBelum ada peringkat
- Penggolongan Kation KLP 1Dokumen9 halamanPenggolongan Kation KLP 1Zhalzhabilla AzzahrahBelum ada peringkat
- Modul 2 Analisa Kualitatif Metoda Reagen Spesifik Sampel Anorganik Untuk KationikDokumen14 halamanModul 2 Analisa Kualitatif Metoda Reagen Spesifik Sampel Anorganik Untuk KationikAl GhifarBelum ada peringkat
- TugasDokumen7 halamanTugasMulti ArmainahBelum ada peringkat
- Analisiskation 190425155404Dokumen13 halamanAnalisiskation 190425155404Dechia Sachamyta LicheresBelum ada peringkat
- CBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDokumen12 halamanCBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDesima SamosirBelum ada peringkat
- Kimia Analitik IDokumen10 halamanKimia Analitik INurul afiqah suburanBelum ada peringkat
- Analisis Kation Golongan I II III IV TUGASDokumen12 halamanAnalisis Kation Golongan I II III IV TUGASdutaBelum ada peringkat
- Makalah Pemisahan Kation Golongan II PDFDokumen14 halamanMakalah Pemisahan Kation Golongan II PDFPrilaHermanto100% (2)
- Analisis Kation Golongan I II III IV DanDokumen13 halamanAnalisis Kation Golongan I II III IV Dannadya aulia100% (1)
- Analisis KationDokumen17 halamanAnalisis KationSileents ShaadowBelum ada peringkat
- Analisis Anion KationDokumen6 halamanAnalisis Anion KationPuspipita DewiBelum ada peringkat
- Golongan Kation Ke DuaDokumen16 halamanGolongan Kation Ke DuaFitriyaniBelum ada peringkat
- Makalah Kimia Analisis TeoriDokumen6 halamanMakalah Kimia Analisis Teorisambois567Belum ada peringkat
- Analisis KationDokumen16 halamanAnalisis KationLinggar Rudiarto100% (1)
- Makalah Tembaga JadiDokumen11 halamanMakalah Tembaga Jadipranggajati100% (1)
- Kation III Kelompok 1Dokumen24 halamanKation III Kelompok 1ZahraBelum ada peringkat
- RX Kation Gol 1 & 2 Kmia AnalisaDokumen27 halamanRX Kation Gol 1 & 2 Kmia Analisalisa andriani100% (1)
- Jurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariDokumen31 halamanJurnal Praktikum Analisis Kation Dan Anion - 008 - Tiara PuspitasariBani AsrorBelum ada peringkat
- Analisis Kualitatif Kation Gol 2Dokumen28 halamanAnalisis Kualitatif Kation Gol 2Gita Yuliana DewiBelum ada peringkat
- Dalam Sistem H2S Kation Golongan IDokumen9 halamanDalam Sistem H2S Kation Golongan IDea Aliftia FirdaushyaBelum ada peringkat
- Kimia AnalisDokumen15 halamanKimia AnalisJihan Essa SiregarBelum ada peringkat
- Kation Golongan IibDokumen5 halamanKation Golongan IibRianIDBelum ada peringkat
- MAKALAH ANALISIS KATION GOL 1,2 (Celine Alfiona)Dokumen19 halamanMAKALAH ANALISIS KATION GOL 1,2 (Celine Alfiona)Celine AlfiBelum ada peringkat
- Pemisahan Kation Golongan I Dan IiDokumen14 halamanPemisahan Kation Golongan I Dan IiFadhil FerdianBelum ada peringkat
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Analisis Kation Golongan IIDokumen3 halamanAnalisis Kation Golongan IIrianto sitanggangBelum ada peringkat
- Makalah Pemisahan Kation Golongan IIDokumen9 halamanMakalah Pemisahan Kation Golongan IIFinta C LimbongBelum ada peringkat
- Laporan Resmi KationDokumen20 halamanLaporan Resmi KationFikriyah Nugiari RachmahBelum ada peringkat
- Pembuatan CuSo4Dokumen7 halamanPembuatan CuSo4ardhiBelum ada peringkat
- Identifikasi Kation Golongan 4 Dan 5Dokumen7 halamanIdentifikasi Kation Golongan 4 Dan 5asnhyBelum ada peringkat
- Analisis Senyawa KimiaDokumen17 halamanAnalisis Senyawa KimiaZulitaBelum ada peringkat
- Identifikasi Kation Golongan 2Dokumen7 halamanIdentifikasi Kation Golongan 2ervhintia mkBelum ada peringkat
- Analisis Anion KationDokumen5 halamanAnalisis Anion KationFrengky AfrimirzaBelum ada peringkat
- Kation AnionDokumen12 halamanKation AnionRizki Alfi MuhammadBelum ada peringkat
- Pembahasan Jamur UdaraDokumen7 halamanPembahasan Jamur UdaraNi Komang Ayu WidyantariBelum ada peringkat
- Mature SkizonDokumen1 halamanMature SkizonNi Komang Ayu WidyantariBelum ada peringkat
- SADTDokumen16 halamanSADTNi Komang Ayu WidyantariBelum ada peringkat
- Dampak Pestisida Terhadap Lingkungan Dan KesehatanDokumen7 halamanDampak Pestisida Terhadap Lingkungan Dan KesehatanNi Komang Ayu WidyantariBelum ada peringkat
- NAPZADokumen68 halamanNAPZANi Komang Ayu WidyantariBelum ada peringkat
- Mekanisme KeracunanDokumen14 halamanMekanisme KeracunanNi Komang Ayu WidyantariBelum ada peringkat
- PemeriksaanDokumen23 halamanPemeriksaanNi Komang Ayu WidyantariBelum ada peringkat
- P07134018064 - Ni Komang Ayu Widyantari - 2BDokumen24 halamanP07134018064 - Ni Komang Ayu Widyantari - 2BNi Komang Ayu WidyantariBelum ada peringkat
- TOKSIKOLOGIDokumen25 halamanTOKSIKOLOGINi Komang Ayu WidyantariBelum ada peringkat
- VITAMINDokumen26 halamanVITAMINNi Komang Ayu WidyantariBelum ada peringkat
- Hipotesis TbaDokumen1 halamanHipotesis TbaNi Komang Ayu WidyantariBelum ada peringkat
- Resume 5 JurnalDokumen33 halamanResume 5 JurnalNi Komang Ayu WidyantariBelum ada peringkat
- Laporan Kimia Klinik Dasar Sgot Dan SGPTDokumen22 halamanLaporan Kimia Klinik Dasar Sgot Dan SGPTNi Komang Ayu WidyantariBelum ada peringkat
- 4 Penggunaan Huruf Tebal Yang Benar Sesuai EYD Dalam Bahasa IndonesiaDokumen6 halaman4 Penggunaan Huruf Tebal Yang Benar Sesuai EYD Dalam Bahasa IndonesiaNi Komang Ayu Widyantari0% (1)
- Laporan Praktikum Tikus & PinjalDokumen27 halamanLaporan Praktikum Tikus & PinjalNi Komang Ayu WidyantariBelum ada peringkat
- PEMBAHASAN KationDokumen5 halamanPEMBAHASAN KationNi Komang Ayu WidyantariBelum ada peringkat
- EVALUASI MORFOLOGI LeukositDokumen18 halamanEVALUASI MORFOLOGI LeukositNi Komang Ayu WidyantariBelum ada peringkat
- Tes Retraksi Bekuan MateriDokumen2 halamanTes Retraksi Bekuan MateriNi Komang Ayu WidyantariBelum ada peringkat
- Evaluasi Morfologi EritrositDokumen23 halamanEvaluasi Morfologi EritrositNi Komang Ayu WidyantariBelum ada peringkat