Poster Koordinasi PDF
Diunggah oleh
SyifaAnanda0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
70 tayangan1 halamanTeori Werner dan Graham hanya dapat menjelaskan sebagian sifat senyawa kompleks, sedangkan teori rantai Blomstrand dan Jorgensen tidak dapat menjelaskan sifat nonelektrolit dari beberapa senyawa kompleks tertentu. Teori-teori ini memiliki kelemahan dalam menjelaskan seluruh sifat senyawa kompleks.
Deskripsi Asli:
Judul Asli
poster koordinasi.pdf
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniTeori Werner dan Graham hanya dapat menjelaskan sebagian sifat senyawa kompleks, sedangkan teori rantai Blomstrand dan Jorgensen tidak dapat menjelaskan sifat nonelektrolit dari beberapa senyawa kompleks tertentu. Teori-teori ini memiliki kelemahan dalam menjelaskan seluruh sifat senyawa kompleks.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
70 tayangan1 halamanPoster Koordinasi PDF
Diunggah oleh
SyifaAnandaTeori Werner dan Graham hanya dapat menjelaskan sebagian sifat senyawa kompleks, sedangkan teori rantai Blomstrand dan Jorgensen tidak dapat menjelaskan sifat nonelektrolit dari beberapa senyawa kompleks tertentu. Teori-teori ini memiliki kelemahan dalam menjelaskan seluruh sifat senyawa kompleks.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 1
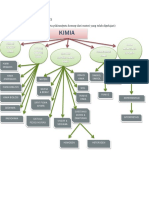
Kelebihan Dan Kelemahan Teori Koordinasi
WERNER DAPAT MEMPOSTULASIKAN
DUA MACAM VALENSI YAITU
VALENSI PRIMER DAN
SEKUNDER DAN HANYA BERDASARKAN TEORI INI, AMINA-
AMINA LIGAN DIANGGAP
AMMONIUM
DIMILIKI OLEH ATOM LOGAM.
VALENSI PRIMER DIPENUHI SEBAGAI SENYAWA-SENYAWA GRAHAM
OLEH ANION SEDANGKAN AMMONIUM YANG
VALENSI SEKUNDER DIPENUHI TERSUBSTITUSI. CONTOHNYA
OLEH ANION ATAU MOLEKUL DAPAT DIGAMBARKAN DALAM
NETRAL. ATOM PUSAT SENYAWA KOMPLEKS PADA
DENGAN ANION ATAU DIAMINATEMBAGA (II) KLORIDA.
MENURUT GRAHAM, DUA ATOM
MOLEKUL NETRAL YANG
HYDROGEN, MASING-MASING
TERIKAT PADA ATOM PUSAT
SATU DARI SETIAP ION
MEMBENTUK SUATU
AMMONIUM, DISUBSTITUSI OLEH
KOMPLEKS. KOMPLEKS YANG
SEBUAH ATOM TEMBAGA. DUA
ATOM PUSATNYA MEMILIKI
ATOM HIDROGEN DAPAT
BILOKS 6 DISEBUT
DISUBSTITUSI OLEH SATU ATOM
OKTAHEDRAL, SEDANGKAN
TEMBAGA KARENA TEMBAGA
YANG BILOKSNYA 4 ADALAH
MEMILIKI VALENSI DUA
TETRAHEDRAL ATAU BUJUR
SEDANGKAN HIDROGEN SATU.
SANGKAR.
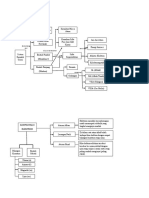
Teori Werner tidak menjelaskan
bagaimana pembentukanikatan
antara atom pusat dengan ligan ligan Teori ammonium dari Graham
yang ada hanya dapat diterapkan bila
jumlah NH3 yang terikat pada
atom logam jumlahnya sama
dengan valensi ligan atau
elektrovalensi dari logam
KEKULE
- Dapat mengemukakan struktur
benzen dengan tepat, atom
karbon memiliki valensi 4,
rumus metana CH4, atom-atom
karbon dapat membentuk rantai
- Dapat membagi senyawa
menjadi 2 golongan, yaitu BLOMSTRAND MENGAJUKAN
TEORI RANTAI YANG
atomik dan molekular KEMUDIAN DISEMPURNAKAN
OLEH JORGENSEN.
BERDASARKAN TEORI RANTAI,
MOLEKUL-MOLEKUL NH3
DAPAT MEMBENTUK RANTAI –
- Hanya menjelaskan bahwa gaya yang bekerja NH3–, ANALOG DENGAN
antara senyawa atomik dan molekular lebih RANTAI –CH2– PADA BLOMSTRAND
lemah sehingga tidak stabil. Tidak dapat SENYAWA ORGANIK. DIDALAM
menjelaskan gaya yang terlibat dalam SENYAWA KOMPLEKS, JUMLAH
pembentukan senyawa molekuler dari senyawa- NH3 YANG TERIKAT PADA JORGENSEN
senyawa atomik. Ikatan rangkap pada benzena ATOM LOGAM TERGANTUNG
seharusnya mempunyai kecenderungan bereaksi PADA VALENSI LOGAM. ATOM
secara adisi. Kenyataannya, banyak benzena HALOGEN DI DALAM SENYAWA
terlibat pada reaksi substitusi. KOMPLEKS DIBAGI DUA
MACAM, YAITU ATOM
HALOGEN LEBIH DEKAT DAN
ATOM HALOGEN LEBIH JAUH.
TEORI INI TIDAK DAPAT MENJELASKAN SIFAT
NONELEKTROLIT DARI COCL3.3NH3. NAMUN
DEMIKIAN DIA DAPAT MEMBUAT SENYAWA
IRCL3.3NH3 YANG DIHARAPKAN AKAN
MEMPUNYAI SIFAT YANG SMA DENGAN
COCL3.3NH3 YAITU MEMBERIKAN REAKSI
PENGENDAPAN DENGAN ION AG+ DENGAN RASIO
STOIKIOMETRI 1:1. NAMUN KENYATAANNYA,
SENYAWA INI TIDAK DAPAT MENGHASILKAN
ENDAPAN DENGAN ION AG+ DAN TIDAK DAPAT
MENGHANTARKAN ALIRAN LISTRIK SEHINGGA
TEORI PEMBENTUKAN RANTAI MODEL INI TIDAK
DAPAT DIPERTAHANKAN
SASTI GONA
FADHILAH/185090201111022, KELEBIHAN
DIMAS AZIZ
SYAIFUDDI/185090200111009
KELEMAHAN
Anda mungkin juga menyukai
- Scientific Method Educational Poster 20240123 143706 0000Dokumen1 halamanScientific Method Educational Poster 20240123 143706 0000Aqila RahmatfadillahBelum ada peringkat
- Kenrick MantapDokumen13 halamanKenrick MantaprheyyudhapratamaBelum ada peringkat
- Rangkuman Instrumen DaspekDokumen4 halamanRangkuman Instrumen Daspekfrenellayahya19Belum ada peringkat
- Laporan PraktikumDokumen2 halamanLaporan Praktikumellysa kurniasihBelum ada peringkat
- Struktur Atom Sist. Berkala OkDokumen37 halamanStruktur Atom Sist. Berkala OkCeline Dian SitorusBelum ada peringkat
- Kimia Dasar PERT 2Dokumen18 halamanKimia Dasar PERT 2noning2004Belum ada peringkat
- LKPD Atom Ion MolekulDokumen4 halamanLKPD Atom Ion MolekulErly NovianaBelum ada peringkat
- Vatars Zanzim Mario - Uts Kimia DasarDokumen5 halamanVatars Zanzim Mario - Uts Kimia DasarMario PardedeBelum ada peringkat
- Buku Studi Interferensi Pada AASDokumen46 halamanBuku Studi Interferensi Pada AASMuchlas AkbarBelum ada peringkat
- BIORADIASIDokumen36 halamanBIORADIASISalman JBelum ada peringkat
- Tugas 1Dokumen4 halamanTugas 1Muhammad Fadillah EfendiBelum ada peringkat
- Struktur Atom SistemDokumen37 halamanStruktur Atom SistemAyaka KalilaBelum ada peringkat
- Adoc - Pub - Atomic Absorption Spectrophotometry Aas SpektrofotDokumen12 halamanAdoc - Pub - Atomic Absorption Spectrophotometry Aas SpektrofotMiftah patrielaBelum ada peringkat
- Martins Physical Pharmacy and Pharmaceutical Sciences, 6th Edition (Kazirhut - Com) - Pages-207-232 - 1583644838456Dokumen26 halamanMartins Physical Pharmacy and Pharmaceutical Sciences, 6th Edition (Kazirhut - Com) - Pages-207-232 - 1583644838456why uBelum ada peringkat
- Analisis Instrumen SAP 4Dokumen9 halamanAnalisis Instrumen SAP 4Siti Aminah Rahma YantiBelum ada peringkat
- Infra RedDokumen28 halamanInfra RedWinda Camelia Nagesha100% (1)
- Teori AtomDokumen1 halamanTeori AtomReindhardhBelum ada peringkat
- Gambarkan Peta Pikiran/peta Konsep Dari Materi Yang Telah Dipelajari)Dokumen5 halamanGambarkan Peta Pikiran/peta Konsep Dari Materi Yang Telah Dipelajari)Ika Ajeng Ayu PutriBelum ada peringkat
- Kartu Ujian Teori AtomDokumen3 halamanKartu Ujian Teori AtomAl Muhalla AmartaBelum ada peringkat
- Perkembangan Model AtomDokumen4 halamanPerkembangan Model Atomifan shoviBelum ada peringkat
- Teori Atom Kuantum Kel.5 X.1 - 20231101 - 130315 - 0000Dokumen19 halamanTeori Atom Kuantum Kel.5 X.1 - 20231101 - 130315 - 0000nabillanafissatunBelum ada peringkat
- Laporan Analisa Instrumen Spektrofotometri Serapan AtomDokumen23 halamanLaporan Analisa Instrumen Spektrofotometri Serapan AtomffatikatusBelum ada peringkat
- KimMed Ikatan Kimia (Kelompok 3)Dokumen26 halamanKimMed Ikatan Kimia (Kelompok 3)Alif AzmarBelum ada peringkat
- Diskusi 2 Kimia Dasar - Ina Saila 043010933Dokumen17 halamanDiskusi 2 Kimia Dasar - Ina Saila 043010933DadanBelum ada peringkat
- Laporan Praktikum AASDokumen22 halamanLaporan Praktikum AASasriBelum ada peringkat
- AASDokumen12 halamanAASPutri ElysabethBelum ada peringkat
- ANFISKO 2023 01 Dasar Spektroskopi & Teori Ikatan 3Dokumen48 halamanANFISKO 2023 01 Dasar Spektroskopi & Teori Ikatan 3231ff03032Belum ada peringkat
- Pertemuan 7. Teori-Teori Kimia Koordinasi Sebelum 1930Dokumen14 halamanPertemuan 7. Teori-Teori Kimia Koordinasi Sebelum 1930Mutiya Bimba DewiBelum ada peringkat
- PPT AasDokumen30 halamanPPT AasilmaristaBelum ada peringkat
- Tugas Tuton1 - KIMD4110 - LINTANG SATITI (043060153) PDFDokumen4 halamanTugas Tuton1 - KIMD4110 - LINTANG SATITI (043060153) PDFLintang SatitiBelum ada peringkat
- Kimia Kompleks Kel 4Dokumen23 halamanKimia Kompleks Kel 4Silvia WulandariBelum ada peringkat
- Kel. 5 Teori Orbital MolekulDokumen10 halamanKel. 5 Teori Orbital MolekulNurularistaBelum ada peringkat
- Spektroskopi Serapan Atom (AAS)Dokumen13 halamanSpektroskopi Serapan Atom (AAS)Ridho HermawanBelum ada peringkat
- Spektrofotometri Serapan AtomDokumen45 halamanSpektrofotometri Serapan Atombellamerdikaaa_75804Belum ada peringkat
- AasDokumen26 halamanAasAnonymous 5YG7VqjEBelum ada peringkat
- Atom Bag 1Dokumen7 halamanAtom Bag 1keylaBelum ada peringkat
- Struktur AtomDokumen51 halamanStruktur AtomBejoan FfyisjeliBelum ada peringkat
- Tugas Kimia Komputasi Terapan 5Dokumen16 halamanTugas Kimia Komputasi Terapan 5Helda Dwi HardiyantiBelum ada peringkat
- LK 0 Struktur AtomDokumen9 halamanLK 0 Struktur Atomchairi yanaBelum ada peringkat
- Atom Dan Radio AktivitasDokumen14 halamanAtom Dan Radio AktivitasMeyshiaBelum ada peringkat
- Kimia Struktur Atom Dan Ikatan Kimia - Mohamad Hafizh AlgifarriDokumen17 halamanKimia Struktur Atom Dan Ikatan Kimia - Mohamad Hafizh AlgifarriMohamad Hafizh AlgifarriBelum ada peringkat
- LKPD Kimia (Chandra Kirana X MIPA 1)Dokumen2 halamanLKPD Kimia (Chandra Kirana X MIPA 1)Linggar AdiBelum ada peringkat
- Bab 1Dokumen34 halamanBab 1M Altamis SaadanBelum ada peringkat
- Makalah Analisis Mineral Dengan Metode ModernDokumen28 halamanMakalah Analisis Mineral Dengan Metode ModernSartiana AnaBelum ada peringkat
- STereokimiaDokumen27 halamanSTereokimiaNanda 777Belum ada peringkat
- 1b. Struktur Atom Dan Sistem PeriodikDokumen34 halaman1b. Struktur Atom Dan Sistem PeriodikDafit Ari PrasetyoBelum ada peringkat
- Kimia InfografisDokumen5 halamanKimia InfografisDevan ImanBelum ada peringkat
- X MIPA Lembar Kerja Perkembangan Model AtomDokumen3 halamanX MIPA Lembar Kerja Perkembangan Model AtomNilam Putri Defa50% (2)
- Kelompok 11 KimanorDokumen16 halamanKelompok 11 KimanorBang OtBelum ada peringkat
- Analisis Konsep Partikel Materi.Dokumen1 halamanAnalisis Konsep Partikel Materi.FhebriBelum ada peringkat
- Chapt03 en IdDokumen40 halamanChapt03 en IdEdi SuharmonoBelum ada peringkat
- Makalah Kuantisasi Gelombang FononDokumen5 halamanMakalah Kuantisasi Gelombang FononEkki GustiBelum ada peringkat
- BAHANDokumen25 halamanBAHANsilviaawdBelum ada peringkat
- Laporan AasDokumen19 halamanLaporan AasTresia Anita SariBelum ada peringkat
- BuktiDokumen3 halamanBuktiYannieApriyaniBelum ada peringkat
- 1 Kimia OrganikDokumen51 halaman1 Kimia OrganikErika Nur ApriantiBelum ada peringkat
- Pert 2 Struktur AtomDokumen37 halamanPert 2 Struktur AtomKurnia Unhy100% (1)
- Draft Jurnal Orlan Belom JadiDokumen5 halamanDraft Jurnal Orlan Belom JadiSyifaAnandaBelum ada peringkat
- Epms Kelompok 1 Setelah RevisiDokumen31 halamanEpms Kelompok 1 Setelah RevisiSyifaAnandaBelum ada peringkat
- Kimia Koordinasi - MEKANISME REAKSI - I - 2019Dokumen32 halamanKimia Koordinasi - MEKANISME REAKSI - I - 2019SyifaAnandaBelum ada peringkat
- Karbohidrat LaporanDokumen14 halamanKarbohidrat LaporanSyifaAnanda100% (1)
- Uts Kuantum 2018Dokumen7 halamanUts Kuantum 2018SyifaAnandaBelum ada peringkat
- Kimia Koordinasi - MEKANISME REAKSI Konjugat BasaDokumen11 halamanKimia Koordinasi - MEKANISME REAKSI Konjugat BasaSyifaAnandaBelum ada peringkat
- LAPORAN PKL FORMALIN PUSLAB VentyDokumen29 halamanLAPORAN PKL FORMALIN PUSLAB VentySyifaAnandaBelum ada peringkat
- UTS Dasar Elektrometri Dan Pemisahan Kelas A 2017-2018Dokumen1 halamanUTS Dasar Elektrometri Dan Pemisahan Kelas A 2017-2018SyifaAnandaBelum ada peringkat
- KarbohidratDokumen3 halamanKarbohidratSyifaAnandaBelum ada peringkat
- 014 Perizinan Peminjaman Lapangan Voli UKMDokumen2 halaman014 Perizinan Peminjaman Lapangan Voli UKMSyifaAnandaBelum ada peringkat
- Bab IDokumen3 halamanBab ISyifaAnandaBelum ada peringkat
- Surat Pernyataan BEM FMIPADokumen1 halamanSurat Pernyataan BEM FMIPASyifaAnandaBelum ada peringkat
- Kuota Tambahan Dan Alok KhususDokumen12 halamanKuota Tambahan Dan Alok KhususSyifaAnandaBelum ada peringkat
- Jurnal Kadar Ethanol Dengan GCDokumen3 halamanJurnal Kadar Ethanol Dengan GCSyifaAnandaBelum ada peringkat