LK 0.1 Modul 4 Kimia Eli Sofiati
Diunggah oleh
elisofiati0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
61 tayangan5 halamanJudul Asli
LK 0.1 Modul 4 kimia Eli Sofiati
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
61 tayangan5 halamanLK 0.1 Modul 4 Kimia Eli Sofiati
Diunggah oleh
elisofiatiHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 5
Nama : Eli Sofiati,S.
Pd
No. UKG : 202000549376
PPG KIMIA KATEGORI 2
UNIVERSITAS NEGERI SEMARANG
LK 0.1: Lembar Kerja Belajar Mandiri
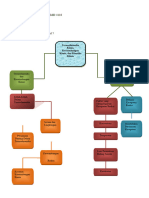
Judul Modul Modul 4 Kinetika
Judul Kegiatan Belajar (KB) 1. KB 1 : Laju Reaksi
2. KB 2 : Kesetimbangan Kimia
3. KB 3 : Energetika
4. KB 4 : Redoks dan Elektrokimia
No Butir Refleksi Respon/Jawaban
1 Garis besar materi yang KB 1 : Laju Reaksi
dipelajari a. Konsep Laju Reaksi
- Laju reaksi atau kecepatan reaksi
adalah perubahan konsentrasi
pereaksi maupun produk dalam
satuan waktu
b. Hukum Laju dan Orde Reaksi
- Hukum laju reaksi merupakan
persamaan yang menghubungkan
laju reaksi dengan konstanta laju dan
konsentrasi reaktan
- Orde reaksi adalah pangkat-pangkat
konsentrasi reaktan yang ada dalam
hukum laju
1) Orde nol
2) Orde Satu
3) Orde dua
4) Orde tiga
c. Waktu Paro
- Waktu paro adalah waktu yang
dibutuhkan oleh reaktan untuk
bereaksi sehingga konsentrasi
pereaksi menjadi setengah
1) Waktu paro orde nol
2) Waktu paro orde Satu
3) Waktu paro orde dua
d. Persamaan Laju Reaksi
- Persamaan laju reaksi adalah
persamaan yang menghubungkan
laju reaksi dengan konsentrasi/
tekanan spesi yang terlibat dalam
reaksi.
1) Metode penentuan laju
- metoda integral
- metode grafik
- metode laju awal
- metode waktu fraksi
2) Mekanisme reaksi
- Reaksi elementer dan reaksi
rumit
- Tahap penentu laju
- Kemolekulan reaksi
- Reaksi rantai
- Hukum laju dari mekanisme
reaksi
e. Pengaruh Tumbukan Terhadap Laju
Reaksi
- Teori tumbukan menggambarkan
pertemuan partikel-partikel pereaksi
sebagai suatu tumbukan.
f. Faktor-faktor yang Mempengaruhi Laju
Reaksi
- Keadaan pereaksi/ kereaktifan zat
- Pengaruh konsentrasi
- Pengaruh luas permukaan
- Pengaruh suhu
- Pengaruh katalis
KB 2 : Kesetimbangan Kimia
a. Kesetimbangan Dinamis
- Kesetimbangan kimia merupakan
kesetimbangan dinamis dimana laju
perubahan zat pereaksi menjadi zat
hasil reaksi sama dengan laju
perubahan produk menjadi reaktan.
- Kesetimbangan dinamis terdiri dari:
1) Kesetimbangan kimia :
kesetimbangan dinamis dimana
laju reaksi kearah produk sama
dengan laju reaksi kearah reaktan
dan konsentrasi reaktan dan
produk konstan
2) Kesetimbangan fisika : perubahan
terjadi hanya pada proses fisis
b. Kesetimbangan Homogen dan Heterogen
- Kesetimbangan homogen : hanya
terdapat satu fasa
- Kesetimbangan heterogen : terdapat
lebih dari satu fasa
c. Hukum Kesetimbangan
- Pada keadaan setimbang,
perbandingan hasil kali konsentrasi
produk yang dipangkatkan dengan
koefisiennya terhadap hasil kali
konsentrasi reaktan dipangkatkan
koefisiennya adalah tetap.
d. Tetapan Kesetimbangan dan
stoikiometri reaksi
e. Tetapan kesetimbangan berdasarkan
konsentrasi (Kc)
f. Tetapan kesetimbangan berdasarkan
tekanan parsial (Kp)
g. Hubungan Kc dengan Kp
h. Kesetimbangan Disosiasi
i. Faktor-faktor yang mempengaruhi
kesetimbangan kimia
1) Pengaruh Konsentrasi
2) Pengaruh Suhu
3) Pengaruh Volume dan Tekanan
4) Proses Haber – Bosch dan Proses
Kontak
KB 3 : Energetika
a. Sistem dan lingkungan
- Sistem adalah bagian dari alam
semesta yang menjadi pusat
perhatian atau yang akan kita pelajari
- Lingkungan adalah suatu yang
berada diluar sistem
b. Kerja, Kalor dan Energi Dalam
- Kerja adalah setiap bentuk energi
yang bukan kalor yang dipertukarkan
antara sistem dan lingkungan
- Kalor adalah energi yang dipindahkan
melalui batas-batas sistem, akibat
perbedaan suhu sistem dan
lingkungan
- Energi adalah kemampuan untuk
melakukan kerja
1) Energi potensial : energi yang
didasarkan pada posisi benda,
dipengaruhi oleh massa, tinggi
dan gaya gravitasi
2) Energi kinetika :energi pada benda
bergerak
c. Rumusan hukum pertama
termodinamika
- Hukum kekekalan energi “ energi
tidak dapat dimusnahkan dan tidak
dapat diciptakan”
d. Perubahan energi dalam pada berbagai
macam Proses
- Proses isotermal
- Proses isovolum
- Proses adiabatik
- Ekspansi isobarik reversibel
- Ekspansi isotermal reversibel
e. Reaksi eksoterm dan endoterm
- Reaksi eksoterm adalah reaksi yang
pada saat berlangsung disertai
pelepasan kalor atau sistem
melepaskan kalor ke lingkungan
- Reaksi endoterm adalah reaksi yang
pada saat berlangsung disertai
penyerapan kalor atau sistem
menyerap kalor dari lingkungan.
f. Kalor reaksi pada tekanan tetap (ΔH)
- Entalpi reaksi (ΔHr)
- Entalpi pembentukan standar
- Entalpi penguraian standar
- ΔH pembakaran standar
g. Penentuan Harga ΔH dengan berbagai
metode
- Kalorimetri
- Hukum Hess
- Energi Ikatan
- Penentuan ΔHreaksi berdasarkan
entalpi pembentukan standar
h. Entropi : ukuran keacakan atau
ketidakteraturan suatu sistem.
i. Hukum Kedua Termodinamika
- Hukum kedua termodinamika yaitu
entropi alam semesta (universe) akan
meningkat dalam proses spontan dan
tidak berubah dalam proses
kesetimbangan.
j. Energi bebas Gibbs
KB 4 Redoks dan Elektrokimia
a. Reaksi Redoks
1) Konsep Redoks :
- berdasarkan pengikatan dan pelepasan
oksigen
- Berdasarkan menangkap dan melepas
elektron
- Berdasarkan perubahan biloks
2) Oksidator dan reduktor
3) Setengah Reaksi
4) Bilangan Oksidasi
5) Reaksi disproporsionasi
6) Penyetaraan reaksi redoks :
- Cara Perubahan Biloks
- Cara setengah reaksi
7) Ekivalen Redoks
b. Sel Elektrokimia
1) Sel Volta dan susunannya
2) Potensial sel
3) Potensial reduksi standar
4) Sel volta dalam kehidupan sehari-hari
:
- Sel primer
- Sel sekunder
c. Korosi
d. Sel Elektrolisis
1) Susunan sel elektrolisis
2) Reaksi -reaksi elektrolisis
3) Elektroda aktif
4) Konstanta Faraday
5) Hukum Faraday
6) Kegunaan elektrolisis
- Produksi hidrogen
- Pembuatan klor dan natrium
- Pembuatan natrium hidroksida
- Pembuatan aluminium,
magnesium, dan tembaga
- Penyepuhan listrik
2 Daftar materi yang sulit 1. Waktu Paro
dipahami di modul ini 2. Metode Penentuan Laju dan orde reaksi
3. Reaksi elementer dan reaksi rumit
4. Proses Haber Bosch dan Kontak
5. Energi bebas Gibbs
6. Perubahan energi bebas standar
7. Persamaan Nerst
3 Daftar materi yang sering 1. Penentuan Entalpi Reaksi
mengalami miskonsepsi 2. Penyetaraan Reaksi Redoks
Anda mungkin juga menyukai
- LK 1 Modul 4 Profesional Irwan AprayadiDokumen8 halamanLK 1 Modul 4 Profesional Irwan AprayadiIrwan Aprayadi SyakiraBelum ada peringkat
- LK 1 Modul 4 NewDokumen5 halamanLK 1 Modul 4 NewAgus SanzdingerBelum ada peringkat
- LK 0.1.4Dokumen6 halamanLK 0.1.4Imam SuhadaBelum ada peringkat
- LK 1.1 Modul 4 - Ririn Qurniawati - KimiaDokumen7 halamanLK 1.1 Modul 4 - Ririn Qurniawati - KimiaRirin QurniawatiBelum ada peringkat
- LK 1 - Lembar Kerja Belajar Mandiri - Modul 4Dokumen5 halamanLK 1 - Lembar Kerja Belajar Mandiri - Modul 4putra100% (1)
- LK 0.1 Modul 4 - ProfesionalDokumen12 halamanLK 0.1 Modul 4 - ProfesionalSiti SupriyantiBelum ada peringkat
- LK 0.1 Lembar Kerja Belajar Mandiri - Profesional Modul 4 - EkoDokumen5 halamanLK 0.1 Lembar Kerja Belajar Mandiri - Profesional Modul 4 - EkoEko SulistyaningsihBelum ada peringkat
- LK1-Modul 4 ProfesionalDokumen7 halamanLK1-Modul 4 Profesionaldiyah noviBelum ada peringkat
- LK 1 Modul 4 ProfesionalDokumen10 halamanLK 1 Modul 4 ProfesionalDian Ubaedillah NuraeniBelum ada peringkat
- DISKUSI.6.Kimia Dasar Deti TesmitaDokumen4 halamanDISKUSI.6.Kimia Dasar Deti TesmitaFadhlan FadhilahBelum ada peringkat
- Bab IiDokumen7 halamanBab IiWAHYU YAHYA SAPUTRABelum ada peringkat
- LK1-Modul 4 ProfesionalDokumen10 halamanLK1-Modul 4 ProfesionalHasNa YushaaBelum ada peringkat
- Dasar Kinetika Kimia Dan TermodinamikaDokumen37 halamanDasar Kinetika Kimia Dan TermodinamikaJian0% (1)
- Diskusi 6 Kimia DasarDokumen4 halamanDiskusi 6 Kimia DasarSyahmadcs SyahmadcsBelum ada peringkat
- LK Belajar Mandiri - Modul 4 Profesional - IKE PDFDokumen8 halamanLK Belajar Mandiri - Modul 4 Profesional - IKE PDFIKE YUSRIANTIBelum ada peringkat
- Diskusi 6 Kimia DasarDokumen7 halamanDiskusi 6 Kimia DasarDerby larasatiBelum ada peringkat
- Laporan Hasil PraktikumDokumen9 halamanLaporan Hasil PraktikumAriella Trixie HartonoBelum ada peringkat
- Artikel Laju Reaksi BerkesudahanDokumen7 halamanArtikel Laju Reaksi BerkesudahanmutiaBelum ada peringkat
- Bab 1. Kinetika Kimia-ModulDokumen22 halamanBab 1. Kinetika Kimia-ModulValenzia Ayu MahartantiBelum ada peringkat
- LK 0.1 Modul 4 ProfesionalDokumen6 halamanLK 0.1 Modul 4 ProfesionalAlfa Dina PrianotoBelum ada peringkat
- LK 0.1 Lembar Kerja Belajar Mandiri Profesional 4Dokumen12 halamanLK 0.1 Lembar Kerja Belajar Mandiri Profesional 4Rina TyasningBelum ada peringkat
- LKM Laju Reaksi (P-1)Dokumen9 halamanLKM Laju Reaksi (P-1)raiBelum ada peringkat
- LK 0.1 LK Mandiri Modul 4 ProfesionalDokumen8 halamanLK 0.1 LK Mandiri Modul 4 ProfesionalAl-murtadoBelum ada peringkat
- Kinetika KimiaDokumen19 halamanKinetika KimiaKiki D'SquardBelum ada peringkat
- Kinetika KimiaDokumen8 halamanKinetika KimiasakurakeeBelum ada peringkat
- Artikel KF 2 Percobaan 1Dokumen7 halamanArtikel KF 2 Percobaan 1Dina fadhilaBelum ada peringkat
- 2 Dan 3 - Dasar-Dasar Kinetika Reaksi Kimia - Gasal 2020-2021Dokumen40 halaman2 Dan 3 - Dasar-Dasar Kinetika Reaksi Kimia - Gasal 2020-2021Chisya Ayu PuspitaweniBelum ada peringkat
- 2018.pertemuan I-Kinetika MetalurgiDokumen26 halaman2018.pertemuan I-Kinetika MetalurgiAlfiansyah DarmawanBelum ada peringkat
- Laporan Praktikum Laju ReaksiDokumen28 halamanLaporan Praktikum Laju ReaksiDenesya Natalia P100% (1)
- Konsep Dasar Kinetika KimiaDokumen38 halamanKonsep Dasar Kinetika KimiaJianBelum ada peringkat
- Laporan Kinetika ReaksiDokumen21 halamanLaporan Kinetika ReaksiAriyatiBelum ada peringkat
- Laporan Kinetika KimiaDokumen32 halamanLaporan Kinetika KimiaRifa'atul Mahmudah86% (7)
- Kinetika Kimia ReaksiDokumen12 halamanKinetika Kimia Reaksichelsie camariBelum ada peringkat
- LK 01 Modul 4 KnetikaDokumen14 halamanLK 01 Modul 4 KnetikaSyarif SuhermanBelum ada peringkat
- TRK02 11BDokumen4 halamanTRK02 11BIrene sephiaBelum ada peringkat
- Lkpdorde ReaksiDokumen18 halamanLkpdorde Reaksipopit widyaBelum ada peringkat
- Benaziria LK 1 Modul 4Dokumen2 halamanBenaziria LK 1 Modul 4BenaziriaBelum ada peringkat
- RPP Teori Tumbukan Dan Orde, Persamaan Laju FiksssDokumen18 halamanRPP Teori Tumbukan Dan Orde, Persamaan Laju FiksssAgus IndrawanBelum ada peringkat
- Laporan Praktikum Kimia Dasar PenentuanDokumen21 halamanLaporan Praktikum Kimia Dasar PenentuanSandy HarbianBelum ada peringkat
- Laporan Resmi Kimia Analisis IiDokumen27 halamanLaporan Resmi Kimia Analisis Ii1B. Winda WidiartiBelum ada peringkat
- Muhammad Rafi Wirdian UTS Kimia 2Dokumen8 halamanMuhammad Rafi Wirdian UTS Kimia 2Farraz Azzahra AlfirahBelum ada peringkat
- Ii Kinetika ReaksiDokumen15 halamanIi Kinetika ReaksiAriestan SuhendraBelum ada peringkat
- Revisi LAPRAK Kinetika ReaksiDokumen21 halamanRevisi LAPRAK Kinetika ReaksiiinBelum ada peringkat
- Kinetika Kimia AQDokumen29 halamanKinetika Kimia AQputraBelum ada peringkat
- Kinetika ReaksiDokumen14 halamanKinetika ReaksiyunitaBelum ada peringkat
- Rencana Pelaksanaan Pembelajaran: Praktik Keterampilan MengajarDokumen43 halamanRencana Pelaksanaan Pembelajaran: Praktik Keterampilan MengajarAkther PBelum ada peringkat
- Laporan Kimia Dasar I Laju ReaksiDokumen12 halamanLaporan Kimia Dasar I Laju ReaksiWardah Faizah0% (1)
- Laporan Praktikum Kinetika KimiaDokumen23 halamanLaporan Praktikum Kinetika KimiaFitrata WidyaBelum ada peringkat
- 1 LAPRES Laju ReaksiDokumen25 halaman1 LAPRES Laju ReaksiSa'adahBelum ada peringkat
- Makalah Kinetika KimiaDokumen11 halamanMakalah Kinetika KimiaRizki KinantiBelum ada peringkat
- LTK-II-16 - KA - LAPORAN AWAL (AutoRecovered)Dokumen34 halamanLTK-II-16 - KA - LAPORAN AWAL (AutoRecovered)Rifa FadhilahBelum ada peringkat
- Ali Musa - 24030120130077 - P2 - Kelompok 2Dokumen26 halamanAli Musa - 24030120130077 - P2 - Kelompok 2Ali MucaniagoBelum ada peringkat
- Irvan Saputra 191910801021 Kelompok 2Dokumen8 halamanIrvan Saputra 191910801021 Kelompok 2Irvan PutraBelum ada peringkat
- Modul 6 Kimdas2Dokumen25 halamanModul 6 Kimdas2rini kristiyantiBelum ada peringkat
- Jurnal Praktikum Kimia Dasar LanjutanDokumen8 halamanJurnal Praktikum Kimia Dasar LanjutanIrvan PutraBelum ada peringkat
- Modul 4Dokumen15 halamanModul 4Marta LenaBelum ada peringkat
- Sukarman - Kimia - Diskusi Sesi 6Dokumen5 halamanSukarman - Kimia - Diskusi Sesi 6Pascal AliBelum ada peringkat
- Laporan Praktikum Kinetika ReaksiDokumen20 halamanLaporan Praktikum Kinetika ReaksiiinBelum ada peringkat
- LK 3.1 Menyusun Best Practices ELIDokumen8 halamanLK 3.1 Menyusun Best Practices ELIelisofiatiBelum ada peringkat
- Modul Ajar PapuaDokumen60 halamanModul Ajar PapuaelisofiatiBelum ada peringkat
- Aksi Nyata Sosialisasi PPPDokumen15 halamanAksi Nyata Sosialisasi PPPelisofiatiBelum ada peringkat
- LK 0.1 Modul 3 Kimia Eli SofiatiDokumen4 halamanLK 0.1 Modul 3 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK 0.1 Modul 5 Kimia Eli SofiatiDokumen5 halamanLK 0.1 Modul 5 Kimia Eli SofiatielisofiatiBelum ada peringkat
- Jurnal Refleksi 4FDokumen1 halamanJurnal Refleksi 4Felisofiati100% (1)
- Window ShopingDokumen7 halamanWindow ShopingelisofiatiBelum ada peringkat
- PJBL Sel VoltaDokumen27 halamanPJBL Sel VoltaelisofiatiBelum ada peringkat
- Bahan Ajar Sel VoltaDokumen19 halamanBahan Ajar Sel VoltaelisofiatiBelum ada peringkat
- LKPD Persamaan Reaksi.Dokumen11 halamanLKPD Persamaan Reaksi.elisofiatiBelum ada peringkat
- PBL Konsep MolDokumen7 halamanPBL Konsep Molelisofiati100% (1)
- Surat TugasDokumen1 halamanSurat TugaselisofiatiBelum ada peringkat
- LK 0.1 Modul 2 Kimia Eli SofiatiDokumen4 halamanLK 0.1 Modul 2 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK 0.1 Modul 1 Kimia Eli SofiatiDokumen3 halamanLK 0.1 Modul 1 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK. 2.2 Menentukan SolusiDokumen18 halamanLK. 2.2 Menentukan Solusielisofiati100% (1)
- Forum Diskusi KB2Dokumen1 halamanForum Diskusi KB2elisofiatiBelum ada peringkat
- Forum Diskusi KB 4Dokumen1 halamanForum Diskusi KB 4elisofiatiBelum ada peringkat
- Tes Formatif Dan Sumatif Modul 1Dokumen19 halamanTes Formatif Dan Sumatif Modul 1elisofiatiBelum ada peringkat
- Pemanasan GlobalDokumen9 halamanPemanasan Globalelisofiati0% (1)
- Materi KB2Dokumen2 halamanMateri KB2elisofiatiBelum ada peringkat
- LK 2.2Dokumen8 halamanLK 2.2elisofiatiBelum ada peringkat
- LK Modul 1Dokumen11 halamanLK Modul 1elisofiatiBelum ada peringkat
- Absen Tahun Ajaran 2022-2023Dokumen36 halamanAbsen Tahun Ajaran 2022-2023elisofiatiBelum ada peringkat
- Refleksi LK 2.2 Menentukan SolusiDokumen2 halamanRefleksi LK 2.2 Menentukan Solusielisofiati89% (9)
- Nama: Eli Sofiati, S.PD No. Ukg: 202000549376 PPG Kimia Kategori 2 Universitas Negeri Semarang LK. 1.1. Identifikasi MasalahDokumen2 halamanNama: Eli Sofiati, S.PD No. Ukg: 202000549376 PPG Kimia Kategori 2 Universitas Negeri Semarang LK. 1.1. Identifikasi Masalahelisofiati50% (2)
- LK. 2.2 Menentukan SolusiDokumen20 halamanLK. 2.2 Menentukan SolusielisofiatiBelum ada peringkat
- Modul AjarDokumen4 halamanModul Ajarelisofiati100% (1)
- LKPD - Konsep Mol - Pertemuan 3Dokumen8 halamanLKPD - Konsep Mol - Pertemuan 3elisofiatiBelum ada peringkat
- Asesmen Diaknostik IPADokumen22 halamanAsesmen Diaknostik IPAelisofiatiBelum ada peringkat
- ASESMEN DIAGNOSTIK MATA PELAJARAN IPA KELAS X TAHUN AJARAN 2022 (Jawaban)Dokumen5 halamanASESMEN DIAGNOSTIK MATA PELAJARAN IPA KELAS X TAHUN AJARAN 2022 (Jawaban)elisofiatiBelum ada peringkat