Diskusi 6 Kimia Dasar
Diunggah oleh
Derby larasatiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Diskusi 6 Kimia Dasar
Diunggah oleh
Derby larasatiHak Cipta:
Format Tersedia
DISKUSI 6
KIMIA DASAR
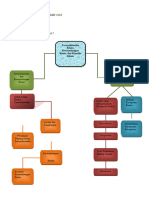
1. Buat peta konsep materi modul 7.
Istilah-istilah dalam
termodinamika :
1. sistem dan lingkungan.
Termodinamika
2. persamaan penting
dan dalam termodinamika.
kesetimbangan 3. kesetimbangan reaksi.
kimia
Termodinamika 4. konstanta
kimia, kesetimbangan kimia.
kesetimbangan
kimia, dan kinetika
kimia
Definisi kecepatan reaksi
Kinetika kimia
Faktor-faktor yang
mempengaruhi kecepatan
reaksi
2. Jelaskan dengan kata-kata sendiri berbagai istilah termodinamika:
1) sistem dan lingkungan,
sistem adalah bagian dari alam semesta yang dipisahkan
secara khusus dan menjadi pusat perhatian, dengan tujuan
untuk mempelajari sifat-sifatnya.
Lingkungan adalah bagian alam di luar sistem dan antara
sistem dan lingkungan dipisahkan oleh suatu batas.
2) fungsi dan bukan fungsi keadaan,
Fungsi keadaan adalah suatu fungsi yang hanya tergambar
pada keadaan sistem.
Bukan fungsi keadaan adalah suatu fungsi yang besarnya
tergantung pada tahapan-tahapan proses yang dialami
sistem.
3) besaran-besaran fungsi keadaan
Besaran-besaran yang termasuk fungsi keadaan adalah
tekanan, temperatur dan volum. Selain itu dalam
termodinamika juga dikenal besaran lainnya yang
merupakan fungsi keadaan, yaitu energi dalam energi bebas
Gibbs, entalpi dan entropi.
4) besaran-besaran bukan fungsi keadaan
Besaran yang bukan merupakan fungsi keadaan adalah kalor
(q) dan kerja (w).
5) Proses utama dalam termodinamika
Proses irriversibel adalah proses yang berlangsung spontan,
dalam proses ini tidak ada suatu gaya penentang kecil yang
dapat membalikkan proses.
Proses reversibel adalah proses yang antara sistem dan
lingkungannya pada setiap saat terdapat kesetimbangan,
sehingga seolah-olah antara sistem dan lingkungan tidak ada
perubahan. Apabila ada gaya penentang proses yang kecil
maka proses akan berbalik arah.
6) Persamaan dalam termodinamika
G = H – TS atau biasa ditulis sebagai: ∆G = ∆H - T∆S
yang menyatakan perubahan energi bebas Gibbs (∆G) pada
temperatur (T) konstan, sebanding dengan perubahan entalpi (∆H)
dan berlawanan dengan perubahan entropi (∆S). Persamaan ini
merupakan bentuk dari kuantifikasi sifat dari suatu reaksi kimia,
dimana :
suatu reaksi akan berlangsung spontan, dari persamaan di
atas dapat dilihat jika ∆G bernilai lebih kecil dari nol
(negatif), maka ∆S yang dimiliki bernilai positif cukup
besar. Sedangkan nilai ∆S yang besar menunjukkan derajat
ketidakteraturan yang tinggi yang artinya proses berlangsung
dengan kespontanan yang tinggi.
suatu reaksi akan berlangsung tidak spontan, dari persamaan
di atas dapat dilihat jika ∆G bernilai lebih besar dari nol
(positif), maka ∆S yang dimiliki adalah negatif. Sedangkan
nilai ∆S yang negatif menunjukkan derajat keteraturan yang
tinggi, yang berarti proses yang dilalui tidak spontan.
suatu reaksi berada dalam keadaan setimbang, dari
persamaan di atas dapat dilihat jika ∆G bernilai nol artinya
perubahan entalpi (∆H) yang dialami oleh sistem sebanding
dengan perubahan entropi (∆S) pada temperatur (T) yang
konstan.
3. Jelaskan tentang kesetimbangan reaksi dan konstanta kesetimbangan
reaksi
Kesetimbangan reaksi adalah reaksi yang akan mencapai
keadaan dinamis dimana kecepatan reaksi dalam dua arah
yang berlawanan adalah sama.
Konstanta kesetimbangan adalah nilai dari hasil bagi reaksinya
pada kesetimbangan kimia, suatu keadaan yang didekati oleh
sistem kimia dinamis setelah waktu yang cukup telah berlalu
di mana komposisinya tidak memiliki kecenderungan terukur
terhadap perubahan lebih lanjut. Untuk satu set kondisi reaksi
tertentu, konstanta kesetimbangan tidak bergantung terhadap
konsentrasi analitis awal dari spesi reaktan dan produk dalam
campuran. Dengan demikian, dengan adanya konsentrasi awal
dari suatu sistem, nilai konstanta kesetimbangan yang
diketahui dapat digunakan untuk menentukan komposisi
sistem pada kesetimbangan. Namun, parameter reaksi seperti
suhu, pelarut, dan kekuatan ionik dapat mempengaruhi nilai
konstanta kesetimbangan.
4. Jelaskan tentang:
1) kecepatan reaksi,
Kecepatan reaksi didefinisikan sebagai perubahan
konsentrasi zat pereaksi atau produk per satuan waktu.
2) cara menentukan persamaan kecepatan reaksi
Persamaan kecepatan reaksi tidak dapat diturunkan
hanya dari persamaan stoikiometrinya saja, tetapi
ditentukan melalui percobaan. Salah satu cara adalah
metode kecepatan awal. Dalam metode ini persamaan
kecepatan reaksi ditentukan dengan melakukan
serangkaian percobaan dengan konsentrasi awal pereaksi
yang bervariasi.
3) Faktor-faktor yang mempengaruhi kecepatan reaksi
Konsentrasi
Temperatur
Luas permukaan bidang sentuh
Katalisator
5. Buat latihan dan tes formatif pada modul 7 dengan aktif tanpa
melihat kunci jawaban.
Latihan 1
1. Apa yang dapat Anda terangkan mengenai sistem dan
lingkungan?
Sistem adalah bagian dari alam semesta yang kita pisahkan
secara khusus dan menjadi pusat perhatian kita, dengan
tujuan untuk mempelajari sifat-sifatnya.
Lingkungan adalah bagian alam di luar sistem. Antara sistem
dan lingkungan dipisahkan oleh suatu batas.
2. Terangkan juga mengenai fungsi keadaan dan besaran-besaran
yang termasuk dalam fungsi keadaan!
Fungsi keadaan adalah suatu fungsi yang hanya tergambar
pada keadaan sistem.
Besaran-besaran yang termasuk fungsi keadaan adalah
tekanan, temperatur dan volum. Selain itu dalam
termodinamika juga dikenal besaran lainnya yang
merupakan fungsi keadaan, yaitu energi dalam energi bebas
Gibbs, entalpi dan entropi.
3. Berapa kerja (w) yang dilakukan pada reaksi pemuaian dai 1
mol gas pada keadaan standar T dan P dari volume 22,4 L
menjadi volume 44,8 L dan tekanan tetap 1 atm?
Kerja w karena proses pemuaian maka mempunyai tanda
negatif, kerja w didapat dengan rumus –P.
4. Apa perbedaan kalor dengan energi ? Jika suatu proses
dikerjakan dalam termos yang ideal, apakah sistem mengalami
perubahan energi?
Kalor (q)merupakan energi yang dipindahkan melalui batas-
batas sistem sebagai akibat perbedaan temperatur antara
sistem dan lingkungannya. Kerja (w) adalah setiap bentuk
energi yang bukan kalor yang dipertukarkan antara sistem
dan lingkungan dalam suatu perubahan keadaan sistem. Jika
suatu proses dikerjakan di dalam termos ideal, maka sistem
tidak mengalami perubahan energi karena perubahan energi
dari sistem ke lingkungan atau sebaliknya dapat terjadi
dengan menggunakan cara transfer kalor (kerja) dengan
lingkungannya.
5. Tuliskan Kc atau Kp untuk reaksi-reaksi reversibel berikut ini
pada keadaan kesetimbangan
Sistem botol termos ideal termasuk dalam sistem terisolasi,
yang diharapkan tidak terjadi transfer massa dan energi.
a) Karena fasa gas tidak ada maka kita menuliskan
ekspresi konstanta kesetimbangan Kc saja.
b) Karena HF merupakan asam lemah maka konsentrasi
H2O kita abaikan, sehingga konstanta kesetimbangan
dapat di tulis kembali ,
Latihan 2
1. Mengapa reaksi berlangsung lebih cepat pada temperatur yang
lebih tinggi?
Kenaikan temperatur akan meningkatkan kecepatan reaksi,
karena pada temperatur tinggi pergerakan molekul akan
semakin cepat. Sehingga kemungkinan terjadinya tumbukan
efektif akan lebih besar dibandingkan dengan pada
temperatur rendah.
2. Serbuk pualam dapat bereaksi lebih cepat daripada keping pualam
masing-masing dengan HCl 3M. Bagaimana Anda menjelaskan
hal ini?
Reaksi antara pualam dengan HCl merupakan reaksi yang
melibatkan 2 fasa yang berbeda, yaitu padat dan cair. Dalam
reaksi heterogen ini kecepatan reaksi dipengaruhi oleh luas
permukaan bidang sentuh. Makin besar luas permukaan
bidang sentuh, makin besar kemungkinan terjadinya kontak
atau tumbukan antar molekul-molekul reaktan sehingga
mempercepat kecepatan reaksi
Jawaban tes formatif
No Tes formatif 1 No Tes formatif 2
1 B. Waktu 1 D. M detik-1
-1
2 C. Terisolasi 2 A. Mengubah konsentrasi salah satu
reaktan
3 C. Kalor (q) dan kerja (w) 3 B. Pada temperatur tetap, volume
diperbesar
4 B. Kalor 4 C. Konsentrasi air tidak mempengaruhi
kecepatan reaksi.
5 B. Tergantung pada variabel 5 D. 20 mL HCI 0,2 M + 20 mL Na2S2O3
waktu dan kecepatan 0,1 M + 20 mL air pada 40oC
6 A. Kinetik 6 B. k[A] [B]2
7 A. Reversibel 7 B. Katalisator menurunkan energi
aktifasi
8 C. Tidak Spontan 8 A. 1/3 menit
9 B. Reaksi berjalan ke arah kanan, 9 C. 0,00048k
tidak dalam keadaan setimbang
10 A. 1,59 10 D. Warna molekul
Anda mungkin juga menyukai
- Tugas Mata Kuliah 3Dokumen3 halamanTugas Mata Kuliah 3manajemen kesehatanBelum ada peringkat
- ID Penerapan Metode Regresi Logistik Dalam Menganalisis Adopsi Teknologi Pertanian PDFDokumen9 halamanID Penerapan Metode Regresi Logistik Dalam Menganalisis Adopsi Teknologi Pertanian PDFanitaBelum ada peringkat
- .Dokumen2 halaman.Application GCL ThermoBelum ada peringkat
- Naskah Biol4119 Tugas2Dokumen1 halamanNaskah Biol4119 Tugas2Dio Alif UlamaBelum ada peringkat
- Teknologi Top Working Pada Tanaman JerukDokumen7 halamanTeknologi Top Working Pada Tanaman JerukPri KayamahisanBelum ada peringkat
- Contoh Busines PlanDokumen45 halamanContoh Busines PlanHodijah SariBelum ada peringkat
- Konsep AgroekosistemDokumen16 halamanKonsep AgroekosistemDIFA HANIF MUHAMMADBelum ada peringkat
- Membuat KuesionerDokumen12 halamanMembuat KuesionerAdhelia Desi PrawestriBelum ada peringkat
- Pengantar Statistik Sosial (Tugas 1)Dokumen1 halamanPengantar Statistik Sosial (Tugas 1)Muhammad Comaru Walid0% (1)
- Tugas 3 Perkoperasian MakalahDokumen16 halamanTugas 3 Perkoperasian MakalahSondang MandasariBelum ada peringkat
- Sejarah EpidemiologiDokumen12 halamanSejarah EpidemiologiDeviBelum ada peringkat
- Diskusi 4 Kimia DasarDokumen6 halamanDiskusi 4 Kimia DasarFahmi JunaidiBelum ada peringkat
- 7.4 Tugas 3 BIOL 4119 - 041181877 - Dhiya' Dinan RosikhunDokumen2 halaman7.4 Tugas 3 BIOL 4119 - 041181877 - Dhiya' Dinan RosikhunMbah TubeBelum ada peringkat
- Pentingnya Pendidikan Multikultural Dalam Mewujudkan Demokrasi Di Indonesia PDFDokumen15 halamanPentingnya Pendidikan Multikultural Dalam Mewujudkan Demokrasi Di Indonesia PDFsriarliyantiBelum ada peringkat
- Tugas 3 Kimia Dasar 1Dokumen1 halamanTugas 3 Kimia Dasar 1FeriyantoBelum ada peringkat
- Pengembangan MasyarakatDokumen50 halamanPengembangan MasyarakatWilda TussaadahBelum ada peringkat
- Budidaya Jamur MeranhDokumen40 halamanBudidaya Jamur MeranhSuryadiBelum ada peringkat
- Latar Belakang PrivatisasiDokumen9 halamanLatar Belakang PrivatisasiTika LestariBelum ada peringkat
- UTS Ekonomi Politik 2020 Farah Rahmadhani 071811333027Dokumen6 halamanUTS Ekonomi Politik 2020 Farah Rahmadhani 071811333027I LIVE FOR HOBI'S DIMPLESBelum ada peringkat
- MAKALAH ARSITEK 5 HalamanDokumen6 halamanMAKALAH ARSITEK 5 HalamanPatricia Maria PatriciaBelum ada peringkat
- TUGAS TMK KLIMATOLOGI PERTANIAN SamasuddinDokumen3 halamanTUGAS TMK KLIMATOLOGI PERTANIAN SamasuddinParman ichal100% (1)
- Fertilitas Dalam Perspektif DemografiDokumen30 halamanFertilitas Dalam Perspektif Demografifahmi_geoBelum ada peringkat
- Espa4415 M1Dokumen26 halamanEspa4415 M1Kristina PasaribuBelum ada peringkat
- LAPORAN PRAKTIK MANDIRI LUHT4442 Nim 042732959 MUHAMMAD NURILDokumen13 halamanLAPORAN PRAKTIK MANDIRI LUHT4442 Nim 042732959 MUHAMMAD NURILAkbar Hidayatullah ZainiBelum ada peringkat
- Kinetika Pertumbuhan M.O BatchpptDokumen24 halamanKinetika Pertumbuhan M.O BatchpptdeddysetiadiBelum ada peringkat
- Nuri Alvianita - Tugas 1Dokumen22 halamanNuri Alvianita - Tugas 1NitaBelum ada peringkat
- Hubungan IndustrialDokumen11 halamanHubungan IndustrialEkacipta InfotamaBelum ada peringkat
- Template Proposal PKM-PM 2022Dokumen21 halamanTemplate Proposal PKM-PM 2022Ahmad FariskiBelum ada peringkat
- Tugas 1 - Luht4448 - Wahyu ErmaDokumen5 halamanTugas 1 - Luht4448 - Wahyu ErmaAkbar Hidayatullah ZainiBelum ada peringkat
- Tugas 1 Metode Penelitian SosialDokumen7 halamanTugas 1 Metode Penelitian Sosialarini riniBelum ada peringkat
- BJU - Umum LUHT4330 Media Penyuluhan PertanianDokumen7 halamanBJU - Umum LUHT4330 Media Penyuluhan PertanianMira FadilaaBelum ada peringkat
- Sosiologi PedesaanDokumen4 halamanSosiologi PedesaanEfi Kristiani HuluBelum ada peringkat
- Tabel Rangkuman JurnalDokumen2 halamanTabel Rangkuman Jurnalneng ilahBelum ada peringkat
- BAB 3 Distribusi FrekuensiDokumen19 halamanBAB 3 Distribusi FrekuensiAraaBelum ada peringkat
- Differential Opportunity StructureDokumen5 halamanDifferential Opportunity StructureAyudya Ning TyasBelum ada peringkat
- Modul Diklatsar Penyuluhan Pertanian 2018 PDFDokumen416 halamanModul Diklatsar Penyuluhan Pertanian 2018 PDFpaktanisampangBelum ada peringkat
- Hubungan Masyarakat Skom4103 04Dokumen6 halamanHubungan Masyarakat Skom4103 04Gillian AdamsBelum ada peringkat
- Tugas 1 Kimia DasarDokumen25 halamanTugas 1 Kimia DasarAgus Dian SaputraBelum ada peringkat
- Soal UTS Mikro 1 Ganjil 2020 2021 INDODokumen4 halamanSoal UTS Mikro 1 Ganjil 2020 2021 INDOReza AkbarBelum ada peringkat
- Triadik Dalam Analisis Jaringan SosialDokumen24 halamanTriadik Dalam Analisis Jaringan SosialDavid YuBelum ada peringkat
- Laporan Tahunan HC LBS 2020Dokumen45 halamanLaporan Tahunan HC LBS 2020berlianBelum ada peringkat
- Pertemuan 9 & 10 - Statistik Inferensial & ProbabilitasDokumen16 halamanPertemuan 9 & 10 - Statistik Inferensial & ProbabilitasSuci SuciBelum ada peringkat
- Mekanisme Katalisis Enzim 2019Dokumen33 halamanMekanisme Katalisis Enzim 2019LovaaManiarBelum ada peringkat
- Materi Teori SistemDokumen3 halamanMateri Teori SistemArdhika PoetraBelum ada peringkat
- Jenis-Jenis Surat PDFDokumen6 halamanJenis-Jenis Surat PDFM Fithrul muttaqin100% (1)
- BIOL4110 043867633 DikonversiDokumen5 halamanBIOL4110 043867633 DikonversiRidho AlfadliBelum ada peringkat
- Kelas Akselerasi Dan Diskriminasi AnakDokumen9 halamanKelas Akselerasi Dan Diskriminasi AnakoutzBelum ada peringkat
- ASPEK BuahDokumen15 halamanASPEK BuahMuhammad Rizki ArifBelum ada peringkat
- Pengertian KomunikasiDokumen128 halamanPengertian KomunikasiDianSelviaBelum ada peringkat
- Diskusi 4Dokumen4 halamanDiskusi 4david leiBelum ada peringkat
- Implementasi Kebijakan Peningkatan Produksi Tanaman Pangan Lokal Dan Ketahanan Pangan Di Provinsi Nusa Tenggara Timur (NTT)Dokumen12 halamanImplementasi Kebijakan Peningkatan Produksi Tanaman Pangan Lokal Dan Ketahanan Pangan Di Provinsi Nusa Tenggara Timur (NTT)MayaTerry007100% (1)
- Kewargaan DigitalDokumen23 halamanKewargaan DigitalLailatul RohmahBelum ada peringkat
- Sistem PengkondisianDokumen10 halamanSistem PengkondisianDaud Simon ABelum ada peringkat
- Instrumen Kebijakan MoneterDokumen14 halamanInstrumen Kebijakan Monetererlinda pratiwiBelum ada peringkat
- Tugas2-Pengumpulan Dan Penyajian Data-Yusriyanti FikaisaDokumen9 halamanTugas2-Pengumpulan Dan Penyajian Data-Yusriyanti Fikaisayusriyanti fikaisaBelum ada peringkat
- PRINSIP EvaluasiDokumen4 halamanPRINSIP EvaluasiAbi SetiawanBelum ada peringkat
- Resensi JurnalDokumen14 halamanResensi JurnalDyah Arum PBelum ada peringkat
- DISKUSI.6.Kimia Dasar Deti TesmitaDokumen4 halamanDISKUSI.6.Kimia Dasar Deti TesmitaFadhlan FadhilahBelum ada peringkat
- Diskusi 6 Kimia DasarDokumen4 halamanDiskusi 6 Kimia DasarSyahmadcs SyahmadcsBelum ada peringkat
- Diskusi 6 Kimia Dasar FixDokumen11 halamanDiskusi 6 Kimia Dasar FixMuhammad Azwar100% (1)
- Diskusi 8 Bhs. IndonesiaDokumen3 halamanDiskusi 8 Bhs. IndonesiaDerby larasatiBelum ada peringkat
- Jawaban Diskusi 2 Kimia DasarDokumen6 halamanJawaban Diskusi 2 Kimia DasarDerby larasatiBelum ada peringkat
- Diskusi 8 Analisis Data StatistikDokumen4 halamanDiskusi 8 Analisis Data StatistikDerby larasatiBelum ada peringkat
- Diskusi 8 FisikaDokumen2 halamanDiskusi 8 FisikaDerby larasatiBelum ada peringkat
- Inisiasi 1 Uji Binomial Metstat Non ParametikDokumen11 halamanInisiasi 1 Uji Binomial Metstat Non ParametikDerby larasatiBelum ada peringkat
- Diskusi 2 Bhs - InggrisDokumen1 halamanDiskusi 2 Bhs - InggrisDerby larasatiBelum ada peringkat
- Diskusi 2 Biologi UmumDokumen2 halamanDiskusi 2 Biologi UmumDerby larasatiBelum ada peringkat
- Tugas 2 Metode Statistika 1Dokumen2 halamanTugas 2 Metode Statistika 1Derby larasatiBelum ada peringkat
- Diskusi 2 ISBDDokumen2 halamanDiskusi 2 ISBDDerby larasatiBelum ada peringkat
- DISKUSI 1 Analisis Data StatistikDokumen1 halamanDISKUSI 1 Analisis Data StatistikDerby larasatiBelum ada peringkat
- DISKUSI 1 SosiologiDokumen1 halamanDISKUSI 1 SosiologiDerby larasatiBelum ada peringkat
- DISKUSI 1 Bhs. IndonesiaDokumen2 halamanDISKUSI 1 Bhs. IndonesiaDerby larasatiBelum ada peringkat
- Tugas 3 ISBDDokumen7 halamanTugas 3 ISBDDerby larasatiBelum ada peringkat
- DISKUSI 1 StatistikaDokumen2 halamanDISKUSI 1 StatistikaDerby larasatiBelum ada peringkat
- Inisiasi 5 Bekerja Dengan Grafik Di Lingkungan RDokumen17 halamanInisiasi 5 Bekerja Dengan Grafik Di Lingkungan RDerby larasatiBelum ada peringkat
- Tugas 2 Metode Statistika 1Dokumen2 halamanTugas 2 Metode Statistika 1Derby larasatiBelum ada peringkat
- Tugas 2 Kimia DasarDokumen4 halamanTugas 2 Kimia DasarDerby larasatiBelum ada peringkat
- Tugas 1 Metode Statistika 1Dokumen3 halamanTugas 1 Metode Statistika 1Derby larasati50% (2)
- Tugas 1 ISBDDokumen3 halamanTugas 1 ISBDDerby larasatiBelum ada peringkat
- Tugas 2 ISBDDokumen3 halamanTugas 2 ISBDDerby larasatiBelum ada peringkat
- Jawaban Diskusi 5 Bhs - InggrisDokumen1 halamanJawaban Diskusi 5 Bhs - InggrisDerby larasatiBelum ada peringkat
- Jawaban Diskusi 7 Kimia DasarDokumen7 halamanJawaban Diskusi 7 Kimia DasarDerby larasatiBelum ada peringkat
- Jawaban Diskusi 5 Kimia DasarDokumen3 halamanJawaban Diskusi 5 Kimia DasarDerby larasatiBelum ada peringkat
- Tugas 1 PKNDokumen10 halamanTugas 1 PKNDerby larasatiBelum ada peringkat
- Tugas 1 KIMD4110Dokumen4 halamanTugas 1 KIMD4110Derby larasatiBelum ada peringkat
- Jawaban DISKUSI 6 Bhs. InggrisDokumen1 halamanJawaban DISKUSI 6 Bhs. InggrisDerby larasatiBelum ada peringkat
- Jawaban Diskusi 8 Bahasa InggrisDokumen1 halamanJawaban Diskusi 8 Bahasa InggrisDerby larasatiBelum ada peringkat
- Diskusi 5 Biologi UmumDokumen2 halamanDiskusi 5 Biologi UmumDerby larasatiBelum ada peringkat