LK 0.1 Modul 1 Kimia Eli Sofiati
Diunggah oleh
elisofiati0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
16 tayangan3 halamanJudul Asli
LK 0.1 Modul 1 kimia Eli Sofiati
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
16 tayangan3 halamanLK 0.1 Modul 1 Kimia Eli Sofiati
Diunggah oleh
elisofiatiHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 3
Nama : Eli Sofiati,S.
Pd
No. UKG : 202000549376
PPG KIMIA KATEGORI 2
UNIVERSITAS NEGERI SEMARANG
LK 0.1: Lembar Kerja Belajar Mandiri
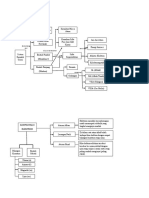
Judul Modul Modul 1 Struktur Atom Dan Sistem Periodik
Unsur
Judul Kegiatan Belajar (KB) 1. KB 1 :
Perkembangan Teori Atom
2. KB 2 :
Atom, Molekul Dan Ion
3. KB 3 :
Sistem Periodik Unsur
4. KB 4 :
Sifat Keperiodikan Unsur
No Butir Refleksi Respon/Jawaban
1 Garis besar materi yang KB 1 : Perkembangan Teori Atom
dipelajari a. Model Atom Dalton
- Dalton menyatakan bahwa atom
adalah partikel terkecil materi yang
tidak dapat dibagi lagi.
b. Model Atom Thomson
- Model atom Thomson : Atom
merupakan sebuah bola kecil
bermuatan positif dan
dipermukaanya tersebar elektron
yang bermuatan negatif.
c. Model Atom Rutherford
- Model atom rutherford : atom terdiri
dari inti yang bermuatan positif yang
merupakan terpusatnya massa. Di
sekitar inti terdapat elektron yang
bergerak mengelilinginya dalam ruang
hampa.
d. Model Atom Bohr
- Model atom Bohr : Atom terdiri atas
inti bermuatan positif dan elektron
bergerak mengelilingi inti atom dalam
lintasan atau orbit tertentu.
e. Model Atom Mekanika Gelombang
- Model atom mekanika gelombang
yaitu elektron berputar mengelilingi
inti atom membentuk gelombang,
bukan berupa garis lingkaran.
- Bilangan Kuantum
1) Bilangan kuantum utama
2) Bilangan kuantum azimuth
3) Bilangan kuantum magnetik
4) Bilangan kuantum spin
- Konfigurasi elektron menggambarkan
sebaran/ susunan elektron dalam
suatu atom
- Prinsip Aufbau
- Prinsip Larangan Pauli
- Aturan Hund
KB 2 : Atom, Molekul Dan Ion
a. Partikel Dasar Penyusun Atom
- Elektron adalah partikel penyusun
atom bermuatan negatif
- Proton adalah partikel penyusun
atom bermuatan positif terpusat pada
inti atom
- Neutron adalah partikel penyusun
aton yang tidak bermuatan / netral
b. Nomor Atom dan Nomor Massa
- Nomor atom adalah jumlah proton
dalam inti setiap atom suatu unsur
- Nomor massa adalah jumlah total
netron dan proton yang ada dalam
inti atom suatu unsur
- Molekul adalah kumpulan yang
terdiri dari sedikitnya dua atom
- Rumus empiris adalah rumus kimia
yang paling sederhana
- Rumus senyawa ionik
- Ion adalah atom yang memiliki
muatan
c. Isotop, Isobar, Isoton, dan Isoelektron
- Isotop adalah atom-atom yang
mempunyai nomor atom sama tetapi
berbeda nomor massanya
- Isobar adalah atom dari unsur yang
berbeda ( mempunyai nomor atom
berbeda ) tetapi mempunyai jumlah
nomor massa yang sama
- Isoton adalah atom dari unsur yang
berbeda ( mempunyai nomor atom
dan nomor massa berbeda), tetapi
mempunyai jumlah neutron yang
sama
- Isoelektron adalah atom yang
memiliki jumlah elektron yang sama
d. Penamaan Senyawa
- Senyawa Molekuler
- Asam dan Basa
KB 3 : Sistem Periodik Unsur
a. Perkembangan Sistem Periodik Unsur
- Sistem Periodik Dobereiner
- Sistem Periodik Newlands
- Sistem Periodik Mendeleev
- Sistem Periodik Modern
b. Penggolongan Periodik Unsur
c. Hubungan Konfigurasi Elektron dengan
Sistem Periodik Unsur
- Konfigurasi Elektron Kation dan
Anion
- Ion yang dihasilkan dari unsur
golongan utama
- Kation yang dihasilkan logam transisi
KB 4 : Sifat Keperiodikan Unsur
a. Jari – Jari atom
- Dalam satu periode jari-jari
bertambah dari kiri ke kanan
sedangkan dalam satu golongan jari-
jari bertambah dari atas ke bawah
b. Energi ionisasi
- Dalam satu periode energi ionisasi
pertama bertambah dari kiri ke
kanan, sedangkan dalam satu
golongan energi ionisasi pertama
bertambah dari bawah ke atas
c. Afinitas elektron
- Dalam satu periode afinitas elektron
bertambah dari kiri ke kanan,
sedangkan dalam satu golongan
afinitas elektron bertambah dari
bawah ke atas
d. Keelektronegatifan
- Dalam satu periode
keelektronegatifan bertambah dari
kiri ke kanan, sedangkan dalam satu
golongan keelektronegatifan
bertambah dari bawah ke atas
2 Daftar materi yang sulit 1. Model Atom
dipahami di modul ini 2. Penamaan Senyawa
3 Daftar materi yang sering 1. Model Atom
mengalami miskonsepsi 2. Sifat Keperiodikan Unsur
Anda mungkin juga menyukai
- LK 1 Modul 1 ProfesionalDokumen6 halamanLK 1 Modul 1 Profesionalsilvi nafidah0% (1)
- LK 1 Modul 1 Profesional Irwan AprayadiDokumen8 halamanLK 1 Modul 1 Profesional Irwan AprayadiIrwan Aprayadi SyakiraBelum ada peringkat
- LK 0.1 Lembar Kerja Profesional (Modul 1)Dokumen4 halamanLK 0.1 Lembar Kerja Profesional (Modul 1)kyuminniers137Belum ada peringkat
- LK 1 Modul 1 ProfesionalDokumen7 halamanLK 1 Modul 1 ProfesionalDian Ubaedillah NuraeniBelum ada peringkat
- LK 1 Modul 1 Profesional EditDokumen6 halamanLK 1 Modul 1 Profesional Editellsha septyawantiBelum ada peringkat
- LK 0.1 Modul 1Dokumen5 halamanLK 0.1 Modul 1Akbar SuhajiBelum ada peringkat
- Struktur AtomDokumen17 halamanStruktur AtomwilmaBelum ada peringkat
- LK 01 - Modul 1-Nyanyak MistiaDokumen5 halamanLK 01 - Modul 1-Nyanyak MistiaHasNa YushaaBelum ada peringkat
- LK Belajar Mandiri - Modul 1 Profesional - IKE PDFDokumen4 halamanLK Belajar Mandiri - Modul 1 Profesional - IKE PDFIKE YUSRIANTIBelum ada peringkat
- Power Point 3.2Dokumen8 halamanPower Point 3.2Andaru RizaBelum ada peringkat
- LK 0.1 Modul 1 Kurnia - Teori AtomDokumen5 halamanLK 0.1 Modul 1 Kurnia - Teori AtomFenis Fitria DewiBelum ada peringkat
- LK 0.1 Profesional Modul 1Dokumen3 halamanLK 0.1 Profesional Modul 1Meilina Rahayu UtamiBelum ada peringkat
- Modul 1LK 1 - Lembar Kerja Belajar Mandiri Dien Agustina KimiaDokumen8 halamanModul 1LK 1 - Lembar Kerja Belajar Mandiri Dien Agustina KimiaPelita SukmaBelum ada peringkat
- LK 0.1 Modul 1 ProfesionalDokumen5 halamanLK 0.1 Modul 1 ProfesionalAlfa Dina PrianotoBelum ada peringkat
- Kimia Bab 2Dokumen3 halamanKimia Bab 2Reyna RenataBelum ada peringkat
- Diskusi 2Dokumen4 halamanDiskusi 2DadanBelum ada peringkat
- AtomDokumen31 halamanAtomMaro MendoncaBelum ada peringkat
- Struktur AtomDokumen35 halamanStruktur AtomBima Sakti Surya PermanaBelum ada peringkat
- Simulasi 1Dokumen18 halamanSimulasi 1whynovia29Belum ada peringkat
- Materi 2 Atom Dan Konfigurasi ElektronDokumen103 halamanMateri 2 Atom Dan Konfigurasi ElektronDestiny NathaniaBelum ada peringkat
- LK Modul 1 KimiaDokumen9 halamanLK Modul 1 KimiaNyonyaeedBelum ada peringkat
- LK 0.1 Modul 1Dokumen38 halamanLK 0.1 Modul 1ISTI MATUS NUR KHOMARIABelum ada peringkat
- LK 0.1 Modul 1 Dan Modul 2Dokumen14 halamanLK 0.1 Modul 1 Dan Modul 2aihuBelum ada peringkat
- Diskusi 2 Kimia Dasar 1Dokumen11 halamanDiskusi 2 Kimia Dasar 1DadanBelum ada peringkat
- LK 1: Lembar Kerja Belajar Mandiri Modul 1: No Butir Refleksi Respon/ Jawaban KB 1: Perkembangan Teori AtomDokumen6 halamanLK 1: Lembar Kerja Belajar Mandiri Modul 1: No Butir Refleksi Respon/ Jawaban KB 1: Perkembangan Teori AtomFitria LatifahBelum ada peringkat
- Struktur AtomDokumen50 halamanStruktur AtomPutri S. DadungBelum ada peringkat
- 2 RPP - Struktur Atom Dan Sistem Periodik 1 FixDokumen29 halaman2 RPP - Struktur Atom Dan Sistem Periodik 1 FixdellasepiraBelum ada peringkat
- Materi PartikelDokumen5 halamanMateri Partikelatitombro77Belum ada peringkat
- MP1 TUGAS AKHIR Elcha Bagus NarendraDokumen8 halamanMP1 TUGAS AKHIR Elcha Bagus NarendraGraha MadinaBelum ada peringkat
- Perkembangan Teori Atom Dan Konfigurasi Elektron 23Dokumen35 halamanPerkembangan Teori Atom Dan Konfigurasi Elektron 23MGR GAMINGBelum ada peringkat
- Struktur Dan Fungsi AtomDokumen29 halamanStruktur Dan Fungsi AtomZoerien Pellokila0% (1)
- KISI KisiDokumen11 halamanKISI KisiFritz Pieter Michael NahuwayBelum ada peringkat
- Soal Model AtomDokumen6 halamanSoal Model Atom24Putriku 1B MPK100% (1)
- Isotop Isobar Isoton Dan Konfigurasi ElektronDokumen4 halamanIsotop Isobar Isoton Dan Konfigurasi ElektronPubg MobileBelum ada peringkat
- Susunan Tabel BerkalaDokumen9 halamanSusunan Tabel BerkalaRyan R. EzraBelum ada peringkat
- Pertemuan 3Dokumen10 halamanPertemuan 3Wahyu ade dwi anugraBelum ada peringkat
- Struktur Atom 1Dokumen30 halamanStruktur Atom 1Nanda AnnisaBelum ada peringkat
- Hizkia YogatamaDokumen10 halamanHizkia YogatamaDenny MaulanaBelum ada peringkat
- LK 0 Struktur AtomDokumen9 halamanLK 0 Struktur Atomchairi yanaBelum ada peringkat
- LK 0.1 - ProfesioanalModul 1 - Dwi PurwitasariDokumen7 halamanLK 0.1 - ProfesioanalModul 1 - Dwi PurwitasariDwi purwitasariBelum ada peringkat
- (Template) TUGAS KELAS X MIPA-PERTEMUAN 1 PERKEMBANGAN MODEL ATOMDokumen6 halaman(Template) TUGAS KELAS X MIPA-PERTEMUAN 1 PERKEMBANGAN MODEL ATOMRatna AnggraeniBelum ada peringkat
- Partikel Dasar AtomDokumen22 halamanPartikel Dasar AtomSairahBelum ada peringkat
- (SKL 6 Indikator 6.1 Teori Atom) PDFDokumen8 halaman(SKL 6 Indikator 6.1 Teori Atom) PDFNur Ilham QoharBelum ada peringkat
- LK Atom Pert 1 (9i - 13 - Anantara)Dokumen6 halamanLK Atom Pert 1 (9i - 13 - Anantara)anantaraBelum ada peringkat
- Struktur Atom - Kelompok 5Dokumen12 halamanStruktur Atom - Kelompok 5trisuryantiyantiBelum ada peringkat
- Pert 2 STRUKTUR ATOM MOLEKULDokumen41 halamanPert 2 STRUKTUR ATOM MOLEKULAndi nurfaidahBelum ada peringkat
- Makalah Struktur AtomDokumen15 halamanMakalah Struktur AtomGusti HandikaBelum ada peringkat
- Diskusi 2 Kimia Dasar - Ina Saila 043010933Dokumen17 halamanDiskusi 2 Kimia Dasar - Ina Saila 043010933DadanBelum ada peringkat
- TUGAS 1 - EL - Firman Ilham Ramadhan Rifai - 231043038Dokumen4 halamanTUGAS 1 - EL - Firman Ilham Ramadhan Rifai - 231043038Firman KelilauwBelum ada peringkat
- Teori Aton John DoltonDokumen6 halamanTeori Aton John DoltonVina SaraswatiBelum ada peringkat
- Struktur AtomDokumen37 halamanStruktur AtomOcto SagalaBelum ada peringkat
- Perkembangan Teori AtomDokumen28 halamanPerkembangan Teori AtomCristy SusiBelum ada peringkat
- Modul Struktur AtomDokumen22 halamanModul Struktur AtomLyanBelum ada peringkat
- LK 0.1 - Modul 1 - Profesional - Sri HandiniDokumen5 halamanLK 0.1 - Modul 1 - Profesional - Sri HandiniSri HandiniBelum ada peringkat
- Meri Eliza - Bahan Ajar Ra 1Dokumen10 halamanMeri Eliza - Bahan Ajar Ra 1Meri ElizaBelum ada peringkat
- Vatars Zanzim Mario - Uts Kimia DasarDokumen5 halamanVatars Zanzim Mario - Uts Kimia DasarMario PardedeBelum ada peringkat
- KD 1, Struktur Atom, Sistem Periodik Unsur Dan Ikatan KimiaDokumen11 halamanKD 1, Struktur Atom, Sistem Periodik Unsur Dan Ikatan KimiaAprya NingsihBelum ada peringkat
- Struktur Atom-2017-1 PDFDokumen32 halamanStruktur Atom-2017-1 PDFAndi Ammas AfdaniarBelum ada peringkat
- Bab 13 Fisika Terapan 2Dokumen39 halamanBab 13 Fisika Terapan 2Hermansyah NvlBelum ada peringkat
- LK 3.1 Menyusun Best Practices ELIDokumen8 halamanLK 3.1 Menyusun Best Practices ELIelisofiatiBelum ada peringkat
- Modul Ajar PapuaDokumen60 halamanModul Ajar PapuaelisofiatiBelum ada peringkat
- Aksi Nyata Sosialisasi PPPDokumen15 halamanAksi Nyata Sosialisasi PPPelisofiatiBelum ada peringkat
- LK 0.1 Modul 4 Kimia Eli SofiatiDokumen5 halamanLK 0.1 Modul 4 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK 0.1 Modul 5 Kimia Eli SofiatiDokumen5 halamanLK 0.1 Modul 5 Kimia Eli SofiatielisofiatiBelum ada peringkat
- Jurnal Refleksi 4FDokumen1 halamanJurnal Refleksi 4Felisofiati100% (1)
- Window ShopingDokumen7 halamanWindow ShopingelisofiatiBelum ada peringkat
- PJBL Sel VoltaDokumen27 halamanPJBL Sel VoltaelisofiatiBelum ada peringkat
- Bahan Ajar Sel VoltaDokumen19 halamanBahan Ajar Sel VoltaelisofiatiBelum ada peringkat
- LKPD Persamaan Reaksi.Dokumen11 halamanLKPD Persamaan Reaksi.elisofiatiBelum ada peringkat
- PBL Konsep MolDokumen7 halamanPBL Konsep Molelisofiati100% (1)
- Surat TugasDokumen1 halamanSurat TugaselisofiatiBelum ada peringkat
- LK 0.1 Modul 3 Kimia Eli SofiatiDokumen4 halamanLK 0.1 Modul 3 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK 0.1 Modul 2 Kimia Eli SofiatiDokumen4 halamanLK 0.1 Modul 2 Kimia Eli SofiatielisofiatiBelum ada peringkat
- LK. 2.2 Menentukan SolusiDokumen18 halamanLK. 2.2 Menentukan Solusielisofiati100% (1)
- Forum Diskusi KB2Dokumen1 halamanForum Diskusi KB2elisofiatiBelum ada peringkat
- Forum Diskusi KB 4Dokumen1 halamanForum Diskusi KB 4elisofiatiBelum ada peringkat
- Tes Formatif Dan Sumatif Modul 1Dokumen19 halamanTes Formatif Dan Sumatif Modul 1elisofiatiBelum ada peringkat
- Pemanasan GlobalDokumen9 halamanPemanasan Globalelisofiati0% (1)
- Materi KB2Dokumen2 halamanMateri KB2elisofiatiBelum ada peringkat
- LK 2.2Dokumen8 halamanLK 2.2elisofiatiBelum ada peringkat
- LK Modul 1Dokumen11 halamanLK Modul 1elisofiatiBelum ada peringkat
- Absen Tahun Ajaran 2022-2023Dokumen36 halamanAbsen Tahun Ajaran 2022-2023elisofiatiBelum ada peringkat
- Refleksi LK 2.2 Menentukan SolusiDokumen2 halamanRefleksi LK 2.2 Menentukan Solusielisofiati89% (9)
- Nama: Eli Sofiati, S.PD No. Ukg: 202000549376 PPG Kimia Kategori 2 Universitas Negeri Semarang LK. 1.1. Identifikasi MasalahDokumen2 halamanNama: Eli Sofiati, S.PD No. Ukg: 202000549376 PPG Kimia Kategori 2 Universitas Negeri Semarang LK. 1.1. Identifikasi Masalahelisofiati50% (2)
- LK. 2.2 Menentukan SolusiDokumen20 halamanLK. 2.2 Menentukan SolusielisofiatiBelum ada peringkat
- Modul AjarDokumen4 halamanModul Ajarelisofiati100% (1)
- LKPD - Konsep Mol - Pertemuan 3Dokumen8 halamanLKPD - Konsep Mol - Pertemuan 3elisofiatiBelum ada peringkat
- Asesmen Diaknostik IPADokumen22 halamanAsesmen Diaknostik IPAelisofiatiBelum ada peringkat
- ASESMEN DIAGNOSTIK MATA PELAJARAN IPA KELAS X TAHUN AJARAN 2022 (Jawaban)Dokumen5 halamanASESMEN DIAGNOSTIK MATA PELAJARAN IPA KELAS X TAHUN AJARAN 2022 (Jawaban)elisofiatiBelum ada peringkat