25 - Muhayah - Peta Konsep - SPK
Diunggah oleh
ZakariaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
25 - Muhayah - Peta Konsep - SPK
Diunggah oleh
ZakariaHak Cipta:
Format Tersedia
Kompetisi Dasar (KD)
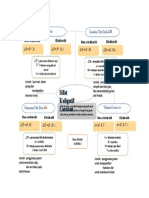
PETA KONSEP
Memahami Sifat Koligatif dari Larutan Non Elektrolit
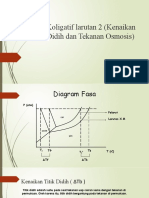
Sifat Koligatif
Larutan Non Penurunan Tekanan Uap Jenuh(∆P) Kenaikan Titik Didih (∆Tb)
Elektrolit
∆P=P°- P
Sifat larutan yang hanya ∆P=P°. Xa
P= P°.Xb
∆Tb= Kb.m
bergantung pada jumlah zat
terlarut relatif terhadap
jumlah total zat dan tidak Keterangan:
keterangan:
P°= tekanan uap pelarut murni ( mmHg)
bergantung pada jenis zat Kb= tetapan kenaikan
P= tekanan uap larutan (mmHg)
titik didih(°C/m)
Xa= fraksi mol zat terlarut
terlarut. m= molalitas larutan (m)
Xb=fraksi mol pelarut
Tekanan Osmotik (π) Penurunan Titik Beku (∆Tf)
1.Selisih antara tekanan uap jenuh pelarut
murni dengan tekanan uap jenuh larutan
disebut penurunan tekanan uap jenuh (ΔP).
2.Selisih antara titik didih suatu larutan
dengan titikdidih pelarut murni disebut π= M.R.T
∆Tf= Kf.m
kenaikan titik didih larutan (ΔTb).
3.Selisih temperatur titik beku larutan
dengan titik beku pelarut murni disebut
penurunan titik beku (∆Tf). keterangan: Keterangan:
4.Perpindahan larutan dari konsentrasi M= Molaritas (M) Kf= tetapan penurunan
rendah ke konsentrasi tinggi melalu R= terapan gas (0.082 L ATM mol^1 K^1) titik beku (°C/m)
membran semi permeabel disebut tekanan T= suhu larutan (K) m= molalitas larutan (m)
Osmotik (π).
Anda mungkin juga menyukai
- Materi Sifat Koligatif LarutanDokumen6 halamanMateri Sifat Koligatif LarutanKintan PutriBelum ada peringkat
- Bab 1 - Sifat Koligatif Larutan - CompressedDokumen28 halamanBab 1 - Sifat Koligatif Larutan - CompressedAnna SutrianahBelum ada peringkat
- Koligatif FixDokumen11 halamanKoligatif FixKnucnicBelum ada peringkat
- Sifat Koligatif Larutan XIDokumen14 halamanSifat Koligatif Larutan XIIgnatia Fransiska Sari IndahBelum ada peringkat
- Bab 1 - Sifat Koligatif LarutanDokumen17 halamanBab 1 - Sifat Koligatif LarutanTata KimBelum ada peringkat
- Kimia 12 1 Sifat Koligatif Larutan PDFDokumen15 halamanKimia 12 1 Sifat Koligatif Larutan PDFmuhamad tharmiziBelum ada peringkat
- 4a. Biomedik-Kesetimbangan KimiaDokumen28 halaman4a. Biomedik-Kesetimbangan KimiaandhikaBelum ada peringkat
- PPT SKLDokumen38 halamanPPT SKLRakha FadhliBelum ada peringkat
- Sifat Koligatif Larutan - Kelompok 10Dokumen7 halamanSifat Koligatif Larutan - Kelompok 10BTS V.Belum ada peringkat
- SIFAT KOLIGATIF LARUTAN Latihan Soal Kimia Smu Kelas 12 Semester 1Dokumen5 halamanSIFAT KOLIGATIF LARUTAN Latihan Soal Kimia Smu Kelas 12 Semester 1nadya8845Belum ada peringkat
- Sifat Koligatif Larutan..Dokumen4 halamanSifat Koligatif Larutan..Gerrard SitohangBelum ada peringkat
- Xii I Konsentrasi & Sifat Koligatif LarutanDokumen8 halamanXii I Konsentrasi & Sifat Koligatif LarutanMarwan Hasbun NurBelum ada peringkat
- Sifat Koligatif LarutanDokumen5 halamanSifat Koligatif LarutanRiskiBelum ada peringkat
- Modul Kimia Kelas XiiDokumen6 halamanModul Kimia Kelas XiisherinBelum ada peringkat
- Sifat Koligatif Larutan 2Dokumen15 halamanSifat Koligatif Larutan 2Vicky raihan akbar 068Belum ada peringkat
- Mind Maps Sifat KoligatifDokumen1 halamanMind Maps Sifat Koligatifdessy nataliaBelum ada peringkat
- Bahan Ajar Sifat Koligatif LarutanDokumen8 halamanBahan Ajar Sifat Koligatif LarutanAkhmad FaridBelum ada peringkat
- Kimia 12 Bab 1 Koligatif LarutanDokumen10 halamanKimia 12 Bab 1 Koligatif LarutanDaeylen BebyBelum ada peringkat
- Sifat Koligatif Larutan - IntensiveDokumen5 halamanSifat Koligatif Larutan - IntensivestevenBelum ada peringkat
- Ringkasan Materi Sifat Koligatif LarutanDokumen2 halamanRingkasan Materi Sifat Koligatif LarutanHenpaBelum ada peringkat
- Koligatif LarutanDokumen7 halamanKoligatif LarutanMuhammad RodifaBelum ada peringkat
- Diagram PTDokumen20 halamanDiagram PTSatrianiRahmayanti100% (1)
- Kesetimbangan Larutan Lanjutan PDFDokumen25 halamanKesetimbangan Larutan Lanjutan PDF데피나딘다Belum ada peringkat
- Sifat-Sifat Koligatif Larutan Part 2Dokumen11 halamanSifat-Sifat Koligatif Larutan Part 2Muhammad Afnan MBelum ada peringkat
- Rangkuman KoligatifDokumen1 halamanRangkuman KoligatifI PutuBelum ada peringkat
- Sifat Koligatif LarutanDokumen50 halamanSifat Koligatif LarutanLUSPI MINDAH XII MIPA 5Belum ada peringkat
- 1.sifat Koligatif Larutan - PowerpointDokumen33 halaman1.sifat Koligatif Larutan - PowerpointMachmud AminudinBelum ada peringkat
- Koligatif Larutan - SWD 1Dokumen22 halamanKoligatif Larutan - SWD 1SEPTIANA SAPUTRIBelum ada peringkat
- Kelas Xii Bab 1 Sifat Koligatif LarutanDokumen10 halamanKelas Xii Bab 1 Sifat Koligatif LarutanPutri NovitasariBelum ada peringkat
- Biomedik-LarutanDokumen24 halamanBiomedik-LarutanandhikaBelum ada peringkat
- Sifat KoligatifDokumen23 halamanSifat KoligatiffikarakhmalindaBelum ada peringkat
- Bab 1 Sifat KoligatifDokumen23 halamanBab 1 Sifat KoligatifNendah Nur JanahBelum ada peringkat
- 1 Sifat Koligatif LarutanDokumen48 halaman1 Sifat Koligatif LarutanRafli hendiansyahBelum ada peringkat
- Koligatif LarutanDokumen22 halamanKoligatif LarutanSatriawan JuniBelum ada peringkat
- Sifat Koligatif LarutanDokumen6 halamanSifat Koligatif LarutanBahrul UlumBelum ada peringkat
- Sifat Koligatif Larutan - Pengertian, Macam, Rumus, Contoh Soal - InformasainsEduDokumen8 halamanSifat Koligatif Larutan - Pengertian, Macam, Rumus, Contoh Soal - InformasainsEduElla AprilyaBelum ada peringkat
- Sifat Koligatif Larutan Kelas XiiDokumen17 halamanSifat Koligatif Larutan Kelas XiiIntan MaulidaBelum ada peringkat
- Sifat Koligatif LarutanDokumen18 halamanSifat Koligatif LarutannanaBelum ada peringkat
- SIFAT - KOLIGATIF - LARUTAN OkDokumen12 halamanSIFAT - KOLIGATIF - LARUTAN OknamdaBelum ada peringkat
- Koligatif FixDokumen16 halamanKoligatif FixwulanrahayuputriBelum ada peringkat
- Kimia KoligatifDokumen20 halamanKimia KoligatifVincentBelum ada peringkat
- LarutanDokumen13 halamanLarutanSasqia FesantiBelum ada peringkat
- Sifat-Sifat Larutan KimiaDokumen40 halamanSifat-Sifat Larutan KimiaGreztoKozhoBelum ada peringkat
- ARSIP SIFAT KOLIGATIF LARUTAN - PowerPointDokumen34 halamanARSIP SIFAT KOLIGATIF LARUTAN - PowerPointNoor AinunBelum ada peringkat
- Presentasi KL Sem Awal 2015Dokumen22 halamanPresentasi KL Sem Awal 2015FiTri Yani SyarbiniBelum ada peringkat
- Sifat Fisik Larutan - 02Dokumen24 halamanSifat Fisik Larutan - 02Dini IzzatyBelum ada peringkat
- Sifat KoligatifDokumen11 halamanSifat KoligatifaswanBelum ada peringkat
- Bab 5 Sifat Sifat Fisis LarutanDokumen34 halamanBab 5 Sifat Sifat Fisis LarutanAbdul Haarys Al-kahtaniBelum ada peringkat
- BKS Kimia XII ADokumen68 halamanBKS Kimia XII AafifahBelum ada peringkat
- Larutan Sifat Koligatif LarutanDokumen29 halamanLarutan Sifat Koligatif LarutanKiki RuhimanBelum ada peringkat
- Kimia Bener 2Dokumen15 halamanKimia Bener 2Fahreza Dimas SusantoBelum ada peringkat
- Rangkuman Sifat Koligatif LarutanDokumen6 halamanRangkuman Sifat Koligatif LarutanjuspariatnaBelum ada peringkat
- PDF 20230726 082141 0000Dokumen2 halamanPDF 20230726 082141 0000Oktavia RamadhaniBelum ada peringkat
- Kimia Kelas 12Dokumen17 halamanKimia Kelas 12Viona Ananda PutriBelum ada peringkat
- Sifat Koligatif Dan Pengaruh Terhadap SuhuDokumen15 halamanSifat Koligatif Dan Pengaruh Terhadap SuhuTitah Aldila BudiastantiBelum ada peringkat
- Sifat Koligatif Larutan Kel 5Dokumen11 halamanSifat Koligatif Larutan Kel 5Fahreza Dimas SusantoBelum ada peringkat
- Bab 11 Sifat Koligatif LarutanDokumen5 halamanBab 11 Sifat Koligatif Larutanchem_vivinBelum ada peringkat
- Masalah 2Dokumen13 halamanMasalah 2ZakariaBelum ada peringkat
- HTML CodeDokumen1 halamanHTML CodeZakariaBelum ada peringkat
- Sifat Koligatif Larutan ElektrolitDokumen5 halamanSifat Koligatif Larutan ElektrolitZakariaBelum ada peringkat
- Laporan Pengabdian Masyarakat - Cut Zauja ChairunnisaDokumen16 halamanLaporan Pengabdian Masyarakat - Cut Zauja ChairunnisaZakariaBelum ada peringkat
- Peta Konsep Larutan Non ElektrolitDokumen1 halamanPeta Konsep Larutan Non ElektrolitZakariaBelum ada peringkat
- Analisis JurnalDokumen5 halamanAnalisis JurnalZakariaBelum ada peringkat
- Cut Zauja Chairunnisa - 11 - Kelompok 2 - Teori Pembelajaran KonstruktivismeDokumen5 halamanCut Zauja Chairunnisa - 11 - Kelompok 2 - Teori Pembelajaran KonstruktivismeZakariaBelum ada peringkat
- Silvia Fidyati-FstDokumen10 halamanSilvia Fidyati-FstZakariaBelum ada peringkat
- SHOLAT JAMA DAN-WPS OfficeDokumen3 halamanSHOLAT JAMA DAN-WPS OfficeZakariaBelum ada peringkat
- Makalah Kelompok 1 - Evaluasi Proses Dan Hasil Belajar Pada Ranah Kognitif, Afektif, Dan PsikomotorikDokumen32 halamanMakalah Kelompok 1 - Evaluasi Proses Dan Hasil Belajar Pada Ranah Kognitif, Afektif, Dan PsikomotorikZakariaBelum ada peringkat
- Aturan Umum PMPC 2021Dokumen6 halamanAturan Umum PMPC 2021ZakariaBelum ada peringkat
- Tugas Biokimia Asam Nukleat Jul-Des 2021Dokumen1 halamanTugas Biokimia Asam Nukleat Jul-Des 2021ZakariaBelum ada peringkat
- Bawang PutihDokumen5 halamanBawang PutihZakariaBelum ada peringkat
- Silvia Fidyati FSTDokumen97 halamanSilvia Fidyati FSTZakariaBelum ada peringkat
- 4 - Bab 1Dokumen17 halaman4 - Bab 1ZakariaBelum ada peringkat
- Buku Referensi Inovasi Pengajaran - Pembelajaran - CompressedDokumen158 halamanBuku Referensi Inovasi Pengajaran - Pembelajaran - CompressedZakariaBelum ada peringkat
- Tugas Individu Format Kartu Soal KAPSEL 2Dokumen35 halamanTugas Individu Format Kartu Soal KAPSEL 2ZakariaBelum ada peringkat
- 05.1 Bab 2Dokumen4 halaman05.1 Bab 2ZakariaBelum ada peringkat
- 6A - Kelompok 3 - UTS - Jurnal Bioteknologi PanganDokumen25 halaman6A - Kelompok 3 - UTS - Jurnal Bioteknologi PanganZakariaBelum ada peringkat
- WWW Academia Edu 11819643 Spektometer IrDokumen12 halamanWWW Academia Edu 11819643 Spektometer IrZakariaBelum ada peringkat
- Skripsi Analisa Penggunaan Frame Relay Sebagai Komunikasi DataDokumen96 halamanSkripsi Analisa Penggunaan Frame Relay Sebagai Komunikasi DataZakariaBelum ada peringkat
- Makalah Spektrofotometer IR Kelompok 4 PDFDokumen26 halamanMakalah Spektrofotometer IR Kelompok 4 PDFZakariaBelum ada peringkat
- 0032 - Memo Persiapan RUPS IPBDokumen2 halaman0032 - Memo Persiapan RUPS IPBZakariaBelum ada peringkat
- 394F3C495EAF76Dokumen1 halaman394F3C495EAF76ZakariaBelum ada peringkat
- Learning Management Syste1Dokumen3 halamanLearning Management Syste1ZakariaBelum ada peringkat
- 394F3C495EAF76Dokumen1 halaman394F3C495EAF76ZakariaBelum ada peringkat