Koloid
Diunggah oleh
Atikatul MutmainahJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Koloid
Diunggah oleh
Atikatul MutmainahHak Cipta:
Format Tersedia
LAPORAN PRAKTIKUM
FISIKA FARMASI
DISPERSI KOLIODAL
DISUSUN OLEH
NAMA : RISA WURIANA MAWARDI
NIM : 120239
TANGGAL PRAKTIKUM : 23 OKTOBER 20013
DOSEN PENGAMPU : SISKA DEVI S.Farm, Apt
LABORATORIUM FISIKA FARMASI
AKADEMI FARMASI THERESIANA SEMARANG
2013
I. TUJUAN
Mahasiswa mengerti dan memahami tentang apa yang dimaksud dengan
dispersi koloidal.
Mahasiswa mampu mengerti sifat-sifat koloid
Mahasiswa manpu mengerti penggolongan koloid dan dapat
mengklasifikasikan cairan uji termasuk ke dalam liofobik atau liofilik.
II. DASAR TEORI
Keadaan koloid materi ditandai oleh kisaran tertentu dari ukuran partikel
dengan akibat, sifat khas tertentu menjadi nampak. (vogel, 1994 )
Ciri khas dari kebanyakan tipe koloid yang dijumpai dalam analisa
anorganik adalah:
a. Partikel partikel itu memperlihatkan efek tyndall apabila dipandang
dengan penyinaran cahaya sesuai.
b. Partikel-partikel dapat dipisahkan dari larutan sejati dengan dari
koloidon atau perkamen yaitu proses dialisis.
c. Partikel partikel itu memiliki luas permukaan besar.
d. Partikel itu memiliki muatan listrik karena bermigran dibawah
pengaruh suatu selisih potensial yang sesuai. (vogel,1994)
Pembagian koloid menjadi dua golonhan utama yang disebut koloid liofilik
dan liofobik.
Koloid Liofobik Koloid Liofilik
Dispersi atau sol hanya sedikit agak kental.
Contoh: sol logam, perak halida, sulfida
logam.
Dispersi sangat kental, memadat
menjadi massa seperti selai yang
disebut gel.
Contoh: sol asam silikat, gelatin
Elektrolit dalam konsentrasi rendah akan
mengakibatkan gumpalan ( flokulasi )
irreversible. Penambahan air tidak
berpengaruh.
Perlu elektrolit konsentrasi tinggi
untuk mengendapkan bersifat
reverssible. Pengembalian dengan
penambahan air.
Mempunyai muatan listrik dengan tanda
tertentu yang hanya bisa dibalik dengan
metode istimewa.
Mudah berubah tanda muatan
listriknya.
Ultramikroskop memperagakan partikel
yang bergerak hebat ( gerak brown )
Pada ultramikroskop hanya
diperagakan kerucut cahaya baur
(Vogel, 1994)
Pembuatan sistem koloid terdapat dua metode:
1. Metode Kondensasi
Menggabungkan partikel kecil untuk membentuk partikel yang lebih
besar yaitu koloid.
2. Metode Dispersi
Mekanik
Menggerus butir kasar sampai terbentuk partikel dengan
ukuran tertentu lalu mencampurkan dengan media pendispers
kemudian diaduk.
Peptisasi
Memecah butir kasar dengan zat pemecah semacam peptid
sampai terbentuk koloid
Menggunakan busur bredig
Membuat logam sebagai elektroda dan kemudian diberi
kejutan listrik sehingga logam terlepas ke air dan kemudian
mengalami kondensasi membentuk koloid.
Manfaat dan kerugian koloid :
1. Dialisis
Penghilangan ion pengganggu kestabilan koloid dengan memasukkan
ke kantong semipermeable.
Contoh : proses hemodialisis.
2. Koloid Pelindung
Dibuat dengan menstabilkan sistem koloid yang perlu dijaga
kestabilannya, koloid pelindung membungkus partikel zat terdispersi
supaya tidak mengelompok.
Contoh : gelatin sebagai koloid pelindung es krim agar mencegah
terbentuknya kristal es.
3. Pengolahan air
Menggunakan sifat koloid yaitu adsorbsi dan koagulan.
larutan
kondensasi
kolid
dispersi
suspensi
Koagulasi : tawas menggumpalkan lumpur koloid sehingga mudah
disaring
Adsorbsi : tawas dapat menyerap zat pewarna dan pencemar lain.
4. Polusi
Polusi udara umumnya dikarenakan oleh partikel polutan berbentuk
koloid seperti debu dan asap.
(Krisbiantoro adi, 2008)
Sifat sifat koloid
a. Filtrasi
Partikel koloid dapat melalui pori-pori dari kertas saring biasa yang
tidak dapt dilalui partikel suatu suspensi jadi penyaringan biasa tidak
dapat dilakukan. Membran koloidon membuat partikel koloid tidak
dapat lewat jadi dapat dipisah dari medium pendispers.
b. Pengendapan
Partikel suspensi dengan air bila dibiarkan akan mengendap sendiri
karena adanya gaya berat kecepatan mengendap dipengaruhi besar
partikel.
c. Efek tyndall
Bila cahaya dijatuhkan pada larutan koloid, tergantung konsentrasi zat
terdispersi maka larutan dapat terlihat keruh seperti suspensi / jernih
seperti larutan. Apabila ada cahaya koloid dilihat tegak lurus dari arah
sinar maka jalan yang dilalui sinar akan terlihat kabur meski larutan
koloid jernih. Jalan yang kabur dari sinar tersebut adalah kerucut
tyndall yang terjadi karena tersebarnya cahaya oleh partikel kecil
kolid.
d. Gerak brown
Partikel koloid hanya dapat bergerak dengan sedikit tetapi karena
adanya tumbukan dengan molekul fase pendispers gerakannya akan
terbentuk zig zag yang dapat dilihat dengan mikroskop.
e. Listrik pada koloid
Fase terdispersi pada koloid mengandung muatan listrik. Muatan
dapat positif atau negatif sedangkan medium pendispers akan
memiliki muatan berlawanan.
(sukmariah,1990)
III. ALAT DAN BAHAN
ALAT BAHAN
Timbangan analitik NaCl
Sendok FeCl3
Beaker glass 100ml Gelatin
Cawan porselin kecil Na Lauryl Sulfas
Kompor listrik Aquadest
Pengaduk kaca Es
Gelas ukur Vaselin
Labu takar PGA
Mortir dan stamfer Aquadest panas
Viskometer brookfield ES
Pipet volume 10,0 ml
Buret
Erlenmeyer
Pipet filler
Klep dan statif
Corong kaca
Waskom tempat es
IV. CARA KERJA
Pembuatan Larutan kolid
Ada pada pembahasan
Viskositas koloid
Larutan Koloid dimasukkan ke dalam wadah
Diuji menggunakan viskometer brookfield menggunakan spindle dan
RPM tertentu
Dihasilkan viskositan koloid
Pengaruh elektrolit terhadap koloid
1. Diambil masing masing larutan yang telah dibuat kemudian
dimasukkan ke dalam erlenmeyen
Dititrasi menggunakan NaCl sampai terbentuk endapan
Dilakukan pengamatan setiap penambahan 2ml NaCl
Pengamatan dilakukan dengan membandingkan denganlarutan
pembanding
2. 10ml FeCl3 0,5% dan 0,25 % masing-masing dipipet
dimasukkan erlenmeyer kemudian dipipet 10ml larutan gelatin
10% dan dicampur di erlenmeyer
Dititrasi dengan larutan NaCl sampai terbentuk endapan,
diamati setiap penambahan 2ml NaCl
Pengaruh alkohol terhadap koloid
Dipipet 10ml larutan gelatin 5 dan 10% kemudian dimasukkan ke dalam
erlenmeyer
Dititrasi menggunakan alkohol 96% sampai terbentuk endapan lau dicatan
banyaknya alkohol yang dibutuhkan
Reversibilitas koloid
Mucilago gum arab 10%, na lauryl sulfat 0,1 % FeCl3 diuapkan hingga
kering pada cawan porselin
Setelah mengering, masing-masing ditambah 10 ml air dingin
Diamati perubahan yang terjadi
V. HASIL DAN PENGOLAHAN DATA
Viskositas koloid
Larutan fecl3 0,5% 3,1 cps
Larutan fecl3 0,25% 2,5 cps
Gelatin 5% 2,5 cps
Gelatin 10 % 9,6 cps
Pengaruh elektrolit terhadap koloid
a. Larutan gum mucilago 10%
Penambahan NaCl ke -
I II III IV V VI
+ (2ml) + (4ml) + (6ml)
b. Na Lauryl sulfat 0,1 %
Penambahan NaCl ke -
I II III IV V VI
+ (3,4)
c. Larutan gelatin 5%
Penambahan NaCl ke -
I II III IV V VI
d. Larutan gelatin 10%
Penambahan NaCl ke -
I II III IV V VI
e. Larutan fecl3 0,25%
Penambahan NaCl ke -
I II III IV V VI
+ (2ml)
f. Larutan fecl3 0,5%
Penambahan NaCl ke -
I II III IV V VI
+(2ml)
g. Larutan fecl3 0,25% + gelatin 10 %
Penambahan NaCl ke -
I II III IV V VI
+ (2ml)
Pengaruh alkohol terhadap koloid
Larutan gelatin 5%
Penambahan NaCl ke -
I II III IV V VI
- - + ( 5,5ml) + (6,3ml) + (6,6ml)
Larutan gelatin 10%
Penambahan NaCl ke -
I II III IV V VI
+ (1,7ml) +(3,5ml) + (4,3ml)
Reversibilitas koloid
No Nama larutan Hasil
1 Musilago gum Irreversible
2 Na lauryl sulfat 0,1 % Reversible
3 Larutan fecl3 Irreversible
VI. PEMBAHASAN
Tujuan dari praktikum yang dilakukan yaitu untuk membedakan antara
koloid liofilik dan koloid liofobik dengan cara melihat sifat koloid seperti
viskositas, pengaruh elektrolit, pengaruh alkohol dan reversibilitas.
Solvatasi adalah melekatnya molekul-molekul air pada fase dispers
sebagai akibat dari gaya tarik menarik antara fase dispers dan fase pendispers.
Berdasarkan sifat solvatasi ini maka dapat dibedakan dua tipe koloid yaitu :
1. Koloid Hidrofilik
Koloid yang fase dispersnya membungkus diri dengan air (pendispers)
2. Koloid Hidrofobik
Koloid yang fase dispersnya tidak dapat membungkus diri dengan air (
pendispers) sehingga tidak ada solvent yang mengelilingi dispers.
Langkah pertama yang harus dilakukan dalam praktikum ini yaitu pembuatan
larutan koloid yang akan dilakukan percobaan, larutan koloid tersebut adalah:
Larutan Jumlah Bahan Cara Pembuatan
Mucilago Gum Arab
10%
PGA = 10% x 100ml = 10g
Aquadest = 100ml 10g =
90ml
80ml untuk melarutkan PGA,
sisanya 10ml untuk
mengaddkan pada labu takar
100ml.
10 g PGA dimasukkan
mortir, ditambahkan
aquadest sedikit 20ml
diaduk dengan cepat dan
kuat, setelah terbentuk
massa pekat ditambahkan
aquadest sisa sedikit demi
sedikit terus diaduk
hingga honogen.
Dimasukkan ke labu takar
100ml dan ditambah air
yang digunakan untuk
membilas mortir terlebih
dahulu.
Na Lauryl Sulfat 0,1
%
Na Lauryl Sulfat = 0,1% x
100ml 0,1g
Aquadest = 100ml- 0,01g =
99,9 ml
Na Lauryl Sulfat 0,1 g
pada cawan porselin
ditambahkan sedikit air
untuk melarutkan, setelah
larut dimasukkan labu
takar 100ml kemudian di
add kan dengan aquadest
dibantu denga corong
kaca kemudian
dihomogenkan perlahan.
FeCl3 0,25 % 0,25 % x 100ml = 0,25 g
Aquadest = 100ml 0,25 =
99,75 ml
Fecl3 0,25g dilarutkan
dengan aquadest sedikit
demi sedikit kemudian
disaring, dimasukkan ke
labu takar sampai batas
tanda.
FeCl3 0.5 % 0,5% x 100ml = 0,5 g
100ml 0,5 g = 99,5 ml
Fecl3 0,5g dilarutkan
dengan aquadest sedikit
demi sedikit kemudian
disaring, dimasukkan ke
labu takar sampai batas
tanda.
Gelatin 5 % Gelatin 5% x 100ml = 5g
Aquadest 100ml 5g = 95ml
80ml aquadest panas
15ml aquadest digunakan
untuk mengadd pada labu
takar
Ditimbang gelatin
sebanyak 5g kemudian
ditambahkan air panas
80ml diaduk sampai larut.
Dimasukkan ke dalam
labu takar kemudian di
add sampai tanda batas
Keterangan :
Pengadukan pembuatan mucilago gum arab harus dilakukan dengan sedikit air
kemudian diaduk kuat agar diperoleh mucilago yang baik ( larut dan homogen) serta
tidak pecah. Baik atau buruk mucilago akan mempengaruhi uji viskositas yang
dilakukan. Mucilago yang pecah akan menurunkan viskositas karena ikatan antar
molekul putus sehingga lebih encer.
Na Lauryl Sulfat dilarutkan dengan sedikit air terlebih dahulu di cawan porselin dan
ketika dimasukkan ke labu takar dibantu dengan corong kaca untuk meminimalisir
gelembung udara.
Air yang digunakan untuk membuat larutan gelatin sebagian adalah air panas kagar
gelatin mudah larut, kemudian diaddkan mengunakan aquadest.
Langkah kedua yaitu menentukan masing-masing viskositas larutan koloid tersebut
sehingga dapat dibandingkan antara koloid hidrofilik dan hidrofobik terhapad pengaruh
viskositasnya. Hasil dari percobaan yaitu:
Larutan fecl3 0,5% 3,1 cps
Larutan fecl3 0,25% 2,5 cps
Gelatin 5% 2,5 cps
Gelatin 10 % 9,6 cps
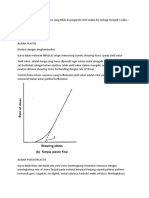
Viskositas adalah tahanan untuk mngalir dimana dikenal dengan aliran newton dan
non newton. Berdasarkan viskositas newton berlaku hukum bahwa shearing stress ( gaya
gesek ) sebanding dengan shering rate (kecepatan gesek) dan tipe non newton dipengaruhi
oleh shering streesnya. Pada percobaan viskositas larutan koloid digunakan viskometer
brookfield dimana spindle mempunyai pengaruh pemberi tekanan atau gaya gesek dan rpm
labu menggunakan
aquadest.
Gelatin 10 % Gelatin 10% X 100ml = 10g
Aquadest 100ml 10g =
90ml
80ml aquadest panas
10ml aquadest digunakan
untuk mengadd pada labu
takar
Ditimbang gelatin
sebanyak 10g kemudian
ditambahkan air panas
80ml diaduk sampai larut.
Dimasukkan ke dalam
labu takar kemudian di
add sampai tanda batas
labu menggunakan
aquadest.
NaCl 20 % NaCl 20% x 300ml = 60g
Aquadest 300ml 60g =
240ml
Ditimbang NaCl yang
dubutuhkan kemudian
dimasukkan beaker,
ditambahkan aquadest
add 300ml sedikit demi
sedikit sambil diaduk
larut
adalah kecepatannya. Larutan koloid yang kental seperti gelatin dipilih spindle no 62 dengan
ukuran yang kecil dan larutann koloid yang lebih encer menggunakan spindle ukuran besar
dengan no spindle 61 yaitu larutan fecl3. Pemilihan spindle in i penting agar viskometer
dapat melakukan gaya gesek terhadap koloid dan menghasilkan nilai viskositas yang stabil.
Pemilihan spindle yang salah dapat menghilangkan pembacaan viskositas, viskositas dilihat
dari pembacaan monitor dengan angka cps yang stabil. Semakin tinggi cps maka semakin
kental cairan tersebut seperti dapat diamati pada hasil percobaan bahwa gelatin yang lebih
kental dari fecl3 memiliki angka cps yang lebih besar dan dua larutan gelatin berbeda
konsentrasi juga menunjukkan hasil yang berbeda dimana konsentrasi dispers yang lebih
tinggi, maka viskositasnya tinggi.
Hubungan viskositas dengan jenis koloid yaitu :
Pada koloid hidrofilik, partikel fase dispersnya tersolvatasi dengan molekul solven maka
dengan adanya kenaikan kadar akan menyebabkan kenaikan viskositas secara nyata sehingga
cps besar.
Pada koloid hidrofobik, dimana fase dispersnya tidak tersolvatasi oleh molekul solven
sehingga kadar tidak mempengaruhi vskositasnya.
Pada larutan gelatin 5 % = 2,5 cps ketika kadar gelatin ditingkatkan menjadi 10%
viskositasnya naik secara signifikan menjadi 9,6 cps (rentan = 7,1)
Pada larutan fecl3 0,25 % = 2,5 ketika kadar dinaikkan menjadi 0,5% viskositasnya naik
wallaupun tidak signifikan menjadi 3,1 cps (rentan = 0,6 )
Maka dapat disimpulkan bahwa gelatin termasuk hidrofilik dan fecl termasuk hidrofobik.
Percobaan ini sudah sesuai teori bahwa pada koloid hidrofilik peningkatan kadar akan
menyebabkan peningkatan viskositas koloid karena fase dispers tersolvatasi dengan solven.
Jadi semakin banyak molekul yang tersolvatasi, semakin tinggi pula kadarnya, dan semakin
kental koloid tersebut.
Tahap slanjutnya adalah pengaruh penambahan elektrolit terhadap koloid. Larutan yang
di uji di tambah dengan larutan NaCl 20%. Reaksi yang akan terjadi adalah adanya endapan
yang ditandai degan munculnya awan pada masing-masing larutan koloid tersebut.
Hubungan elektrolit dengan koloid yaitu elektrolit dapat menetralkan muatan dengan
memutuskan ikatan larutan antara fase dispers dan fase pendispers.
Pada koloid hidrofilik fase dispersnya membungkus diri dengan air (pendispers) atau
tersolvatasi.
Pada koloid hidrofobik fase dispersnya tidak dapat membungkus diri dengan air (pendispers)
sehingga tidak ada solvent yang mengelilingi dispers atau tidak tersolvatasi.
Jadi dengan adanya NaCl sebagai larutan elektrolit dapat menetralkan dengan memutuskan
ikatan antara fase dispers dan fase pendispers, hal ini dapat terjadi mudah pada koloid
hidrofobik yang fase dispersnya tidak dilindungi oleh fase pendispers sehingga muatannya
mudah dinetralkan (mudah diendapkan). Dapat dilihat dari titrasi bahwa dibutuhkan NaCl
yang lebih sedikit untuk koloid hidrofobik dan lebih banyak pada koloid hidrofilik karena
medium dispers hidrofilik dilindungi pendispers.
Hasil percobaan
Nama larutan Rata rata NaCl yang dibutuhkan
Gum arab 4ml
Na laury sulfat 3,9 ml
Gelatin Belum dilakukan percobaan
Fecl3 2ml
Berdasarkan data tersebut dapat disimpulkan bahwa
Gum arab = hidrofilik
Na lauryl sulfat = hidrofilik
Gelatin = hidrofilik
Fecl3 = hidrofobik
Gum arab dan na lauryl sulfat merupakan hidrofilik karena membutuhkan lebih banyak
volume NaCl dan Fecl lebih sedikit mebutuhkan NaCl. Gelatin tidak dapat diamati dari
percobaan ini karena belum dilakukan tetapi pada percobaaan sebelumnya telah diketahui
bahwa gelatin adalah hidrofilik jadi seharusnya pada percobaan ini NaCl yang dibutuhkan
untuk gelatin juga banyak.
Percobaan yang ketiga yaitu melakukan titrasi alkohol terhadap larutan koloid ( gelatin ).
Hubungan alkohol dengan koloid yaitu kompetisi antara alkohol dan gelatin untuk
berikatan dengan air dimana kedua larutan ini memiliki sifat hidrofilik yang akan berikatan
dengan air. Di dalam sampel digunakan sejumlah kadar air untuk melarutkan gelatin dan pada
titran digunakan air untuk melarutkan alkohol. Ketika bercampur, air air ini diperebutkan
oleh alkohol dan gelatin untuk berikatan dan apabila gelatin terdesak oleh alkohol sebagai
titran maka akan terjadi endapan dan perebutan air ini dimenangkan oleh alkohol karena
jumlahnya yang terus ditingkatkan. Larutan gelatin dengan konsentrasi tinggi lebih mudah
mengendap karena lebih banyak gelatin yg didesak keluar.
Nama larutan Rata rata alkohol yang dibutuhkan
Larutan gelatin 5% 6,13ml
Larutan gelatin 10% 3,16 ml
Terlihat bahwa jumlah alkohol untuk mengendapkan gelatin 5% lebih tinggi daripada
jumlah alkohol untuk mengendapkan gelatin 10 %. Percobaan ini sudah sesuai teori bahwa
semakin tinggi kadar gelatin maka semakin sedikit alkohol yg diperlukan untuk
mengendapkannya karena dengan kadar tinggi berarti lebih banyak gelatin yang didesak.
Percobaan reversibilitas ditujukan untuk mengetahui sifat koloid yaitu kemampuan
untuk membentuk larutan koloid lagi setelah koloid diuapkan. Secara teori, karena koloid
hidrofilik mudah tersolvatasi dengan medium dispersnya, maka setelah ia menguap ia dapat
kembali menjadi koloid dengan penambahan pelarut. Ini terlihat pada koloid Mucilago.
Setelah koloid Mucilago diuapkan, kemudian ditambahkan air dingin, dapat terbentuk koloid
kembali. Namun pada FeCl3 setelah penambahan air dingin tidak terbentuk kembali larutan
FeCl3. Hal ini disebabkan molekul FeCl3 tidak tersolvatasikan oleh air karena ia merupakan
koloid hidrofobik.
Nama larutan Rata rata alkohol yang dibutuhkan
Mucilago Tidak kembali
Na lauryl sulfat Kembali
Larutan fecl3 Tidak kembali
Pada hasil percobaan diatas terdapat penyimpangan hasil pada larutan mucilago yang
seharusnya kembali ke bentuk koloid tetapi tidak kembali, hal ini dapat disebabkan oleh;
Pengeringan larutan sampai gosong
Air yang ditambahkan tidak diukur seharusnya diukur dengan takaran yang sama
untuk masing-masing sampel
VII. KESIMPULAN
Kesimpulan setelah melakukan percobaan dengan berbagai sampel yang dibuat,
dapat dibedakan menjadi :
Koloid Hidrofilik Koloid Hidrofobik
Larutan gelatin Fecl3
Larutan gum
Larutan na lauryl sulfat
Penentuan penggolongan tersebut dilakukan dengan menggunakan sifat koloid
yang berhubungan dengan :
1. Viskositas
Hidrofilik : viskositas tinggi
Hidrofobik : viskositas rendah
2. Elektrolit
Hidrofilik : kebutuhan larutan elektrolit lebih banyak
Hidrofobik : kebutuhan larutan elektrolit lebih sedikit
3. Alkohol
Semakin banyak alkohol yang dibutuhkan maka semakin banyak terjadi
endapan karena gelatin terdesak dalam perebutan molekul air dalam berikatan
4. Reversibilitas
Hidrofilik : dapat kembali ke bentuk koloid setelah diuapkan
Hidrofobik : tidak dapat kembali ke bentuk koloid setelah diuapkan
VIII. DAFTAR PUSTAKA
Krisbiayantoro adi, 2008. Panduan kimia praktis SMA . Pustaka widyatama.
Jakarta
Sukmariah, 1990. Kimia kedokteran edisi 2. Binarupa . Jakarta
Vogel, 1994. Kimia analisa kuantitatif anorganik . EGC . Jakarta
Anda mungkin juga menyukai
- Bahan PengikatDokumen8 halamanBahan Pengikatdinda amandaBelum ada peringkat
- Soal Farfis Dispersi Molekuler Dan Fenomena Distribusi-2Dokumen5 halamanSoal Farfis Dispersi Molekuler Dan Fenomena Distribusi-2ilaBelum ada peringkat
- Laporan Resmi Farmasi FisikaDokumen18 halamanLaporan Resmi Farmasi FisikaAlisaBelum ada peringkat
- Dispersi Koloid Dan SifatnyaDokumen14 halamanDispersi Koloid Dan SifatnyaImaMuliaNingrumBelum ada peringkat
- Blok 5 Skenario 2.Dokumen11 halamanBlok 5 Skenario 2.adistineBelum ada peringkat
- Wujud Zat Dan Kesetimbangan FaseDokumen47 halamanWujud Zat Dan Kesetimbangan FaseTinaBelum ada peringkat
- Laporan Teg PermukaanDokumen18 halamanLaporan Teg PermukaanNanda AuziaBelum ada peringkat
- Pembahasan GelDokumen6 halamanPembahasan GelFathiyya Azizah RahmahBelum ada peringkat
- Happy Jendry Allositandi Firdaus - b1 - HistologiDokumen10 halamanHappy Jendry Allositandi Firdaus - b1 - HistologiHappy Jendry A. F.Belum ada peringkat
- Konsep Flokulasi Dan Deflokulasi Dalam Sediaan FarmasiDokumen3 halamanKonsep Flokulasi Dan Deflokulasi Dalam Sediaan Farmasiwidya nabilaBelum ada peringkat
- Laporan KoloidDokumen17 halamanLaporan KoloidRizkiBelum ada peringkat
- Laporan Akhir Praktikum Farmasi Fisika Tegangan PermukaanDokumen10 halamanLaporan Akhir Praktikum Farmasi Fisika Tegangan PermukaanPikiy PutriBelum ada peringkat
- Bab Iii Metode Praktikum A. Alat Dan BahanDokumen6 halamanBab Iii Metode Praktikum A. Alat Dan BahanIndra NopianBelum ada peringkat
- Makalah UnguetaDokumen20 halamanMakalah UnguetaDebo AhmadiBelum ada peringkat
- Fucidine Tab (Sodium Fusidate)Dokumen15 halamanFucidine Tab (Sodium Fusidate)Noviani NovitaBelum ada peringkat
- Bobot Jenis 1Dokumen16 halamanBobot Jenis 1Ahmad JakaBelum ada peringkat
- solutio-LARUTANDokumen68 halamansolutio-LARUTANWijayaBelum ada peringkat
- Lapleng Dispersi KoloidDokumen25 halamanLapleng Dispersi KoloidMusyarrafaBelum ada peringkat
- Praktikum V SuspensiDokumen15 halamanPraktikum V SuspensiMawar IgaBelum ada peringkat
- p3 Fluiditas SerbukDokumen41 halamanp3 Fluiditas SerbukRosyadah HfdzBelum ada peringkat
- Fatahillah Percobaan3Dokumen6 halamanFatahillah Percobaan3FatahillahBelum ada peringkat
- Praktek Farfis Difusi DisolusiDokumen19 halamanPraktek Farfis Difusi DisolusiRetno ErmadiningtyasBelum ada peringkat
- Makalah Farmasi Fisika 2 Sistem DispersiDokumen35 halamanMakalah Farmasi Fisika 2 Sistem DispersiOktasyon100% (1)
- P14. Sifat-Sifat BiofarmasetisDokumen24 halamanP14. Sifat-Sifat BiofarmasetisElfa SakinahBelum ada peringkat
- Buku Kerja Praktikum Botani FarmasiDokumen6 halamanBuku Kerja Praktikum Botani Farmasicarolin enjelin rumaikewiBelum ada peringkat
- Berat Jenis Dan KerapatanDokumen22 halamanBerat Jenis Dan Kerapatanhanifa salehBelum ada peringkat
- DISOLUSIDokumen7 halamanDISOLUSIAndi Firda IndiraBelum ada peringkat
- EMULSIDokumen40 halamanEMULSIVika amaliaBelum ada peringkat
- Anatomi BuahDokumen2 halamanAnatomi BuahMei SiagianBelum ada peringkat
- Laporan Fix SimplisiaDokumen4 halamanLaporan Fix SimplisiaIndah HariyatiBelum ada peringkat
- Laporan Praktikum Kiman BromometriDokumen22 halamanLaporan Praktikum Kiman BromometriSyamsudin HarsisBelum ada peringkat
- Kel 7 - DAPARDokumen15 halamanKel 7 - DAPARhikmahBelum ada peringkat
- MIKROMERITIKDokumen18 halamanMIKROMERITIKStephanie FigueroaBelum ada peringkat
- Tugas Farmasi FisikaDokumen8 halamanTugas Farmasi FisikaClaris BulukianBelum ada peringkat
- Farsetdas Pembuatan EmulsiDokumen35 halamanFarsetdas Pembuatan EmulsiYunita Carolline PanggabeanBelum ada peringkat
- Farmasi Fisik-RheologiDokumen27 halamanFarmasi Fisik-RheologiEphram GunawanBelum ada peringkat
- Farfis 05 Fenomena AntarmukaDokumen21 halamanFarfis 05 Fenomena AntarmukaChiyo Natha100% (2)
- Morfologi BatangDokumen18 halamanMorfologi BatangDiany LiemBelum ada peringkat
- Pilulae Dan GranulaDokumen62 halamanPilulae Dan Granula2OO111OO Luthfiyah Mutiara HasanahBelum ada peringkat
- Jawaban Essay No 1Dokumen2 halamanJawaban Essay No 1Shenina KnightleyBelum ada peringkat
- OleumDokumen45 halamanOleumAghnat Firasyan100% (1)
- Tegangan Muka 2019Dokumen42 halamanTegangan Muka 2019Hanifatin AzizahBelum ada peringkat
- InimiDokumen27 halamanInimiResa SaputraBelum ada peringkat
- Biofarmasetika 2008Dokumen60 halamanBiofarmasetika 2008reza rahmadBelum ada peringkat
- Formula EmulsiDokumen2 halamanFormula EmulsimemeeeyyyBelum ada peringkat
- Difusi Dan DisolusiDokumen30 halamanDifusi Dan Disolusimarlin NiabBelum ada peringkat
- Granul Dan SerbukDokumen23 halamanGranul Dan SerbukDesmon Jonathan SumolangBelum ada peringkat
- Laporan Prak - Farmakognosi Simplisia RadixDokumen11 halamanLaporan Prak - Farmakognosi Simplisia Radixdynasti aryaBelum ada peringkat
- Suspensi PPT DikonversiDokumen60 halamanSuspensi PPT DikonversiLaptop ToshibaBelum ada peringkat
- Laporan Awal - Morfologi Batang - Reny Aryanti - I1021211068Dokumen24 halamanLaporan Awal - Morfologi Batang - Reny Aryanti - I1021211068KimiaDinaa Ulayaa Aqilatun NajlaaBelum ada peringkat
- Daun Paliasa FixDokumen9 halamanDaun Paliasa FixNur SuharBelum ada peringkat
- Kelompok 5 - Transfer B - Farfif ViskositasDokumen31 halamanKelompok 5 - Transfer B - Farfif ViskositasayaBelum ada peringkat
- JURNAL EmulsiDokumen9 halamanJURNAL Emulsisintya dewiBelum ada peringkat
- Pemanfaatan Lipid Dalam Bidang KefarmasianDokumen16 halamanPemanfaatan Lipid Dalam Bidang Kefarmasianramadhani annisa sekar langitBelum ada peringkat
- Dispersi Kolloidal Dan Sifat-SifatnyaDokumen6 halamanDispersi Kolloidal Dan Sifat-Sifatnya078 Aldi Waskito NugrohoBelum ada peringkat
- Buku Saku. Sistem Koloid. Nungki Shahna AshariDokumen18 halamanBuku Saku. Sistem Koloid. Nungki Shahna AsharinenengBelum ada peringkat
- Puspita 02Dokumen8 halamanPuspita 02Lani PuspitaBelum ada peringkat
- DialisisDokumen6 halamanDialisisrivaldyogieBelum ada peringkat
- KoloidDokumen9 halamanKoloidAdinda TrianaBelum ada peringkat
- KOLOID - C - 05201017 - Annissa Fauzia Hasqa AnhbalDokumen14 halamanKOLOID - C - 05201017 - Annissa Fauzia Hasqa AnhbalAnnisa FauziaBelum ada peringkat
- Percobaan 8Dokumen10 halamanPercobaan 8Atikatul MutmainahBelum ada peringkat
- ReologyDokumen14 halamanReologyRobert NunezBelum ada peringkat
- Tahapan Replikasi ProkariotDokumen1 halamanTahapan Replikasi ProkariotAtikatul MutmainahBelum ada peringkat
- Materi 2Dokumen8 halamanMateri 2Atikatul MutmainahBelum ada peringkat
- Makalah IsbdDokumen9 halamanMakalah IsbdAtikatul MutmainahBelum ada peringkat
- Makalah KapasitorDokumen3 halamanMakalah KapasitorAtikatul MutmainahBelum ada peringkat
- Kinetika Kimia1Dokumen6 halamanKinetika Kimia1Kalis AmartaniBelum ada peringkat
- StoikiometriDokumen58 halamanStoikiometriAtikatul MutmainahBelum ada peringkat