Teori Asam
Teori Asam
Diunggah oleh
ovi saputra astamaHak Cipta:
Format Tersedia
Anda mungkin juga menyukai
- Teori Asam BasaDokumen6 halamanTeori Asam BasaWayan WahyuBelum ada peringkat
- Teori Asam PrintDokumen9 halamanTeori Asam Printtiara kasihBelum ada peringkat
- Penelitian Kimia 2Dokumen15 halamanPenelitian Kimia 2R e a l d iBelum ada peringkat
- Teori Asam Basa Menurut para AhliDokumen8 halamanTeori Asam Basa Menurut para AhlimuhammadfauziladhimBelum ada peringkat
- Asam BasaDokumen20 halamanAsam BasawahyuBelum ada peringkat
- Asam Basa MattDokumen8 halamanAsam Basa MattDaus ElitBelum ada peringkat
- Teori Asam BasaDokumen12 halamanTeori Asam BasaMuhammad NusaBelum ada peringkat
- Laporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaDokumen12 halamanLaporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaayinBelum ada peringkat
- Asam Basa Raihan Baihaqi 17 XIMipa7Dokumen2 halamanAsam Basa Raihan Baihaqi 17 XIMipa7Raihan BaihaqiBelum ada peringkat
- Jurnal3 AndreansyahDwiPratama 191910801017 Kel8Dokumen16 halamanJurnal3 AndreansyahDwiPratama 191910801017 Kel8Reyhan AdfriansyahBelum ada peringkat
- Dasar2 RX AnorgBAB IVDokumen51 halamanDasar2 RX AnorgBAB IVSitti hanafiahBelum ada peringkat
- Perkembangan Konsep Asam BasaDokumen4 halamanPerkembangan Konsep Asam BasaMeilinda HandayaniBelum ada peringkat
- Makalah Larutan Asam Dan BasaDokumen15 halamanMakalah Larutan Asam Dan BasaAndrea Rootz OnlyskyproBelum ada peringkat
- Pengertian Asam Basa Menurut ArrheniusDokumen1 halamanPengertian Asam Basa Menurut ArrheniusNadilla RahmahBelum ada peringkat
- Arabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumDokumen4 halamanArabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumBellaBelum ada peringkat
- Reaksi Reaksi KimiaDokumen31 halamanReaksi Reaksi KimiaIrji Rizqi SabilaBelum ada peringkat
- Warna Warni Ilustrasi Sains PresentasiDokumen16 halamanWarna Warni Ilustrasi Sains Presentasimikaelgobai660Belum ada peringkat
- Teori Asam Basa Modul 6Dokumen4 halamanTeori Asam Basa Modul 6Ito KhikmatullohBelum ada peringkat
- Asam BRDokumen4 halamanAsam BRMuhammad ArisBelum ada peringkat
- Reaksi Asam Basa - Tugas Kelompok 2Dokumen18 halamanReaksi Asam Basa - Tugas Kelompok 2Dzakiyyah RaharjoBelum ada peringkat
- Teori Asam Basa Bronsted LewisDokumen4 halamanTeori Asam Basa Bronsted LewisR Yayang Yulia LizaBelum ada peringkat
- Asam BasaDokumen17 halamanAsam BasaIne KeBelum ada peringkat
- Asam Dan BasaDokumen19 halamanAsam Dan BasaGilang AditiyaBelum ada peringkat
- Teori Asam BasaDokumen5 halamanTeori Asam BasaMeilisa WulandariBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaEnggar WahyuBelum ada peringkat
- Teori Asam-BasaDokumen5 halamanTeori Asam-BasaHasan NyambeBelum ada peringkat
- Makalah Asam Basa SukrisnoDokumen27 halamanMakalah Asam Basa SukrisnoSukrisno SyukriBelum ada peringkat
- Contoh Laporan Praktikum Kimia (Subbab Pengujian PH)Dokumen14 halamanContoh Laporan Praktikum Kimia (Subbab Pengujian PH)VericoBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaYola EfriantiBelum ada peringkat
- Tugas KimiaDokumen18 halamanTugas Kimiajaybreaker764Belum ada peringkat
- ASam BasaDokumen26 halamanASam BasaJoel Pandy100% (1)
- Makalah Asam BasaDokumen18 halamanMakalah Asam BasaAgung AntaraniBelum ada peringkat
- Kunci Jawaban LKPDDokumen1 halamanKunci Jawaban LKPDLiyaAlBrhBelum ada peringkat
- A.Pengertian Asam Basa, Sifat, TeoriDokumen6 halamanA.Pengertian Asam Basa, Sifat, TeoriAmerika SerikatBelum ada peringkat
- TEORI ASAM BASA - Kelompok 3Dokumen23 halamanTEORI ASAM BASA - Kelompok 3Frida AprillaBelum ada peringkat
- Teori Asam Basa Menurut Arrhenius, Bronsted LowryDokumen10 halamanTeori Asam Basa Menurut Arrhenius, Bronsted LowryMcReczs RistantoBelum ada peringkat
- Kuis Asam-BasaDokumen2 halamanKuis Asam-BasadiansaBelum ada peringkat
- Teori Asam Basa Bronsted LowryDokumen10 halamanTeori Asam Basa Bronsted LowryTjokorda Istri Agung Dwi PradnyaniBelum ada peringkat
- Laporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Dokumen18 halamanLaporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Chandini Rut YapnoBelum ada peringkat
- Kimia Analitik PDF 1Dokumen7 halamanKimia Analitik PDF 1noviahergianiBelum ada peringkat
- Asam BasaDokumen3 halamanAsam BasatauramuhammadarieffiandaraBelum ada peringkat
- RANGKUMAN Bab Asam-BasaDokumen12 halamanRANGKUMAN Bab Asam-BasaAlvan BernalynBelum ada peringkat
- Teori Asam BasaDokumen4 halamanTeori Asam Basaberkas abdulhafidBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaAnggi WahyuBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaAzizahnurbewiBelum ada peringkat
- Reaksi Asam Basa - Group e 1Dokumen12 halamanReaksi Asam Basa - Group e 1MUH. ROIHAN WIRAYUDABelum ada peringkat
- Teori Asam BasaDokumen5 halamanTeori Asam BasaAsniya WatiBelum ada peringkat
- Kelompok 6 Teori Archenius Untuk Disosiasi ArcheniusDokumen13 halamanKelompok 6 Teori Archenius Untuk Disosiasi ArcheniusGlenn MochmmadBelum ada peringkat
- Ionisasi Asam Kuat Dan PHDokumen13 halamanIonisasi Asam Kuat Dan PHErna LibyaBelum ada peringkat
- Kimia Unit 2Dokumen19 halamanKimia Unit 2AndinurlindasariBelum ada peringkat
- Uraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373Dokumen20 halamanUraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373lenrokmartdwi23Belum ada peringkat
- Rangkuman Asam Basa 2021Dokumen8 halamanRangkuman Asam Basa 2021Diva Intan AafiyahBelum ada peringkat
- 05 Teori Asam BasaDokumen16 halaman05 Teori Asam BasaDesi WulansariBelum ada peringkat
- Teori Asam-BasaDokumen1 halamanTeori Asam-BasaputriyazBelum ada peringkat
- 3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaDokumen7 halaman3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaAnonymous 2h42EJ7YBBelum ada peringkat
- Asam Basa RensiDokumen10 halamanAsam Basa Rensilinda djaraBelum ada peringkat
- 07 Bab6Dokumen26 halaman07 Bab6JalaludinBelum ada peringkat
- Makalah Muh IlhamDokumen12 halamanMakalah Muh IlhamMuh IlhamBelum ada peringkat
- Makalah Asam BasaDokumen28 halamanMakalah Asam BasaBunda FykriBelum ada peringkat
Teori Asam
Teori Asam
Diunggah oleh
ovi saputra astamaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Teori Asam
Teori Asam
Diunggah oleh
ovi saputra astamaHak Cipta:
Format Tersedia
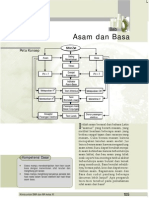
Teori Asam-Basa
Teori Asam Dan Basa
Teori ini terbagi menjadi beberapa ahli yaitu sebagai berikut ini:
Teori menurut Arrhenius
Pada tahun 1884, ia adalah seorang ilmuwan Swedia yang bernama Avante Arrhenius yang
mengemukakan teori Asam-Basa berdasarkan reaksi ionisasi.yang menjelaskan bahwa jika suatu
senyawa yang menghasilkan ion H+ jika dilarutkan dalam Air maka larutan senyawa tersebut
bersifat Asam,sedangkan jika suatu senyawa yang menghasilkan ionOH- jika dilarutkan dalam Air
maka larutan senyawa tersebut bersifat Basa.
Contoh Reaksi:
HCl => H + + Cl NaOH => Na + + OH -
Teori menurut Bronsted-Lowry
Pada tahun 1923, kedua tokoh ini adalah seorang ilmuan Denmark yang bernama Johannes
Bronsted dan ilmuan inggris yang bernamaThomas Lowry yang mengemukakan teori Asam-Basa
berdasarkan serah-terima proton [H+]. Mereka menjelaskan bahwa, jika suatu zat yang memberikan
proton [H+] atau Donor ion [H+],maka larutan zat tersebut bersifat Asam,sedangkan jika suatu zat
yang menerima proton [H+] atau Akseptor ino [H +], maka larutan zat tersebut bersifat Basa.
Contoh Reaksi
NH + H O <=> NH
3
+ OH
NH (sebagai Basa) + H O (sebagai Asam) <=> NH
+ OH (sebagai Basa)
H O dan OH adalah pasangan asam konjungasi.
3
(sebagai Asam)
NH dan NH adalah pasangan asam basa konjungasi.
3
Teori menurut Lewis
Pada tahun 1938, ia adalah seorang ilmuan Amerika Serikat, Gilbert Newton Lewis yang
mengusulkan pengertian Asam-Basa berdasarkan reaksi serah-terima elektron. ia menjelaskan
bahwa. jika suatu zat yang dapat menerima pasanganan elektron (Akseptor) maka larutan zat
tersebut bersifat Asam, sedangkan jika suatu zat yang dapat memberi pasangan
elektron (Donor) maka larutan zat tersebut bersifat Basa.
Contoh Reaksi
senyawa NH3 memberikan sepasang elektron pada senyawa BF3, sehingga BF3 sebagai asam lewis
dan NH3 sebagai basa lewis.
Anda mungkin juga menyukai
- Teori Asam BasaDokumen6 halamanTeori Asam BasaWayan WahyuBelum ada peringkat
- Teori Asam PrintDokumen9 halamanTeori Asam Printtiara kasihBelum ada peringkat
- Penelitian Kimia 2Dokumen15 halamanPenelitian Kimia 2R e a l d iBelum ada peringkat
- Teori Asam Basa Menurut para AhliDokumen8 halamanTeori Asam Basa Menurut para AhlimuhammadfauziladhimBelum ada peringkat
- Asam BasaDokumen20 halamanAsam BasawahyuBelum ada peringkat
- Asam Basa MattDokumen8 halamanAsam Basa MattDaus ElitBelum ada peringkat
- Teori Asam BasaDokumen12 halamanTeori Asam BasaMuhammad NusaBelum ada peringkat
- Laporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaDokumen12 halamanLaporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaayinBelum ada peringkat
- Asam Basa Raihan Baihaqi 17 XIMipa7Dokumen2 halamanAsam Basa Raihan Baihaqi 17 XIMipa7Raihan BaihaqiBelum ada peringkat
- Jurnal3 AndreansyahDwiPratama 191910801017 Kel8Dokumen16 halamanJurnal3 AndreansyahDwiPratama 191910801017 Kel8Reyhan AdfriansyahBelum ada peringkat
- Dasar2 RX AnorgBAB IVDokumen51 halamanDasar2 RX AnorgBAB IVSitti hanafiahBelum ada peringkat
- Perkembangan Konsep Asam BasaDokumen4 halamanPerkembangan Konsep Asam BasaMeilinda HandayaniBelum ada peringkat
- Makalah Larutan Asam Dan BasaDokumen15 halamanMakalah Larutan Asam Dan BasaAndrea Rootz OnlyskyproBelum ada peringkat
- Pengertian Asam Basa Menurut ArrheniusDokumen1 halamanPengertian Asam Basa Menurut ArrheniusNadilla RahmahBelum ada peringkat
- Arabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumDokumen4 halamanArabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumBellaBelum ada peringkat
- Reaksi Reaksi KimiaDokumen31 halamanReaksi Reaksi KimiaIrji Rizqi SabilaBelum ada peringkat
- Warna Warni Ilustrasi Sains PresentasiDokumen16 halamanWarna Warni Ilustrasi Sains Presentasimikaelgobai660Belum ada peringkat
- Teori Asam Basa Modul 6Dokumen4 halamanTeori Asam Basa Modul 6Ito KhikmatullohBelum ada peringkat
- Asam BRDokumen4 halamanAsam BRMuhammad ArisBelum ada peringkat
- Reaksi Asam Basa - Tugas Kelompok 2Dokumen18 halamanReaksi Asam Basa - Tugas Kelompok 2Dzakiyyah RaharjoBelum ada peringkat
- Teori Asam Basa Bronsted LewisDokumen4 halamanTeori Asam Basa Bronsted LewisR Yayang Yulia LizaBelum ada peringkat
- Asam BasaDokumen17 halamanAsam BasaIne KeBelum ada peringkat
- Asam Dan BasaDokumen19 halamanAsam Dan BasaGilang AditiyaBelum ada peringkat
- Teori Asam BasaDokumen5 halamanTeori Asam BasaMeilisa WulandariBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaEnggar WahyuBelum ada peringkat
- Teori Asam-BasaDokumen5 halamanTeori Asam-BasaHasan NyambeBelum ada peringkat
- Makalah Asam Basa SukrisnoDokumen27 halamanMakalah Asam Basa SukrisnoSukrisno SyukriBelum ada peringkat
- Contoh Laporan Praktikum Kimia (Subbab Pengujian PH)Dokumen14 halamanContoh Laporan Praktikum Kimia (Subbab Pengujian PH)VericoBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaYola EfriantiBelum ada peringkat
- Tugas KimiaDokumen18 halamanTugas Kimiajaybreaker764Belum ada peringkat
- ASam BasaDokumen26 halamanASam BasaJoel Pandy100% (1)
- Makalah Asam BasaDokumen18 halamanMakalah Asam BasaAgung AntaraniBelum ada peringkat
- Kunci Jawaban LKPDDokumen1 halamanKunci Jawaban LKPDLiyaAlBrhBelum ada peringkat
- A.Pengertian Asam Basa, Sifat, TeoriDokumen6 halamanA.Pengertian Asam Basa, Sifat, TeoriAmerika SerikatBelum ada peringkat
- TEORI ASAM BASA - Kelompok 3Dokumen23 halamanTEORI ASAM BASA - Kelompok 3Frida AprillaBelum ada peringkat
- Teori Asam Basa Menurut Arrhenius, Bronsted LowryDokumen10 halamanTeori Asam Basa Menurut Arrhenius, Bronsted LowryMcReczs RistantoBelum ada peringkat
- Kuis Asam-BasaDokumen2 halamanKuis Asam-BasadiansaBelum ada peringkat
- Teori Asam Basa Bronsted LowryDokumen10 halamanTeori Asam Basa Bronsted LowryTjokorda Istri Agung Dwi PradnyaniBelum ada peringkat
- Laporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Dokumen18 halamanLaporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Chandini Rut YapnoBelum ada peringkat
- Kimia Analitik PDF 1Dokumen7 halamanKimia Analitik PDF 1noviahergianiBelum ada peringkat
- Asam BasaDokumen3 halamanAsam BasatauramuhammadarieffiandaraBelum ada peringkat
- RANGKUMAN Bab Asam-BasaDokumen12 halamanRANGKUMAN Bab Asam-BasaAlvan BernalynBelum ada peringkat
- Teori Asam BasaDokumen4 halamanTeori Asam Basaberkas abdulhafidBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaAnggi WahyuBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaAzizahnurbewiBelum ada peringkat
- Reaksi Asam Basa - Group e 1Dokumen12 halamanReaksi Asam Basa - Group e 1MUH. ROIHAN WIRAYUDABelum ada peringkat
- Teori Asam BasaDokumen5 halamanTeori Asam BasaAsniya WatiBelum ada peringkat
- Kelompok 6 Teori Archenius Untuk Disosiasi ArcheniusDokumen13 halamanKelompok 6 Teori Archenius Untuk Disosiasi ArcheniusGlenn MochmmadBelum ada peringkat
- Ionisasi Asam Kuat Dan PHDokumen13 halamanIonisasi Asam Kuat Dan PHErna LibyaBelum ada peringkat
- Kimia Unit 2Dokumen19 halamanKimia Unit 2AndinurlindasariBelum ada peringkat
- Uraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373Dokumen20 halamanUraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373lenrokmartdwi23Belum ada peringkat
- Rangkuman Asam Basa 2021Dokumen8 halamanRangkuman Asam Basa 2021Diva Intan AafiyahBelum ada peringkat
- 05 Teori Asam BasaDokumen16 halaman05 Teori Asam BasaDesi WulansariBelum ada peringkat
- Teori Asam-BasaDokumen1 halamanTeori Asam-BasaputriyazBelum ada peringkat
- 3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaDokumen7 halaman3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaAnonymous 2h42EJ7YBBelum ada peringkat
- Asam Basa RensiDokumen10 halamanAsam Basa Rensilinda djaraBelum ada peringkat
- 07 Bab6Dokumen26 halaman07 Bab6JalaludinBelum ada peringkat
- Makalah Muh IlhamDokumen12 halamanMakalah Muh IlhamMuh IlhamBelum ada peringkat
- Makalah Asam BasaDokumen28 halamanMakalah Asam BasaBunda FykriBelum ada peringkat