Pencegahan Enzimatis Wulan
Diunggah oleh
Wulan R AuliaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pencegahan Enzimatis Wulan
Diunggah oleh
Wulan R AuliaHak Cipta:
Format Tersedia
Wulan Rizqianti Aulia
240210150003
IV.
HASIL PENGAMATAN DAN PEMBAHASAN
Praktikum kali ini mengenai cara pencegahan pencoklatan enzimatis. Enzim
adalah substansi yang dihasilkan oleh sel-sel hidup dan beperan sebagai katalisator
pada reaksi kimia yang berlangsung dalam organisme. Katalisator adalah substansi
yang mempercepat reaksi tetapi pada hasil reaksi, substansi tersebut tidak berubah
(Gaman & Sherrington, 1994). Fungsi suatu enzim adalah sebagai katalis untuk
proses biokimia yang terjadi dalam sel maupun di luar sel. Suatu enzim dapat
mempercepat reaksi 108 sampai 1011 kali lebih cepat daripada apabila reaksi tersebut
dilakukan tanpa katalis. Jadi enzim dapat berfungsi sebagai katalis yang sangat
efisien, di samping itu mempunyai derajat kekhasan yang tinggi (Poedjiadi, 1994).
Adanya enzim dalam bahan pangan seperti sayur dan buah dapat
menyebabkan perubahan yang dikehendaki maupun perubahan yang tidak
dikehendaki. Perubahan yang dikehendaki seperti pada reaksi pencoklatan enzimatis
pada produk yang dipanggang seperti biji kopi,sedangkan perubahan perubahan yang
tidak dikehendaki misalnya pada pemutihan sayuran. Enzim yang biasanya ada dalam
produk sayur dan buah ini misalnya enzim katalase dan enzim peroksidase.
Menurut Tjahjadi (2008), enzim katalase dan peroksidase yang bersifat heatresistant dalam buah-buahan dan sayuran, dapat menimbulkan perubahan yang tidak
dikehendaki selama masa penyimpanan. Perubahan-perubahan tersebut dapat dicegah
dengan cara menekan aktivitas enzim yang terjadi dalam bahan. Cara yang lazim
dilakukan untuk inaktivasi enzim tersebut adalah dengan melakukan blansing buahbuahan dan sayur-sayuran tersebut atau dengan penambahan asam dan basa sebelum
diproses lebih lanjut.
Menurut Winarno (2004), kerja enzim dipengaruhi oleh beberapa faktor, yaitu
substrat, susu, keasaman, kofaktor, dan inhibitor. Enzim lengkap disebut holoenzim,
bagian protein, apoenzim; dan bagian nonprotein, kofaktor. Senyawa yang diubah
dalam reaksi yang dikatalisis enzim disebut substrat. Tiap enzim memerlukan suhu
dan pH (tingkat keasaman) optimum yang berbeda-beda karena enzim adalah protein,
yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Jika suhu
Wulan Rizqianti Aulia
240210150003
dan pH tidak sesuai, maka enzim tidak dapat bekerja secara optimal atau strukturnya
akan mengalami kerusakan. Hal ini akan menyebabkan enzim kehilangan fungsinya.
Cara pencegahan pencoklatan enzimatis yang dilakukan pada praktikum kali ini ada 3
jenis pengujian, yaitu pencegahan pencoklatan enzimatis dengan mengurangi kontak
dengan peralatan pengolahan besi, pencegahan pencolatan enzimatis dengan cara
mengurangi kontak dengan oksigen, dan pencegahan pencolatan enzimatis dengan
cara menonaktifkan enzim polifenoloksidase. Sampel yang digunakan dalam
praktikum ini adalah apel, pir, terong, kentang, dan pisang.
4.1
Pencegahan Pencoklatan Enzimatis dengan Mengurangi Kontak dengan
Peralatan Pengolahan Pangan
Pengujian yang pertama dilakukan dalam praktikum ini adalah pencegahan
dengan mengurangi kontak dengan perlatan pengolahan pangan yang berupa pisau
besi dan pisau stainless steel. Bahan pangan seperti sayuran dan buah-buahan adalah
bahan pangan yang mudah rusak, misalnya karena dibiarkan di udara terbuka atau
karena perlakuan mekanis pada saat pengolahan. Menurut Andarwulan & Koswara
(1992), proses pengolahan pangan akan menyebabkan perubahan-perubahan jaringan
pada sayur dan buah. Perubahan ini dikarenakan komposisi yang terkandung dalam
sampel mengalami kerusakan, seperti kandungan vitamin C yang teroksidasi dan
tereduksi sebagai asam dehidroaskorbat secara bersama-sama dan reaksi pencoklatan
enzimatis dimana senyawa fenol yang teroksidasi karena adanya enzim fenolase yang
terjadi akibat bagian buah atau sayuran terluka.
Langkah-langkah yang dilakukan dalam pengujian ini, mula-mula sampel
dicuci kemudian dikupas dan diiris dengan menggunakan 2 buah pisau yang berbeda,
yakni pisau stainless steel dan pisau besi. Selanjutnya didiamkan selama 15 menit
lalu diamati perubahan warna yang terjadi. Berikut adalah hasil pengamatan dari
pengujian yang dilakukan dapat dilihat pada tabel 1:
Tabel 1. Kontak dengan Perlatan Pengolahan Pangan
Sampel
Stainless Steel
Apel
Kuning Kecoklatan +++
Pir
Putih Kecoklatan +
Terong
Putih Bercak Coklat ++
Besi
Kuning Kecoklatan ++++
Putih Kecoklatan ++
Putih Bercak Coklat +
Wulan Rizqianti Aulia
240210150003
Sampel
Kentang
Stainless Steel
Kuning Cerah
Kuning Dengan Bercak
Pisang
Coklat Sedikit
(Sumber: Dokumentasi Pribadi, 2016)
Besi
Kuning Kecoklatan
Kuning Dengan Bercak
Hitam
Berdasarkan tabel 1, semua sampel yang berupa apel, pir, terong, kentang, dan
pisang yang di iris atau dipotong dengan menggunakan pisau stainless steel
menunjukkan warna yang lebih terang atau dengan kata lain tingkat pembentukan
warna coklat (pencoklatan) lebih rendah jika dibandingkan dengan sampel yang di
iris dengan menggunakan pisau besi. Data yang didapat dari hasil pengamatan ini
berarti sudah sesuai dengan literatur, yang menyebutkan bahwa sampel buah
pencoklatannya akan lebih terhambat jika menggunakan alat pengolahan atau
dipotong dengan menggunakan pisau stainless steel.
Perubahan warna sampel yang dipotong dengan menggunakan pisau stainless
steel lebih cerah atau tingkat pencoklatannya lebih rendah karena permukaan untuk
pisau yang terbuat dari stainless steel akan terdapat suatu lapiasam oksida (krom)
yang sangat stabil, sehingga pisau ini tahan terhadap korosi. Sedangkan pisau yang
terbuat dari besi biasa mudah mengalami korosi, dan apabila digunakan dalam
pengupasan akan mengakibatkan bahan mudah mengalami oksidasi menghasilkan
warna coklat (pencoklatan) (Supardi, 1997).
Pendapat ini juga di dukung oleh
Tranggono (1990) yang menyebutkan bahwa pisau besi terbuat dari besi yang
mengandung senyawa Fe3+ dan Cu2+, sedangkan stainless steel terbuat dari baja. Fe3+
dan Cu2+ cenderung lebih reaktif apabila bertemu dengan oksigen dan dapat
mempengaruhi senyawa fenolase dan mempercepat terjadinya pencoklatan pada
buah.
Pencokelatan tersebut juga dapat disebabkan oleh aktivitas kresolase yang
dapat menyebabkan timbulnya protein- tembaga dengan menggabungkan satu atau
lebih molekul oksigen dengan protein tempat atom kupro yang berdampingan terikat (
Margono, 1993). Sampel yang dipotong akan mengalami kerusakan pada
jaringannya, sehingga enzim polifenolase yang menyebabkan pencokelatan akan
lebih cepat bereaksi dengan permukaan bahan. Kemudian enzim polifenolase tersebut
Wulan Rizqianti Aulia
240210150003
akan mengoksidasi senyawa fenol menjadi o-quinone dan melakukan aktivitas
katekolase dimana pada reaksi tersebut melibatkan pengoksidasian dua molekul odifenol menjadi dua molekul o-quinone. Reaksi yang terjadi adalah sebagai berikut :
Protein-Cu+-O2 + monofenol Protein-Cu2+ + o-quinone + H2O
Kemudian senyawa trihidroksi benzene berinteraksi dengan o-quinone
membentuk hidroksiquinone. Hidroksiquinone yang terbentuk akan mengalami
polimerisasi dengan cepat dikonversi menjadi polimer berwarna cokelat merah dan
akhirnya menjadi melanin yang berwarna cokelat (Margono, 1993). Jadi, dapat
disimpulkan bahwa untuk meminimalisir pencoklatan yang terjadi yaitu bisa dengan
menggunakan alat-alat pengolahan yang contohnya pisau stainless steel.
4.2
Pencegahan Pencoklatan Enzimatis dengan Cara Mengurangi Kontak
dengan Oksigen
Pengujian kedua yang dilakukan untuk mencegah pencoklatan enzimatis
adalah dengan cara mengurangi kontak dengan oksigen. Proses pencoklatan enzimatis
akan terjadi apabila adanya reaksi antara enzim fenol oksidase dan oksigen dengan
substrat tersebut. Pada pencoklatan enzimatis seperti pada buah apel dan buah yang
lainnya setelah dikupas disebabkan oleh pengaruh aktivitas enzim Polypenol Oxidase
(PPO), yang dengan bantuan oksigen akan mengubah gugus monophenol menjadi Ohidroksi phenol, yang selanjutnya diubah lagi menjadi O- kuinon yang membentuk
warna coklat (Rahmawati, 2008).
Sampel yang digunakan pada pengujian kali ini juga sama dengan pengujian
sebelumnya yaitu apel, pir, pisang, terong, dan kentang dengan diberi 4 perlakuan
berbeda. Pengujian ini digunakan larutan gula 20%, larutan garam 2,5% dan akuades.
Langkah-langkah yang dilakukan dalam praktikum ini adalah, sampel diiris kemudian
sampel yang telah diiris tersebut dimasukkan ke dalam wadah sterofoam kosong
sebagai kontrol, wadah berisi air, wadah berisi larutan garam 2,5%, dan wadah berisi
larutan gula 20%. Sampel tersebut diletakkan didalam wadah hingga terendam selama
15 menit lalu diamati perubahan warna dan tekstur yang terjadi. Berikut adalah hasil
pengamatan dari pengujian yang dilakukan:
Wulan Rizqianti Aulia
240210150003
Tabel 2. Pencegahan Pencoklatan Enzimatis
dengan Oksigen
Tanpa
Rendam
Sampel
Direndam
Dalam Air
Kuning
Kuning
Apel
Kecoklatan + Kecoklatan +
++
+
Putih
Putih
Pear
Kecoklatan +
Kecoklatan
++
Putih Bercak Putih Bercak
Terong
Coklat ++++
Coklat +++
Kuning
Kuning Cerah
Kentang
Kecoklatan
+++
Kuning
Keputihan
Kuning
Pisang
Sedikit
Keputihan ++
Bercak
Coklat
(Sumber: Dokumentasi pribadi, 2016)
dengan Cara Mengurangi Kontak
Air Garam
2,5%
Air Gula
20%
Kuning Cerah
Kuning
Kecoklatan +
Putih
Putih
Kecoklatan +
+
Putih Bercak Putih Bercak
Coklat +
Coklat ++
Kuning Cerah Kuning Cerah
++++
+++
Kuning
Keputihan ++
+
Kuning
Keputihan ++
++
Berdasarkan hasil pengamatan yang didapat, semua sampel yang diberi
perlakuan dengan tidak di rendam yang digunakan sebagai control mengalami
pencoklatan yang lebih cepat dan warna coklat yang terbentuk juga lebih pekat di
banding dengan sampel yang diberi perlakuan di rendam dalam larutan. Pencoklatan
yang lebih cepat ini terjadi karena, enzim polifenol oksidase yang terdapat dalam
masing-masing sampel bereaksi langsung dengan oksigen yang ada di udara dengan
tidak adanya zat yang dapat menghambat reaksi tersebut sehingga sampel yang tidak
di rendam mengalami pencoklatan yang lebih pekat.
Sampel yang diberi perlakuan dengan di rendam dalam aquades atau air
menunjukkan reaksi pencoklatan tidak begitu terhambat karena pada sampel yang di
uji tetap mengalami perubahan warna meskipun warna coklat yang terbentuk tidak
sepekat warna coklat pada sampel yang di biarkan atau tidak diberi perlakuan
perendaman. Hal ini berarti sudah sesuai dengan literatur, karena sampel dapat
dengan mudah teroksidasi pada udara bebas. Buah atau sayuran akan menjadi coklat
Wulan Rizqianti Aulia
240210150003
apabila kontak dengan udara karena menambah jumlah oksigen yang sebenarnya
secara alami sudah ada dalam jaringan tanaman. (Tranggono, 1990).
Pemberian perlakuan dengan perendaman di larutan garam 2,5% dan larutan
gula 20% menunjukkan reaksi pencoklatan enzimatis dapat terhambat dengan di
tandai oleh warna dari masing-masing sampel yang di rendam dalam ke dua larutan
tersebut tidak menunjukkan perubahan warna menjadi coklat secara signifikan, hanya
beberapa sampel saja yang mengalami perubahan warna menjadi sedikit kecoklatan
dengan perlakuan di rendam menggunakan larutan gula 20%. Semua sampel yang di
rendam menggunakan larutan garam 2,5% dapat di hambat pencoklatan enzimatisnya
karena sampel tetap berwarna cerah sesuai dengan warna khas dari masing-masing
sampel, kecuali pada terong masih ditemukan adanya sedikit bercak coklat. Hasil
pengamatan yang di dapat sudah bisa dikatakan sesuai dengan literatur, karena
menurut Winarno (1997), larutan gula dan larutan garam merupakan salah satu
larutan yang mampu membentuk lapisan pelindung bagi jaringan sayur atau buah
yang telah mengalami kerusakan seperti sayur dan buah yang telah dipotong atau
diiris. Selain itu , larutan gula dapat menurunkan pH lingkungan sehingga enzim PPO
ini menjadi inaktif. Semakin tinggi konsistensi pemanis dalam suatu larutan
menyebabkan
pH
menurun,
hal ini disebabkan
karena
gula mempunyai
sifat coolingeffect. Pendapat ini juga di dukung oleh Tranggono (1990), yang
menyebutkan bahwa campuran antara NaCl/larutan gula dan asam klorogenat serta
fenolase dari sampel akan menghambat enzim yang dihasilkan oleh sayuran atau
buah-buahan. Perlakuan ini menyebabkan pembentukan senyawa dopakrom menjadi
metionin yang berwarna coklat akan berkurang.
Sampel yang direndam dengan larutan gula dan garam, interaksi antara
oksigen dengan permukaan sampel yang luka telah terbatasi secara sempurna.
Sehingga dapat disimpulkan bahwa perendaman sayur dan buah kedalam larutan gula
dan garam lebih efektif menghambat pencokelatan enzimatis karena oksigen
dibandingkan dengan perendaman menggunakan air.
4.3
Pencegahan Pencoklatan Enzimatis dengan Cara Menonaktifkan Enzim
Polifenol Oksidase
Wulan Rizqianti Aulia
240210150003
Cara pencegahan pencoklatan enzimatis yang terakhir adalah dengan
menonaktifkan enzim polifenol oksidase. Pencoklatan enzimatis pada buah-buahan
terjadi karena adanya enzim polifenoloksidase pada bahan yang bereaksi dengan
oksigen (Buta et al., 1999). Untuk mencegah atau meminimalisir terjadinya
pencoklatan enzimatis ini adalah dengan menonaktifkan enzim polifenoloksidase
dengan cara mencampurkan sampel dengan antioksidan, sehingga kontak antara
sampel dan oksigen akan dapat diminimalisir karena dengan penambahan antioksidan
oksigen akan bereaksi dahulu dengan antioksidan tersebut, tidak langsung dengan
sampel. Antioksidan dinyatakan sebagai senyawa yang secara nyata dapat
memperlambat oksidasi, walaupun dalam konsentrasi yang lebih rendah sekalipun
dibandingkan dengan substrat yang dapat dioksidasi. Selain itu, senyawa kompleks
logam juga dapat menginaktifkan enzim dengan mengikat logam yang diperlukan
enzim itu (Buta et al., 1999). Selain itu pencegaha pencoklatan enzimatis dengan
menonaktifkan enzim polifenol oksidase dapat juga dilakukan dengan cara
pemanasan, karena enzim tersebut bersifat heat resistant sehingga ketika dipanaskan
(pemblansingan) secara tidak langsung akan menghambat aktivtas enzim polifenol
oksidase.
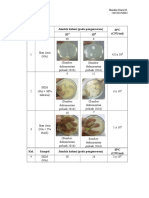
Sampel yang digunakan dalam pengujian ini masih sama dengan ditambahkan
zat antioksidan yang berupa Na-metabisulfit, asam askorbat, dan asam sitrat dan di
uji juga sampel yang tidak di rendam dalam larutan yang ditambahkan zat antioksidan
tersebut untuk dijadikan sebagai kontrol. Langkah-langkah yang dilakukan dalam
praktikum ini adalah sampel diiris, kemudian sampel yang diberi antioksidan sampel
direndam dalam larutan asam sistrat, asam askorbat dan Na-Metabisulfit. Selanjutnya
untuk sampel yang diblansing, sampel direbus dan dikukus selama 3 menit untuk
sayur dan 2 menit untuk buah. Setelah di blansing di rendam dalam air es selama 3
menit untuk menghindari over cook pada sampel. Sampel di diamkan selama 15
menit dan di amati perubahan yang terjadi. Berikut hasil pengamatan yang dilakukan
dapat dilihat pada tabel 3 :
Wulan Rizqianti Aulia
240210150003
Berdasarkan hasil pengamatan yang terdapat dalam tabel 3, sampel yang tidak
diberi perlakuan perendaman ataupun pemblansingan mengalami pencoklatan
enzimatis yang lebih cepat dengan ditandai perubahan warna pada sampel menjadi
lebih coklat karena tidak adanya penghambat aktivitas enzim polifenol oksidase yang
terdapat dalam sampel tersebut sehingga enzim ini kontak langsung dengan udara dan
mempercepat terjadinya reaksi pencoklatan enzimatis. Tekstur dari sampel masih
tetap keras karena tidak diberi perlakuan apa-apa sehingga tidak menimbulkan
perubahan pada tekstur sampel.
Sampel yang diberi perlakuan dengan direndam dalam larutan NaMetabisulfit menunjukkan hasil yang paling optimal karena dapat menghambat
pencoklatan enzimatis pada masing-masing sampel, dimana warna sampel mendekati
warna buah dan sayur sebelumnya saat masih segar meskipun dari beberapa sampel
ada perubahan bercak coklat yang tingkat kepekatan warna coklatnya hanya sedikit
sekali. Hal ini sesuai dengan literatur yaitu Sulfit dapat mencegah pencoklatan baik
enzimatik maupun non enzimatik, melindungi vitamin C dan mempertahankan warna
alami bahan, selain itu juga sulfit murah dan bersifat antiseptik (Eskin, 1990).
Mekanisme penghambatan dengan sulfit merupakan inhibitor paling baik
untuk menghambat pencoklatan enzimatis, adalah dengan cara langsung dan tidak
langsung. Secara langsung yaitu dengan mengikat logam Cu pada enzim. Secara tidak
langsung yaitu dengan cara menghambat oksidasi L-Tyrosin menjadi 3,4
dihydroksiphenylalanine, interaksi dengan quinon menjadi difenol (bentuk semula),
dan mengikat O2. Mekanisme penghambatan sulfit pada proses pencoklatan non
enzimatis adalah dengan menghambat reaksi Mailard, dimana sulfit akan bereaksi
dengan hasil urai gula amino dan mencegah senyawa ini berkondensasi menjadi
melanoidin (de Man,1997). Selain itu sulfit juga dapat bereaksi dengan quinone yang
dihasilkan dari oksidasi senyawa fenolik sehingga menghambat polimerisasi quinon
membentuk pigmen melanin (cokelat). Adanya Na- bisulfit pada sayur dan buah akan
menyebabkan sayur dan buah tampak lebih segar, cerah dan lambat dalam mengalami
Wulan Rizqianti Aulia
240210150003
pencokelatan (Margono, 1993). Sedangkan tekstur dari masing-masing sampel masih
bagus dalam keadaan keras tidak begitu berbeda dengan sampel yang tidak diberi
perlakuan sehingga masih dapat dikatakan segar.
Sampel yang diberi perlakuan perendaman dengan larutan asam askorbat juga
menunjukkan bahwa asam askorbat cukup mencegah terjadinya reaksi pencoklatan
enzimatis namun tidak lebih baik dari Na-metabisulfit dan juga asam sitrat. Hal ini
ditandai dengan perubahan warna dari sampel masih ada yang mengalami perubahan
warna jadi coklat dengan tingkat kepekatan di bawah warna yang terjadi pada sampel
tanpa perlakuan. Hal ini berarti sudah sesuai dengan literatur, karena menurut literatur
pencegahan pencoklatan enzimatis yang paling baik dari urutan yang paling kuat
menghambat sampai yang tidak begitu mengahambat pencoklatan secara berturutturut adalah Na-metabisulfit > Asam sitrat > Asam askorbat. Asam askorbat dalam
percobaan ini merupakan senyawa pereduksi kuat yang bersifat asam di alam,
membentuk garam netral dengan basa, dan memiliki kelarutan air yang tinggi.
Asam askorbat dan garam-garam netral serta turunannya merupakan
antioksidan yang digunakan pada buah-buahan dan sayuran dan juga pada jus buah
untuk pencoklatan dan reaksi oksidatif lainnya. Asam askorbat bertindak sebagai
antioksidan karena oksigen akan mengoksidasi askorbat bukan senyawa fenolik
sehingga dapat menghambat atau menurunkan terjadinya reaksi pencoklatan (Martin,
1994). Mekanisme pengghambatan raksi pencoklatan enzimatis oleh asam askorbat
adalah, bahwa dalam suasana asam, cincin lakton asam dehidroaskorbat terurai secara
irreversible dengan membentuk suatu senyawa diketogulonat (Winarno, 2004).
Vitamin C disebut juga asam askorbat, adalah vitamin yang paling sederhana, mudah
berubah akibat oksidasi, tetapi amat berguna bagi manusia. Struktur kimianya terdiri
dari rantai 6 atom C dan kedudukannya tidak stabil (C6H8O6), karena mudah bereaksi
dengan O2 di udara menjadi asam dehidroaskorbat. Vitamin ini merupakan fresh food
vitamin karena sumber utamanya adalah buah-buahan dan sayuran segar. Berbagai
sumbernya adalah jeruk, brokoli, brussel sprout, kubis, dan lobak (Linder, l992).
Sampel yang diberi perlakuan dengan perendaman dalam larutan asam sitrat
juga menunjukkan bahwa asam sitrat dapat menghambat reaksi pencoklatan enzimatis
Wulan Rizqianti Aulia
240210150003
pada semua sampel dengan di tandai tidak berubahnya warna sampel menjadi coklat
pekat, hanya beberapa sampel saja yang warna nya berubah menjadi bercak coklat.
Warna pada sampel yang diberi perlakuan perendaman asam sitrat ini tidak lebih
cerah jika dibandingkan dengan warna sampel yang diberi perlakuan perendaman
dengan Na-metabisulfit. Hal ini sudah sesuai dengan literatur yang menyebutkan
bahwa penambahan asam sitrat dapat mencegah pencoklatan enzimatis. Asam sitrat
dapat menghambat terjadinya pencoklatan karena dapat mengkompleks ion tembaga
yang dalam hal ini berperan sebagai katalis dalam reaksi pencoklatan. Selain itu,
asam sitrat juga dapat menghambat pencoklatan dengan cara menurunkan pH seperti
halnya pada asam asetat sehingga enzim PPO menjadi inaktif (Winarno, 1992). Asam
sitrat merupakan senyawa intermediet dari asam organik yang berbentuk kristal atau
serbuk putih. Sifat-sifat asam sitrat antara lain: mudah larut dalam air, spiritus, dan
ethanol, tidak berbau, rasanya sangat asam, serta jika dipanaskan akan meleleh
kemudian terurai yang selanjutnya terbakar sampai menjadi arang.
Perlakuan dengan pemblansingan pada sampel menunjukkan perubahan warna
yang diberi perlakuan blansing kukus atau rebus tidak begitu berbeda bisa dikatakan
dalam tingkat warna yang sama. Perlakuan blansing rebus dan blansing kukus juga
menyebabkan perubahan tekstur yang menjadi lebih bila dibandingkan dengan
sampel yang tanpa pemblansingan. Hampir semua sampel yang di blansing dengan
cara kukus memiliki tekstur yang lebih lunak jika dibandingkan dengan sampel yang
di rebus. Sampel yang di rebus menunjukkan tekstur nya masih keras, atau lebih keras
dari sampel yang di kukus. Hal ini tidak sesuai dengan literatur, karena seharusnya
sampel yang di rebus teksturnya lebih lunak dari pada sampel yang dikukus karena
terjadinya kontak langsung antara sayuran dengan medium air panas yang digunakan
untuk merebus, sehingga suhu pemasakan lebih merata. Akibatnya degradasi dinding
sel dan kehilangan sifat turgor sel lebih cepat, sehingga air dapat berdifusi kedalam
sel.
Wulan Rizqianti Aulia
240210150003
V.
5.1
KESIMPULAN DAN SARAN
Kesimpulan
Adapun kesimpulan yang dapat diambil dari praktikum kali ini adalah :
1. Semua sampel yang di beri perlakuan pemotongan dengan pisau stainless steel
dapat mencegah pencoklatan enzimatis karena warna dari masing-masing
sampel masih dikatakan cerah.
2. Semua sampel yang dipotong dengan menggunakan pisau besi mengalami
reaksi pencoklatan enzimatis lebih cepat dengan ditandai perubahan warna
menjadi coklat.
3. Pemberian perlakuan perendaman pada larutan garam 2,5% menunjukkan
dapat menghambat pencoklatan enzimatis dengan mengurangi kontak enzim
dengan oksigen.
4. Pemberian perlakuan perendaman pada larutan gula 20% juga dapat
menghambat pencoklatan enzimatis namun tidak lebih baik dari pada
perendaman dalam larutan garam 2,5%.
5. Sampel yang di rendam dalam larutan Na-metabisulfit dapat mencegah
pencoklatan enzimatis dengan optimal.
6. Urutan kekuatan antioksidan dalam menghambat reaksi pencoklatan enzimatis
dari yang paling kuat sampai paling rendah adalah Na-metabisulfit > asam
sitrat > asam askorbat
7. Pengaruh pemblansingan dengan di kukus dapat melunakan tekstur sampel
seharusnya yang lebih lunak adalah sampel yang diblansing dengan di rebus
karena lebih banyak menyerap air.
5.2
Saran
Prosedur percobaan dilakuakan lebih aspetis lagi agar hasil pengamatan yang
didapat lebih akurat.
Wulan Rizqianti Aulia
240210150003
DAFTAR PUSTAKA
Andarwulan, N., dan Koswara, S. 1992. Kimia Vitamin. Rajawali Press, Jakarta.
Buta, G. J., Moline, H. E., Spaulding, D. W., & Wang, C. Y. 1999. Extending storage
life of fresh-cut apples using natural products and their derivatives. Journal of
Agricultural and Food Chemistry, 47, 16.
DeMann, J.M.1997. Kimia Makanan. Edisi kedua. Penerbit ITB, Bandung.
Eskin, N. A.M. 1990. Biochemistry of Foods. Edisi II. Academic Press, New York.
Gaman dan Sherrington. 1994. Ilmu Pangan: Pengantar Ilmu Pangan, Nutrisi dan
Mikrobiologi. Gadjah Mada University Press, Yogyakarta.
Linder, M.C. l992. Biokimia Nutrisi dan Metabolisme dengan Pemekaian Secara
Klinis. UI Press, Jakarta.
Margono, T dkk. 1993. Buku Panduan Teknologi Pangan. Pusat Informasi Wanita
dalam Pembangunan PDII-LIPI, Jakarta.
Martin, P. 1994. Food Science and Technology. Instructional Materials Laboratory,
Columbia.
Supardi, R., 1997, Korosi, Penerbit Tarsito, Bandung.
Tjahjadi, Carmencita. 2008. Pengantar Teknologi Pangan (Volume I). Jurusan
Teknologi Industri Pangan. Fakultas Teknologi Industri Pertanian. Universitas
Padjadjaran, Bandung.
Tranggono dan Sutardi. 1990. Biokimia dan Teknologi Pascapanen. Pusat Antar
Universitas-pangan dan Gizi. Universitas Gajah Mada, Yogyakarta.
Winarno, F.G. 1992. Kimia Pangan dan Gizi. PT Gramedia Pustaka Utama, Jakarta.
Winarno, F.G. 1997. Kimia Pangan dan Gizi. PT Gramedia Pustaka Utama, Jakarta.
Winarno F.G. 2004.Kimia Pangan dan Gizi.PT Gramedia Pustaka Utama. Jakarta.
Anda mungkin juga menyukai
- ACARA IV KimpangDokumen18 halamanACARA IV KimpangnoorarifahBelum ada peringkat
- Laprak 7-Sifat OptikDokumen5 halamanLaprak 7-Sifat OptikShafira Aulia RahmahBelum ada peringkat
- Pembahasan TermodurikDokumen6 halamanPembahasan TermodurikGhina KhoerunisaBelum ada peringkat
- Uji HedonikDokumen6 halamanUji HedonikAyud PratiwiBelum ada peringkat
- Pigmen Pada Tanaman PDFDokumen10 halamanPigmen Pada Tanaman PDFRezkyBelum ada peringkat
- Pengaruh Pembekuan terhadap Tekstur PanganDokumen2 halamanPengaruh Pembekuan terhadap Tekstur PanganAmanda Rizky PutriBelum ada peringkat
- Bismillah Latihan RancidityDokumen12 halamanBismillah Latihan RancidityAprillia Trinanda KartikaBelum ada peringkat
- Kuring Daging - Kelompok 2Dokumen14 halamanKuring Daging - Kelompok 2Farahnaz MustikaBelum ada peringkat
- Pemanfaatan Limbah Udang (Penaeus SP) Sebagai Alternatif Bahan Pengolahan Kerupuk Untuk Mengurangi Resiko Pencemaran LingkunganDokumen10 halamanPemanfaatan Limbah Udang (Penaeus SP) Sebagai Alternatif Bahan Pengolahan Kerupuk Untuk Mengurangi Resiko Pencemaran LingkunganRajis AdityaBelum ada peringkat
- 1886 2605 1 PBDokumen6 halaman1886 2605 1 PBEcha ChacaBelum ada peringkat
- KADAR PROTEIN IKAN LELEDokumen78 halamanKADAR PROTEIN IKAN LELEAji BayuBelum ada peringkat
- Pengaruh Iradiasi Pada Komponen Otot IkanDokumen9 halamanPengaruh Iradiasi Pada Komponen Otot IkanYuslita RinikaBelum ada peringkat
- AflatoksinDokumen12 halamanAflatoksinLutfi ChabibBelum ada peringkat
- RUMPUTLAUTDokumen17 halamanRUMPUTLAUTMuflihatun NajmiaBelum ada peringkat
- MemperpanjangUmurSimpanDokumen31 halamanMemperpanjangUmurSimpanBayu AirlanggaBelum ada peringkat
- Food Fraud - En.idDokumen44 halamanFood Fraud - En.idgede aris prayoga mahardikaBelum ada peringkat
- GULADokumen19 halamanGULASebastian RussarkBelum ada peringkat
- Pembuatan Jam Dan JellyDokumen14 halamanPembuatan Jam Dan JellyMonika Gitarani AndriyanaBelum ada peringkat
- OPTIMASI DAGINGDokumen24 halamanOPTIMASI DAGINGDina Andrasyifa100% (1)
- TM + Laporan LKP Praktikum PasterurisasiDokumen34 halamanTM + Laporan LKP Praktikum PasterurisasiReza Luckyvianto RamadhanBelum ada peringkat
- Uji Aktivitas EnzimDokumen35 halamanUji Aktivitas EnzimIlham Eka SaputraBelum ada peringkat
- SELAI BUAH NAGA PEPAYADokumen51 halamanSELAI BUAH NAGA PEPAYAJonathanBelum ada peringkat
- Variasi Penggunaan Karagenan Dan Lama Ekstraksi Bunga TuriDokumen11 halamanVariasi Penggunaan Karagenan Dan Lama Ekstraksi Bunga Turirosa ratna dewiBelum ada peringkat
- Penggunaan Enzim PektinaseDokumen10 halamanPenggunaan Enzim PektinaseDaniall AbdanBelum ada peringkat
- Materi 2 Food Bar AtunDokumen6 halamanMateri 2 Food Bar AtunAthundd CucoBelum ada peringkat
- Laporan Ki Aphp 23Dokumen18 halamanLaporan Ki Aphp 23bootplayer072Belum ada peringkat
- Fenita Miati - MikroPeng Tugas 1Dokumen3 halamanFenita Miati - MikroPeng Tugas 1mahfuzatulkhairani2011122030Belum ada peringkat
- Jurnal HACCp PDFDokumen8 halamanJurnal HACCp PDFMuhammad RahmanBelum ada peringkat
- LAPORAN Analisis Mutu Mikrobiologi Pangan Pada REMPAHDokumen32 halamanLAPORAN Analisis Mutu Mikrobiologi Pangan Pada REMPAHRico Fernando Theo100% (3)
- Pengalengan Kornet Kelompok 4Dokumen16 halamanPengalengan Kornet Kelompok 4Lilik ZakiyaBelum ada peringkat
- Mempelajari Perubahan Tekstur MakananDokumen15 halamanMempelajari Perubahan Tekstur MakananAlfiNurfauziahBelum ada peringkat
- ROASTINGDokumen34 halamanROASTINGYoga Adi PrasetyoBelum ada peringkat
- Review Jurnal Kotak PendinginDokumen3 halamanReview Jurnal Kotak PendinginYudi WahyudiBelum ada peringkat
- Manajemen Industri PanganDokumen5 halamanManajemen Industri PanganNaylaBelum ada peringkat
- Teknologi Pemasakan Ekstrusi PDFDokumen16 halamanTeknologi Pemasakan Ekstrusi PDFWahyudiBandhaBelum ada peringkat
- Kel2 - Mixing Dan HomogenisasiDokumen6 halamanKel2 - Mixing Dan HomogenisasiRatri RestiBelum ada peringkat
- UGM WIDE-v1Dokumen28 halamanUGM WIDE-v1Falla NisyaBelum ada peringkat
- TM ProteinDokumen11 halamanTM ProteinLusio Erian Pradana PutraBelum ada peringkat
- Pembahasan Daging KornetDokumen3 halamanPembahasan Daging KornetanataamaliaBelum ada peringkat
- Laporan Amami Maninggar P27834012021 2007Dokumen39 halamanLaporan Amami Maninggar P27834012021 2007Maning ManinggarBelum ada peringkat
- Bakteri Ikan AsinDokumen10 halamanBakteri Ikan AsinShaskianrlBelum ada peringkat
- 723 2087 2 PBDokumen8 halaman723 2087 2 PBJill DagreatBelum ada peringkat
- Formulasi Optimal Bandrek SerbukDokumen101 halamanFormulasi Optimal Bandrek SerbukBagus WicaksonoBelum ada peringkat
- Laporan Praktikum 5Dokumen21 halamanLaporan Praktikum 5Viara ReginaBelum ada peringkat
- Chilling Dan Pembekuan Daging Dan Efeknya PADA KUALITAS DagingDokumen19 halamanChilling Dan Pembekuan Daging Dan Efeknya PADA KUALITAS DaginganggitBelum ada peringkat
- Laporan TADokumen6 halamanLaporan TAyermiaBelum ada peringkat
- ASEPTIS PACKAGINGDokumen38 halamanASEPTIS PACKAGINGWind Si PurpleBelum ada peringkat
- Laporan PANG4423Dokumen41 halamanLaporan PANG4423Andreas ChandraBelum ada peringkat
- Proses Thermal Pangan #1Dokumen22 halamanProses Thermal Pangan #1ANBelum ada peringkat
- Laporan Kerja Praktek PT Agro (39Dokumen5 halamanLaporan Kerja Praktek PT Agro (39Rival GustianBelum ada peringkat
- Pengaruh Kemasan dan Volume Ketan pada Fermentasi dan Mutu Tape KetanDokumen107 halamanPengaruh Kemasan dan Volume Ketan pada Fermentasi dan Mutu Tape KetanImage WatanabeBelum ada peringkat
- 1 Pengujian Sanitasi Udara Dan Ruangan PDFDokumen7 halaman1 Pengujian Sanitasi Udara Dan Ruangan PDFNur Aini IktikhafsariBelum ada peringkat
- Materi SenyawaDokumen7 halamanMateri SenyawaAnis Dwi AgustinBelum ada peringkat
- Uji Kualitas SusuDokumen17 halamanUji Kualitas SusuRatna SalsabielaBelum ada peringkat
- 8837 - SNI 7953-2014 Kunyit PDFDokumen12 halaman8837 - SNI 7953-2014 Kunyit PDFFadli IkhsanBelum ada peringkat
- Haccp Workbook Kel 5Dokumen12 halamanHaccp Workbook Kel 5Lathifah JungBelum ada peringkat
- Enzim Kimpang GHEADokumen11 halamanEnzim Kimpang GHEAresresfirBelum ada peringkat
- Pencoklatan Besi & Stailess LalaDokumen19 halamanPencoklatan Besi & Stailess LalaYolla Cahya ApischaBelum ada peringkat
- Laporan EnzimDokumen11 halamanLaporan EnzimSherry NovaliaBelum ada peringkat
- Pencegahan PencoklatanDokumen19 halamanPencegahan PencoklatanYolla Cahya ApischaBelum ada peringkat
- Haspeng Sabu Fermentasi A1 FixDokumen4 halamanHaspeng Sabu Fermentasi A1 FixWulan R AuliaBelum ada peringkat
- Dasar Pastry untuk Profesi PerhotelanDokumen209 halamanDasar Pastry untuk Profesi PerhotelanRadhin Wijaya Rahman100% (3)
- Makala H Per Sagi Cookies in DoDokumen6 halamanMakala H Per Sagi Cookies in DoWulan R AuliaBelum ada peringkat
- Kbli 2015 PDFDokumen566 halamanKbli 2015 PDFGeorge Cobra100% (1)
- Diagram Alir Pembuatan Tempe1Dokumen2 halamanDiagram Alir Pembuatan Tempe1Rosi Mauliana100% (1)
- Laprak Sabu 5Dokumen23 halamanLaprak Sabu 5Wulan R AuliaBelum ada peringkat
- 104 199 1 PB PDFDokumen11 halaman104 199 1 PB PDFWulan R AuliaBelum ada peringkat
- Bab I IV Atau V Daftar PustakaDokumen43 halamanBab I IV Atau V Daftar PustakaWulan R AuliaBelum ada peringkat
- 104 199 1 PBDokumen64 halaman104 199 1 PBWulan R AuliaBelum ada peringkat
- Optimized Cookies PembuatanDokumen17 halamanOptimized Cookies PembuatanWulan R AuliaBelum ada peringkat
- Haspeng Kue Jentik DGN TP KompositDokumen1 halamanHaspeng Kue Jentik DGN TP KompositWulan R AuliaBelum ada peringkat
- Laprak Sensori 2Dokumen16 halamanLaprak Sensori 2Wulan R AuliaBelum ada peringkat
- Rule of LawDokumen14 halamanRule of LawWulan R AuliaBelum ada peringkat
- DEMOKRASIDokumen18 halamanDEMOKRASIRafi Farhan AbdillahBelum ada peringkat
- Praktikum Teknologi Pengolahan Daging Dan IkanDokumen5 halamanPraktikum Teknologi Pengolahan Daging Dan IkanWulan R AuliaBelum ada peringkat
- Filsafat Pancasila Dan Identitas NasionalDokumen13 halamanFilsafat Pancasila Dan Identitas NasionalWulan R AuliaBelum ada peringkat
- Format Penilaian Tugas Buku Prabu Unpad 2017Dokumen15 halamanFormat Penilaian Tugas Buku Prabu Unpad 2017Wulan R AuliaBelum ada peringkat
- Hasil Pengamatan Uji Pasangan Dan Rangsangan TunggalDokumen3 halamanHasil Pengamatan Uji Pasangan Dan Rangsangan TunggalWulan R AuliaBelum ada peringkat
- CoverDokumen1 halamanCoverWulan R AuliaBelum ada peringkat
- Cover 4Dokumen1 halamanCover 4Wulan R AuliaBelum ada peringkat
- Tujuan CoverDokumen2 halamanTujuan CoverWulan R AuliaBelum ada peringkat
- BAB I PendahuluanDokumen18 halamanBAB I PendahuluanWulan R AuliaBelum ada peringkat
- Pemeliharaan KulturDokumen20 halamanPemeliharaan KulturWulan R AuliaBelum ada peringkat
- Presentasi Determining ThresholdDokumen15 halamanPresentasi Determining ThresholdWulan R AuliaBelum ada peringkat
- Latar BelakangDokumen8 halamanLatar BelakangWulan R AuliaBelum ada peringkat
- OPTIMIZASI KINETIKA ENZIMDokumen55 halamanOPTIMIZASI KINETIKA ENZIMWulan R AuliaBelum ada peringkat
- JENIS ADONAN MAKANANDokumen33 halamanJENIS ADONAN MAKANANWulan R AuliaBelum ada peringkat
- BAB I PendahuluanDokumen18 halamanBAB I PendahuluanWulan R AuliaBelum ada peringkat
- Pendahuluan: 1.1 Latar BelakangDokumen9 halamanPendahuluan: 1.1 Latar BelakangWulan R AuliaBelum ada peringkat
- New Microsoft Word DocumentDokumen33 halamanNew Microsoft Word DocumentWulan R AuliaBelum ada peringkat