Amina
Diunggah oleh
Gita Wulandari0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
17 tayangan8 halamanAMINA
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniAMINA
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
17 tayangan8 halamanAmina
Diunggah oleh
Gita WulandariAMINA
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 8
Reaksi Hidrolisis terjadi ketika suatu asam bertemu dengan basa yang akan
menghasilkan garam dan air yang merubah pH dari campuran tersebut. Dalam reaksi
hidrolisis, terjadi penarikan H+ dan OH- dari senyawa asam dan basa. H+ dan OH- berikatan
menjadi air. Sedangkan pembentuk senyawa asam dan basa yang lain bersatu membentuk
dari garam campuran asam basa tersebut. Garam tersebut dapat bersifat asam atau basa atau
netral tergantung dari sifat sifat para campurannya apakan asam kuat, asam lemah, basa
kuat, basa lemah.
AMINA
Amina adalah turunan amoniak, dimana 1 atom H atau
lebih diganti dengan
gugus alkil (R), aril, hidroatil atau heterosiklik. Ada tiga
macam amina yaitu :
Amina primer
anilin 1- aminoantraquinon
amina sekunder
difenil amina dimetilamina
amina tersier
Proses pembentukan amina
dapat dilakukan
dengan dua macam cara, yaitu:
1. aminasi secara reduksi : yaitu
proses
pembuatan amina berdasarkan
reaksi
reduksi
2. amonolisis : yaitu proses
pembuatan
amina dari reaksi dengan amonia.
Zat yang dapat direduksi adalah
senyawa-senyawa
yang telah mengandung atom N,
yaitu :
1. Senyawa nitro (R-NO2)
2. Senyawa nitroso (R-NO)
3. Senyawa hidroksilamin (R-NH-OH)
4. Senyawa hidraso (R-NH-NH-R)
5. Senyawa azoxybenzena (R-NH-
NO-R)
6. Senyawa nitril (R-CN), azida,
amida (RCO-NH2)
Zat-zat yang digunakan sebagai
pereduksi adalah :
1. Logam dan asam
Logam yang digunakan adalah : Fe, Zn,
Sn, Al sebagai
sumber elektron
Asam yang digunakan adalah : HCl,
H2SO4 sebagai sumber
ion H+. HNO3 jarang digunakan karena
mempunyai sifat
sebagai oksidator kuat.
2. Logam dan basa
Logamnya adalah : Fe, Zn, Sn, Al
Basa : NaOH, KOH
3. Sulfida
Untuk mereduksi sebagian senyawa polinitro
aromatik
menjadi nitro amina dan mereduksi
aminoantraquinon
menjadi antraquinon.
4. Sulfit (Na-sulfit dan bisulfit)
5. Hidrogen (H2) dengan katalis
Penggunaan hidrogen sebagai
reduktor,
biasanya dengan katalisator. Reduksi
dengan
hidrogen disebut hidrogenasi.
6. Elektrolisa
Ion hidrogen dihasilkan dari
elektrolisa. Hidrogen
inilah yang kemudian melakukan
reduksi.
7. Na-hidrosulfit
8. Metal hidrida
9. Natrium dan Na-alkoholat
Pereduksi tersebut di atas memiliki
kekuatan mereduksi yang
berbeda. Yang paling banyak digunakan
adalah logam dan
asam. Dengan memilih reduktor yang sesuai
dan mengatur
kondisi operasi, maka reduksi dapat
dihentikan tidak sampai
hasil akhir.
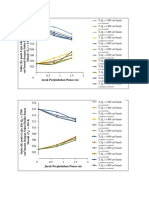
Pengaruh kekuatan zat pereduksi tersebut
dapat dilihat pada
hasil reduksi nitrobenzena sebagai berikut :
Reduksi menggunakan Besi dan
Asam.
Disebut juga reduksi Bechamp.
Reaksi :
2RNO2 + FeCl2 + 6Fe + 10H2O 2RNH3Cl +
7Fe(OH)2
RNO2 + 6Fe(OH)2 + 4H2O RNH2 + 6Fe(OH)2
Apabila reaksi dijalankan pada bejana
gelas, maka mulamula
terbentuk endapan kehijauan dari mula
Fe(OH)2, kemudian
endapan coklat dari Fe(OH)3; kemudian
endapan coklat
dari Fe3O4. Reaksi:
Fe(OH)2 + 2Fe(OH)3 Fe3O4 + H2O
Aminahidroklorida bereaksi dengan besi
dan nitrobenzena:
6RNH3Cl + 3Fe + RNO2 RNH2 + FeCl2 + H2O
Jadi ada 3 tahap reaksi, yang setiap
tahapannya
membutuhkan 2 mol H2 dan 3 atom Fe yang
menjadi ion Fe2+.
Hidrogen juga dihasilkan dari reaksi samping
berikut ini :
R(NH3)+ + 2Cl- + Fe RNH2 +FeCl2 + H2
3Fe + 6H2O 3Fe(OH)2 + 3H2
Termodinamika
Usaha Memperbesar hasil :
1. Logam berlebih (2,5-5 mol/mol senyawa nitro)
2. HCl berlebih
3. H2O berlebih
4. H2O hasil samping tidak diusir karena berfungsi
sebagai
pensuspensi
5. Suhu dicari yang optimum
Kinetika
Untuk mempercepat Reaksi :
1. Memperbesar A
2. Logam dan asam diperbesar
3. Suhu dinaikkan sampai optimum
4. Ditambahkan zat pelarut untuk
memudahkan
pencampuran. Mis : alkohol, piridin dll.
Anda mungkin juga menyukai
- HidrolisisDokumen29 halamanHidrolisisTino UmbarBelum ada peringkat
- Fungsi Hidrolisis Dan Macam-Macam HidrolisisDokumen6 halamanFungsi Hidrolisis Dan Macam-Macam HidrolisisSyahrul FabanyoBelum ada peringkat
- Modul Kim Kls Xi Ipa 3 Hidrolisis GaramDokumen39 halamanModul Kim Kls Xi Ipa 3 Hidrolisis GaramRafian DanaswaraBelum ada peringkat
- Hidrolisis XI MIPA 4Dokumen13 halamanHidrolisis XI MIPA 4fatma ayyallaBelum ada peringkat
- Makalah Kimia HidrolisissDokumen14 halamanMakalah Kimia HidrolisissFania Suci AzlienaBelum ada peringkat
- Materi HidrolisisDokumen9 halamanMateri HidrolisisAchmad Zaenuri RajasaBelum ada peringkat
- Reaksi Oksidasi Dan ReduksiDokumen24 halamanReaksi Oksidasi Dan Reduksiaulia safiraBelum ada peringkat
- Kimia Hidrolisis Garam Dan Larutan PenyanggaDokumen16 halamanKimia Hidrolisis Garam Dan Larutan PenyanggaAlfie Hasya ThoriqiBelum ada peringkat
- Makalah Definisi & Ruang Lingkup HidrolisaDokumen10 halamanMakalah Definisi & Ruang Lingkup HidrolisaFITRIBelum ada peringkat
- 9 AminasiDokumen36 halaman9 AminasiUsman MansurBelum ada peringkat
- 4 AminasiDokumen39 halaman4 AminasiSARIPAH SOBAHBelum ada peringkat
- Rangkuman Materi Bab 3 - Hidrolisis GaramDokumen4 halamanRangkuman Materi Bab 3 - Hidrolisis Garamardiva salsyabilaBelum ada peringkat
- Cara Menentukan Bilangan Oksidasi-2Dokumen37 halamanCara Menentukan Bilangan Oksidasi-2Maria FitrianiBelum ada peringkat
- AlkoholDokumen7 halamanAlkoholWRizki NandaBelum ada peringkat
- Materi Hidrolisis GaramDokumen5 halamanMateri Hidrolisis GaramAgnes klon TsuBelum ada peringkat
- Reaksi HidrolisisDokumen7 halamanReaksi Hidrolisis13west.east51Belum ada peringkat
- Kim orDokumen16 halamanKim ormonalisaBelum ada peringkat
- Pelarut Non AirDokumen35 halamanPelarut Non Airdevy ridhaBelum ada peringkat
- KIMDAS KELOMPOK 4 HIDROLISIS, BUFER, KSPDokumen59 halamanKIMDAS KELOMPOK 4 HIDROLISIS, BUFER, KSPRevanda ArriveraBelum ada peringkat
- HIDROLISADokumen7 halamanHIDROLISAAkmal_FuadiBelum ada peringkat
- Pelarut Bukan AirDokumen26 halamanPelarut Bukan AirindahyanuarBelum ada peringkat
- Pelarut Organik Selain AirDokumen36 halamanPelarut Organik Selain AirFitriyaniBelum ada peringkat
- (M. Owen) PenggaramanDokumen17 halaman(M. Owen) PenggaramanErna kobawon ErinBelum ada peringkat
- Pengertian HidrolisisDokumen5 halamanPengertian HidrolisisErwinBelum ada peringkat
- 6 Reaksi-Reaksi Asam Basa PDFDokumen22 halaman6 Reaksi-Reaksi Asam Basa PDFSeptianBelum ada peringkat
- Reaksi-Reaksi Asam BasaDokumen22 halamanReaksi-Reaksi Asam BasaBebeBelum ada peringkat
- Pelarut Bukan AirDokumen23 halamanPelarut Bukan AirUmar Bahary PrijatnaBelum ada peringkat
- Isi Hidrolisis GaramDokumen10 halamanIsi Hidrolisis GaramRaerenoyBelum ada peringkat
- PIK Aminasi ReduksiDokumen18 halamanPIK Aminasi ReduksiAxza Seventh50% (2)
- Alkohol FIKS - REVRRDokumen49 halamanAlkohol FIKS - REVRRAhmad Naufal GiovanniBelum ada peringkat
- Iden 1 FixDokumen16 halamanIden 1 FixCandra PuspitasariBelum ada peringkat
- Pelarut Air & Non Air-MEDIADokumen55 halamanPelarut Air & Non Air-MEDIANozha Dikdo100% (1)
- Identifikasi Gugus Fungsi AlkoholDokumen5 halamanIdentifikasi Gugus Fungsi AlkoholMaya ismayaBelum ada peringkat
- Tugas Kimia OrganikDokumen13 halamanTugas Kimia OrganikNunik Utari NurwulandariBelum ada peringkat
- Asam Basa DuaDokumen25 halamanAsam Basa DuaSetyaniBelum ada peringkat
- Reaksi AlkenaDokumen50 halamanReaksi AlkenaShifa RisyaBelum ada peringkat
- Resume Kimor AgustinaDokumen7 halamanResume Kimor AgustinaFuad AmrillahBelum ada peringkat
- Laporan Kimia Dasar Percobaan 3Dokumen14 halamanLaporan Kimia Dasar Percobaan 3Sindy SafitriBelum ada peringkat
- KD-3.11 HidrolisisDokumen13 halamanKD-3.11 HidrolisisSuciBelum ada peringkat
- Hidrolisis Berasal Dari Kata Hidro Yaitu Air Dan Lisis Berarti PenguraianDokumen2 halamanHidrolisis Berasal Dari Kata Hidro Yaitu Air Dan Lisis Berarti PenguraianIrvansyahBelum ada peringkat
- Bahan AjarDokumen13 halamanBahan AjarSedis LoinBelum ada peringkat
- AminasiDokumen15 halamanAminasilavenBelum ada peringkat
- NonairDokumen21 halamanNonairBella WahyuniBelum ada peringkat
- HIDROLISISDokumen8 halamanHIDROLISISCalon FarmasisBelum ada peringkat
- Penggaraman ClearDokumen14 halamanPenggaraman ClearRizky AJBelum ada peringkat
- Ainun SalsabilaDokumen16 halamanAinun SalsabilaAnonymous ySCZN5hwYBelum ada peringkat
- Sifat Dan Pembuatan HaloalkanaDokumen13 halamanSifat Dan Pembuatan HaloalkanaEka marlynBelum ada peringkat
- Bab 2 Sistem Pelarut Anfis PDFDokumen64 halamanBab 2 Sistem Pelarut Anfis PDFAmalia AfiyantiBelum ada peringkat
- HidrolisisDokumen3 halamanHidrolisisAnnisatur RohmahBelum ada peringkat
- AMMONOLISADokumen7 halamanAMMONOLISALuthfi M fikriBelum ada peringkat
- Terfix Agak Banget Hidrolisisi Larutan PenyanggaDokumen20 halamanTerfix Agak Banget Hidrolisisi Larutan PenyanggaSalmah SalmahBelum ada peringkat
- Reaksi Pembuatan AminaDokumen11 halamanReaksi Pembuatan AminaTuhfatul Ulya100% (4)
- Hidrolisis GaramDokumen4 halamanHidrolisis Garamanggraeni candra p.Belum ada peringkat
- Praktikum Organik SikloheksanolDokumen16 halamanPraktikum Organik SikloheksanolDiah PurnamiBelum ada peringkat
- Kimia LarutanDokumen12 halamanKimia LarutanAhmad AfandiBelum ada peringkat
- Traceable Declaration IDNDokumen1 halamanTraceable Declaration IDNGita WulandariBelum ada peringkat
- JudulaaDokumen3 halamanJudulaaGita WulandariBelum ada peringkat
- Cetak KRSDokumen1 halamanCetak KRSGita WulandariBelum ada peringkat
- RPP Bab 1 - Seni MusikDokumen43 halamanRPP Bab 1 - Seni MusikGita WulandariBelum ada peringkat
- Cetak KRS PDFDokumen1 halamanCetak KRS PDFGita WulandariBelum ada peringkat
- Cetak Billing Statement - Billing Statement PDFDokumen1 halamanCetak Billing Statement - Billing Statement PDFGita WulandariBelum ada peringkat
- Pomade Rambut Murrays SuperriorDokumen5 halamanPomade Rambut Murrays SuperriorGita WulandariBelum ada peringkat
- Review JurnalDokumen4 halamanReview JurnalGita WulandariBelum ada peringkat
- Rundown Ikhlas BeramalDokumen4 halamanRundown Ikhlas BeramalGita WulandariBelum ada peringkat
- Lembar PenugasanDokumen2 halamanLembar PenugasanGita WulandariBelum ada peringkat
- Tugas Teknik Reaktor Kimia CovDokumen1 halamanTugas Teknik Reaktor Kimia CovGita WulandariBelum ada peringkat
- Bag 12 - REV Analisis KestabilanDokumen46 halamanBag 12 - REV Analisis KestabilanGita WulandariBelum ada peringkat
- Grafik HE Kelompok VDokumen12 halamanGrafik HE Kelompok VGita WulandariBelum ada peringkat
- Rundown Phbi FixedDokumen4 halamanRundown Phbi FixedGita WulandariBelum ada peringkat
- Grafik KompositDokumen2 halamanGrafik KompositGita WulandariBelum ada peringkat
- Bab IvDokumen7 halamanBab IvGita WulandariBelum ada peringkat
- Lampiran B C KompositDokumen19 halamanLampiran B C KompositGita WulandariBelum ada peringkat
- Grafik SedimenDokumen4 halamanGrafik SedimenGita WulandariBelum ada peringkat
- Poliuretan ItsDokumen4 halamanPoliuretan ItsGita WulandariBelum ada peringkat
- Kisi Soal Utilitas 2017Dokumen1 halamanKisi Soal Utilitas 2017Gita Wulandari0% (1)
- Industri Pupuk UreaDokumen45 halamanIndustri Pupuk UreamurnimunBelum ada peringkat
- Pisang TjoyDokumen15 halamanPisang TjoyGita WulandariBelum ada peringkat
- SulfonasiDokumen10 halamanSulfonasiMumahmmad Rizwan RBelum ada peringkat
- Bab IV Gita (Repaired) ZZDokumen17 halamanBab IV Gita (Repaired) ZZGita WulandariBelum ada peringkat
- Perpin Kelompok Vii Bab VDokumen22 halamanPerpin Kelompok Vii Bab VGita WulandariBelum ada peringkat
- Lampiran A GitaDokumen2 halamanLampiran A GitaGita WulandariBelum ada peringkat
- Lembar Data Kualitatif Gita RepairedDokumen3 halamanLembar Data Kualitatif Gita RepairedGita WulandariBelum ada peringkat
- Tugas Komputt BDokumen19 halamanTugas Komputt BGita WulandariBelum ada peringkat
- Lembar Pengesahan GitaDokumen1 halamanLembar Pengesahan GitaGita WulandariBelum ada peringkat