Kimia Organik
Diunggah oleh
Arya Wikranta0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
39 tayangan25 halamankimia organik
Judul Asli
kimia organik
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inikimia organik
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
39 tayangan25 halamanKimia Organik
Diunggah oleh
Arya Wikrantakimia organik
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 25
KIMIA DASAR
Kimia Organik
Pertemuan ke-4 Universitas Pembangunan Nasional
“Veteran” Yogyakarta
Oleh :
Tim Dosen Kimia Dasar Jl. SWK 104 (Lingkar Utara),
Condongcatur, Depok, Sleman, DIY
www.upnyk.ac.id
Fakultas Teknologi Mineral
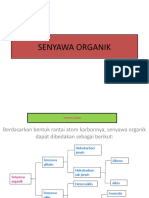
Bentuk Senyawa Karbon
• Bentuk senyawa organik plg sederhana = CH4 (hidrokarbon)
• Bentuk lain :
Nama Senyawa Rumus Molekul
Etana CH3 – CH3
Propana CH3 – CH2 – CH3
Butana CH3 – CH2 – CH2 – CH3
Isomer Kerangka
Isobutana CH – (CH3)3
• Ada pula jumlah C > 4 : pentana, heksana, heptana, oktana, nonana,
dekana.
Fakultas Teknologi Mineral
Tatanama Senyawa Karbon
Awalnya berasal dari
sumber atau sifat tertentu dr
senyawa tsb
Asam sitrat, asam urat,
asam format
Tatanama tsb idak baku sehingga
keluar sistem IUPAC (Union of Pure
and Applied Chemistry)
Fakultas Teknologi Mineral
Kaidah IUPAC
1. Hidrokarbon jenuh = ALKANA
2. Pilih rantai C terpanjang dan jadikan sebagai nama dasar – RANTAI
UTAMA
3. Cabang dari rantai utama diberi nama dan diubah dari akhiran “ana”
menjadi “il” – SUBSTITUEN. Co : metana metil, etana etil
4. Beri nomor rantai utama, substituen di nomor terendah
5. Substituen mempunyai nama dan nomor
6. Nomor dipisahkan satu sama lain dengan koma dan dari huruf
dengan tanda garis.
7. Susun substituen secara abjad
8. Jika ada lebih dari 1 rantai yang panjang, beri satu nama sehingga
jumlah rantai samping yang maksimum
Fakultas Teknologi Mineral
Keisomeran
• Isomer adalah senyawa yang memiliki rumus
molekul sama tetapi berbeda struktur
molekulnya.
• Ada banyak jenis isomer antara lain keisomeran
kerangka dan keisomeran kedudukan
• Semakin panjang rantai semakin banyak jenis
isomer kerangkanya.
• Keisomeran kedudukan terjadi karena perbedaan
kedudukan substituen pada rantai karbon
Fakultas Teknologi Mineral
Latihan
1. Buatlah rumus struktur dari :
a. heptana
b. 2,2-dimetil pentana
c. 2-etil-3-metil heptana
2. Susun isomer rangka dari heksana dan beri
nama.
Fakultas Teknologi Mineral
GUGUS FUNGSI
Jenis Senyawa Rumus Umum
Alkana R–H
Atom yang Alkena R2C=CR2
Alkuna R–C C–R
Alkohol R – OH
Alkilhalida R–X
Eter R–O–R
Aldehid R – CO – H
Keton R – CO – R
Asam Karboksilat R – CO – OH
Ester R – CO – O – R
Amina R – NH2
Fakultas Teknologi Mineral
Alkana
• Ikatan kovalen tunggal = hidrokarbon jenuh
• Dari C1 – C50 dalam deret homolog
• Kenaikan bobot molekul sebanding dengan
kenaikan titik didih
• Semakin bercabang rantai karbon, makin
rendah titik didih
• Cincin alifatik (CnH2n+2) dan alisiklik (CnH2n)
• Alisiklik atau sikloalkanaberbentuk cincin
atau rantai tertutup
Fakultas Teknologi Mineral
Pembuatan Alkana
Pt atau Pd
CH2 CH2 + H2 Kalor/tekanan CH3 – CH3
Etana
Pt atau Pd
HC CH + 2H2 Kalor/tekanan CH3 – CH3
Etana
2CH3CH2Br + 2Na 2NaBr + CH3 – CH2 – CH2 – CH3
Etil bromida Butana
Kalor
CH3CONa + NaOH Na2CO3 + CH4
Natrium Asetat Metana
Fakultas Teknologi Mineral
Alkena dan Alkuna
• Alkena = olefin mengandung satu ikatan
ganda dua (CnH2n)
• Alkuna atau asetilenaikatan ganda tiga
(CnH2n-2)
• Sifat fisik alkena serupa dengan alkana, C2-C4
gas, C5-C18 cairan, >C18 padatan
• Pada C yang sama, alkena dan alkuna memiliki
titik didih lebih tinggi dari alkana
Fakultas Teknologi Mineral
• Penamaan sama dengan alkana dengan
akhiran “ena” untuk alkena dan “una” untuk
alkuna
• Penomoran rantai diawali pada ujung yang
dekat dengan ikatan ganda
• Buatlah rumus struktur dari 2-metil-3-heptena
Fakultas Teknologi Mineral
Pembuatan
• Reaksi eliminasi dalam pembuatan olefin ada
2 cara.
• Asetilena dibuat dari batubara, air dan kapur
Kalor
CaCO3 CaO + CO2
Tanur Listrik
CaO + 3C 2000 C o CaC2 + CO
Kalsium Asetilida
(Kalsium Karbida)
CaC2 + 2H2O HC CH + Ca(OH)2
Fakultas Teknologi Mineral
Polimerisasi
• Etilena dan olefin bisa membentuk molekul raksasa melalui
reaksi polimerisasi
• Kuncinya adalah inisiator radikal bebas
• Mekanisme :
Awalan : R – O : O – R 2 R – O•
Peroksida organik
Diikuti oleh : CH2 = CH2 + RO• R – O – CH2 – CH2
Pembiakan :
ROCH2CH2• + CH2 = CH2 ROCH2CH2CH2CH2•
RO(CH2)3CH2• + CH2 = CH2 RO(CH2)5CH2•
Penghentian : RO(CH2)nCH2• + RO• RO(CH2)nCH2OR
Atau 2RO(CH2)nCH2• RO(CH2)nCH2CH2(CH2)nOR
Fakultas Teknologi Mineral
Hidrokarbon Aromatik
• Rumus umum C6H6 (benzena)
• Toluena, naftalena, antrasena merupakan turunan
benzena
• Substituen di cincin benzena menggunakan istilah orto
(o), meta (m), para (p)
• Sifat pengarah o, m, p tergantung bagaimana 1
substituen mempengaruhi penyebaran elektron dalam
cincin benzena
orto pengarah para : - NH2, -OR, -OH, -OCOR, -R, -X
pengarah meta : -NO2, -CN, -SO3H, -CHO, -COR, -COOH, -
COOR
Fakultas Teknologi Mineral
Latihan
Fakultas Teknologi Mineral
• Benzena dan turunannya tidak larut dalam air tetapi
larut dalam pelarut organik
• Pada C yang sama, TD benzena > TD alkana
• Elektron terdelokasi shg gaya tarik menarik sehingga
TD naik
• TL benzena lebih tinggi dari heksana. Benzena 5,5◦C
sedangkan n-heksana -95 ◦.
• HK mudah terbakar
• Benzena merupakan karsinogen
• Contohnya 3,4-benzipirena
DDT (2,2-di-(p-kloropenil)-1,1,1,-trikloroetana
Fakultas Teknologi Mineral
Alkohol, Fenol dan Eter
• Pada alkohol dan fenol ciri khasnya ada gugus
hidroksil (-OH)
• Jika OH > 1 disebut alkohol polihidrat
• Beberapa alkohol yang populer : Metanol, Etanol,
Etilen glikol dan Gliserol.
• Eter memiliki rumus umum : R – O – R
• Dapat berupa alifatik, aromatik, atau campuran
• Dietil eter salah satu contoh senyawa eter yang
berfungsi sebagai anestesi
Fakultas Teknologi Mineral
Contoh senyawa alkohol, fenol dan eter
CH3 – OH (Metanol)
CH3 – CH2 – OH (Etanol)
HO – CH2 – CH2 – OH
(1,2-etanadiol (etilen glikol))
OH – CH2 – CH2(OH) – CH2 – OH
(1,2,3-propanatrial (gliserol))
CH3 – CH2 – O – CH2 – CH3 (dietil eter)
Fakultas Teknologi Mineral
Aldehid dan Keton
• Mengandung gugus karbonil ( C = O )
• Berdasarkan IUPAC, penamaan menggunakan
akhiran –al untuk aldehid dan –on untuk keton
• Contoh senyawa yang populer yaitu formalin
dan aseton
Fakultas Teknologi Mineral
Asam Karboksilat dan Turunannya
• Cirinya mengandung gugus karboksil (karbonil dan
hidroksil) :
HO C = O
• Rumus umum : R – CO2H
• Dikenal sebagai asam lemak
• Beberapa asam karboksilat
Rumus Struktur Nama IUPAC Nama biasa
HCOOH Metanoat Asam format
CH3COOH Etanoat Asam asetat
CH3CH2COOH Propanoat Asam propionat
CH3(CH2)2COOH Butanoat Asam butirat
O2NC6H4COOH 4-nitrobenzoat p-nitrobenzoat
Fakultas Teknologi Mineral
Amina
• Senyawa organik turunan dari amonia dengan satu atau lebih
gugus organik (R) yang mensubstitusi atom H.
• Penggolongan amina :
• Dimetilanilina salah satu contoh amina yang digunakan dalam
industri penyamakan kulit untuk memicu lepasnya bulu
rambut.
Fakultas Teknologi Mineral
Sintesis Senyawa Organik
Sintesis etil asetat (ester) dengan menggunakan senyawa anorganik
Kalor
CaCO3 CaO + CO2(g)
Tangki listrik
CaO + 3C 2000◦ CaC2 + CO(g)
CaC2 + 2H2O HC CH + Ca(OH)2
Etena dihasilkan dari penambahan H2 pada C2H2
Pt atau Pd
HC CH + H2 Kalor/tekanan H2C = CH2
Etanol dihasilkan dari adisi H2O pada C2H4
H2SO4
H2C = CH2 + H2O CH3CH2OH
Sebagian etanol dioksidasi menjadi asam asetat
K2Cr2O7
CH3CH2OH H+
CH3CO2H
Akhirnya, etanol dan asam asetat digabungkan membentuk etil asetat
CH3COOH + HOCH2CH3 H2O + CH3 – C – O – CH2CH3
O
Fakultas Teknologi Mineral
Bahan Baku untuk Industri Kimia Organik
• RM : C153H115N3O13S2
• Pirolisis kokas, tar batu
Batu Bara bara, gas batu bara
• Gasifikasi berbagai produk
sintesis
Minyak • Penyusun utama CxHy
• Campuran yang kompleks :
alifatik, alisiklik dan aromatik
Bumi • fraksi gas sampai fraksi padat
Hasil Nabati • Contohnya ekstrak obat2an,
bioetanol, biodiesel
• Sangat luas penggunaan di
(Biomassa) bidang farmasi
Fakultas Teknologi Mineral
Fraksi Utama Minyak Bumi
Selang TD Komposisi Fraksi Kegunaan
(◦C)
0 – 30 C1 – C4 Gas Bahan bakar gas
30 – 60 C5 – C7 Eter Petroleum Pelarut
60 – 100 C6 – C8 Ligroin Pelarut
70 – 150 C6 – C9 Bensin BB motor
175 – 300 C10 – C16 Minyak tanah Bahan bakar jet, minyak diesel
Diatas 300 C16 – C18 Minyak-gas Minyak diesel, bahan ‘cracking’
C18 – C20 Minyak lilin Minyak pelumas, minyak mineral,
bahan ‘cracking’
C21 – C40 Lilin parafin Lilin, kertas minyak
Diatas C40 residu Tar atap, bahan pembuat jalan,
ditambah C zat penolak air
Fakultas Teknologi Mineral
SEKIAN
TERIMA KASIH..
Fakultas Teknologi Mineral
Anda mungkin juga menyukai
- Bahan Ajar PPT HidrokarbonDokumen55 halamanBahan Ajar PPT HidrokarbonDhe-dhew Dewii KoeMala80% (15)
- Kimia HidrokarbonDokumen47 halamanKimia HidrokarbonImaruchi Zumaki100% (2)
- 3 - AlkanaDokumen23 halaman3 - AlkanaVika MelindaBelum ada peringkat
- AlkanaDokumen38 halamanAlkanaMuhammad Sulthon SBelum ada peringkat
- 4 Kimia Organik 28Dokumen28 halaman4 Kimia Organik 28Syafrin Kultsum Naura AzzaBelum ada peringkat
- Sarah Elisa Diskusi 1 KIm - orDokumen4 halamanSarah Elisa Diskusi 1 KIm - orAyyub SudrajadBelum ada peringkat
- 12 - HidrokarbonDokumen27 halaman12 - HidrokarbonAhmad Nur FajarBelum ada peringkat
- Lembar Aktifitas Peserta Didik KD 3.1 Alkana, Alkena, Alkuna, Alkohol & EterDokumen15 halamanLembar Aktifitas Peserta Didik KD 3.1 Alkana, Alkena, Alkuna, Alkohol & EterEvelyn DewaBelum ada peringkat
- Biomedik Karbon-Keragaman MolekulDokumen80 halamanBiomedik Karbon-Keragaman Molekulega auliaBelum ada peringkat
- Materi HidrokarbonDokumen46 halamanMateri HidrokarbonNur AmaliaBelum ada peringkat
- Lembar Aktifitas Peserta Didik 01 Alkana, Alkena Dan AlkunaDokumen6 halamanLembar Aktifitas Peserta Didik 01 Alkana, Alkena Dan AlkunaEvelyn DewaBelum ada peringkat
- RPP Senyawa KarbonDokumen9 halamanRPP Senyawa KarbonsulistyowatiBelum ada peringkat
- Aldehid Dan KetonDokumen12 halamanAldehid Dan KetonSri WahyuniBelum ada peringkat
- Lembar Aktifitas Peserta Didik KD 3.1 Alkana, Alkena, Alkuna, Alkohol & EterDokumen13 halamanLembar Aktifitas Peserta Didik KD 3.1 Alkana, Alkena, Alkuna, Alkohol & EterEvelyn DewaBelum ada peringkat
- Kimia Organik IDokumen67 halamanKimia Organik IsilvyaprilianiBelum ada peringkat
- Kuliah 1 - Kimia DasarDokumen44 halamanKuliah 1 - Kimia DasarRenty Lumban TobingBelum ada peringkat
- Gugus FungsiDokumen26 halamanGugus FungsiviviBelum ada peringkat
- Kimia Organik 1 1Dokumen41 halamanKimia Organik 1 1gilang wicaksono wibowo jatiBelum ada peringkat
- SENYAWA TURUNAN ALKANA Okt2020Dokumen32 halamanSENYAWA TURUNAN ALKANA Okt2020Faizah Aulia AzzahraBelum ada peringkat
- HIDROKARBONDokumen13 halamanHIDROKARBONLuhur Hendrawan WibowoBelum ada peringkat
- Kimia Organik PDFDokumen47 halamanKimia Organik PDFMelia QisthiaBelum ada peringkat
- Kuliah 11 Senyawa Dan Reaksi OrganikDokumen34 halamanKuliah 11 Senyawa Dan Reaksi OrganikAinindia HermiatiBelum ada peringkat
- E-MODUL 1-KimorDokumen14 halamanE-MODUL 1-KimorO'ozatulo GuloBelum ada peringkat
- HIDROKARBONDokumen52 halamanHIDROKARBONburhan abdurrahman tsabitBelum ada peringkat
- Kimia Organik Sesi 1 Diskusi 1Dokumen9 halamanKimia Organik Sesi 1 Diskusi 1Salsa SylviaBelum ada peringkat
- Senyawa Turunan AlkanaDokumen66 halamanSenyawa Turunan AlkanaipakkhairafitriBelum ada peringkat
- Alkana Minggu 1Dokumen11 halamanAlkana Minggu 1Tiara AbramBelum ada peringkat
- Kimia OrganikDokumen44 halamanKimia OrganiksugitayonoBelum ada peringkat
- 1 Alkana-1Dokumen30 halaman1 Alkana-1Hey TayoBelum ada peringkat
- Gugus Fungsi KIMIADokumen39 halamanGugus Fungsi KIMIADamaris Wesly Lubis0% (1)
- Kimia Organik 1Dokumen46 halamanKimia Organik 1Muhammad RzaBelum ada peringkat
- Senyawa HidrokarbonDokumen24 halamanSenyawa HidrokarbonesmarmangalikBelum ada peringkat
- Kimia OrganikDokumen44 halamanKimia OrganikNurul MasyithahBelum ada peringkat
- KETONDokumen21 halamanKETONArief FatanenBelum ada peringkat
- Aldehid Dan KetonDokumen10 halamanAldehid Dan Ketonapasi gtauBelum ada peringkat
- Senyawa KarbonDokumen9 halamanSenyawa KarbondimashanungwibisonoBelum ada peringkat
- Alkana SikloalkanaDokumen38 halamanAlkana SikloalkanaAliyah Nahda UtamiBelum ada peringkat
- Senyawa HidrokarbonDokumen24 halamanSenyawa HidrokarbonesmarmangalikBelum ada peringkat
- Kimia Organik 1Dokumen44 halamanKimia Organik 1Muhammad Asri Sukma WijayaBelum ada peringkat
- Kimia Organik 1Dokumen44 halamanKimia Organik 1Moonlight SonataBelum ada peringkat
- 15 Kimia Karbon 1Dokumen22 halaman15 Kimia Karbon 1Kadek AdhieBelum ada peringkat
- Gugus Fungsi Senyawa KarbonDokumen21 halamanGugus Fungsi Senyawa KarbonM.Qohary.RBelum ada peringkat
- Kuliah1 Alkana AlkunaDokumen52 halamanKuliah1 Alkana AlkunaBelda Amelia Junisu0% (1)
- Gugus Fungsional Alkohol Dan EterDokumen41 halamanGugus Fungsional Alkohol Dan EterNur' Athiyyah Muyassar SiregarBelum ada peringkat
- Struktur Dan Ikatan Senyawa Organik Alkana Dan SikloalkanaDokumen24 halamanStruktur Dan Ikatan Senyawa Organik Alkana Dan SikloalkanaHaidar HanifBelum ada peringkat
- Kimia OrganikDokumen61 halamanKimia Organiksubhan fahmi nasutionBelum ada peringkat
- HidrokarbonDokumen39 halamanHidrokarbonMini OneBelum ada peringkat
- KIMIA Senyawa Karbon Dan TurunannyaDokumen33 halamanKIMIA Senyawa Karbon Dan TurunannyaPandu Imam NugrohoBelum ada peringkat
- KODokumen29 halamanKOLucky SendyBelum ada peringkat
- Gugus FungsiDokumen31 halamanGugus FungsiCah Julli JulliBelum ada peringkat
- KETON (Kelompok 4)Dokumen13 halamanKETON (Kelompok 4)Nur Annisa AnggraenyBelum ada peringkat
- Pendahuluan Dan Hidrokarbon Alkana - Compatibility ModeDokumen36 halamanPendahuluan Dan Hidrokarbon Alkana - Compatibility ModeRizqy RamadhanBelum ada peringkat
- Senyawa KarbonDokumen7 halamanSenyawa KarbonTaufik Agung Sasongko29Belum ada peringkat
- Senyawa Alkohol Dan Senyawa Eter: Ayus Diningsih, M.SiDokumen19 halamanSenyawa Alkohol Dan Senyawa Eter: Ayus Diningsih, M.SiAyus diningsihBelum ada peringkat
- Senyawa Turunan AlkanaDokumen8 halamanSenyawa Turunan AlkanaAynie Chem'sBelum ada peringkat
- Modul 1Dokumen27 halamanModul 1sumarnoBelum ada peringkat
- Laporan StakeoutDokumen12 halamanLaporan StakeoutIkhsan Setyawan100% (2)
- 4-Ikatan KimiaDokumen42 halaman4-Ikatan KimiaArya WikrantaBelum ada peringkat
- 4-Ikatan KimiaDokumen42 halaman4-Ikatan KimiaArya WikrantaBelum ada peringkat
- DAPUSDokumen2 halamanDAPUSArya WikrantaBelum ada peringkat
- DAPUSDokumen2 halamanDAPUSArya WikrantaBelum ada peringkat
- C. Format Aturan Proposal PKM Ed KDokumen12 halamanC. Format Aturan Proposal PKM Ed KAdinda WardhaniBelum ada peringkat
- Modul Praktikum Perpetaan Topografi 2019Dokumen126 halamanModul Praktikum Perpetaan Topografi 2019Arya WikrantaBelum ada peringkat
- Tugas Poligon 19Dokumen24 halamanTugas Poligon 19Arya WikrantaBelum ada peringkat
- Tugas Poligon 19Dokumen24 halamanTugas Poligon 19Arya WikrantaBelum ada peringkat
- FahmiiDokumen18 halamanFahmiiArya WikrantaBelum ada peringkat
- Laporan StakeoutDokumen12 halamanLaporan StakeoutIkhsan Setyawan100% (2)
- DAPUSDokumen2 halamanDAPUSArya WikrantaBelum ada peringkat
- FahmiiDokumen18 halamanFahmiiArya WikrantaBelum ada peringkat
- FahmiiDokumen18 halamanFahmiiArya WikrantaBelum ada peringkat
- Tugas Lapangan Stake OutDokumen2 halamanTugas Lapangan Stake OutArya WikrantaBelum ada peringkat
- FahmiiDokumen18 halamanFahmiiArya WikrantaBelum ada peringkat
- Paper Peta PadiDokumen6 halamanPaper Peta PadiArya WikrantaBelum ada peringkat