Teori Asam Basa
Teori Asam Basa
Diunggah oleh
Kekasih BayanganHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Teori Asam Basa
Teori Asam Basa
Diunggah oleh
Kekasih BayanganHak Cipta:
Format Tersedia
Teori Asam Basa
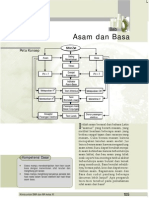
Asam dan basa adalah dua golongan zat kimia yang sangat umum ditemukan di sekitar
kita. Sebagai contoh, cuka, asam sitrun, dan asam dalam lambung tergolong asam,
sedangkan kapur sirih dan soda api tergolong basa. Asam dan basa memiliki sifat-sifat
yang berbeda. Pada mulanya, asam dan basa dibedakan berdasarkan rasanya, di mana
asam terasa masam sedangkan basa terasa pahit dan licin seperti sabun. Namun, secara
umum zat-zat asam maupun basa bersifat korosif dan beracun — khususnya dalam bentuk
larutan dengan kadar tinggi — sehingga sangat berbahaya jika diuji sifatnya dengan
metode merasakannya.
Seiring perkembangan ilmu pengetahuan dan teknologi, pembedaan asam dan basa pun
dapat dilakukan dengan menggunakan indikator seperti kertas lakmus dan indikator
universal ataupun instrumen pH meter. Larutan asam akan memerahkan kertas lakmus
biru, sedangkan larutan basa akan membirukan kertas lakmus merah. Pada pengujian zat
dengan pH meter, larutan asam akan menunjukkan pH lebih kecil dari 7, sedangkan larutan
basa akan menunjukkan pH lebih besar dari 7. Larutant dengan pH sama dengan 7 disebut
netral.
Teori Asam Basa Arrhenius
Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius.
Menurut Arrhenius, definisi dari asam dan basa, yaitu:
asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +.
basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.
Gas asam klorida (HCl) yang sangat larut dalam air tergolong asam Arrhenius,
sebagaimana HCl dapat terurai menjadi ion H+dan Cl− di dalam air. Berbeda halnya dengan
metana (CH4) yang bukan asam Arrhenius karena tidak dapat menghasilkan ion H + dalam
air meskipun memiliki atom H. Natrium hidroksida (NaOH) termasuk basa Arrhenius,
sebagaimana NaOH merupakan senyawa ionik yang terdisosiasi menjadi ion Na + dan
OH− ketika dilarutkan dalam air. Konsep asam dan basa Arrhenius ini terbatas pada kondisi
air sebagai pelarut.
Anda mungkin juga menyukai
- Asam BasaDokumen15 halamanAsam BasaQaireen ZahraBelum ada peringkat
- Arabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumDokumen4 halamanArabella R.V Ukat Teori Asam-Basa Teknik LaboratoriumBellaBelum ada peringkat
- Teori Asam-BasaDokumen5 halamanTeori Asam-BasaHasan NyambeBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaEnggar WahyuBelum ada peringkat
- Teori Asam Basa Bronsted LowryDokumen10 halamanTeori Asam Basa Bronsted LowryTjokorda Istri Agung Dwi PradnyaniBelum ada peringkat
- Rangkuman Asam Basa 2021Dokumen8 halamanRangkuman Asam Basa 2021Diva Intan AafiyahBelum ada peringkat
- Asam Dan BasaDokumen19 halamanAsam Dan BasaGilang AditiyaBelum ada peringkat
- Makalah Asam Basa SukrisnoDokumen27 halamanMakalah Asam Basa SukrisnoSukrisno SyukriBelum ada peringkat
- Makalah Larutan Asam Dan BasaDokumen15 halamanMakalah Larutan Asam Dan BasaAndrea Rootz OnlyskyproBelum ada peringkat
- Laporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaDokumen12 halamanLaporan Resmi Asam Basa PH I Ketut Wisnu Arya WiratamaayinBelum ada peringkat
- Definisi Asam Dan Basa ArrheniusDokumen15 halamanDefinisi Asam Dan Basa ArrheniusBeatriks Faustina Sura LegaBelum ada peringkat
- Teori Asam Basa Menurut Arrhenius, Bronsted LowryDokumen10 halamanTeori Asam Basa Menurut Arrhenius, Bronsted LowryMcReczs RistantoBelum ada peringkat
- Contoh Laporan Praktikum Kimia (Subbab Pengujian PH)Dokumen14 halamanContoh Laporan Praktikum Kimia (Subbab Pengujian PH)VericoBelum ada peringkat
- Uraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373Dokumen20 halamanUraian ASAM-BASA DAN LARUTAN BUFFER Kornelius Mart Dwi A29237373lenrokmartdwi23Belum ada peringkat
- NamaDokumen14 halamanNamalenrokmartdwi23Belum ada peringkat
- Asam Basa MattDokumen8 halamanAsam Basa MattDaus ElitBelum ada peringkat
- Asam BasaDokumen20 halamanAsam BasawahyuBelum ada peringkat
- Teori Asam BasaDokumen5 halamanTeori Asam BasaMeilisa WulandariBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaAnggi WahyuBelum ada peringkat
- 07 Bab6Dokumen26 halaman07 Bab6JalaludinBelum ada peringkat
- Asam Dan BasaDokumen7 halamanAsam Dan BasaFahmi HidayatBelum ada peringkat
- Teori Asam BasaDokumen6 halamanTeori Asam BasaWayan WahyuBelum ada peringkat
- Asam BasaDokumen17 halamanAsam BasaIne KeBelum ada peringkat
- KIMIADokumen12 halamanKIMIATaufiq IhdinaBelum ada peringkat
- Praktikum Ke V Kelompok 3 Grup 3Dokumen34 halamanPraktikum Ke V Kelompok 3 Grup 3NURUL IHKSANI -Belum ada peringkat
- Makalah Asam BasaDokumen11 halamanMakalah Asam BasaeviBelum ada peringkat
- RPP Teori Asam-BasaDokumen3 halamanRPP Teori Asam-BasaErica MooreBelum ada peringkat
- Kelebihan Dan Kekurangan Teori Asam Basa Bronsted LowryDokumen6 halamanKelebihan Dan Kekurangan Teori Asam Basa Bronsted LowryPutri Ardiana Puspita Sari100% (3)
- Kimia DasarDokumen16 halamanKimia DasarPaulus Leonardo ManurungBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasaAzizahnurbewiBelum ada peringkat
- Teori Asam BasaDokumen4 halamanTeori Asam BasaLavinia RahmawatiBelum ada peringkat
- Makalah Muh IlhamDokumen12 halamanMakalah Muh IlhamMuh IlhamBelum ada peringkat
- Teori Asam Basa Menurut para AhliDokumen8 halamanTeori Asam Basa Menurut para AhlimuhammadfauziladhimBelum ada peringkat
- Asam BasaDokumen7 halamanAsam BasaErsan Yudhapratama MuslihBelum ada peringkat
- Jurnal3 AndreansyahDwiPratama 191910801017 Kel8Dokumen16 halamanJurnal3 AndreansyahDwiPratama 191910801017 Kel8Reyhan AdfriansyahBelum ada peringkat
- Asam BasaDokumen16 halamanAsam BasawidyaairfaniiBelum ada peringkat
- 1Dokumen3 halaman1Sri YulianaBelum ada peringkat
- Teori Asam BasaDokumen3 halamanTeori Asam BasaAyu Marisa Al-RahmanBelum ada peringkat
- Modul Kelas XI Pertama Asam BasaDokumen22 halamanModul Kelas XI Pertama Asam Basalevi yunitasariBelum ada peringkat
- Teori Asam Basa Bronsted LewisDokumen4 halamanTeori Asam Basa Bronsted LewisR Yayang Yulia LizaBelum ada peringkat
- Kimia Unit 2Dokumen19 halamanKimia Unit 2AndinurlindasariBelum ada peringkat
- Makalah Asam BasaDokumen18 halamanMakalah Asam BasaAgung AntaraniBelum ada peringkat
- Teori Asam Basa Bronsted LowryDokumen8 halamanTeori Asam Basa Bronsted LowrychochoBelum ada peringkat
- Asam BasaDokumen6 halamanAsam BasaAkuu DaayyBelum ada peringkat
- Asam Dan BasaDokumen14 halamanAsam Dan BasaFirda FauziahBelum ada peringkat
- Teori Asam BasaDokumen4 halamanTeori Asam Basaberkas abdulhafidBelum ada peringkat
- Teori Titrasi Asam Basa KLP 1Dokumen10 halamanTeori Titrasi Asam Basa KLP 1nahdliyahputriiBelum ada peringkat
- Teori Asam PrintDokumen9 halamanTeori Asam Printtiara kasihBelum ada peringkat
- RANGKUMAN Bab Asam-BasaDokumen12 halamanRANGKUMAN Bab Asam-BasaAlvan BernalynBelum ada peringkat
- KIMIA Laprak Asam BasaDokumen14 halamanKIMIA Laprak Asam BasaseekerBelum ada peringkat
- Ba. Asam BasaDokumen15 halamanBa. Asam BasaMarti Kemala DewiBelum ada peringkat
- Laporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Dokumen18 halamanLaporan Akhir Kimia Dasar Penetapan Harga PH - Dhaffin Aufa R (Fix)Chandini Rut YapnoBelum ada peringkat
- Bahan Ajar 1 OktaDokumen7 halamanBahan Ajar 1 Oktawahono FKIPURBelum ada peringkat
- Definisi AsamDokumen9 halamanDefinisi AsamAgustina RahmawatiBelum ada peringkat
- 3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaDokumen7 halaman3 Teori Lengkap Asam Basa Menurut para Ahli Beserta ContohnyaAnonymous 2h42EJ7YBBelum ada peringkat
- Teori Asam BasaDokumen7 halamanTeori Asam Basaratna93Belum ada peringkat
- Tetapan Kesetimbangan Pengionan AsamDokumen17 halamanTetapan Kesetimbangan Pengionan AsamandikartiniBelum ada peringkat
- TEORI ASAM BASA - Kelompok 3Dokumen23 halamanTEORI ASAM BASA - Kelompok 3Frida AprillaBelum ada peringkat
- Larutan Asam Basa Kelas 11Dokumen16 halamanLarutan Asam Basa Kelas 11Akun GoogleBelum ada peringkat