Dasar Teori Bhs Ind
Diunggah oleh
Durriyah AmiiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Dasar Teori Bhs Ind
Diunggah oleh
Durriyah AmiiHak Cipta:
Format Tersedia
BAB II
DASAR TEORI
2.1 Kalor
Kalor merupakan panas yang bisa berpindah dari benda yang memiliki kelebihan kalor
menuju benda yang kekurangan kalor. Kalor biasanya dinyatakan dalam suhu. Dalam satuan
internasional, kalor dinyatakan dengan Joule. Satuan lainnya dinyatakan dengan kalori.
Kapasitas kalor didefinisikan sebagai banyaknya kalor yang diperlukan atau dilepaskan untuk
mengubah suhu benda sebesar satu satuan suhu. 1 kalori didefinisikan sebagai banyaknya
kalor yang diperlukan untuk memanaskan sebanyak 1 kg air sebesar 1°C. 1 kalori = 4,2 Joule
dan 1 Joule = 0,24 kalori. Kalor mengalir dari satu bagian sistem ke bagian yang lain karena
terdapat perbedaan temperatur (Puspitasari, 2020). Secara matematis, banyaknya kalor yang
diserap atau dilepas suatu zat dinyatakan melalui persamaan berikut :
Q=m. c . ∆T
Keterangan : Q = Kalor yang dibutuhkan
m = massa kalor
c = kalor jenis
∆T = perubahan suhu
Sedangkan kalor jenis (c) adalah banyaknya kalor (Q) yang dibutuhkan untuk menaikkan
suhu (T) satu satuan massa (m) benda sebesar satu derajat. Jika sebuah balok logam (massa
m) dipanaskan hingga suhu T1 kemudian balok dimasukkan ke dalam air dingin pada
kalorimeter (dengan massa m2 dan suhu T2). Saat suhu balok logam turun dan suhu
kalorimeter serta air yang ada di dalamnya meningkat hingga mencapai kesetimbangan
termal, suhu sistem adalah T3 (Puspitasari, 2020). Secara matematis dapat ditulis sebagai
berikut :
C=m . c atau H =Q/∆ T
Keterangan : C = kapasitas kalor
Q = Kalor yang dibutuhkan
c = kalor jenis
m = massa kalor
2.2 Asas Black
Kalor yang dilepas oleh balok logam sama dengan kalor yang diterima oleh kalorimeter dan
air. Prinsip kalor ini dinamakan dengan asas black. Seorang ilmuwan Inggris yaitu Joseph
Black yang hidup pada 1720-1749 mengadakan pengamatan mengenai kalor. Asas Black
berbunyi sebagai berikut “jumlah kalor yang diterima sama dengan jumlah kalor yang
dilepaskan”.
Dari situ dapat dijabarkan apabila dua buah zat yang berbeda suhunya disentuhkan, maka zat
yang suhunya lebih tinggi akan melepaskan kalor. Jumlah kalor yang dilepaskan tersebut
akan diserap oleh zat yang suhunya lebih rendah. Secara garis besar Asas Black dikemukakan
oleh Joseph Black, di mana asas ini merupakan suatu prinsip dalam termodinamika yang
berbunyi "Pada pencampuran dua zat, banyaknya kalor yang dilepas oleh zat yang suhunya
lebih tinggi sama dengan banyaknya kalor yang diterima zat yang suhunya lebih rendah".
Asas Black secara sistematis dapat dinyatakan dalam persamaan berikut:
Qlepas=Qterima
m1. c1 (T1-Tc) = m2. c2 (Tc-T2) + mkal + ckal
Keterangan : m1 = massa benda bersuhu tinggi
m2 = massa benda bersuhu rendah
c1 = kalor jenis benda bersuhu tinggi
c2 = kalor jenis benda bersuhu rendah
T1 = suhu dari benda bersuhu tinggi
T2 = suhu dari benda bersuhu rendah
Tc = suhu akhir kedua benda
Karena hanya beda temperatur yang ada dalam persamaan di atas dan kelvin dengan Celsius
berukuran sama, maka temperatur dapat diukur dengan skala Celsius maupun kelvin tanpa
mempengaruhi hasil (Muran, 2004).
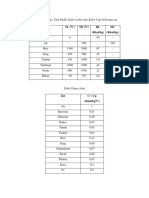
Kalor jenis beberapa zat dapat dilihat pada tabel berikut :
Zat Kalor jenis Kalor jenis
Kal/g°C J/kg K
Air 1,00 4200
Air laut 0,93 3900
Alkohol 0,55 230
Minyak tanah 0,52 220
Raksa 0,033 140
Es 0,595 2500
Aluminum 0,214 900
Kaca 0,16 670
Besi 0,11 460
Tembaga 0,093 390
Kuningan 0,90 380
Perak 0,056 230
Emas 0,031 130
Timbal 0,031 130
Anda mungkin juga menyukai
- Azas Black KimiaDokumen8 halamanAzas Black KimiaNico IvanandaBelum ada peringkat
- Kalor JenisDokumen3 halamanKalor JenismahmurodhiBelum ada peringkat
- Tugas Etika Profesi (Bahan Ajar)Dokumen48 halamanTugas Etika Profesi (Bahan Ajar)Achhy Ansi AnastasiaBelum ada peringkat
- BAB 14 FisikaDokumen11 halamanBAB 14 FisikanuruldiahnabilaBelum ada peringkat
- Bab 14Dokumen10 halamanBab 14nuruldiahnabilaBelum ada peringkat
- Hukum Dasar Termodinamika (Pertemuan 3)Dokumen22 halamanHukum Dasar Termodinamika (Pertemuan 3)Fairus Salam KhemBelum ada peringkat
- Bahan Ajar Kalor Dan PerpindahannyaDokumen10 halamanBahan Ajar Kalor Dan PerpindahannyaDewa Nyoman Sadewa-A20-035Belum ada peringkat
- Bab 5 Kalor Bag 2Dokumen4 halamanBab 5 Kalor Bag 2jjhmyhusbandBelum ada peringkat
- Resume Untuk Materi Pertemuan 3,4,5Dokumen6 halamanResume Untuk Materi Pertemuan 3,4,5gamea0900Belum ada peringkat
- Kalorimeter: Materi PokokDokumen14 halamanKalorimeter: Materi PokokRikardo ManurungBelum ada peringkat
- TermofisikaDokumen18 halamanTermofisikaindriani debora0% (1)
- KalorDokumen18 halamanKalorRenato Linggo KusumoBelum ada peringkat
- Lap Kalor JenisDokumen7 halamanLap Kalor JenisFrisma PuspitaBelum ada peringkat
- Bab I. Ilmu Bahan ListrikDokumen11 halamanBab I. Ilmu Bahan ListrikRehan Putra HerdaniBelum ada peringkat
- Perpindahan Kalor Atau Alih BaranghDokumen16 halamanPerpindahan Kalor Atau Alih BaranghAezmar MamehBelum ada peringkat
- Materi KalorDokumen14 halamanMateri KalorMia RosalinaBelum ada peringkat
- Perbedaan Suhu Dan KalorDokumen6 halamanPerbedaan Suhu Dan KalorInna MeilindaBelum ada peringkat
- Laporan KonduktivitasDokumen18 halamanLaporan KonduktivitasTahayatiIchsan50% (2)
- Contoh Soal Suhu Dan KalorDokumen7 halamanContoh Soal Suhu Dan KalorFahrurojiBelum ada peringkat
- Reny Juniar - Konstanta JouleDokumen27 halamanReny Juniar - Konstanta JouleReny Juniar50% (2)
- Perpindahan PanasDokumen3 halamanPerpindahan Panasمكسندري اكسنيتBelum ada peringkat
- Tabel TermodinamikaDokumen2 halamanTabel TermodinamikaHariz AudirahmawanBelum ada peringkat
- Perpindahan PanasDokumen8 halamanPerpindahan PanasRyanBelum ada peringkat
- Suhu Dan KalorDokumen24 halamanSuhu Dan KalorMuhammad Annajmi AlhadidBelum ada peringkat
- Richard GamariDokumen15 halamanRichard GamariRichard GamariBelum ada peringkat
- Bahan Ajar Suhu Dan KalorDokumen25 halamanBahan Ajar Suhu Dan KalorRichard AlgristonBelum ada peringkat
- Sifat Listrik Material: SemikonduktorDokumen20 halamanSifat Listrik Material: SemikonduktorCiitraaWeyasu100% (2)
- SAS Specific HeatDokumen4 halamanSAS Specific HeatFiki ArfiandiBelum ada peringkat
- 04-Suhu Dan Kalor-Pert-9Dokumen30 halaman04-Suhu Dan Kalor-Pert-9MAFTAZANI FIRDAUSBelum ada peringkat
- KONDUKSIDokumen12 halamanKONDUKSIAvivPujaanBelum ada peringkat
- KalorDokumen26 halamanKalorReski AmeliaBelum ada peringkat
- MODUL FISIKA LANJUTAN Pertemuan 4Dokumen7 halamanMODUL FISIKA LANJUTAN Pertemuan 4Tamaraa RayBelum ada peringkat
- Laporan Praktikum Fisika Dasar I (Kalorimeter)Dokumen12 halamanLaporan Praktikum Fisika Dasar I (Kalorimeter)Ibnu FthnBelum ada peringkat
- PemuaianDokumen19 halamanPemuaiananggunBelum ada peringkat
- Tugas Makalah 3 (Penyekat Gas, Penghantar, Magnet Dan Semikonduktor, SuperkonduktorDokumen31 halamanTugas Makalah 3 (Penyekat Gas, Penghantar, Magnet Dan Semikonduktor, SuperkonduktorlufimanBelum ada peringkat
- Bab 3 Suhu Dan Kalor Materi Perpindahan PanasDokumen13 halamanBab 3 Suhu Dan Kalor Materi Perpindahan PanasAris RantepasangBelum ada peringkat
- AttachmentDokumen10 halamanAttachmentFanyBelum ada peringkat
- BAHAN AJAR Suhu Dan KalorDokumen25 halamanBAHAN AJAR Suhu Dan KalorEva JatiBelum ada peringkat
- Suhu Dan KalorrrDokumen56 halamanSuhu Dan KalorrrGunawan Limbong 2205113129Belum ada peringkat
- 4 Termometri Dan PanasDokumen43 halaman4 Termometri Dan PanasfathurBelum ada peringkat
- Pertemuan 2Dokumen14 halamanPertemuan 2alfathihanakuBelum ada peringkat
- Bahan Ajar Suhu Dan Perpindahan KalorDokumen15 halamanBahan Ajar Suhu Dan Perpindahan Kalorcut idawaniBelum ada peringkat
- Suhu Dan KalorDokumen27 halamanSuhu Dan KalorLuthfie ZaidanBelum ada peringkat
- Suhu Dan KalorDokumen4 halamanSuhu Dan KalorDewi LarasatiBelum ada peringkat
- Fisika Panas Dan GelombangDokumen13 halamanFisika Panas Dan GelombangLeonard SajaBelum ada peringkat
- Fisika Panas Dan GelombangDokumen13 halamanFisika Panas Dan GelombangLeonard SajaBelum ada peringkat
- Bahan Ajar RPP 2 - RochayatiDokumen5 halamanBahan Ajar RPP 2 - RochayatirochayarochBelum ada peringkat
- Cover Tugas PPGDokumen21 halamanCover Tugas PPGPandu PandawaBelum ada peringkat
- Suhu Dan KalorDokumen25 halamanSuhu Dan KalorenesBelum ada peringkat
- 5 Kapasitas KalorDokumen15 halaman5 Kapasitas KalorAbdul Salim100% (1)
- Teknologi Bahan ElektrikDokumen14 halamanTeknologi Bahan ElektrikHeri SusantoBelum ada peringkat
- Kisi2 UnbkDokumen53 halamanKisi2 UnbkNabila Sophia SyahzananiBelum ada peringkat
- Makalah Perpindahan Kalor SMAN 1 Banyumas 4 Mei 2016Dokumen15 halamanMakalah Perpindahan Kalor SMAN 1 Banyumas 4 Mei 2016rahzalursanBelum ada peringkat
- Bab V Suhu Dan KalorDokumen6 halamanBab V Suhu Dan KalorDamar DjatiBelum ada peringkat
- Suhu Kalor Dan Pemuaian Kelas Xi 2013Dokumen70 halamanSuhu Kalor Dan Pemuaian Kelas Xi 2013Rizal Aditya IrfaiBelum ada peringkat
- FISIKADokumen29 halamanFISIKAM Ihsan SidiqBelum ada peringkat
- Bab 4 Suhu Dan Kalor 37-42Dokumen6 halamanBab 4 Suhu Dan Kalor 37-42Anonymous s7xTz1Belum ada peringkat
- Bab 4 KaloryDokumen9 halamanBab 4 Kaloryfahril abdjanBelum ada peringkat
- Perp Panas (Pengantar)Dokumen27 halamanPerp Panas (Pengantar)pancaBelum ada peringkat
- LKPD Pembelajaran SteamDokumen7 halamanLKPD Pembelajaran SteamDurriyah AmiiBelum ada peringkat
- Grafik HK FaradayDokumen6 halamanGrafik HK FaradayDurriyah AmiiBelum ada peringkat
- Lapres GO2Dokumen12 halamanLapres GO2Durriyah AmiiBelum ada peringkat
- LKM 1 - Gelombang ElektromagnetikDokumen2 halamanLKM 1 - Gelombang ElektromagnetikDurriyah AmiiBelum ada peringkat
- Bab IDokumen30 halamanBab IDurriyah AmiiBelum ada peringkat
- Bab IiDokumen16 halamanBab IiDurriyah AmiiBelum ada peringkat
- Pkm-Ebs 2-1Dokumen9 halamanPkm-Ebs 2-1Durriyah AmiiBelum ada peringkat
- Lapressss Hambatan Durr-1Dokumen21 halamanLapressss Hambatan Durr-1Durriyah AmiiBelum ada peringkat
- Poster KsdalDokumen1 halamanPoster KsdalDurriyah AmiiBelum ada peringkat
- Makalah ELDAS 1 Dioda VaractorDokumen10 halamanMakalah ELDAS 1 Dioda VaractorDurriyah AmiiBelum ada peringkat
- PresentasiDokumen6 halamanPresentasiDurriyah AmiiBelum ada peringkat
- Makalah ELDAS 1 Dioda VaractorDokumen10 halamanMakalah ELDAS 1 Dioda VaractorDurriyah AmiiBelum ada peringkat
- Lampiran PemrosesanDokumen2 halamanLampiran PemrosesanDurriyah AmiiBelum ada peringkat
- BAB II MekanikaDokumen3 halamanBAB II MekanikaDurriyah AmiiBelum ada peringkat