Asroriyatul Bahiroh - Mindmap LAJU REAKSI - KimFis
Asroriyatul Bahiroh - Mindmap LAJU REAKSI - KimFis
Diunggah oleh
ASRORIYATUL BAHIROHHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Asroriyatul Bahiroh - Mindmap LAJU REAKSI - KimFis
Asroriyatul Bahiroh - Mindmap LAJU REAKSI - KimFis
Diunggah oleh
ASRORIYATUL BAHIROHHak Cipta:
Format Tersedia
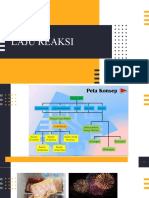
ASRORIYATUL BAHIROH
220351602956
PENGERTIAN FAKTOR YANG
LAJU
Laju reaksi yaitu penurunan MEMPENGARUHI
reaktan atau bertambahnya
Konsentrasi
produk. Laju reaksi bisa
digambarkan sebagai cepat Suhu
Tekanan
REAKSI
lambatnya suatu reaksi kimia,
sedangkan reaksi kimia Katalis
adalah proses mengubah Luas Permukaan
suatu zat menjadi zat baru
yang disebut produk.
PERSAMAAN
hubungan konsentrasi pereaksi
dengan laju reaksi.
TEORI TUMBUKAN
ORDE REAKSI “ketika partikel reaktan
Bilangan pangkat pada persamaan Laju Reaksi ini disebut bertumbukan satu sama
Keterangan : orde reaksi atau tingkat reaksi pada reaksi yang
v = laju reaksi bersangkutan. Jika bilangan pangkat konsentrasi pereaksi- lain, hanya beberapa
k = tetapan laju reaksi pereaksi tersebut dijumlahkan, itu merupakan orde reaksi persen tumbukan saja yang
[A] = konsentrasi awal A (mol dm-3) total. Jadi, orde reaksinya adalah x + y. Faktor k yang
[B] = konsentrasi awal B (mol dm-3)
menyebabkan perubahan
terdapat pada persamaan ini disebut tetapan reaksi.
x = orde reaksi terhadap A kimia yang dikenal sebagai
y = orde reaksi terhadap B Untuk menentukan persamaan laju reaksi, terlebih dahulu tumbukan yang berhasil”.
mencari orde reaksi.
Cara menentukan orde reaksi yaitu : "Konsentrasi zat
tersebut dinaikkan, sedangkan konsentrasi zat lain dibuat
tetap, selanjutnya dua data percobaan dibandingkan."
Anda mungkin juga menyukai
- Konsep Dasar Kinetika KimiaDokumen38 halamanKonsep Dasar Kinetika KimiaJianBelum ada peringkat
- Asroriyatul Bahiroh - Mindmap LAJU REAKSIDokumen1 halamanAsroriyatul Bahiroh - Mindmap LAJU REAKSIASRORIYATUL BAHIROHBelum ada peringkat
- Tugas Kelajuan Reaksi Rafif Hadi Atha Xi Mipa 7Dokumen9 halamanTugas Kelajuan Reaksi Rafif Hadi Atha Xi Mipa 7rafif hadi athaBelum ada peringkat
- Laju ReaksiDokumen17 halamanLaju ReaksiSetia lara LubisBelum ada peringkat
- Laju Reaksi UppDokumen15 halamanLaju Reaksi UppSintia At-tiantaBelum ada peringkat
- LK 01 Modul 4 KnetikaDokumen14 halamanLK 01 Modul 4 KnetikaSyarif SuhermanBelum ada peringkat
- Tugas Laju Reaksi Bunga Bela SiregarDokumen7 halamanTugas Laju Reaksi Bunga Bela Siregarrafif hadi athaBelum ada peringkat
- Handout KB 1Dokumen11 halamanHandout KB 1wahyuBelum ada peringkat
- Handout 1Dokumen4 halamanHandout 1hidayattudin29Belum ada peringkat
- Elssya Manullang - LKPD Combine - CESP 2018Dokumen21 halamanElssya Manullang - LKPD Combine - CESP 2018Elssya ManullangBelum ada peringkat
- Bahan Ajar Persamaan Laju ReaksiDokumen12 halamanBahan Ajar Persamaan Laju Reaksiyulli elveni qomariyahBelum ada peringkat
- LK 0.1 Lembar Kerja Belajar Mandiri Profesional 4Dokumen12 halamanLK 0.1 Lembar Kerja Belajar Mandiri Profesional 4Rina TyasningBelum ada peringkat
- Artikel KF 2 Percobaan 1Dokumen7 halamanArtikel KF 2 Percobaan 1Dina fadhilaBelum ada peringkat
- Laju ReaksiDokumen8 halamanLaju ReaksiNisrinaBelum ada peringkat
- Jurnal Laju ReaksiDokumen16 halamanJurnal Laju ReaksiSagung DyahBelum ada peringkat
- Dasar Teori Laju ReaksiDokumen3 halamanDasar Teori Laju ReaksiYechinta devi ramadhaniBelum ada peringkat
- LK 0.1 LK Mandiri Modul 4 ProfesionalDokumen8 halamanLK 0.1 LK Mandiri Modul 4 ProfesionalAl-murtadoBelum ada peringkat
- Laju ReaksiDokumen23 halamanLaju ReaksiCr PepsBelum ada peringkat
- KIMIA DASAR - Kinetika KimiaDokumen30 halamanKIMIA DASAR - Kinetika KimiaDinda NovitaBelum ada peringkat
- Artikel Laju Reaksi BerkesudahanDokumen7 halamanArtikel Laju Reaksi BerkesudahanmutiaBelum ada peringkat
- Kinetika KimiaDokumen19 halamanKinetika KimiaKiki D'SquardBelum ada peringkat
- PPT Laju Reaksi FixDokumen22 halamanPPT Laju Reaksi FixErlinda Novriani SaputriBelum ada peringkat
- LK 0.1 Modul 4 - ProfesionalDokumen12 halamanLK 0.1 Modul 4 - ProfesionalSiti SupriyantiBelum ada peringkat
- Lapres AntaraDokumen41 halamanLapres AntaraRizka AmaliaBelum ada peringkat
- Laju ReaksiDokumen6 halamanLaju ReaksiMuhammadIlhamBelum ada peringkat
- Dasar Dasar KinetikaDokumen38 halamanDasar Dasar KinetikaDedi TeguhBelum ada peringkat
- MAKALAH KIMIA FISIK III - Kelompok 1 5CDokumen13 halamanMAKALAH KIMIA FISIK III - Kelompok 1 5CSyifa MdnyhBelum ada peringkat
- LK1-Modul 4 ProfesionalDokumen7 halamanLK1-Modul 4 Profesionaldiyah noviBelum ada peringkat
- Lkpdorde ReaksiDokumen18 halamanLkpdorde Reaksipopit widyaBelum ada peringkat
- LK1-Modul 4 ProfesionalDokumen10 halamanLK1-Modul 4 ProfesionalHasNa YushaaBelum ada peringkat
- Kimia Farmasi Xi Laju ReaksiDokumen13 halamanKimia Farmasi Xi Laju ReaksiDeka ChintiyaBelum ada peringkat
- LK Modul 4 ProfesionalDokumen8 halamanLK Modul 4 ProfesionalServas ParihiBelum ada peringkat
- Konsep Kinetika Reaksi RahmatiahDokumen14 halamanKonsep Kinetika Reaksi RahmatiahRahmatiahBelum ada peringkat
- Kel 3 Kinetika ReaksiDokumen25 halamanKel 3 Kinetika Reaksirindy tika lestariBelum ada peringkat
- Jawaban TP Kimia IniDokumen4 halamanJawaban TP Kimia Ininur wahidaBelum ada peringkat
- BAB 3 Laju ReaksiDokumen8 halamanBAB 3 Laju ReaksiNatania Auleria SanadaBelum ada peringkat
- RPP Teori Tumbukan Dan Orde, Persamaan Laju FiksssDokumen18 halamanRPP Teori Tumbukan Dan Orde, Persamaan Laju FiksssAgus IndrawanBelum ada peringkat
- Laporan Akhir Objek 5Dokumen6 halamanLaporan Akhir Objek 5Ulfa MutiaBelum ada peringkat
- Kesetimbangan KimiaDokumen18 halamanKesetimbangan KimiaNabila EaslyBelum ada peringkat
- Kelompok 11 - Laju Reaksi - Kapsel.Dokumen6 halamanKelompok 11 - Laju Reaksi - Kapsel.Tulus panindoan LumbantobingBelum ada peringkat
- LK 0.1 Modul 4 ProfesionalDokumen6 halamanLK 0.1 Modul 4 ProfesionalAlfa Dina PrianotoBelum ada peringkat
- Buku AjarDokumen23 halamanBuku AjarAlvira MelindaBelum ada peringkat
- Farmakokinetik Klmpok 2Dokumen11 halamanFarmakokinetik Klmpok 2Chaken SamangunBelum ada peringkat
- Viola Laju ReaksiDokumen6 halamanViola Laju ReaksiViola Dwicha AsdaBelum ada peringkat
- BAB IX RingkasanDokumen8 halamanBAB IX RingkasanNila Fitra AndiniBelum ada peringkat
- Kinetika KIMIA 2Dokumen11 halamanKinetika KIMIA 2Yabes SimbolonBelum ada peringkat
- Metode Awal Laju Reaksi Kimia FisikaDokumen11 halamanMetode Awal Laju Reaksi Kimia FisikaAnas Ilham100% (2)
- Reaction RateDokumen38 halamanReaction RateElssya ManullangBelum ada peringkat
- Unit 1 Amelia KartikaDokumen19 halamanUnit 1 Amelia KartikaMuh. FauzhalBelum ada peringkat
- Screenshot 2024-01-09 at 13.32.28Dokumen13 halamanScreenshot 2024-01-09 at 13.32.28kylannaomiBelum ada peringkat
- Kimia PB4Dokumen78 halamanKimia PB4Siska PrimadewiBelum ada peringkat
- Presentasi Laju ReaksiDokumen12 halamanPresentasi Laju ReaksiPeny PetlyBelum ada peringkat
- Lapres Inversi Gula RevDokumen29 halamanLapres Inversi Gula RevFerdiansyah SetiawanBelum ada peringkat
- TugasDokumen13 halamanTugasSULAIMAN MUNTAZBelum ada peringkat
- Kinematika KimiaDokumen4 halamanKinematika KimiaLenia W SugiyantoBelum ada peringkat
- Kinetika KimiaDokumen9 halamanKinetika KimiaNurul QadimahBelum ada peringkat
- Dasar Kinetika Kimia Dan TermodinamikaDokumen37 halamanDasar Kinetika Kimia Dan TermodinamikaJian0% (1)
- Kinetika KimiaDokumen8 halamanKinetika KimianidiaBelum ada peringkat
- LAPORAN PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI MeydaDokumen10 halamanLAPORAN PENENTUAN ORDE REAKSI DAN TETAPAN LAJU REAKSI MeydaAnonymous 52dM3jCJMBelum ada peringkat
- RPP Referensi Tugas PpiDokumen3 halamanRPP Referensi Tugas PpiASRORIYATUL BAHIROHBelum ada peringkat
- 8 Standar PendidikanDokumen10 halaman8 Standar PendidikanASRORIYATUL BAHIROHBelum ada peringkat
- Mindmap Sifat Koligatif Larutan - Asroriyatul BahirohDokumen1 halamanMindmap Sifat Koligatif Larutan - Asroriyatul BahirohASRORIYATUL BAHIROHBelum ada peringkat
- REVISI Pengembangan KD - Tugas PPI - Kelompok 4Dokumen1 halamanREVISI Pengembangan KD - Tugas PPI - Kelompok 4ASRORIYATUL BAHIROHBelum ada peringkat
- Asroriyatul Bahiroh - Artikel Tingkah Laku Ayam KampungDokumen4 halamanAsroriyatul Bahiroh - Artikel Tingkah Laku Ayam KampungASRORIYATUL BAHIROHBelum ada peringkat