Artikel Kimia Tentang Peranan Larutan Penyangga
Artikel Kimia Tentang Peranan Larutan Penyangga
Diunggah oleh
Warnet 786Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Artikel Kimia Tentang Peranan Larutan Penyangga
Artikel Kimia Tentang Peranan Larutan Penyangga
Diunggah oleh
Warnet 786Hak Cipta:
Format Tersedia
Artikel Kimia tentang Peranan Larutan Penyangga
A. PENGERTIAN
Larutan penyangga atau dikenal juga dengan nama larutan buffer adalah larutan
yang dapat mempertahankan nilai pH apabila larutan tersebut ditambahkan sejumlah
asam atau basa maupun diencerkan dengan menambah sejumlah volume air.
Jadi apabila suatu larutan penyangga ditambahkan asam atau basa ataupun
diencerkan maka nilai pH larutan penyangga tersebut akan tetap. Andaikan kita memiliki
larutan penyangga ber-pH 6.5 kemudian kedalam larutan penyangga itu kita tetesi
sejumlah asam (misalnya HCl) lalu pH larutan tersebut kita ukur pH nya maka pH larutan
tersebut akan tetap 6.5. Hal yang sama juga terjadi bila larutan penyangga itu kita tetesi
basa (misalnya KOH) ataupun kita tambahkan air sehingga volumenya menjadi 3 kali
volume semula, pHnya akan tetap menunjukan 6.5.
Berapa banyak asam atau basa yang bisa kita tambahkan ke dalam larutan
penyangga sehingga nilai pH larutan penyangga tersebut akan tetap?
Jumlah asam atau basa yang dapat kita tambahkan ke dalam suatu larutan
penyangga adalah terbatas dan hal ini tergantung dari konsentrasi komponen penyususn
larutan penyangga itu sendiri.
Jadi setiap larutan penyangga memiliki batasan sampai berapa banyak dia mampu
menampung asam atau basa yang ditambahkan kepadanya sehingga larutan penyangga
tersebut mampu mempertahankan nilai pH seperti semula. Hal inilah yang kita kenal
dengan istilah “Kapasitas Larutan Penyangga”.
Sifat yang khas dari larutan penyangga ini adalah pH-nya hanya berubah sedikit
dengan pemberian sedikit asam kuat atau basa kuat.
Larutan penyangga asam terbuat dari “asam lemah dan garam dari basa
konjugasinya” sedangakan larutan penyangga basa dibuat dari “basa lemah dengan garam
dari asam konjugasinya”.
Reaksi di antara kedua komponen penyusun ini disebut sebagai reaksi asam-basa
konjugasi. Komponen larutan penyangga terbagi menjadi:
A. Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7).
Untuk mendapatkan larutan ini dapat dibuat dari asam lemah dan garamnya yang
merupakan basa konjugasi dari asamnya. Adapun cara lainnya yaitu mencampurkan suatu
asam lemah dengan suatu basa kuat dimana asam lemahnya dicampurkan dalam jumlah
berlebih.
Campuran akan menghasilkan garam yang mengandung basa konjugasi dari asam
lemah yang bersangkutan. Pada umumnya basa kuat yang digunakan seperti natriumNa),
kalium, barium, kalsium, dan lain-lain.
B. Larutan penyangga yang bersifat basa
Larutan ini mempertahankan pH pada daerah basa (pH > 7).
Untuk mendapatkan larutan ini dapat dibuat dari basa lemah dan garam, yang
garamnya berasal dari asam kuat. Adapun cara lainnya yaitu dengan mencampurkan
suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
B. CONTOH LARUTAN PENYANGGA DALAM KEHIDUPAN SEHARI-HARI
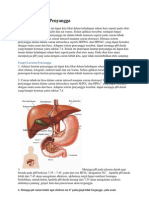
1. Darah Sebagai Larutan Penyangga
Ada beberapa faktor yang terlibat dalam pengendalian pH darah, diantaranya penyangga
karbonat, penyangga hemoglobin dan penyangga fosfat.
a. Penyangga Karbonat
Penyangga karbonat berasal dari campuran asam karbonat (H2CO3) dengan basa
konjugasi bikarbonat (HCO3).
H2CO3 (aq) --> HCO3(aq) + H + (aq)
Penyangga karbonat sangat berperan penting dalam mengontrol pH darah. Pelari
maraton dapat mengalami kondisi asidosis, yaitu penurunan pH darah yang disebabkan
oleh metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi
asidosis ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit
gula) dan diare. Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita
alkalosis, yaitu peningkatan pH darah. Kadar oksigen yang sedikit di gunung dapat
membuat para pendaki bernafas lebih cepat, sehingga gas karbondioksida yang dilepas
terlalu banyak, padahal CO2 dapat larut dalam air menghasilkan H2CO3 . Hal ini
mengakibatkan pH darah akan naik. Kondisi alkalosis dapat mengakibatkan
hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas dan histeris).
b. Penyangga Hemoglobin
Pada darah, terdapat hemoglobin yang dapat mengikat oksigen untuk selanjutnya
dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga oksi
hemoglobin adalah:
HHb + O2 (g) « HbO2- + H +
Asam hemoglobin ion aksi hemoglobin
Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H+,
sehingga pH darah juga dipengaruhi olehnya. Pada reaksi di atas O2 bersifat basa.
Hemoglobin yang telah melepaskan O2 dapat mengikat H+ dan membentuk asam
hemoglobin. Sehingga ion H+ yang dilepaskan pada peruraian H2CO3 merupakan asam
yang diproduksi oleh CO2 yang terlarut dalam air saat metabolisme.
c. Penyangga Fosfat
Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur
pH darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H2PO4 - ) dengan
monohidrogen fosfat (HPO3 2-).
H2PO4 - (aq) + H+ (aq) --> H2PO4(aq)
H2PO4- (aq) + OH- (aq) --> HPO4 2- (aq) ) + H2O (aq)
Penyangga fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel
hanya sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin.
2. Air Ludah sebagai Larutan Penyangga
Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. Email gigi yang
rusak dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan
pH pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat
menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan.
3. Menjaga keseimbangan pH tanaman.
Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam
kamar kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan
hidroponik . Setiap tanaman memiliki pH tertentu agar dapat tumbuh dengan baik. Oleh
karena itu dibutuhkan larutan penyangga agar pH dapat dijaga.
4. Larutan Penyangga pada Obat-Obatan
Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan
obat penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan pH
pada perut. Perubahan pH ini mengakibakan pembentukan hormon, untuk merangsang
penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh
karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.
C. FUNGSI LARUTAN PENYANGGA
1. Adanya larutan penyangga ini dapat kita lihat dalam kehidupan sehari-hari seperti pada
obat-obatan, fotografi, industri kulit dan zat warna. Selain aplikasi tersebut, terdapat
fungsi penerapan konsep larutan penyangga ini dalam tubuh manusia seperti pada cairan
tubuh.
2. Cairan tubuh ini bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem
penyangga utama dalam cairan intraselnya seperti H2PO4- dan HPO42- yang dapat
bereaksi dengan suatu asam dan basa. Adapun sistem penyangga tersebut, dapat menjaga
pH darah yang hampir konstan yaitu sekitar 7,4.
3. Menjaga pH pada plasma darah agar berada pada pH berkisar 7,35 – 7,45 ,yaitu dari ion
HCO3- dengan ion Na+ . Apabila pH darah lebih dari 7,45 akan mengalami alkalosis,
akibatnya terjdi hiperventilasi/ bernapas berlebihan, mutah hebat.Apabila pH darah
kurang dari 7,35 akan mengalami acidosis akibatnya jantung ,ginjal ,hati dan pencernaan
akan terganggu.
4. Menjaga pH cairan tubuh agar ekskresi ion H+ pada ginjal tidak terganggu, yaitu asam
dihidrogen posphat (H2PO4-) dengan basa monohidrogen posphat (HPO42-)
5. Menjaga pH makanan olahan dalam kaleng agar tidak mudah rusak /teroksidasi (asam
benzoat dengan natrium benzoat).
6. Selain itu penerapan larutan penyangga ini dapat kita temui dalam kehidupan sehari-hari
seperti pada obat tetes mata.
D. FUNGSI LARUTAN PENYANGGA DALAM TUBUH MANUSIA
Reaksi kimia yang terjadi di dalam tubuh manusia merupakan reaksi enzimatis,
yaitu reaski yang melibatkan enzim sebagai katalis. Enzim sebagai katalis hanya dapat
bekerja dengan baik pada pH tertentu (pH optimumnya). Agar enzim tetap bekerja secara
optimum, diperlukan lingkungan reaksi dengan pH yang relative tetap, untuk itu maka
diperlukan larutan penyangga.
Didalam setiap cairan tubuh terdapat pasangan asam-basa konjugasi yang
berfungsi sebagai larutan penyangga. Cairan tubuh, baik sebagai cairan intra sel (dalam
sel) dan cairan ekstra sel (luar sel) memerlukan system penyangga tersebut unutk
mempertahankan harga pH cairan tersebut. System penyangga ekstra sel yang penting
adalah penyangga karbonat ( H2CO3/HCO3-) yang berperan dalam menjaga pH darah, dan
sistem penyangga fosfat (H2PO4-/HPO42-) yang berperan menjaga pH cairan intra sel.
E. FUNGSI LARUTAN PENYANGGA DALAM BIDANG FARMASI
Buffer pada bidang farmasi banyak digunakan untuk menetralkan darah atau
biasanya pada kasus keracunan. Contohnya pada keracunan asam jengkolat. Asam
jengkolat yang terbentuk saat kita terlalu banyak mengonsumsi jengkol ini harus di
kurangi karena akan membetk kristal kristal yang menyumbat saluran kecing. Caranya
dengan memasukan larutan bisa Natrium karbonat(biasanya) yang sifatnya basa yang
nantinya akan membentuk garam ketika bereaksi dengan asam dan kemudian akan keluar
melalui urin (karena garam sifatnya adalah mudah larut dalam air).
Dalam bidang farmasi (obat-obatan) banyak zat aktif yang harus berada dalam
keadaan pH stabil. Perubahan pH akan menyebabkan khasiat zat aktif tersebut berkurang
atau hilang sama sekali. Untuk obat suntik atau obat tetes mata, pH obat-obatan tersebut
harus disesuaikan dengan pH cairan tubuh. pH untuk obat tetes mata harus disesuaikan
dengan pH air mata agar tidak menimbulkan iritasi yang mengakibatkan rasa perih pada
mata. Begitu juga obat suntik harus disesuaikan dengan pH darah agar tidak
menimbulkan alkalosis atau asidosis pada darah.
Perubahan pH pada larutan obat dapat merusak komposisi, fungsi, dan efektivitas
obattersebut. Oleh karena itu, obat-obatan dalam bentuk larutan sering kali bertindak
sebagai sistem penyangga bagi obat itu sendiri untuk mempertahankan kadar larutan obat
tetap berada dalam trayek pH tertentu.
Larutan Penyangga pada Obat-Obatan : asam asetilsalisilat merupakan komponen
utama dari tablet aspirin, merupakan obat penghilang rasa nyeri. Adanya asam pada
aspirin dapat menyebabkan perubahan pH pada perut. Perubahan pH ini mengakibakan
pembentukan hormon, untuk merangsang penggumpalan darah, terhambat; sehingga
pendarahan tidak dapat dihindarkan. Oleh karena itu, pada aspirin ditambahkan MgO
yang dapat mentransfer kelebihan asam.
F. FUNGSI LARUTAN PENYANGGA DALAM BIDANG INDUSTRI
Dalam indutri farmasi, larutan penyangga berperan untuk pembuatan obat-obatan
agar zat aktif dari obat tersebut mempunya pH tertentu. Selain itu larutan penyangga juga
digunakan unutk industri makanan dan minuman ringan seperti yang sering digunakan
adalah Natrium asetat dan asam sitrat.
Contohnya pada asam sitrat :
Asam sitrat merupakan asam organik lemah yang ditemukan pada daun dan buah
tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet yang
baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan dan
minuman ringan. Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam
siklus asam sitrat, yang penting dalam metabolisme makhluk hidup, sehingga ditemukan
pada hampir semua makhluk hidup. Zat ini juga dapat digunakan sebagai zat pembersih
yang ramah lingkungan dan sebagai antioksidan.
Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan
pada konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan
limau (misalnya jeruk nipis dan jeruk purut).
Rumus kimia asam sitrat adalah C6H8O7 (strukturnya ditunjukkan pada tabel
informasi di sebelah kanan). Struktur asam ini tercermin pada nama IUPAC-nya, asam 2-
hidroksi-1,2,3-propanatrikarboksilat.
Sifat-sifat fisis asam sitrat dirangkum pada tabel di sebelah kanan. Keasaman
asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam
larutan. Jika hal ini terjadi, ion yang dihasilkan adalah ion sitrat. Sitrat sangat baik
digunakan dalam larutan penyangga untuk mengendalikan pH larutan. Ion sitrat dapat
bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat
mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan
penghilang kesadahan air.
G. DAFTAR PUSTAKA
http://agusqrana.blogspot.com/2013/04/artikel-kimia-tentang-peranan-larutan.html
Anda mungkin juga menyukai
- Makalah Sistem Buffer TubuhDokumen9 halamanMakalah Sistem Buffer TubuhMaulyda Nurul FaizahBelum ada peringkat
- Larutan PenyanggaDokumen5 halamanLarutan PenyanggaDani IbrahimBelum ada peringkat
- Nitrogen TanahDokumen29 halamanNitrogen TanahrhizaldinasutionBelum ada peringkat
- 7 Perangkat Mutu Politeknik Negeri KupangDokumen10 halaman7 Perangkat Mutu Politeknik Negeri KupangUmari Al Khawari BethanBelum ada peringkat
- Makalah Pengelolaan Satwa Liar (Rofi Purnama.T)Dokumen14 halamanMakalah Pengelolaan Satwa Liar (Rofi Purnama.T)Purnama RofiBelum ada peringkat
- Makalah Integral (MTK Sesi 01)Dokumen35 halamanMakalah Integral (MTK Sesi 01)9661jack100% (1)
- Bab IDokumen5 halamanBab IPutri Nuzul Huda NasirBelum ada peringkat
- PROPOSAL PKM-P Insyaallah SelesaiDokumen22 halamanPROPOSAL PKM-P Insyaallah SelesaiMuhammad AddinulBelum ada peringkat
- Manajemen Keuangan Perusahaan PertanianDokumen17 halamanManajemen Keuangan Perusahaan PertanianFanstagramBelum ada peringkat
- PKM-K Es Krim MorindaDokumen20 halamanPKM-K Es Krim MorindaNanda Wiandynar75% (4)
- Makalah Statistika - Sheren MK 2BDokumen25 halamanMakalah Statistika - Sheren MK 2BEnrico FernandaBelum ada peringkat
- Lembar Kerja Mahasiswa 6Dokumen2 halamanLembar Kerja Mahasiswa 6frdBelum ada peringkat
- Latihan Soal Compare MeansDokumen5 halamanLatihan Soal Compare MeansVivi PrestiwiBelum ada peringkat
- Promosi Coca ColaDokumen4 halamanPromosi Coca ColaYogie NovriandiBelum ada peringkat
- LAPORAN PROJECT MKWU Kelompok 13Dokumen22 halamanLAPORAN PROJECT MKWU Kelompok 13Ananda Amalia RamadhaniBelum ada peringkat
- Limbah Kulit SingkongDokumen2 halamanLimbah Kulit SingkongUswatun KasanahBelum ada peringkat
- Hubungan Ketergantungan Antar 6 KomponenDokumen6 halamanHubungan Ketergantungan Antar 6 Komponenayu IndahBelum ada peringkat
- Pertanyaan Screening+ Panitia UpgradingDokumen2 halamanPertanyaan Screening+ Panitia UpgradingAkmal AdnanBelum ada peringkat
- Materi Pertemuan 6Dokumen7 halamanMateri Pertemuan 6Azi AvrilBelum ada peringkat
- Contoh Soal HipotesisDokumen33 halamanContoh Soal HipotesisDody PermanaBelum ada peringkat
- Resume 1 PKNDokumen9 halamanResume 1 PKNLusiBelum ada peringkat
- Asas Asas Wawasan NusantaraDokumen5 halamanAsas Asas Wawasan NusantaraRiniRiandiniBelum ada peringkat
- MekanikaDokumen9 halamanMekanikaMujibul RijalBelum ada peringkat
- Menaksir Hasil SeleksiDokumen25 halamanMenaksir Hasil SeleksiAlfin YahyaBelum ada peringkat
- Ini Contoh NyaDokumen5 halamanIni Contoh NyaDevi NrizkiBelum ada peringkat
- Pemanfaatan Kulit Jeruk Sebagai Pengawet Makanan AlamiDokumen5 halamanPemanfaatan Kulit Jeruk Sebagai Pengawet Makanan AlamiFernando BudionoBelum ada peringkat
- Makalah Sifat Kimia TanahDokumen14 halamanMakalah Sifat Kimia TanahWitha ChristineBelum ada peringkat
- Bab 123 Analisis KarbohidratDokumen21 halamanBab 123 Analisis KarbohidratKing JunaediBelum ada peringkat
- Pembuatan Biogas Dari Sampah SayuranDokumen3 halamanPembuatan Biogas Dari Sampah SayurannoviBelum ada peringkat
- 00 PKM KewirausahaanDokumen25 halaman00 PKM KewirausahaanRachel HerlindaBelum ada peringkat
- Bab Iv Pengumpulan Dan Pengolahan Data: 4.1 Data Umum Perusahaan 4.1.1 Sejarah Perusahaan PT. Tiki Jalur Nugraha EkakurirDokumen15 halamanBab Iv Pengumpulan Dan Pengolahan Data: 4.1 Data Umum Perusahaan 4.1.1 Sejarah Perusahaan PT. Tiki Jalur Nugraha EkakurirDwi AndriyaniBelum ada peringkat
- Makalah Implementasi Nilai PancasilaDokumen10 halamanMakalah Implementasi Nilai PancasilaTubagus KudratBelum ada peringkat
- Makalah Pengelolaan Laboratorium Pengelolaan Limbah LaboratoriumDokumen21 halamanMakalah Pengelolaan Laboratorium Pengelolaan Limbah Laboratoriumsofi izatiBelum ada peringkat
- Larutanjenis Kons1Dokumen4 halamanLarutanjenis Kons1Rizky Riva'iBelum ada peringkat
- Kul - 4 - Penentuan Posisi Horizontal (Poligon Terbuka Dan Tertutup)Dokumen13 halamanKul - 4 - Penentuan Posisi Horizontal (Poligon Terbuka Dan Tertutup)Dzihnul Abdi WicaksonoBelum ada peringkat
- Buku Panduan Day 2 - 0 - Buku Panduan 2Dokumen27 halamanBuku Panduan Day 2 - 0 - Buku Panduan 2sabBelum ada peringkat
- Values AwarenessDokumen2 halamanValues AwarenessManly LolowangBelum ada peringkat
- Kti LingkunganDokumen17 halamanKti LingkunganMoh Rangga Eko TrisnaBelum ada peringkat
- Makalah Teori EvolusiDokumen30 halamanMakalah Teori EvolusiNike azuraBelum ada peringkat
- DfghyjhDokumen31 halamanDfghyjhninda11Belum ada peringkat
- Pupuk OrganikDokumen25 halamanPupuk OrganikAnang Udah PangkasBelum ada peringkat
- Latihan Soal Ak KeuanganDokumen25 halamanLatihan Soal Ak KeuanganBinom SkuyBelum ada peringkat
- BAB 2 ProteinDokumen13 halamanBAB 2 ProteinDyah HtBelum ada peringkat
- Perhitungan Metode FratarDokumen15 halamanPerhitungan Metode FratarRoihans Muhammad IqbalBelum ada peringkat
- Pertemuan 2. Uji Hipotesis Rata-Rata 1 PopulasiDokumen5 halamanPertemuan 2. Uji Hipotesis Rata-Rata 1 PopulasiAlissiya FahruzBelum ada peringkat
- Proposal PenelitianDokumen26 halamanProposal PenelitianMuhammad Shohairi 2Belum ada peringkat
- Essay Urban Farming IndonesiaDokumen9 halamanEssay Urban Farming IndonesiareniBelum ada peringkat
- Bagaimana Manusia BertuhanDokumen9 halamanBagaimana Manusia BertuhanEga SafitriBelum ada peringkat
- Modul 5Dokumen22 halamanModul 5Alfin SahriBelum ada peringkat
- Formulir Buku Besar Dan Neraca SaldoDokumen26 halamanFormulir Buku Besar Dan Neraca Saldomichael hendricoBelum ada peringkat
- 7 Teknologi Canggih Di Dalam Olahraga SepakbolaDokumen32 halaman7 Teknologi Canggih Di Dalam Olahraga Sepakbolaalhamfarmasi100% (1)
- Pemberian Ektrak Bawang Merah Terhadap Pertumbuhan BayamDokumen19 halamanPemberian Ektrak Bawang Merah Terhadap Pertumbuhan BayamDian Sanita PutriBelum ada peringkat
- PKN-Identitas Nasional Bangsa IndonesiaDokumen41 halamanPKN-Identitas Nasional Bangsa IndonesiaFebyBelum ada peringkat
- Bab2 SEJARAH KOMUNIKASIDokumen30 halamanBab2 SEJARAH KOMUNIKASIMufris SaBelum ada peringkat
- Makalah Kelompok II WSBMDokumen13 halamanMakalah Kelompok II WSBMSukma Cinta SetiawanBelum ada peringkat
- Contoh Perilaku Pejabat Yang Konstitusional Dan InkonstitusionalDokumen9 halamanContoh Perilaku Pejabat Yang Konstitusional Dan InkonstitusionalAhmad Abdullah100% (1)
- 03 - PH Asam Dan BasaDokumen6 halaman03 - PH Asam Dan BasaNida LestariBelum ada peringkat
- Fungsi Larutan Penyangga Dalam Kehidupan SehariDokumen8 halamanFungsi Larutan Penyangga Dalam Kehidupan SehariDusfirah MajidBelum ada peringkat
- Fungsi Larutan PenyanggaDokumen4 halamanFungsi Larutan PenyanggaNur Desi YaniBelum ada peringkat
- Fungsi Larutan Penyangga Dalam Tubuh Makhluk HidupDokumen4 halamanFungsi Larutan Penyangga Dalam Tubuh Makhluk HidupAlvinFloppeeBelum ada peringkat
- Struktur ProteinDokumen7 halamanStruktur ProteinAndinifthBelum ada peringkat
- LemakDokumen5 halamanLemakAndinifthBelum ada peringkat
- Makalah Pendidikan PancasilaDokumen12 halamanMakalah Pendidikan PancasilaAndinifthBelum ada peringkat
- Artikel Kimia Tentang Peranan Larutan PenyanggaDokumen5 halamanArtikel Kimia Tentang Peranan Larutan PenyanggaAndinifth100% (2)