Oligodinamik Dan Thermal Death Time
Diunggah oleh
AntarezaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Oligodinamik Dan Thermal Death Time
Diunggah oleh
AntarezaHak Cipta:
Format Tersedia
1
Laporan Resmi Praktikum Mikrobiologi Teknik
LAPORAN RESMI
OLIGODINAMIK DAN THERMAL DEATH TIME
I. Tujuan
I.1. Oligodinamik
Tujuan percobaan oligodinamik ini adalah untuk mempelajari pengaruh
keberadaan logam Al, Zn, dan Cu terhadap pertumbuhan mikroorganisme.
I.2. Thermal Death Time
Tujuan percobaan thermal death time adalah untuk mengetahui pengaruh
lamanya waktu pemanasan pada suhu konstan terhadap jumlah koloni
mikroorganisme yang terbentuk.
II. Data Pengamatan
II.1 Oligodinamik
II.2 Thermal Death Time
Percobaan Thermal Death Time dengan menggunakan bakteri Eschericia coli
Tabel II.4 Hasil Pengamatan pada Suhu 65oC dengan pemanasan t=0 menit
Kotak Jumlah
Run Total sel /
A B C D E
kotak
1 7 6 4 2 8 27 5,4
Tabel II.5 Hasil Pengamatan pada Suhu 65oC dengan pemanasan t=5 menit
Kotak Jumlah
Run Total sel /
A B C D E
kotak
1 5 5 6 2 4 22 4,4
Tabel II.6 Hasil Pengamatan pada Suhu 65oC dengan pemanasan t=10 menit
Kotak Jumlah
Run Total sel /
A B C D E
kotak
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
2
Laporan Resmi Praktikum Mikrobiologi Teknik
1 5 3 3 2 5 18 3.6
Tabel II.7 Hasil Pengamatan pada Suhu 65oC dengan pemanasan t=15 menit
Kotak Jumlah
Run Total sel /
A B C D E
kotak
1 5 6 3 0 3 17 3,4
Tabel II.8 Hasil Pengamatan pada Suhu 65oC dengan pemanasan t=20 menit
Kotak Jumlah
Run Total sel /
A B C D E
kotak
1 3 2 2 3 1 11 2,2
Tabel II.9 Data Percobaan Thermal Death Time sebagai Acuan Pembuatan
Grafik
Jumlah Sel
Waktu Log jumlah sel % Kematian rata-
(menit) Bakteri
bakteri rata/ menit
(per ml sampel)
0 1350000 6,130334 -
5 1100000 6,041393 3,703704%
10 900000 5,954243 3,636364%
15 850000 5,929419 1,111111%
20 550000 5,740363 7,058824%
Average 3,8775%
III. Pembahasan
III.1 Oligodinamik
Percobaan ini bertujuan untuk mengetahui pengaruh logam berat terhadap
pertumbuhan bakteri. Dalam percobaan ini, logam yang digunakan adalah Cu dan
Al serta mikroorganisme yang digunakan adalah bakteri Escherichia coli dan
bakteri Azotobacter chroococcum. Efek oligodinamik adalah kemampuan
sejumlah kecil logam berat untuk mendesak efek kematian pada sel bakteri.
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
3
Laporan Resmi Praktikum Mikrobiologi Teknik
Logam tertentu dan senyawa logam dalam sekian kuantitas larutan per menit
memiliki kemampuan untuk mengubah dan akhirnya membunuh sel-sel
mikroorganisme. Logam oligodinamik, seperti alumunium, seng dan tembaga,
telah sejak lama digunakan sebagai desinfektan untuk bakteri tak berspora dan
virus.
(Benson, 2001)
Kemampuan sebagian kecil logam berat terutama perak dan tembaga untuk
menghambat pertumbuhan mikroorganisme disebut oligodinamik. Mekanisme
terjadinya daya oligodinamik adalah saat sebagian kecil dari logam berdifusi,
substansi tersebut menghambat pertumbuhan mikroorganisme di sekitar logam.
Efek ini dikeluarkan oleh logam berat pada mikroba yang akhirnya menghasilkan
denaturasi. Tembaga (Cu) dalam bentuk tembaga sulfat atau bentuk murni lain,
mengandung zat aditif yang biasanya digunakan untuk menghilangkan alga hijau
yang biasanya tumbuh di recervoir, kolam ikan, kolam renang, dan aquarium.
(Tortora, 2010)
Langkah pertama adalah menyiapkan 6 buah tabung reaksi dan
mengisinya dengan media NBA (Nutrien Broth Agar), kemudian menutup tabung
reaksi tersebut dengan kapas berlemak. Setelah itu, menyiapkan 7 petridish dan
membungkusnya dengan kertas cokelat. Salah satu petridish diisi dengan NBA
sebagai media blanko nantinya.
Selanjutnya, mensterilkan alat dan media yang akan digunakan didalam
autoclave selama 15 menit dengan suhu 1210C dengan tujuan untuk membunuh
mikroorganisme yang tidak diinginkan. Hal ini dapat terjadi karena autoclave
menggunakan uap air dalam tekanan sebagai pensterilnya. Bila ada kelembapan
(uap air) mikroorganisme akan terkoagulasi dan dirusak pada temperatur yang
lebih rendah, dibandingkan bila tidak ada kelembapan.
( Tortora, 2010)
Kemudian menginokulasikan bakteri Escherichia coli dan Azotobacter
chroococcum di dalam incase menggunakan kawat ose yang dipijarkan terlebih
dahulu agar mikroorganisme yang tidak diinginkan tidak terikut terinokulasi.
Selagi menginokulasi, logam Cu, Zn dan Al dicuci menggunakan larutan HNO3
10% untuk membentuk ion-ion logam dan membersihkan logam dari kerak,
endapan, atau kotoran yang menempel dan zat lainnya yang dapat mempengaruhi
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
4
Laporan Resmi Praktikum Mikrobiologi Teknik
daya oligodinamik. Reaksi yang terjadi saat logam-logam tersebut dicuci dengan
HNO3:
Cu + 2HNO3 → Cu2+ + 2NO3- + H2
2Al + 6HNO3 → 2Al3+ + 6NO3- + 3H2
Zn + 2HNO3 → Zn2+ + 2NO3- + 3H2
Lalu mencuci dengan aquadest agar netral dan steril, karena apabila pH logam
menjadi asam (pH<7) dapat mengganggu pertumbuhan mikroba. Setelah itu,
mengeringkan logam dengan cara memanaskan di atas api bunsen agar bebas dari
mikroorganisme yang tidak diinginkan. Selanjutnya meletakkan logam Cu, Zn
dan Al di tengah-tengah 6 buah petridish. Lalu menuangkan media yang telah
berisi bakteri Azotobacter chroococcum ke petridish 1 yang berisi logam Cu,
petridish 2 berisi logam Zn dan petridish 3 yang berisi logam Al. Kemudian
menuangkan media yang telah berisi bakteri Escherichia coli ke petridish 4 yang
berisi logam Cu, petridish 5 yang berisi logam Zn dan petridish 6 yang berisi
logam Al. Setelah itu mendiamkan beberapa saat sampai media mengeras,
kemudian menginkubasikan dalam inkubator 30ºC selama 24 jam dan 48 jam
Pada pengamatan setelah 24 jam untuk bakteri Azotobacter chroococcum,
untuk logam Cu yang berdiameter 1,5 cm, terdapat zona bebas bakteri dengan
diameter 2 cm. Bentuk koloni yaitu bulat merata dan berwarna putih. Pada
pengamatan setelah 48 jam untuk bakteri Acetobacter chroococcum, untuk logam
Cu yang berdiameter 1,5 cm, terdapat zona bebas bakteri dengan diameter 2,5 cm.
Bentuk koloni yaitu bulat merata dan berwarna putih.
Gambar III. 1 Percobaan bakteri Azotobacter chroococcum dengan logam Cu
pada 24 jam (kiri) dan 48 jam (kanan)
Pada pengamatan setelah 24 jam untuk bakteri Azotobacter chroococcum
untuk logam Al yang berdiameter 1,2 cm, tidak memiliki zona bebas bakteri.
Bentuk koloni yaitu bulatan merata, dan berwarna putih. Pada pengamatan setelah
48 jam untuk bakteri Azotobacter chroococcum untuk logam Al yang berdiameter
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
5
Laporan Resmi Praktikum Mikrobiologi Teknik
1,2 cm, tidak memiliki zona bebas bakteri. Bentuk koloni yaitu bulatan merata,
dan berwarna putih.
Gambar III. 2 Percobaan bakteri Azotobacter chroococcum dengan logam Al
pada 24 jam (kiri) dan 48 jam (kanan)
Pada pengamatan setelah 24 jam untuk bakteri Azotobacter chroococcum
untuk logam Zn dengan diameter 2 cm, logam tidak ditumbuhi bakteri dengan
koloni berbentuk bulat metata dan berwarna putih, dengan daerah bebas bakteri
berdiameter 2,5 cm. Pada pengamatan setelah 48 jam untuk bakteri Azotobacter
chroococcum untuk logam Zn dengan diameter 2 cm, logam tidak ditumbuhi
bakteri dengan koloni berbentuk bulat metata dan berwarna putih, dengan daerah
bebas bakteri berdiameter 2,8 cm.
Gambar III. 3 Percobaan bakteri Azotobacter chroococcum dengan logam Zn
pada 24 jam (kiri) dan 48 jam (kanan)
Pada pengamatan setelah 24 jam untuk bakteri Escherichia coli, untuk
logam Cu yang berdiameter 1,5 cm, terdapat zona bebas bakteri dengan diameter
0 cm. Bentuk koloni yaitu bulat kecil dan berwarna putih. Pada pengamatan
setelah 48 jam untuk bakteri Escherichia coli untuk logam Cu yang berdiameter
1,5 cm, terdapat zona bebas bakteri dengan diameter 0 cm. Bentuk koloni yaitu
bulat kecil dan berwarna putih.
Gambar III. 4 Percobaan bakteri Escherichia coli dengan logam Cu pada 24 jam
(kiri) dan 48 jam (kanan)
Pada pengamatan setelah 24 jam untuk bakteri Escherichia coli untuk
logam Al yang berdiameter 2 cm, tidak memiliki zona bebas bakteri. Bentuk
koloni yaitu bulatan kecil, dan berwarna putih. Pada pengamatan setelah 48 jam
untuk bakteri Escherichia coli untuk logam Al yang berdiameter 2 cm, tidak
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
6
Laporan Resmi Praktikum Mikrobiologi Teknik
memiliki zona bebas bakteri. Bentuk koloni yaitu bulatan kecil, dan berwarna
putih.
Gambar III. 5 Percobaan bakteri Escherichia coli dengan logam Al pada 24 jam
(kiri) dan 48 jam (kanan)
Pada pengamatan setelah 24 jam untuk bakteri Escherichia coli untuk
logam Zn dengan diameter 2 cm, logam tidak ditumbuhi bakteri dengan koloni
berbentuk bulat kecil dan berwarna putih, dengan daerah bebas bakteri
berdiameter 3 cm. Pada pengamatan setelah 48 jam untuk bakteri Escherichia coli
untuk logam Zn dengan diameter 2 cm, logam tidak ditumbuhi bakteri dengan
koloni berbentuk bulat kecil dan berwarna putih, dengan daerah bebas bakteri
berdiameter 3,3 cm.
Gambar III. 6 Percobaan bakteri Escherichia coli dengan logam Zn pada 24 jam
(kiri) dan 48 jam (kanan)
III.2 Thermal Death Time
Pada praktikum ini dikenal dua istilah untuk menyatakan resistensi
mikroba terhadap panas yaitu Thermal Death Time (TDT) dan Decimal Reduction
Time (DRT). Dua cara yang dapat dilakukan untuk pembandingan adalah thermal
death point dan thermal death time. Thermal death point (TDP) adalah suhu
dimana organisme terbunuh dalam waktu 10 menit. Thermal death time (TDT)
adalah waktu yang dibutuhkan untuk membunuh suspensi sel atau spora pada
suhu tertentu. Karena faktor yang bermacam-macam seperti pH, kelembapan,
medium, dan umur sel sangat menentukan hasil, variabel ini harus dijabarkan
dengan jelas.
(Benson, 2001)
Percobaan ini bertujuan untuk mengetahui waktu terpendek yang
dibutuhkan untuk membunuh mikroorganisme pada suhu dan kondisi tertentu
serta mengetahui % kematian rata-rata/menit. Langkah pertama adalah melakukan
sterilisasi pada alat-alat yang dibutuhkan pada percobaan ini, yaitu 1 erlenmeyer
dan 4 buah tabung reaksi. Sterilisasi dilakukan dengan cara mencuci alat-alat
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
7
Laporan Resmi Praktikum Mikrobiologi Teknik
tersebut dengan alkohol. Selanjutnya memasukkan 50 ml larutan isotonik ke
dalam 1 erlenmeyer. Kemudian, menginokulasi bakteri Escherichia coli ke dalam
erlenmeyer yang berisi 50 ml larutan isotonik. Inokulasi harus dilakukan di dalam
incase. Saat sebelum melakukan inokulasi, sebelumnya kawat ose harus dibakar
terlebih dahulu sampai kawat ose terlihat membara. Tujuannya adalah agar kawat
ose steril, tidak terkontaminasi dengan mikroorganisme lain. Setelah dibakar,
kawat ose harus didinginkan dulu agar pada saat mengambil biakan
mikroorganisme tidak mati akibat suhu yang panas dari kawat ose. Inokulasi
dilakukan sebanyak 5 loop, apabila terlalu pekat atau encer akan mempersulit
pengamatan.
Selanjutnya, biakan tersebut dibagi kedalam 4 tabung reaksi sejumlah 10
ml sama besar dan dipanaskan dengan suhu 65°C dengan variabel waktu yang
berbeda-beda yakni 5 menit, 10 menit, 15 menit dan 20 menit.
Penghitungan sel bakteri dalam masing-masing biakkan sesuai variabel
waktunya dihitung dengan menggunakan hemasitometer. Kotak yang terdapat
dalam hemasitometer berjumlah 9. Setiap perseginya memiliki panjang sisi 1mm.
Area penghitungan yang berada di tengah pada hemasitometer memiliki 25 kotak
besar dan setiap kotaknya memiliki 16 kotak kecil. Bila dihitung, sel hanya
dihitung pada baris diantara dua sisi dari kotak besar untuk mencegah
penghitungan sel dua kali. Pada percobaan ini, penghitungan jumlah sel diwakili
oleh 5 area dari 25 area kotak besar pada Counting area (lihat pada Gambar III.1).
Untuk tiap 9 kotak besar, termasuk kotak tengah Counting area yang terdiri dari
25 kotak sedang, yang memiliki luasan masing-masing kotaknya 1/25 mm²,
dengan ketebalan deck glass yakni 0.1mm diatas permukaan Counting Chamber.
Maka total volume untuk masing-masing kotak kecil yakni 1/25 mm² x 0.1mm =
0.004 mm³.
(www.vivo.clostate.edu)
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
8
Laporan Resmi Praktikum Mikrobiologi Teknik
Gambar III.7 Hemocytometer counting area
Setiap spesies memerlukan kisaran suhu tertentu untuk pertumbuhannya.
Mikroorganisme dapat dibagi menjadi 3 golongan atas dasar suhu yang sesuai
untuk menunjang kehidupannya, yaitu:
1. Bakteri psikrofil, yaitu bakteri yang hidup pada daerah suhu antara 0°
30 °C, dengan suhu optimum 15 °C.
2. Bakteri mesofil, yaitu bakteri yang hidup di daerah suhu antara 15° –
55 °C, dengan suhu optimum 25° – 40 °C
3. Bakteri termofil, yaitu bakteri yang dapat hidup di daerah suhu tinggi
antara 40° – 75 °C, dengan suhu optimum 50 - 65 °C
(www.boundless.com)
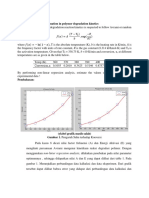
Berdasarkan Tabel II.9 terlihat bahwa semakin lama pemanasan yang
dilakukan, jumlah bakteri Escherichia coli semakin sedikit. Escherichia coli
memiliki suhu optimum pada 37°C semakin tinggi temperatur lingkungannya,
maka jumlah bakteri akan semakin sedikit dan mati. Dari jumlah sel yang didapat
pada penghitungan dengan hemasitometer, kemudian dibuat grafik (lihat grafik
III.1) dengan perbandingan antara jumlah bakteri dalam satuan logaritmik dengan
waktu pemanasan yang dilakukan dalam percobaan.
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
9
Laporan Resmi Praktikum Mikrobiologi Teknik
Gambar III.4 Grafik Hubungan Antara Waktu vs log ∑ sel
Dari grafik tersebut dapat diperoleh regresi linier y = -0.0178x + 6.1375
dimana dari regresi ini dapat diperoleh waktu pemanasan yang dibutuhkan untuk
mematikan seluruh bakteri yang terdapat dalam larutan tersebut. Pada dasarnya,
tidak mungkin untuk membuktikan bahwa semua mikroorganisme telah hancur,
karena kelangsungan hidup suatu mikroorganisme individu tidaklah pernah nol,
untuk itu terdapat suatu parameter atau standar internasional untuk menyatakan
jumlah bakteri paling minimum yang dapat dikatakan sudah dianggap steril yakni
dengan aturan SAL. SAL (Sterility Assurance Level) merupakan kemungkinan
untuk membuat suatu proses pada bidang mikrobiologi menjadi steril. 10 -6
merupakan standar yang direkomendasikan sebagai probabilitas kelangsungan
hidup organisme pada perangkat yang disterilkan. Tingkat ini berarti bahwa ada
kurang dari atau sama dengan satu kesempatan dalam sejuta item yang
terkontaminasi atau tidak steril
(www.nitritex.com)
Dari hasil perhitungan jumlah sel hingga grafik untuk mendapatkan
regresinya, dengan memasukan nilai standar SAL yaitu 10 -6 kemudian dibuat
satuan logaritmik, maka waktu yang dibutuhkan untuk mensterilkan larutan
terhadap bakteri Escherichia coli adalah sebesar 681,882 menit dan persen
kematian rata-rata per menitnya diperoleh sebesar 0,324937 %.
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
10
Laporan Resmi Praktikum Mikrobiologi Teknik
IV. Jawaban Pertanyaan
Oligodinamik
1. Sebutkan logam-logam lain yang mempunyai daya oligodinamik, jelaskan!
Jawab:
Daya oligodinamik adalah suatu daya bunuh logam berat pada kadar
rendah. Logam-logam yang termasuk memiliki daya oligodinamik antara lain:
Hg = Pada zaman dahulu digunakan sebagai antiseptik dan desinfektan namun
sekarang sudah tidak lagi digunakan karena bersifat racun dan dapat menimbulkan
alergi.
Ag = Air perak sejak berabad-abad yang lalu dikenal sebagai antimikrobial untuk
melawan infeksi. Ion Ag+ juga mampu merusak sistem enzim dalam membran sel
patogen. Sifat ion perak yang bersifat racun dalam sel hidup tersebut disebut efek
oligodinamik.
Au = Logam emas juga berbentuk logam yang berdaya oligodinamik. Au yang
berada paling kanan dalam deret volta dapat dikatakan berdaya oligodinamik
tinggi
2. Perbedaan apakah yang tampak pada pertumbuhan Escherichia Coli dan
Bacillus ?
Jawab:
Eschericia coli dan Azotobacter crococcum merupakan salah satu jenis
bakteri gram negatif dimana bakteri gram negatif kurang resisten terhadap
pengaruh daya oligodinamik. Namun, berdasar percobaan Escherichia coli tidak
lebih tahan (resisten) terhadap logam berat daripada Azotobacter chrococcum
ditunjukkan dengan diameter zona bebas bakteri Azotobacter chrococcum lebih
kecil daripada Escherichia coli. Hal ini dikarenakan daya oligodinamik suatu
logam juga bergantung pada jenis mikroorganisme yang akan dihambatnya.
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
11
Laporan Resmi Praktikum Mikrobiologi Teknik
Koloni bakteri Azotobacter chrococcum menyebar merata diseluruh media di luar
zona bebas bakteri..
3. Mengapa logam sebelum digunakan harus dicuci dulu dengan HNO3?
Jawab :
Logam dicuci dengan HNO3 untuk membentuk ion-ion logam dan juga
membersihkan logam dari endapan, kerak, ataupun kotoran lainnya.
4. Apakah pengaruhnya bila logam tersebut digunakan untuk bahan konstruksi
alat fermentasi? Jelaskan!
Jawab :
Fermentasi adalah proses produksi energi dalam sel dalam keadaan
anaerobik (tanpa oksigen). Secara umum, fermentasi adalah salah satu bentuk
respirasi anaerobik, akan tetapi, terdapat definisi yang lebih jelas yang
mendefinisikan fermentasi sebagai respirasi dalam lingkungan anaerobik dengan
tanpa akseptor elektron eksternal. Pelakunya ialah mikroorganisme anaerob
fakultatif atau anaerob obligat.
Thermal Death Time
1. Jelaskan:
a. Thermal Death Time : Waktu yang diperlukan untuk membunuh suatu
jenis mikroba pada suatu temperatur yang tetap.
b. Thermal Death Rate : Kecepatan kematian mikroba akibat pemberian
temperatur.
c. Thermal Death Point : Nilai temperatur serendah-rendahnya yang dapat
mematikan jenis mikroba yang berada dalam medium standar selama 10
menit dalam kondisi tertentu.
(Tortora, 2010)
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
12
Laporan Resmi Praktikum Mikrobiologi Teknik
2. Faktor-faktor yang menentukan Thermal Death Time dan Thermal Death Rate
antara lain:
a. Banyaknya air dalam suatu medium
Semakin banyak kadar air dalam suatu medium, semakin rendah
temperatur yang dibutuhkan untuk mematikan suatu bakteri.
b. Banyaknya air dalam suatu organisme
Semakin banyak kadar air dalam suatu mikroorganisme, semakin rendah
tingkat resistansinya.
c. Konsentrasi ion hidrogen dalam suatu medium
Semakin tinggi kadar keasaman dan alkalinitas, suhu yang dibutuhkan
untuk mematikan bakteria akan semakin rendah.
d. Komposisi dari suatu medium
Media yang mengandung konsentrasi protein dan albumin yang tinggi
biasanya akan menaikkan suhu yang dibutuhkan untuk menhacurkan
bakteri.
e. Umur sel
Sel yang umurnya lebih tua lebih resisten terhadap kondisi lingkungan
yang beragam dibandingkan dengan sel yang masih muda.
f. Ada tidaknya spora pada kultur dari organisme pembentuk spora
Adanya spora pada mikroorganisme akan meningkatkan daya tahan
bakteri terhadap suhu tinggi, sehingga akan menyebabkan tingginya
suhu untuk mematikian mikroorganisme.
g. Suhu inkubasi dari kultur-kultur yang diperoleh
Kisaran suhu kamar 24-270C adalah suhu yang tepat untuk
menginkubasikan suatu mikroorganisme.
3. Dalam hal apakah (bidang apakah) percobaan ini diterapkan, jelaskan!
Percobaan ini biasanya diterapkan dalam bidang pengawetan makanan dan
pengalengan makanan atau minuman olahan.
4. Metode apakah yang paling efektif untuk sterilisasi liquida yang mungkin
mengandung bakteri pembentuk spora?
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
13
Laporan Resmi Praktikum Mikrobiologi Teknik
Metode yang paling efektif adalah pasteurisasi. Metode ini biasa
digunakan untuk mensterilisasi susu, beer, dan wine. Metode pasteurisasi yang
paling sering digunakan adalah High temperature short time [HTST]
pasteurization, yaitu metode pasteurisasi yang dilakukan pada suhu 73˚C dan
hanya memakan waktu 15 detik.
(Tortora, 2010)
5. Bagaimana cara saudara melakukan suatu eksperimen untuk menentukan
waktu TDT dan E.coli? Mulailah dengan data-data yang telah saudara
dapatkan dalam percobaan!
a. Pertama, menentukan terlebih dahulu pada suhu berapa Eschericia coli
dapat hidup berdasarkan literatur. Ini untuk menentukan berapa suhu
pemanasan yang sesuai dalam percobaan.
b. Kedua, menghitung jumlah koloni pada masing-masing petridish yang
berbeda variabel waktu pemanasannya, dikalikan dengan nilai pengenceran
dan dikalikan dengan banyaknya media dalam masing-masing petridish.
Didapatkan jumlah bakteri yang sebenarnya.
c. Selanjutnya, membuat grafik, dengan sumbu x sebagai waktu pemanasan
dan sumbu y sebagai log jumlah bakteri. Maka akan didapatkan persamaan
untuk menghitung waktu tersingkat untuk membunuh mikroorganisme
yang diuji.
V. Kesimpulan
V.1 Oligodinamik
1. Logam Cu mempunyai daya oligodinamik terhadap bakteri Escherichia
coli dan bakteri Azotobacter crococcum.
2. Logam Zn memiliki daya oligodiamik terhadap jamur Aspergillus niger
dan bakteri Azotobacter crococcum yang lebih kuat disbanding dengan Zn.
3. Logam Al tidak mempunyai daya oligodinamik terhadap bakteri
Escherichia coli dan bakteri Azotobacter crococcum.
V.2 Thermal Death Time
Berdasarkan percobaan Thermal Death Time yang telah dilakukan, dapat
disimpulkan bahwa semakin lama waktu pemanasan pada media yang
mengandung bakteri, semakin banyak jumlah bakteri yang mati, dari percobaan
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
14
Laporan Resmi Praktikum Mikrobiologi Teknik
ini, didapatkan Thermal Death Time selama 681,882 menit dengan % kematian
rata-rata / menit adalah 0,324937 %.
Daftar Pustaka
Anonim. 2016. https://www.boundless.com/microbiology/textbooks/boundless-
microbiology-textbook/culturing-microorganisms-6/temperature-and-
microbial-growth-64/growth-rate-and-temperature-387-4713, diakses pada
hari Minggu, 10 April 2016, pukul 19.35.
Benson. 2001. Microbiological Applications Lab Manual, Eighth Edition. USA:
The McGraw−Hill Companies.
Rouge, Melissa, 2002. Counting Cells with a Hemacytometer.
http://www.vivo.colostate.edu/hbooks/pathphys/reprod/semeneval/hemacytome
ter.html, diakses pada hari Minggu, 10 April 2016, pukul 20.10.
Nitritex Ltd, 2016. http://www.nitritex.com/news.php?article=355, diakses pada
hari Minggu, 10 April 2016, pukul 20.30.
Tortora, Gerrars J. 2010. Microbiology an Indtroduction Tenth Edition. San
Francisco: Peasrson
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
15
Laporan Resmi Praktikum Mikrobiologi Teknik
APPENDIKS
Pemanasan 0 menit :
Jumlah bakteri rata-rata = 5,4
Jumlah bakteri = 5,4 x (1/(1/25)) sel / mm2
= 135 sel / mm2
Jumlah bakteri = [135 sel/mm2 x (1/0,1)] sel / mm3
=1350 sel / mm3
Jumlah sel ragi pada pemanasan 0menit = 1350 sel / mm3 x (1 mm3/0,001ml)
= 1.350.000 sel/ml sampel
Pemanasan 5 menit :
Jumlah bakteri rata-rata = 4,4
Jumlah bakteri = 4,4 x (1/(1/25)) sel / mm2
= 110 sel / mm2
Jumlah bakteri = [ sel/mm2 x (1/0,1)] sel / mm3
= 1100 sel / mm3
Jumlah sel ragi pada pemanasan 5 menit = 90 sel / mm3 x (1 mm3/0,001ml)
= 1.100.000 sel/ml sampel
Pemanasan 10 menit :
Jumlah bakteri rata-rata = 3,6
Jumlah bakteri = 3,6 x (1/(1/25)) sel / mm2
= 90 sel / mm2
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
16
Laporan Resmi Praktikum Mikrobiologi Teknik
Jumlah bakteri = [ 90 sel/mm2 x (1/0,1)] sel / mm3
= 900 sel / mm3
Jumlah sel ragi pada pemanasan 10 menit = 900 sel / mm3 x (1 mm3/0,001ml)
= 900.000 sel/ml sampel
Pemanasan 15 menit :
Jumlah bakteri rata-rata = 3,4
Jumlah bakteri = 3,4 x (1/(1/25)) sel / mm2
= 85 sel / mm2
Jumlah bakteri = [ 85 sel/mm2 x (1/0,1)] sel / mm3
= 850 sel / mm3
Jumlah sel ragi pada pemanasan 15 menit = 850 sel / mm3 x (1 mm3/0,001ml)
= 850.000 sel/ml sampel
Pemanasan 20 menit :
Jumlah bakteri rata-rata = 2,2
Jumlah bakteri = 2,2 x (1/(1/25)) sel / mm2
= 55 sel / mm2
Jumlah bakteri = [ 55 sel/mm2 x (1/0,1)] sel / mm3
= 550 sel / mm3
Jumlah sel ragi pada pemanasan 20 menit = 550 sel / mm3 x (1 mm3/0,001ml)
= 550.000 sel/ml sampel
Thermal Death Time
y = Log 10-6
Log 10-6 = -0,0178x + 6,1615
-6 = -0,0178x + 6,1375
0,0178x = 12,1375
x = 681,882
Laboratorium Mikrobiologi Teknik
Jurusan Teknik Kimia FTI-ITS
Anda mungkin juga menyukai
- Laporan Kerja Praktik - Ulfa Izza Aprilla (104216068)Dokumen69 halamanLaporan Kerja Praktik - Ulfa Izza Aprilla (104216068)anwar318Belum ada peringkat
- DMT Dari Asam Tereftalat Dan MeOH 60000Dokumen425 halamanDMT Dari Asam Tereftalat Dan MeOH 60000ZiimiinBelum ada peringkat
- StoikiometriDokumen19 halamanStoikiometriCi SymoChaBelum ada peringkat
- Executive Summary Tugas Perancangan Pabrik KimiaDokumen11 halamanExecutive Summary Tugas Perancangan Pabrik Kimiakresna suryadiBelum ada peringkat
- Laporan 1 FullDokumen48 halamanLaporan 1 FullLiona Margarita100% (1)
- Proposal Peminjaman Laboratorium - MilaDokumen35 halamanProposal Peminjaman Laboratorium - MilaFransiska MilaBelum ada peringkat
- Teknik LaboratoriumDokumen19 halamanTeknik Laboratoriumindriana megaBelum ada peringkat
- Contoh Soal Keselamatan Pabrik KimiaDokumen2 halamanContoh Soal Keselamatan Pabrik KimiaUllia IsmalaBelum ada peringkat
- Bab X. Ekstraksi & Purifikasi EnzimDokumen36 halamanBab X. Ekstraksi & Purifikasi Enzimsatrio wekaBelum ada peringkat
- Tugas Studi KasusDokumen6 halamanTugas Studi KasusAnnisa Syafitri KBelum ada peringkat
- Perancangan Reaktor AmoniaDokumen16 halamanPerancangan Reaktor AmoniaBayu_SeBelum ada peringkat
- Laporan BagusDokumen96 halamanLaporan Bagusrizki rani100% (1)
- 08 161menujukloningterapeutikdenganteknikscntDokumen5 halaman08 161menujukloningterapeutikdenganteknikscntAmilul KhoirBelum ada peringkat
- Bab IvDokumen14 halamanBab IvImamBelum ada peringkat
- Modul 5. Distilasi BatchDokumen12 halamanModul 5. Distilasi BatchIvan FadhillahBelum ada peringkat
- Biofertilizer Berbasis MikroalgaDokumen3 halamanBiofertilizer Berbasis MikroalgaMayadita Dwi SaniBelum ada peringkat
- Laporan Tugas Praktikum Pengendalian Proses Teknik Kimia Basic Flow ControlDokumen16 halamanLaporan Tugas Praktikum Pengendalian Proses Teknik Kimia Basic Flow ControlMUHAMMAD FATHI RIZQILLAHBelum ada peringkat
- TK4103 Keselamatan Pabrik Proses UTSDokumen27 halamanTK4103 Keselamatan Pabrik Proses UTSfachry hafidzBelum ada peringkat
- Laporan Tugas Praktikum Pengendalian Proses Teknik Kimia: Nama: Muhammad Fathi Rizqillah NIM: 3335200108Dokumen13 halamanLaporan Tugas Praktikum Pengendalian Proses Teknik Kimia: Nama: Muhammad Fathi Rizqillah NIM: 3335200108MUHAMMAD FATHI RIZQILLAHBelum ada peringkat
- Modul 7A Hysys - Aliran RecycleDokumen11 halamanModul 7A Hysys - Aliran RecycleAnita FauziyahBelum ada peringkat
- Jenis2 ReaktorDokumen6 halamanJenis2 ReaktorMuhibIb100% (1)
- Pertemuan Ke-6 - Chemical Reaction Equilibrium Dengan GoalseekDokumen7 halamanPertemuan Ke-6 - Chemical Reaction Equilibrium Dengan GoalseekPT. Global indo PowerBelum ada peringkat
- Pik NitrasiDokumen14 halamanPik NitrasiAnonymous XuRLhZ9PM0Belum ada peringkat
- Bundel CPNS Daerah 01Dokumen28 halamanBundel CPNS Daerah 01Naim NhysintaBelum ada peringkat
- Tugas 7 PPTKDokumen3 halamanTugas 7 PPTKFebri5awalsyahBelum ada peringkat
- BAB II IzzurDokumen6 halamanBAB II IzzurAry OctavianiBelum ada peringkat
- Makalah PPK Aplikasi Reaktor Fixed Bed Multitube Pembuatan ETBEDokumen27 halamanMakalah PPK Aplikasi Reaktor Fixed Bed Multitube Pembuatan ETBEAyu NurvitaBelum ada peringkat
- Pertumbuhan BakteriDokumen14 halamanPertumbuhan BakteriRestuan Lubis Sudirman100% (1)
- Paper VCMDokumen18 halamanPaper VCMYunita ParvianaBelum ada peringkat
- Teknik Bioremediasi Ex SituDokumen5 halamanTeknik Bioremediasi Ex SituIsma RiskianiBelum ada peringkat
- Simulasi CESTR Pada Software Scilab 5.1.1Dokumen32 halamanSimulasi CESTR Pada Software Scilab 5.1.1ArfienoJefryKBelum ada peringkat
- Makalah BiohidrogenDokumen18 halamanMakalah BiohidrogenAnshari Kurniawan100% (2)
- TPS Eduka 1-12 PDFDokumen351 halamanTPS Eduka 1-12 PDFAdief Haryagung NugrahaBelum ada peringkat
- Pra Rancangan Pabrik Monemer Vinil KloridaDokumen15 halamanPra Rancangan Pabrik Monemer Vinil KloridaIntan Elvina100% (1)
- Prima Anggraini - 1514904Dokumen298 halamanPrima Anggraini - 1514904AreIf Cron BmxStreetBelum ada peringkat
- Makalah TRK 3Dokumen7 halamanMakalah TRK 3Mawaddah Nur TambakBelum ada peringkat
- Bab 2 Enero FarahDokumen21 halamanBab 2 Enero FarahRuthy Yulianti SusantoBelum ada peringkat
- Prob 8 Dan Prob 9Dokumen9 halamanProb 8 Dan Prob 9Daning Kinanti SutamaBelum ada peringkat
- Proposal Penelitian Kak MahdiDokumen12 halamanProposal Penelitian Kak MahdirenyBelum ada peringkat
- Tugas Responsi A-3Dokumen4 halamanTugas Responsi A-3Yoga PerdanaBelum ada peringkat
- Makalah Reaktor MembranDokumen26 halamanMakalah Reaktor MembranSergie Purnaman100% (1)
- Bab 8Dokumen6 halamanBab 8ratihpujiaBelum ada peringkat
- Proposal EpiklorohidrinDokumen8 halamanProposal EpiklorohidrinToha NasrunBelum ada peringkat
- Kel 8 PolimerDokumen32 halamanKel 8 PolimerdwindahaidarBelum ada peringkat
- NASKAHDokumen68 halamanNASKAHRizky Azizul AfniBelum ada peringkat
- Ethyl Acryate Chapter 1 12 Maret 2017Dokumen25 halamanEthyl Acryate Chapter 1 12 Maret 2017Abdullah Abdul100% (2)
- Laporan ScreeningDokumen5 halamanLaporan ScreeningSayyida ZainahBelum ada peringkat
- Jose Richard Manurung - D-12 - Laporan Abrospsi Gas PDFDokumen27 halamanJose Richard Manurung - D-12 - Laporan Abrospsi Gas PDFPutri SilalahiBelum ada peringkat
- Solfac 10WP MSDSDokumen5 halamanSolfac 10WP MSDSSadhana SentosaBelum ada peringkat
- 1553208143Dokumen59 halaman1553208143NurRiskawati100% (1)
- ITS Paper 37681 4309100085 Paper PDFDokumen6 halamanITS Paper 37681 4309100085 Paper PDFChristy SelevanBelum ada peringkat
- Risk Assessment BAB XI EdunexDokumen36 halamanRisk Assessment BAB XI Edunexpanji rahmanBelum ada peringkat
- Proposal RiakDokumen22 halamanProposal RiakDian Remarthin GirsangBelum ada peringkat
- Laporan Praktikum Biologi EnzimDokumen13 halamanLaporan Praktikum Biologi EnzimMonika UrsulaBelum ada peringkat
- Jurnal Fatty AcidDokumen7 halamanJurnal Fatty AcidindahBelum ada peringkat
- Antiseptik Dan Desinfektan Senin XIIIDokumen15 halamanAntiseptik Dan Desinfektan Senin XIIIAndika DwimasBelum ada peringkat
- Laporan Praktikum Mikrobiologi Teknik - Turbidimetri Dan Counting Chamber - NovitaDokumen16 halamanLaporan Praktikum Mikrobiologi Teknik - Turbidimetri Dan Counting Chamber - NovitaNovita Eka RahmawatiBelum ada peringkat
- Pengaruh Desinfektan Dan Antiseptik Terhadap Pertumbuhan BakteriDokumen23 halamanPengaruh Desinfektan Dan Antiseptik Terhadap Pertumbuhan BakteriNiswatun ChasanahBelum ada peringkat
- Antiseptik, Desinfektan Dan Thermal Death TimeDokumen19 halamanAntiseptik, Desinfektan Dan Thermal Death TimeYesaya Reuben NatanaelBelum ada peringkat
- Tugas Bu LilyDokumen10 halamanTugas Bu LilyAntarezaBelum ada peringkat
- SolurDokumen7 halamanSolurAntarezaBelum ada peringkat
- Kumpulan2 Untuk Bab 3Dokumen5 halamanKumpulan2 Untuk Bab 3AntarezaBelum ada peringkat
- Kumpulan2 CoretanDokumen3 halamanKumpulan2 CoretanAntarezaBelum ada peringkat
- SeedingwbavebDokumen10 halamanSeedingwbavebErwin KurniaBelum ada peringkat
- Cara Mengisi BMC: Segments Mencakup Si Penjual Barang Dan Pembeli Sesuai Dengan KebutuhanDokumen5 halamanCara Mengisi BMC: Segments Mencakup Si Penjual Barang Dan Pembeli Sesuai Dengan KebutuhanAntarezaBelum ada peringkat
- Bab Iii OligodinamikDokumen2 halamanBab Iii OligodinamikAntarezaBelum ada peringkat
- Laporan Sementara Simulasi Membran FixxxxDokumen2 halamanLaporan Sementara Simulasi Membran FixxxxAntarezaBelum ada peringkat
- 1-2 Paralel CounterflowDokumen21 halaman1-2 Paralel CounterflowAntarezaBelum ada peringkat
- Analisis Iodat - Nelson S.Dokumen6 halamanAnalisis Iodat - Nelson S.yuzniaBelum ada peringkat
- Kadar CA 2Dokumen2 halamanKadar CA 2AntarezaBelum ada peringkat
- Pompa T MesinDokumen155 halamanPompa T MesinAntareza100% (2)
- 1-2 Paralel CounterflowDokumen21 halaman1-2 Paralel CounterflowAntarezaBelum ada peringkat
- OligodinamikDokumen6 halamanOligodinamikAntarezaBelum ada peringkat
- Laporan Praktikum Penentuan Bilangan AsaDokumen24 halamanLaporan Praktikum Penentuan Bilangan AsaikhsanBelum ada peringkat
- Oligodinamik - Daya Antibakteri Pada Streptococcus Mutans PDFDokumen7 halamanOligodinamik - Daya Antibakteri Pada Streptococcus Mutans PDFAntarezaBelum ada peringkat
- Bab Iii OligodinamikDokumen2 halamanBab Iii OligodinamikAntarezaBelum ada peringkat
- SDS Id IdDokumen16 halamanSDS Id IdfrankieBelum ada peringkat
- Bab I PDFDokumen4 halamanBab I PDFWidia NoerlaeniBelum ada peringkat
- Laporan Praktikum MikrobiologiDokumen10 halamanLaporan Praktikum MikrobiologiAntarezaBelum ada peringkat
- Chapter II PDFDokumen23 halamanChapter II PDFAndi RajuBelum ada peringkat
- EnzimDokumen4 halamanEnzimErlin WinarniiBelum ada peringkat
- Bab III SedimentasiDokumen2 halamanBab III SedimentasiAntarezaBelum ada peringkat
- Laporan Praktikum Mikrobiologi Isolasi MDokumen18 halamanLaporan Praktikum Mikrobiologi Isolasi MgintaniBelum ada peringkat
- BAB 2 ACC (14b)Dokumen12 halamanBAB 2 ACC (14b)AntarezaBelum ada peringkat
- Recycle SticksDokumen6 halamanRecycle SticksAntarezaBelum ada peringkat
- Pengaruh Suhu Larutan Dan Waktu Pencelupan Terhadap Ketebalan Dan Kekerasan Permukaan Lapisan Nikel Pada Baja ST 37 Melalui Proses ElectroplatingDokumen86 halamanPengaruh Suhu Larutan Dan Waktu Pencelupan Terhadap Ketebalan Dan Kekerasan Permukaan Lapisan Nikel Pada Baja ST 37 Melalui Proses ElectroplatingAnggoro BernardiBelum ada peringkat
- Bab1-Besaran Dan SatuanDokumen12 halamanBab1-Besaran Dan SatuanHafizh Al KhawarizmiBelum ada peringkat
- Efek Penambahan Ion Tartrate Terhadap ElektrodeposDokumen4 halamanEfek Penambahan Ion Tartrate Terhadap ElektrodeposAntarezaBelum ada peringkat