Pertemuan 2 Laju Reaksi Utbk
Diunggah oleh
Annisa mustikaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pertemuan 2 Laju Reaksi Utbk
Diunggah oleh
Annisa mustikaHak Cipta:
Format Tersedia
PERTEMUAN 2 PERSIAPAN UTBK
RND PRIVATE
LAJU REAKSI
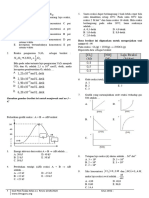
1. Grafik berikut adalah diagram energi untuk suatu reaksi A. Reaksi A→B merupakan tahap penentu laju dan
yang berlangsung dua tahap. endoterm
A. Reaksi A→B merupakan tahap penentu laju dan
eksoterm
B. Reaksi B→C merupakan tahap penentu laju dan
endoterm
C. Reaksi B→C merupakan tahap penentu laju dan
eksoterm
3. Dalam Reaksi:
2HgCl2 + C2O42- → 2Cl- + 2CO2 + Hg2Cl2
Reaksi tahap kedua berlangsung lebih cepat dibandingkan
tahap pertama. Pernyataan yang mendukung pernyataan diperoleh data sebagai berikut:
tersebut adalah….
Percobaan [HgCl2] [C2O42-] Waktu
A. Energi kinetik yang diperlukan untuk terjadinya reaksi (M) [M] (detik)
pada tahap pertama lebih besar dibandingkan pada tahap 1 0,01 0,1 144
kedua 2 0,02 0,4 36
B. Tumbukan pada reaksi tahap kedua lebih sering terjadi 3 0,03 0,5 18
dibandingkan pada tahap pertama 4 0,04 0,8 9
C. Semua tumbukan pada reaksi tahap kedua menghasilkan Berdasarkan data tersebut, maka persamaan laju reaksinya
produk sedangkan reaksi pada tahap pertama tidak. adalah….
D. Energi kinetik partikel pereaksi pada reaksi tahap
A. v = k[HgCl2]2 [C2O42-]2
pertama lebih kecil dibanding energi kinetik partikel
B. v = k[HgCl2] [C2O42-]
pereaksi pada tahap kedua
C. v = k[HgCl2]2
E. Partikel-partikel pereaksi pada reaksi tahap pertama
D. v = k[C2O42-]2
lebih sedikit dibanding partikel pereaksi pada tahap
E. v = k[HgCl2]2 [C2O42-]
kedua
4. Percobaan yang dilakukan untuk mempelajari kinetika
2. Perhatikan diagram reaksi berikut!
kimia dari reaksi :
A+B→P+Q
Memperhatikan hasil sebagai berikut:
Energi (kJ/mol)
Percobaan [A] [B] Laju
H = ? 1 X Y V
2 2X 2Y 4V
3 4X Y V
C
4 4X 4Y 16V
Dari hasil percobaan tersebut dapat disimpulkan bahwa
Pernyataan yang benar terkait diagram reaksi di atas persamaan laju reaksi yang sesuai adalah….
adalah…. A. V = k[A][B]
B. V = k[A]2[B]
C. V = k[A][B]2
D. V = k[B]
E. V = k[B]2
5. Diberikan data percobaan dari reaksi :
Percobaan [NO2] awal (M) Laju reaksi awal (Ms-1)
1 0,01 7,1 x 10-5
2 0,02 28,0 x 10-5
Harga tetapan laju (K) berdasarkan data pada table adalah….
A) 0,01 mol-1 s-1
B) 7,10 x 10-5 s-1
C) 1,4 x 10-2 s-1
D) 0,71 L mol-1 s-1
E) 7,10 L mol-1 s-1
6. Penguraian hidrogen peroksida (H2O2) dalam air terjadi
sesuai reaksi:
2H2O2 (aq) → 2H2O (g) + O2 (g)
Dari 100 mL larutan H2O2 pada saat tertentu teramati laju
pembentukan gas O2 sebesar 4,88 mL/s (pada kondisi
volume 1 mol gas N2 adalah 22,4 L). Pada saat yang sama
laju penguraian H2O2 adalah….
A. 1 x 10-3 M s-1
B. 2 x 10-3 M s-1
C. 4 x 10-3 M s-1
D. 2 x 10-4 M s-1
E. 4 x 10-4 M s-1
7. Untuk reaksi berikut:
H2S (g) + O2 (g) → SO2 (g) + H2O (l) (belum setara)
Bila pada saat tertentu laju pembentukan gas SO2 adalah
6 mol L-1 s-1, maka laju pengurangan gas oksigen
adalah….
(A) 12 mol L-1 s-1
(B) 9 mol L-1 s-1
(C) 6 mol L-1 s-1
(D) 3 mol L-1 s-1
(E) 2 mol L-1 s-1
Anda mungkin juga menyukai
- Kinetika Reaksi Saponifikasi Etil AsetatDokumen25 halamanKinetika Reaksi Saponifikasi Etil AsetatAfifahBelum ada peringkat
- Instrumen TestDokumen11 halamanInstrumen TestLeni Sirait TeladanBelum ada peringkat
- Soal Latihan Kimia FarmasiDokumen2 halamanSoal Latihan Kimia FarmasiIdrus YusupadiBelum ada peringkat
- Latihan Pat Kimia XiDokumen6 halamanLatihan Pat Kimia XiFirsttBelum ada peringkat
- LATSOLDokumen7 halamanLATSOLSwesty ParamithaBelum ada peringkat
- Kimia Kelas 11Dokumen5 halamanKimia Kelas 11soegie_535867100% (3)
- Soal Latihan Kinetika - KimiaDokumen2 halamanSoal Latihan Kinetika - KimiaNovi sapto nugrohoBelum ada peringkat
- Soal Pre Tes Laju Reaksi Kimia SMA Kelas A (Kel 5A Yuli Andrianto DKK, Komentar Liana)Dokumen3 halamanSoal Pre Tes Laju Reaksi Kimia SMA Kelas A (Kel 5A Yuli Andrianto DKK, Komentar Liana)Yuli AndriantoBelum ada peringkat
- 9.tutor IX LHHWDokumen16 halaman9.tutor IX LHHWFebiRisnaKusumastutiBelum ada peringkat
- 9 FebDokumen4 halaman9 FebMuhammad KholidinBelum ada peringkat
- Laju Reaksi XI A 2 No. KDokumen5 halamanLaju Reaksi XI A 2 No. KSuyanta SuyantaBelum ada peringkat
- REVISI 5. Instrumen Penilaian Tri Wulandari Kelompok B 229003495039 Kimia 03 001 UNMDokumen10 halamanREVISI 5. Instrumen Penilaian Tri Wulandari Kelompok B 229003495039 Kimia 03 001 UNMTri WulandariBelum ada peringkat
- Praktikum Kelarutan Sebagai Funsi TemperatureDokumen20 halamanPraktikum Kelarutan Sebagai Funsi TemperatureAntonio GomesBelum ada peringkat
- BS - Laju ReaksiDokumen5 halamanBS - Laju ReaksiArda RahmainiBelum ada peringkat
- Soal+jawaban KesetimbanganDokumen13 halamanSoal+jawaban KesetimbanganputriBelum ada peringkat
- Pertemuan - 3 - Dasar2 Kinetika Reaksi - Bagian 2Dokumen30 halamanPertemuan - 3 - Dasar2 Kinetika Reaksi - Bagian 2EmitalutfiahBelum ada peringkat
- Laju ReaksiDokumen14 halamanLaju ReaksiwildaBelum ada peringkat
- Kisi-Kisi Evaluasi Laju Reaksi PDFDokumen10 halamanKisi-Kisi Evaluasi Laju Reaksi PDFatanageBelum ada peringkat
- Alat Bantu Evaluasi Kel 3Dokumen4 halamanAlat Bantu Evaluasi Kel 3Syarifah RasyidBelum ada peringkat
- BAB I-V Ka Sibad IjalDokumen16 halamanBAB I-V Ka Sibad IjalnurBelum ada peringkat
- Persamaan Laju ReaksiDokumen1 halamanPersamaan Laju Reaksidiah utamiBelum ada peringkat
- Laju ReaksiDokumen25 halamanLaju ReaksiRahmin KimBelum ada peringkat
- Kinetika KimiaDokumen71 halamanKinetika KimiaramlahBelum ada peringkat
- Kinetika 2019 - 1 PDFDokumen23 halamanKinetika 2019 - 1 PDFNathaliaSihombingBelum ada peringkat
- Kinetika KimiaDokumen62 halamanKinetika KimiadefaroBelum ada peringkat
- Laju Reaksi Kelompok PrintDokumen15 halamanLaju Reaksi Kelompok PrintHamidatun NisaBelum ada peringkat
- Bab 7 - Laju ReaksiDokumen17 halamanBab 7 - Laju ReaksitianoorseBelum ada peringkat
- Kertas Model SPM Dan JawapanDokumen24 halamanKertas Model SPM Dan JawapanTc FaridahBelum ada peringkat
- Bab 2Dokumen25 halamanBab 2deriatmanBelum ada peringkat
- Tugas 5 - Kelompok 9 - Kimia Dasar 2Dokumen6 halamanTugas 5 - Kelompok 9 - Kimia Dasar 2Fahmi rezaBelum ada peringkat
- Tugas 1 Kinetika KimiaDokumen3 halamanTugas 1 Kinetika KimiaTiara RiaBelum ada peringkat
- Soal PAS Kimia Inggris KEL 11Dokumen7 halamanSoal PAS Kimia Inggris KEL 11Matthew RadityaBelum ada peringkat
- Laju ReaksiDokumen6 halamanLaju Reaksibentang_kilat1903Belum ada peringkat
- soal/IOT 6 KIMIADokumen18 halamansoal/IOT 6 KIMIAAndre K SianturiBelum ada peringkat
- Ridha Rahmi Khairani - 03211940000097 - Resume Kinetika KimiaDokumen2 halamanRidha Rahmi Khairani - 03211940000097 - Resume Kinetika KimiaridhaBelum ada peringkat
- 15 Soal Kimia Laju Reaksi PembahasanDokumen5 halaman15 Soal Kimia Laju Reaksi Pembahasansyltrin syltrinBelum ada peringkat
- Merging Result-MergedDokumen22 halamanMerging Result-MergedNovydita RiscaBelum ada peringkat
- Ridha Rahmi Khairani - Resume KinetikDokumen2 halamanRidha Rahmi Khairani - Resume KinetikridhaBelum ada peringkat
- SOAL LAJU REAKSI NewDokumen11 halamanSOAL LAJU REAKSI Newhernowokimia81okeBelum ada peringkat
- LATIHAN Soal Laju ReaksiDokumen10 halamanLATIHAN Soal Laju ReaksiEs TehBelum ada peringkat
- Soal Laju Reaksi Dan PembahasanDokumen11 halamanSoal Laju Reaksi Dan PembahasanSMP IT Adzkia Babalan100% (1)
- Buku Siswa LAJU REAKSIDokumen16 halamanBuku Siswa LAJU REAKSIYeni ElindaBelum ada peringkat
- Bahan Ajar Laju ReaksiDokumen3 halamanBahan Ajar Laju ReaksiBimbel Briliant100% (2)
- Bab 6-Laju ReaksiDokumen29 halamanBab 6-Laju ReaksiI Kadek Yudi Agus PratamaBelum ada peringkat
- Bab 6-Laju ReaksiDokumen29 halamanBab 6-Laju ReaksiMalik LamendoBelum ada peringkat
- LATIHAN SOAL BEFORE UH - Docx..bakDokumen4 halamanLATIHAN SOAL BEFORE UH - Docx..bakMia Candra DewiBelum ada peringkat
- Kumpulan Soal Laju ReaksiDokumen8 halamanKumpulan Soal Laju ReaksiAnonymous nZFVZm9QPD100% (1)
- Soal PAS Kimia Kelas XIDokumen7 halamanSoal PAS Kimia Kelas XIAmel LiaBelum ada peringkat
- Resume Kinetik KimiaDokumen8 halamanResume Kinetik KimiaNiken Ayu MaharaniBelum ada peringkat
- Kinetika Reaksi IIDokumen26 halamanKinetika Reaksi IIMag'z DLBelum ada peringkat
- 11 FebDokumen4 halaman11 FebMuhammad KholidinBelum ada peringkat
- Laju ReaksiDokumen46 halamanLaju ReaksiMuhammad KhusaeriBelum ada peringkat
- Kinetika KimiaDokumen19 halamanKinetika KimiaMuhammad FajrinBelum ada peringkat
- Bab IV Kinetika Kimia Kimia UmumDokumen93 halamanBab IV Kinetika Kimia Kimia UmumUdy MaudyBelum ada peringkat
- Laju ReaksiDokumen37 halamanLaju ReaksiRiska FadillahBelum ada peringkat
- TERMODINAMIKADokumen2 halamanTERMODINAMIKAAisya AmaliaBelum ada peringkat
- Rangkuman UnyuDokumen8 halamanRangkuman UnyuRyza Sativa100% (1)
- Tugas Kelompok RevisiDokumen26 halamanTugas Kelompok RevisiAnnisa mustika100% (1)
- RPP RevisiDokumen37 halamanRPP RevisiAnnisa mustikaBelum ada peringkat
- Pertanyaan Dan JawabanDokumen4 halamanPertanyaan Dan JawabanAnnisa mustikaBelum ada peringkat
- Struktur Atom Dan SPUDokumen3 halamanStruktur Atom Dan SPUAnnisa mustikaBelum ada peringkat
- Latihan Utbk Pertemuan 4Dokumen5 halamanLatihan Utbk Pertemuan 4Annisa mustikaBelum ada peringkat
- Pertemuan 1 Stoikiometri UtbkDokumen1 halamanPertemuan 1 Stoikiometri UtbkAnnisa mustikaBelum ada peringkat
- RPP Struktur Dan Sifat BenzenaDokumen26 halamanRPP Struktur Dan Sifat BenzenaAnnisa mustikaBelum ada peringkat
- Latihan Asam BasaDokumen2 halamanLatihan Asam BasaAnnisa mustikaBelum ada peringkat
- 01 REVISI RPP + Peta KonsepDokumen12 halaman01 REVISI RPP + Peta KonsepAnnisa mustikaBelum ada peringkat