REAKSI SN2
Diunggah oleh
Nivi KsdksJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
REAKSI SN2
Diunggah oleh
Nivi KsdksHak Cipta:
Format Tersedia
Reaktivitas Kimia II
REAKTIVITAS KIMIA II
Pengantar Reaksi Eliminasi &
Substitusi Nukleofilik
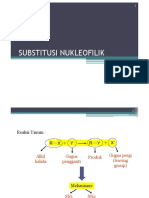
Alkil halida
Reaktivitas Kimia II
Reaksi Substitusi Nukleofilik
Persamaan umum
Contoh:
Nukleofil
Adalah suatu reagen yang senang pada atau
mencari suatu pusat positif di dalam molekul
organik
Pada suatu alkil halida, pusat positifnya adalah
karbon yang berikatan dengan halogen
C X
+
>
Reaktivitas Kimia II
Reaktivitas Kimia II
Nukleofil
pasti punya pasangan elektron bebas
bisa merupakan ion negatif
(contoh ion hidroksida)
bisa merupakan molekul netral
(contoh air)
Nukleofil
Reaktivitas Kimia II
H O H O R +
+
Alkyl halide Alkyloxonium ion
H H
H O R
H
2
O
+ H
3
O
+
+
X
+
X
R X
Nucleophile
Reaktivitas Kimia II
Leaving Groups
Adalah gugus yang dapat disubstitusi
oleh nukleofil. Pada alkil halida, leaving
group nya adalah substituen yang berupa
halogen pada reaksinya ia akan lepas
sebagai ion halida
Harus dapat lepas sebagai molekul atau
ion yang relatif stabil dan merupakan basa
yang lemah
Reaktivitas Kimia II
Leaving Groups
Persamaan umum reaksi substitusi
nukleofilik
Nu
Nu
+ R L L
R
+
Nu
+
Nu
+ R L L
R +
atau
Contoh spesifik
H
3
N CH
3
Br
CH
3
NH
3
+ + Br
+
Reaktivitas Kimia II
Leaving Groups
Substrat (molekul yang diserang nukleofil)
bisa juga mengandung muatan positif
Nu
+
Nu
+ R L
+
L R
+
H
3
C O
+
H
H
3
C O
H
H
+
H O
H
H
3
C O
H
CH
3
+
+
Reaktivitas Kimia II
Molekularitas Reaksi Substitusi
Nukleofilik : Kinetika Reaksi
Beberapa reaksi terdiri atas lebih dari satu
tahap
Kecepatan reaksi keseluruhan =
kecepatan tahap yang paling lambat
(tahap yang mengontrol reaksi
keseluruhan)
Molekularitas suatu reaksi adalah jumlah
molekul atau ion yang berpartisipasi pada
keadaan transisi tahap yang mengontrol
reaksi keseluruhan
Reaktivitas Kimia II
Molekularitas Reaksi Substitusi
Nukleofilik : Kinetika Reaksi
Reaksi unimolekuler
1 molekul/ion yang terlibat
Reaksi bimolekuler
2 molekul/ion yang terlibat
Reaksi termomolekuler
3 molekul/ion yang terlibat
Reaktivitas Kimia II
Molekularitas Reaksi Substitusi
Nukleofilik : Kinetika Reaksi
Dapat disimpulkan dari data kinetika
reaksi
60
o
C
H
2
O
HO
CH
3
Cl CH
3
OH
+
+
Cl
Exp
Number
Initial
[CH
3
Cl]
Initial
[OH
]
Initial
(mol L
1
s
1
)
1 0.0010 1.0 4.9 10
7
2 0.0020 1.0 9.8 10
7
3 0.0010 2.0 9.8 10
7
4 0.0020 2.0 19.6 10
7
Reaktivitas Kimia II
Molekularitas Reaksi Substitusi
Nukleofilik : Kinetika Reaksi
Kecepatan reaksi [CH3Cl] [OH] ;
sehingga persamaan kecepatan reaksi
dari reaksi metil klorida dan ion hidroksida
adalah:
Kecepatan reaksi = k [CH3Cl] [OH]
k = tetapan kesebandingan/tetapan
kecepatan reaksi
Order total reaksi adalah 2
Reaktivitas Kimia II
Molekularitas Reaksi Substitusi
Nukleofilik : Kinetika Reaksi
Kesimpulan:
Baik substrat maupun nukleofil sama-sama
terlibat pada keadaan transisi dari tahap yang
mengontrol reaksi keseluruhan. Karena
kecepatan reaksi sebanding dengan konsentrasi
metil klorida dan ion hidroksida
Maka dapat diasumsi bahwa reaksi
BIMOLEKULER
Reaktivitas Kimia II
Reaksi Substitusi Nukleofilik
Bimolekuler (REAKSI S
N
2)
Pada keadaan transisi dari tahap yang
mengontrol melibatkan 2 buah spesies
Kecepatan reaksi = k [CH3Cl] [OH]
Mekanisme reaksi S
N
2
diusulkan Sir Christopher Ingold
(Mekanisme Ingold)
Reaktivitas Kimia II
Reaksi Substitusi Nukleofilik
Bimolekuler (REAKSI S
N
2)
C
Nu
L Nu
C
+ L
Antibonding orbital
Bonding orbital
Reaktivitas Kimia II
Diagram energi potensial
reaksi S
N
2
Reaktivitas Kimia II
Reaksi Substitusi Nukleofilik
Bimolekuler (REAKSI S
N
2)
Pada reaksi Ingold terjadi perubahan
konfigurasi atom karbon (menjadi obyek
penyerangan nukleofilik)
Konfigurasi atom adalah pengaturan
tertentu gugus-gugus atom dalam ruangan
Reaktivitas Kimia II
REAKSI S
N
2
Konfigurasi atom
H O
C Cl
H
H
H
+
An inversion of configuration
C O H
H
H
H
+
Cl
C Cl O
H
H
H
H
Reaktivitas Kimia II
REAKSI S
N
2
Konfigurasi atom
OH
Cl
+
S
N
2
+
An inversion of configuration
H
OH
H
3
C
H
Cl
H
H
3
C
H
cis-1-Chloro-3-methylcyclopentane trans-3-methylcyclopentanol
Leaving group departs
from the top side.
Nucleophile attacks
from the bottom side.
H
OH
H
3
C
H
Cl
REAKSI S
N
1
Mekanisme Reaksi
(CH
3
)
3
C +
OH
+
Cl
H
2
O
acetone
Cl (CH
3
)
3
C OH
Reaksi antara tert-butil klorid dengan ion
hidroksida
Rate [(CH3)3CCl] Rate = k [(CH3)3CCl]
Reaktivitas Kimia II
Reaktivitas Kimia II
REAKSI S
N
1
Mekanisme Reaksi
Reaksi SN1 terdiri atas 3 tahap reaksi sebagai
berikut:
Tahap 1
Molekul-molekul air akan
menstabilkan kation dan anion
yang terbentuk
Reaktivitas Kimia II
REAKSI S
N
1
Mekanisme Reaksi
Tahap 2
Tahap 3
Reaktivitas Kimia II
Reaktivitas Kimia II
Reaksi substitusi nukleofilik alkil halida
mengikuti reaksi S
N
1 atau S
N
2 ??
Jika suatu alkil halida dan nukleofil
bereaksi dengan cepat menurut
mekanisme S
N
2 dan relatif lambat dengan
mekanisme S
N
1 pada kondisi reaksi
tertentu, maka sebagian besar molekul
akan bereaksi menurut S
N
2
Dan sebaliknya.
Reaktivitas Kimia II
Faktor yang mempengaruhi
kecepatan reaksi S
N
1 & S
N
2
1. Struktur karbon yang mengikat leaving
group
2. Konsentrasi dan reaktivitas nukleofil
(khusus S
N
2)
3. Sifat leaving group
4. Kemampuan mengionisasikan dari
pelarut
Faktor 1 ( Struktur karbon yang
mengikat leaving group untuk reaksi
S
N
2)
Urutan kereaktifan alkil halida
Efek sterik
Hambatan sterik
methyl > 1 > 2 >> 3 (unreactive)
Reaktivitas Kimia II
Reaktivitas Kimia II
Kecepatan relatif alkil halida
Reaktivitas Kimia II
Kecepatan relatif alkil halida Kecepatan relatif alkil halida
Efek sterik adalah suatu efek pada
kecepatan realatif yang disebabkan oleh
sifat-sifat pengisian ruang bagian-bagian
molekul yang melekat pada atau dekat
tempat reaksi
Efek sterik yang penting terkait dengan
hambatan sterik
Reaktivitas Kimia II
t
Kecepatan relatif alkil halida
Halida primer
metil
1
o
2
o
3
o
neopentyl
Reaktivitas Kimia II
Reaktivitas Kimia II
Faktor 1 ( Struktur karbon yang
mengikat leaving group untuk reaksi
S
N
1)
Kereaktifan ditentukan dari stabilitas
karbokation yang terbentuk
Senyawa organik yang mampu bereaksi
menurut mekanisme S
N
1 adalah yang
mampu membentuk karbokation yang
relatif stabil low free energy of
activation
3 > 2 Allyl Benzyl >> 1 > Methyl
Reaktivitas Kimia II
Penjelasan
R X R
+
+ X
-
Reaksi SN1 langkah yang
mengontrol adalah pada
saat delta H positif
(endotermik)
Jadi sesuai dengan
postulat Hammond,
keadaan transisi akan lebih
menyerupai produk ; dalam
hal ini adalah karbokation
(R
+
)
Reaktivitas Kimia II
Faktor 2 ( Pengaruh [ ] dan kekuatan
nukleofil untuk reaksi S
N
2)
Faktor 2 ( Pengaruh [ ] dan kekuatan
nukleofil untuk reaksi S
N
2)
Hanya berpengaruh pada S
N
2
Konsentrasi >> kecepatan reaksi
Nukleofil kuat adalah yang dapat bereaksi
dengan cepat dengan substrat, sedangkan
nukleofil yang lemah adalah yang lambat
bereaksi pada kondisi reaksi yang sama
Reaktivitas Kimia II
Nukleofil yang bermuatan negatif lebih
kuat dari asam konjugasinya
OH
-
>> dari H
2
O
RO
-
>> ROH
Nukleofil yang atom nukleofiliknya sama,
urutan kekuatan nukleofil mengikuti urutan
kekuatan sifat basanya
Kekuatan nukleofil
RO
> HO
>> RCO
2
> ROH > H
2
O
Kekuatan nukleofil
Reaktivitas Kimia II
Kekuatan nukleofil Kekuatan nukleofil
Dalam pelarut alkohol dan air, kekuatan
relatif persenyawaan yang atom
nukleofiliknya berada pada satu golongan
di tabel periodik akan meningkat dengan
makin besarnya ukuran atom nukleofilik
Kekuatan ion halida
I
> Br
> Cl
Reaktivitas Kimia II
Kekuatan nukleofil
Reaktivitas Kimia II
Kekuatan nukleofil
Penjelasan
Atom yang memiliki ukuran lebih besar
mudah terdistrosi (terlepas) nukleofil
mudah menyerang substrat daripada
nukleofil dengan ukuran atom yang lebih
kecil (terikat kuat)
Reaktivitas Kimia II
Faktor 3 ( Pengaruh sifat leaving
group)
Leaving group yang baik adalah molekul-
molekul/ion yang merupakan basa
terlemah (asam terkuat) Ka (besar)
I
> Br
> Cl
>> F
Makin baik sifat
leaving group
Makin bersifat
basa
Reaktivitas Kimia II
Faktor 4 Kemampuan
mengionisasikan dari pelarut
Pelarut polar dapat mensolvasi dan
menstabilkan kation-kation dan anion-
anion dengan cara:
1. Mengelilingi ion-ion (pembahasan
kelarutan)
2. Membentuk ikatan hidrogen dengan
anion
Reaktivitas Kimia II
Reaktivitas Kimia II
Faktor 4 Kemampuan
mengionisasikan dari pelarut
Penjelasan ikatan hidrogen dengan anion
Reaktivitas Kimia II
Faktor 4 Kemampuan
mengionisasikan dari pelarut
Tetapan dielektrik
merupakan suatu ukuran kemampuan
pelarut untuk memisahkan muatan-
muatan yang berlawanan satu sama lain.
makin besar tetapan dielektrik, makin
besar kemampuan pelarut tsb untuk
mensolvasi ion-ion
Acetic acid CH
3
C(O)OH 6.2
tert-Butyl alcohol (CH
3
)
3
COH 10.9
Ethanol CH
3
CH
2
OH 24.3
Methanol CH
3
OH 33.6
Formic acid HC(O)OH 58.0
Water H
2
O 80.4
Tetapan dielektrik
Reaktivitas Kimia II
Dapat menstabilkan ion-ion secara efektif,
meningkatkan kecepatan ionisasi alkil
halida
Penjelasan
Proses solvasi akan menstabilkan
keadaan transisi yang lebih mengarah
pada hasil (karbokation dan ion halida)
Pemakaian pelarut pada reaksi S
N
1
Reaktivitas Kimia II
Reaktivitas Kimia II
Pemakaian pelarut pada reaksi S
N
2
Pemakaian pelarut yang polar akan
meningkatkan kecepatan reaksi S
N
2 dari
alkil halida bila nukleofil merupakan
molekul netral
Kecepatan reaksi akan turun dengan
dipakainya pelarut polar jika nukleofilnya
adalah ion negarif
Reaktivitas Kimia II
Reaktivitas Kimia II
Anda mungkin juga menyukai
- KEBIJAKAN RSDokumen36 halamanKEBIJAKAN RSJoni Rasmanto86% (7)
- STANDAR MINYAK GORENGDokumen16 halamanSTANDAR MINYAK GORENGardhi_asheng0% (1)
- Reaksi Substitusi Dan EliminasiDokumen53 halamanReaksi Substitusi Dan EliminasiDarul NafisBelum ada peringkat
- KO Reaktivitas KimiaDokumen53 halamanKO Reaktivitas KimiaDavid KristiantoBelum ada peringkat
- 3 Mekanisme Reaksi OrganikDokumen51 halaman3 Mekanisme Reaksi OrganikSyawal PratamaBelum ada peringkat
- 3.mekanisme Reaksi Organik (Pertemuan 3)Dokumen51 halaman3.mekanisme Reaksi Organik (Pertemuan 3)Curie_JkBelum ada peringkat
- Sn1 Dan Sn2Dokumen14 halamanSn1 Dan Sn2gitayulianadewiBelum ada peringkat
- BUATTERBUTILDokumen12 halamanBUATTERBUTILPace AjjaBelum ada peringkat
- ALKIL HALIDA REAKSIDokumen36 halamanALKIL HALIDA REAKSIShinta Novita SariBelum ada peringkat
- Bab 9 Jenis PereaksiDokumen22 halamanBab 9 Jenis PereaksiAtikaBelum ada peringkat
- AlkilDokumen32 halamanAlkilAmiza FitriBelum ada peringkat
- MRKODokumen37 halamanMRKOElvany JvcBelum ada peringkat
- REAKSI SUBSTITUSI NUKLEOFILIKDokumen17 halamanREAKSI SUBSTITUSI NUKLEOFILIKLamtaruli PurbaBelum ada peringkat
- Alkil Halida 1Dokumen38 halamanAlkil Halida 1prisantiputamiBelum ada peringkat
- Mekanisme SN1Dokumen6 halamanMekanisme SN1refina silabanBelum ada peringkat
- 3-Substitusi NukleofilikDokumen50 halaman3-Substitusi NukleofilikYeni Dwija CahyantiBelum ada peringkat
- Alkil Halida PANTUL LGDokumen26 halamanAlkil Halida PANTUL LGKurnia BasoBelum ada peringkat
- Laporan Kimia Dasar II Kinetika KimiaDokumen16 halamanLaporan Kimia Dasar II Kinetika KimiaI Putu Adi Surya MahardikaBelum ada peringkat
- Laporan Tertier Butil KloridaDokumen19 halamanLaporan Tertier Butil KloridaAjay TiyaBelum ada peringkat
- Jenis Reaksi Senyawa Organik - 10Dokumen41 halamanJenis Reaksi Senyawa Organik - 10Nadhirah nursBelum ada peringkat
- Kimor 3Dokumen5 halamanKimor 3Ketut ErminBelum ada peringkat
- MEKANISME REAKSI SN1Dokumen4 halamanMEKANISME REAKSI SN1isnaini safitriBelum ada peringkat
- 9.alkil Halida 1Dokumen35 halaman9.alkil Halida 1Maulana Al-mutawajjBelum ada peringkat
- Kinetika Kimia1Dokumen12 halamanKinetika Kimia1ariviztahBelum ada peringkat
- Reaksi Substitusi Adisi Dan EliminasiDokumen14 halamanReaksi Substitusi Adisi Dan EliminasiHesty TorimtubunBelum ada peringkat
- Kimia Organik-Bab IV-ppDokumen14 halamanKimia Organik-Bab IV-ppFirdaus Dyansyah71% (7)
- Konsep Dasar Kinetika KimiaDokumen18 halamanKonsep Dasar Kinetika KimiaARIF SETYAWAN YUSUF YUSUFBelum ada peringkat
- TRK - Course 1 Kinetika PDFDokumen89 halamanTRK - Course 1 Kinetika PDFdinaBelum ada peringkat
- 17 Reaksi SN2Dokumen10 halaman17 Reaksi SN2CilarungBelum ada peringkat
- KatalisDokumen20 halamanKatalisafrica ayatullahBelum ada peringkat
- Kimia Organik - Kelompok Dua - Rombel 1 Kimia 2012 - Reaksi SN1.SN2, E1, E2Dokumen46 halamanKimia Organik - Kelompok Dua - Rombel 1 Kimia 2012 - Reaksi SN1.SN2, E1, E2Atik Atric SalmonitridiumBelum ada peringkat
- Presentation Kimor RSN1Dokumen14 halamanPresentation Kimor RSN1lizia.fn409Belum ada peringkat
- REAKSI RADIKAL BEBAS DAN SENYAWA ORGANOLOGAMDokumen9 halamanREAKSI RADIKAL BEBAS DAN SENYAWA ORGANOLOGAMiinBelum ada peringkat
- Reaksi Substitusi Alkohol dengan Asam KloridaDokumen6 halamanReaksi Substitusi Alkohol dengan Asam Kloridaine rosmala dewiBelum ada peringkat
- Mekanisme Reaksi OrganikDokumen40 halamanMekanisme Reaksi OrganikM.Sidik Ashari100% (1)
- Alkil HalidaDokumen38 halamanAlkil Halidaaermal89Belum ada peringkat
- NukleofilDokumen43 halamanNukleofilWardti SinagaBelum ada peringkat
- Fix Kimia Organik - Kelompok Dua - Rombel 1 Kimia 2012 - Reaksi SN1.SN2, E1, E2Dokumen50 halamanFix Kimia Organik - Kelompok Dua - Rombel 1 Kimia 2012 - Reaksi SN1.SN2, E1, E2Atik Atric SalmonitridiumBelum ada peringkat
- Kinetika Kimia Dan Kimia IntiDokumen51 halamanKinetika Kimia Dan Kimia IntiRestina RachmawatiBelum ada peringkat
- Reaksi SN1Dokumen11 halamanReaksi SN1Rosiana AgustinaBelum ada peringkat
- Alkena 2Dokumen65 halamanAlkena 2arief779Belum ada peringkat
- Makalah Substitusi NukleofilikDokumen16 halamanMakalah Substitusi NukleofilikMusrifah TaharBelum ada peringkat
- Mekanisme Sn2 SniDokumen28 halamanMekanisme Sn2 SniAkbar SyaifarizBelum ada peringkat
- Alkil Halida: Reaksi Substitusi dan EliminasiDokumen9 halamanAlkil Halida: Reaksi Substitusi dan EliminasiTaufik H. Aprillisandy50% (2)
- Bab II Reaksi Pada Senyawa OrganikDokumen22 halamanBab II Reaksi Pada Senyawa OrganikMilsonBelum ada peringkat
- 1,2 Alkil HalidaDokumen47 halaman1,2 Alkil HalidaLaela ZulfawatiBelum ada peringkat
- Redoks PersamaanDokumen4 halamanRedoks PersamaanMujibul RijalBelum ada peringkat
- MEKANISME REAKSI ELIMINASI DAN KONDENSASIDokumen22 halamanMEKANISME REAKSI ELIMINASI DAN KONDENSASIMaulia UlfahBelum ada peringkat
- MAKALAH Kimia OrganikDokumen21 halamanMAKALAH Kimia OrganikAli Balatif100% (1)
- D3 Pertemuan Ke 6 Alkil HalidaDokumen59 halamanD3 Pertemuan Ke 6 Alkil HalidarinahayupingkanBelum ada peringkat
- ALKIL HALIDA REAKSIDokumen43 halamanALKIL HALIDA REAKSIRuth KristiBelum ada peringkat
- Pertemuan 1 Kimia AnorganikDokumen41 halamanPertemuan 1 Kimia AnorganikMaria NovansyaBelum ada peringkat
- REAKSI RADIKAL BEBASDokumen14 halamanREAKSI RADIKAL BEBASmisranasrof9Belum ada peringkat
- Gugus Hidroksi Dalam Tertier Butil Alkohol Gugus Yang Paling Mudah Disubtitusi Dan Hal Ini Menyebabkan Alkohol Tersebut Dapat Bereaksi Dengan Hal Pekat Pada Suhu KamarDokumen5 halamanGugus Hidroksi Dalam Tertier Butil Alkohol Gugus Yang Paling Mudah Disubtitusi Dan Hal Ini Menyebabkan Alkohol Tersebut Dapat Bereaksi Dengan Hal Pekat Pada Suhu KamarHelma KurniaBelum ada peringkat
- Laju ReaksiDokumen42 halamanLaju ReaksiKemal Yusron100% (1)
- Katalis HomogenDokumen21 halamanKatalis HomogenFita KurniaBelum ada peringkat
- PKBPOM No 8 Tahun 2016 Tentang BTP CampuranDokumen10 halamanPKBPOM No 8 Tahun 2016 Tentang BTP CampuranEyka Yuditia Saferia GintingBelum ada peringkat
- MAKALAH Kim - Ind PDFDokumen52 halamanMAKALAH Kim - Ind PDFNivi KsdksBelum ada peringkat
- KAcang GAring - SNI 01 4301 1996Dokumen12 halamanKAcang GAring - SNI 01 4301 1996Ageng Wahyu Patrianita0% (1)
- 9339 17322 1 PB PDFDokumen6 halaman9339 17322 1 PB PDFNivi KsdksBelum ada peringkat
- MAKALAH Kim - Ind PDFDokumen52 halamanMAKALAH Kim - Ind PDFNivi KsdksBelum ada peringkat
- RP VDokumen40 halamanRP VNivi KsdksBelum ada peringkat
- Petunjuk Teknis Pencegahan Plagiat UPIDokumen17 halamanPetunjuk Teknis Pencegahan Plagiat UPIakfaditadikapariraBelum ada peringkat
- SeminarDokumen34 halamanSeminarNivi KsdksBelum ada peringkat
- MethodDokumen42 halamanMethodNivi KsdksBelum ada peringkat
- Poli AmidaDokumen8 halamanPoli AmidaNivi KsdksBelum ada peringkat
- SeminarDokumen34 halamanSeminarNivi KsdksBelum ada peringkat
- MA-Metabolisme Asam AminoDokumen28 halamanMA-Metabolisme Asam AminoNivi KsdksBelum ada peringkat
- Laporan Kunjungan Pabrik Gula Kebon AgungDokumen39 halamanLaporan Kunjungan Pabrik Gula Kebon AgungJojo SantosoBelum ada peringkat
- LAPORAN MAGANG GULADokumen73 halamanLAPORAN MAGANG GULANivi KsdksBelum ada peringkat
- Metabolisme TrigliseridaDokumen28 halamanMetabolisme TrigliseridaAryaditama RismanBelum ada peringkat
- MAKALAH Kim - Ind PDFDokumen52 halamanMAKALAH Kim - Ind PDFNivi KsdksBelum ada peringkat
- Teori Kesalahan Dalam Kimia Analitik Part 1Dokumen12 halamanTeori Kesalahan Dalam Kimia Analitik Part 1Nivi KsdksBelum ada peringkat