Modul 6 Voltametri
Diunggah oleh
Jajang TaryanaHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Modul 6 Voltametri
Diunggah oleh
Jajang TaryanaHak Cipta:
Format Tersedia
1
Modul 6
Voltametri
A. Kompetensi Dasar
Kompetensi dasar yang harus dicapai mahasiswa dalam modul ini adalah
menjelaskan analisis dengan metode voltametri.
B. Materi Pokok
Materi pokok yang harus dipelajari lebih mendalam untuk membantu
memperoleh kemampuan-kemampuan tersebut adalah:
1. Dasar teori metode voltametri
2. Arus difusi
3. Elektroda merkuri tetes (DME)
4. Analisis kuantitatif voltametri
C. Uraian Materi Pokok
Dasar Teori Metode Voltametri
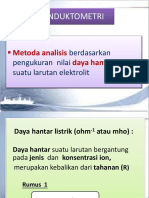
Voltametri adalah metode analisis yang berdasarkan hubungan antara
arus tegangan dengan prinsipnya reaksi elektrolisis (reaksi reduksi). Dalam
voltametri, salah satu elektroda pada sel elektrolitnya terpolarisasi. Voltametri
digunakan untuk menentukan komposisi dan analisis kuantitatif larutan.
Instrumen yang digunakan disebut voltameter, yang menggunakan dua
atau tiga elektroda. elektroda tersebut adalah elektroda kerja mikro, elektroda
pembanding, dan elektroda auxilary. Elektroda tetes raksa digunakan sebagai
katode dan elektroda kalomel jenuh (SCE) sebagai elektroda pembanding. SCE
adalah elektroda pasangannya yang tidak terpolarisasi. SCE dapat juga
digantikan oleh reservoir merkuri. Suatu elektroda kerja mikro adalah elektroda
terpolarisasi yang berukuran jauh lebih kecil daripada elektroda pembandingnya.
Sedangkan elektroda auxilary membantu membawa arus yang dihasilkan. Data
yang terekam disebut sebagai volarogram (arus vs voltage).
Voltametri disebut juga polarografi bila elektroda terpolarisasinya adalah
elektroda merkuri atau dropping mercury electrode (DME). Dengan kata lain,
polarografi merupakan metode analisis kuantitatif dan kualitatif yang didasarkan
pada pengukuran arus difusi dengan naiknya potensial selama proses elektrolisis
yang menggunakan elektroda mikro. Hasil pengukuran polarografi disebut
polarogram yang memuat informasi kualitatif dan kuantitatif, yang dapat
direduksi pada permukaan elektroda.
Arus Difusi
Arus difusi (i
d
) dipengaruhi oleh beberapa faktor yaitu kecepatan
mengalir Hg (m, dalam mg/detik), waktu yang diperlukan untuk setiap tetesan (t,
2
dalam detik), dan konsentrasi (C, dalam mol/liter). Hubungan antara arus difusi
dengan faktor-faktor tersebut dikenal sebagai persamaan Ilkovic:
dimana D adalah koefisien difusi. Persamaan Ilkovic ini diturunkan dengan
memperhitungkan bentuk, luas, dan massa jenis air raksa. Bilangan 607
merupakan koefisien persamaan Ilkovic dan n adalah jumlah elektron yang
terlibat. Arus difusi (i
d
) berbanding lurus dengan konsentrasi zat tereduksi, C,
sehingga arus difusi i
d
berguna untuk analisis kuantitatif.
Elektroda Merkuri Tetes (DME)
Faktor-faktor yang menyebabkan arus dalam proses elektrolisis adalah
faktor elektrostatik, faktor mekanik, dan faktor difusi. Dalam polarografi, faktor
elektrostatik dan mekanik harus dihindarkan. Sel polarografi terdiri dari larutan
elektrolit pendukung, pipa saluran gas inert, dan elektroda.
1. larutan elektrolit pendukung
Larutan elektrolit pendukung berfungsi untuk menghilangkan faktor
elektrostatik. Biasanya berupa larutan inert yang ditambahkan ke dalam sel
elektrolisis. Contoh KCl, NH
4
Cl, KCN, NaOH, H
3
PO
4
.
2. pipa saluran gas inert
Aliran gas inert ini untuk de-aerasi larutan terhadap O
2
terlarut. Contoh N
2
dan
H
2
. Hal ini karena O
2
terlarut dapat mengganggu kurva arus-tegangan.
3. elektroda
Elektroda pada sel polarografi terdiri dari elektroda pembanding dan elektroda
kerja. Elektroda pembanding berfungsi untuk menangkap potensial, contohnya
SCE dan perak-perak klorida. Sedangkan elektroda kerja adalah Elektroda
Merkuri Tetes atau Dropping Mercury Electrode (EMT/DME) yang berfungsi
sebagai tempat terjadinya reaksi redoks.
Penggunaan EMT atau DMT ini memiliki kelebihan dan kelemahan.
Kelebihannya adalah (1) permukaan Hg dapat diperbarui terus menerus selama
proses, (2) arus difusi mencapai harga tetap segera setelah perubahan potensial,
(3) memiliki over voltage hidrogen yang tinggi sehingga dapat digunakan untuk
daerah potensial yang luas, dan (4) pembentukan amalgam, Hg-logam
merendahkan aktivitas logam sehingga mempermudah reduksi ion logam.
Sedangkan kelemahannya adalah (1) oksidasi Hg terjadi pada potensial yang
sangat tidak positif, dan (2) menghasilkan arus sisa yang cukup besar.
Metode polarografi ini dapat digunakan baik untuk analisis kualitatif
maupun kuantitatif. Untuk analisis kualitatifnya, setiap zat tereduksi memiliki
nilai potensial setengah gelombang (E
1/2
) tertentu dan khas untuk setiap zat pada
kondisi tertentu. Potensial setengah gelombang adalah potensial pada setengah
arus difusi. Nilai E
1/2
tergantung dari sifat larutan elektrolit pendukungnya atau
pada jenis zat yang direduksinya. Sedangkan untuk analisis kuantitatifnya
didasarkan pada persamaan Ilkovic, dimana nilai arus difusi sebanding dengan
konsentrasi zat yang tereduksi.
3
Analisis Kuantitatif Voltametri
Analisis kuantitaif voltametri dapat dilakukan dengan cara kurva
kalibrasi, cara standar adisi, dan titrasi amperometri.
1. Kurva kalibrasi
Pengukuran dengan polarografi dilakukan pada sederet larutan standar, yang
kemudian dibuat kurva kalibrasinya antara i
d
terhadap konsentrasi. Larutan
cuplikan diukur pada kondisi yang sama dengan pengukuran larutan standar.
Konsentrasi cuplikan diperoleh dari kurva kalibrasi dengan cara memplotkan i
d
yang diperoleh untuk cuplikan.
2. Standar adisi
Larutan cuplikan dengan volume tertentu diukur harga arus difusinya. Sementara
itu, pada larutan cuplikan lain dengan volume tertentu ditambahkan sejumlah
larutan standar yang sudah diketahui konsentrasinya untuk diukur harga arus
difusinya. Perhitungan dilakukan antara arus difusi dari cuplikan dan arus difusi
dari cuplikan dan standar untuk menentukan konsentrasi cuplikan tersebut. Cara
standar adisi lebih baik daripada kurva kalibrasi karena dapat mengontrol adanya
gangguan oleh kotoran di dalam cuplikan.
3. Titrasi amperometri
Bila salah satu atau kedua pereaksi dapat direduksi pada permukaan elektroda
dan dilakukan pada harga potensial tertentu, maka titik ekivalen suatu titrasi
dapat ditentukan dengan metode voltametri (polarografi).
D. Rangkuman
Prinsip dasar metode voltametri adalah reaksi elektrolisis (reaksi
reduksi), yang didasarkan pada hubungan arus tegangan. Instrumennya berupa
voltameter yang terdiri dari elektroda kerja mikro, elektroda pembanding, dan
elektroda auxilary. Polarografi adalah voltametri yang elektroda kerjanya
elektroda merkuri tetes (DME). Metode polarografi ini dapat digunakan baik
untuk analisis kualitatif maupun kuantitatif. Analisis kualitatif berasal dari harga
E
1/2
yang bergantung pada jenis zat yang direduksi, sedangkan analisis
kuantitatif berasal dari harga i
d
yang bergantung pada konsentrasi zat yang
direduksi. Analisis kuantitatif ini dapat dilakukan dengan cara kurva kalibrasi,
cara standar adisi, dan titrasi amperometri.
E. Latihan/Tugas
Kerjakan latihan berikut untuk memperdalam pemahaman Anda
mengenai materi Voltametri.
1. Suatu sel polarografi berisi 10 mL larutan cuplikan A di dalam larutan
KNO
3
0,1 M dan memberikan arus difusi 3,6 A. Kemudian 0,1 mL
larutan standar A yang mengandung 510
-2
M ditambahkan dan
polarogram baru diperoleh dengan arus difusi 7,2 A. Berapa konsentrasi
A di dalam larutan asli.
4
2. The concentration of As(III) in water can be determined by differential
pulse polarography in 1 M HCl. The initial potential is set to -0.1 V versus
the SCE, and is scanned toward more negative potentials at a rate of 5
mV/s. Reduction of As(III) to As(0) occurs at a potential of approximately -
0.44 V versus the SCE. The peak currents, corrected for the residual
current, for a set of standard solutions are shown in the following table.
[As(III)] M I
p
(A)
1.00 10
-6
3.00 10
-6
6.00 10
-6
9.00 10
-6
0.298
0.947
1.83
2.72
What is the concentration of As(III) in a sample of water if the peak
current under the same conditions is 1.37 A?
Petunjuk Jawaban Latihan!
1. Konsentrasi A di dalam larutan asli:
2. Liniar regression gives the equation for the calibration curve as
substituing the samples peak current into the regression equation gives the
concentration of As(III) as 4.49 10
-6
M.
F. Tes Mandiri
1. The concentration of copper in a sample of sea water is determined by
anodic stripping voltammetry using the method of standard additions.
When a 50.0-mL sample is analyzed, the peak current is 0.886 A. A 5.00-
mL spike of 10.0-ppm Cu
2+
is added, giving a peak current of 2.52 A.
Calculate the parts per million of copper in the sample of sea water.
GLOSARIUM
Voltametri
Elektroda kerja
Elektroda pembanding
5
DAFTA PUSTAKA
Harvey D. 2000. Modern Anayitical Chemistry. USA: McGraw-Hill
Companies, Inc.
Hendayana, S., et.al. 1994. Kimia Analitik Instrumen. Semarang: Penerbit
IKIP Semarang.
Khopkar, S.M. 1990. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Skoog DA, West DM, Holler FJ, Crouch SR. 2004. Fundanentals of
Analytical Chemistry. Eighth Edition. USA: Thomson Learning, Inc.
Anda mungkin juga menyukai
- Makalah Coloumetri Dan ElektrogravimetriDokumen15 halamanMakalah Coloumetri Dan ElektrogravimetriTafta Na E'i100% (1)
- PolarografiDokumen15 halamanPolarografiPutu Monik Ananta PuspitariniBelum ada peringkat
- Laporan Praktikum Percobaan 4Dokumen16 halamanLaporan Praktikum Percobaan 4Rizka Nur Yuniarsih100% (1)
- High Performance Liquid ChromatographyDokumen8 halamanHigh Performance Liquid ChromatographyAbdul HBelum ada peringkat
- Ekstraksi Asam AsetatDokumen22 halamanEkstraksi Asam AsetatMohamad Ardhan Dwiyan Mahendra (Paul Walker)Belum ada peringkat
- Jurnal Aplikom MeDokumen15 halamanJurnal Aplikom MeIntan Ayu Apriliana100% (3)
- SoalDokumen17 halamanSoalDiina ElmilaBelum ada peringkat
- POTENSIOMETRI Sel VoltaDokumen24 halamanPOTENSIOMETRI Sel Voltaalif ramdaniBelum ada peringkat
- Laporan Praktikum Biokimfis Kekentalan - Teni Astuti - K1a018043 PDFDokumen19 halamanLaporan Praktikum Biokimfis Kekentalan - Teni Astuti - K1a018043 PDFNallaBelum ada peringkat
- Kelimpahan LantanidaDokumen2 halamanKelimpahan LantanidaBhakti RahmadhaniBelum ada peringkat
- Pembuatan Dan Pemurnian Kalium IodatDokumen14 halamanPembuatan Dan Pemurnian Kalium IodatUlfah DinaBelum ada peringkat
- Membran CairDokumen10 halamanMembran CairMuhammadIhsanBelum ada peringkat
- Macam ElektrodaDokumen6 halamanMacam ElektrodaAditya Herman PurwantoBelum ada peringkat
- Instrumentasi Turbidimeter Refraktometer PolarimeterDokumen17 halamanInstrumentasi Turbidimeter Refraktometer PolarimeterAkhmad Kautsar0% (1)
- Reaksi Substitusi Nukleofilik Dan Radikal BebasDokumen7 halamanReaksi Substitusi Nukleofilik Dan Radikal BebasQisty Aulia KhoiryBelum ada peringkat
- Ion Kompleks Karbonatotetraminkonalt (III)Dokumen12 halamanIon Kompleks Karbonatotetraminkonalt (III)Zimon Pereiz100% (1)
- Voltammetri 2019-Dh RevDokumen75 halamanVoltammetri 2019-Dh Revfathia faizana rahmanBelum ada peringkat
- Bab 3Dokumen36 halamanBab 3M Nur M. MahmudBelum ada peringkat
- Percobaan 4Dokumen28 halamanPercobaan 4Bayu Pratama100% (1)
- FAJANs RULES Aturan FajansDokumen6 halamanFAJANs RULES Aturan FajansAquwh ChieychuandniechyimoudgthoeBelum ada peringkat
- Elektroda Pada PotensiometriDokumen3 halamanElektroda Pada PotensiometriPricilia Andhika DewiBelum ada peringkat
- Laporan Spektrofotometri Serapan AtomDokumen23 halamanLaporan Spektrofotometri Serapan AtomBima Santri MulyaBelum ada peringkat
- Mekanisme FotokatalisDokumen6 halamanMekanisme FotokatalisDimasBelum ada peringkat
- PresipitimetriDokumen55 halamanPresipitimetriKarina Octaria PutriBelum ada peringkat
- Potensiometri (Edited) CheckedDokumen4 halamanPotensiometri (Edited) CheckedPutri Kholisatun NawaBelum ada peringkat
- Laporan P2 - Kelompok 1Dokumen41 halamanLaporan P2 - Kelompok 1asdaBelum ada peringkat
- VOLTAMMETRIDokumen40 halamanVOLTAMMETRISitiBelum ada peringkat
- Dasar Reaksi Oksidimetri Ialah Reaksi OksidasiDokumen18 halamanDasar Reaksi Oksidimetri Ialah Reaksi OksidasiastiachiBelum ada peringkat
- KonduktometriDokumen16 halamanKonduktometriAmanah Firdausa100% (1)
- LAPORAN PERCOBAAN REAKSI SENYAWA KARBONIL DENGAN KARBANION - KELOMPOK 4 Revisi Mbak Dwi LapterDokumen39 halamanLAPORAN PERCOBAAN REAKSI SENYAWA KARBONIL DENGAN KARBANION - KELOMPOK 4 Revisi Mbak Dwi LapterLifianyAnnisaBelum ada peringkat
- 7.elektroda Selektif Ion KalsiumDokumen11 halaman7.elektroda Selektif Ion KalsiumNurlaeli NaelulmunaMajdiyahBelum ada peringkat
- Dokumen - Tips Objek-3Dokumen11 halamanDokumen - Tips Objek-3Jofi Satrio PurnomoBelum ada peringkat
- Elektroda Ion SelektifDokumen17 halamanElektroda Ion SelektifAdeFriscaDianaIIBelum ada peringkat
- Bab 4 Mehkanisme Radikal BebasDokumen9 halamanBab 4 Mehkanisme Radikal BebasyolandBelum ada peringkat
- Penentuan Energi Pengaktifan Reaksi IonikDokumen5 halamanPenentuan Energi Pengaktifan Reaksi IonikvellarineBelum ada peringkat
- KonduktometriDokumen16 halamanKonduktometriAndrean ChandraBelum ada peringkat
- Ikatan Sigma PiDokumen3 halamanIkatan Sigma PiAulya DhiensnyBelum ada peringkat
- Fenomena PermukaanDokumen21 halamanFenomena PermukaanIrvandar NurviandyBelum ada peringkat
- Pembuatan Cis Dan Trans Kalium DioksalatodiakuokromatDokumen13 halamanPembuatan Cis Dan Trans Kalium DioksalatodiakuokromatM Nur M. Mahmud100% (1)
- Kromatografi SoalDokumen4 halamanKromatografi SoalYahya JaniBelum ada peringkat
- FINIS - Soala DRPM UTSA KOBA - 2020Dokumen19 halamanFINIS - Soala DRPM UTSA KOBA - 2020Diyah Yuni AstutiBelum ada peringkat
- ElektrogravimetriDokumen20 halamanElektrogravimetriNspBelum ada peringkat
- Percobaan I - Kekuatan Medan LiganDokumen17 halamanPercobaan I - Kekuatan Medan LiganlyraBelum ada peringkat
- Volta MetriDokumen11 halamanVolta MetriUfi DamayantiBelum ada peringkat
- Satuan RadioaktivitasDokumen3 halamanSatuan RadioaktivitasKurogane KunBelum ada peringkat
- Viskositas IntrinsikDokumen2 halamanViskositas IntrinsikdiansantosoeffBelum ada peringkat
- Laporan Praktikum Elektoda Selektif Ion CaDokumen10 halamanLaporan Praktikum Elektoda Selektif Ion CaIvan ParulianBelum ada peringkat
- Materi Asidi AlkalimetriDokumen18 halamanMateri Asidi AlkalimetriRizeki Putri AgustinBelum ada peringkat
- Tugas KonduktometriDokumen6 halamanTugas KonduktometriIreniza LianoBelum ada peringkat
- 7-Karakterisasi Katalis PDFDokumen30 halaman7-Karakterisasi Katalis PDFKhairatun NisaBelum ada peringkat
- Materi BaruDokumen3 halamanMateri BaruAnnita Karunia SavitriBelum ada peringkat
- PolarografiDokumen20 halamanPolarografiWifqul LailyBelum ada peringkat
- Analisis VoltametriDokumen16 halamanAnalisis VoltametriindahBelum ada peringkat
- Voltammetri Analisis ParasetamolDokumen9 halamanVoltammetri Analisis ParasetamolNurlaeli NaelulmunaMajdiyahBelum ada peringkat
- Sensor VoltametriDokumen7 halamanSensor Voltametriniluh100% (1)
- Jurnal VoltakuDokumen14 halamanJurnal VoltakuKelvin K.Belum ada peringkat
- Jurnal Instrumen VoltaDokumen13 halamanJurnal Instrumen VoltaADINDABelum ada peringkat
- Volta MetriDokumen30 halamanVolta MetrisarinaBelum ada peringkat
- Modul 5 Potensiometri, KonduktometriDokumen5 halamanModul 5 Potensiometri, KonduktometriApepNurdiyanBelum ada peringkat
- PolarografiDokumen7 halamanPolarografiFikka MaypalitaBelum ada peringkat
- Ledakan Kaleng SodaDokumen7 halamanLedakan Kaleng SodaJajang TaryanaBelum ada peringkat
- Cara Menulis Kutipan Dan Rujukan Yang Baik Dan BenarDokumen3 halamanCara Menulis Kutipan Dan Rujukan Yang Baik Dan BenarJajang TaryanaBelum ada peringkat
- Membuat Sabun Dari Abu Sekam Padi Dan Minyak JelantahDokumen4 halamanMembuat Sabun Dari Abu Sekam Padi Dan Minyak JelantahJajang TaryanaBelum ada peringkat
- Silabus Mata Kuliah SemioticsDokumen24 halamanSilabus Mata Kuliah SemioticsJajang TaryanaBelum ada peringkat
- Makalah PraktekDokumen47 halamanMakalah PraktekJajang TaryanaBelum ada peringkat