Penentuan Kadar Protein Metoda Lowry
Penentuan Kadar Protein Metoda Lowry
Diunggah oleh
Aldo PramudyaJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Penentuan Kadar Protein Metoda Lowry
Penentuan Kadar Protein Metoda Lowry
Diunggah oleh
Aldo PramudyaHak Cipta:
Format Tersedia
Penentuan Kadar Protein Metoda Lowry
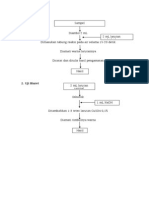
I.
Tujuan
Menentukan kadar protein dalam sampel putih telur ayam ras dengan metoda Lowry.
II.
Prinsip
Reduksi Cu2+ menjadi Cu+ oleh asam amino aromatik dalam protein. Ion Cu+ bersama
dengan Fosfotungsat dan Fosfomolibdat dalam reagen Fenol membentuk warna biru
sehingga dapat menyerap cahaya dan dapat diamati secara spektrofotometri.
III.
Teori
Pendahuluan
Protein adalah makromolekul yang paling berlimpah di dalam sel hidup dan
merupakan 50% atau lebih berat kering sel. Protein ditemukan dalam semua sel dan
semua bagian sel. Protein juga amat bervariasi, ratusan jenis yang berbeda dapat
ditemukan dalam satu sel. Semua protein, baik yang berasal dari bakteri yang paling tua
atau yang berasal dari bentuk kehidupan tertinggi, dibangun dari rangkaian dasar yang
sama dari 20 jenis asam amino yang berikatan kovalendalam urutan yang khas. Karena
masing-masing asam amino mempunyai rantai samping yang khusus, yang memberikan
sifat kimia masing-masing individu, kelompok 20 molekul unit pembangun ini dapat
dianggap sebagai abjad struktur protein. Yang paling istimewa adalah bahwa sel dapat
merangkai ke-20 asam amino dalam berbagai kombinasi dan urutan, menghasilkan
peptida dan protein yang mempunyai sifat-sifat dan aktivitas berbeda. Dari unit
pembangun ini organisme yang berbeda dapat membuat produk-produk yang demikian
bervariasi, seperti enzim, hormon, lensa protein pada mata, bulu ayam, jaring laba-laba,
dan sebagainya.
Protein yang ditemukan kadang-kadang berkonjugasi dengan makromolekul atau
mikromolekul seperti lipid, polisakarida dan mungkin fosfat. Protein terkonjugasi yang
dikenal antara lain nukleoprotein, fosfoprotein, metaloprotein, lipoprotein, flavoprotein
dan glikoprotein. Protein yang diperlukan organisme dapat diklasifikasikan menjadi
dua golongan utama, yang pertama adalah protein sederhana yaitu protein yang apabila
terhidrolisis hanya menghasilkan asam amino dan protein terkonjugasi, yaitu protein
yang hidrolisis tidak hanya menghasilkan asam amino tetapi menghasilkan juga
komponen anorganik yang disebut gugus prostetic.
Penentuan Kadar Protein Metoda Lowry
Langkah awal dalam pemurnian protein ialah menentukan bahan alam yang akan
diproses. Penentuan ini didasarkan pada kadar protein yang ada didalamnya. Tentu saja
dipilih bahan alam yang mempunyai kadar protein yang tinggi dan mudah diperoleh.
Analisis terhadap kadar protein dalam bahan alam tersebut perlu dilakukan untuk
memperoleh data tentang kadar protein yang akan dimurnikan. Bila protein yang
diinginkan tahan terhadap panas, campuran protein dapat dipanaskan sebentar untuk
mengendapkan protein lain yang diinginkan. Disamping itu protein juga sensitif
terhadap asam dan basa dengan konsentrasi tinggi, dan biasanya pemurnian protein
dilakukan pada pH mendekati netral dengan menggunakan buffer tertentu. Setelah
diperoleh larutan yang berisi beberapa macam protein maka proses selanjutnya ialah
fraksionasi, yaitu memisahkan masing-masing protein dalam campuran secara fraksi
demi fraksi. Dua cara yang biasa digunakan untuk proses fraksionasi ini yaitu
pengendapan dan kromatografi.
Sampel Putih Telur
Putih telur merupakan komponen terbesar dari sebuah telur utuh, yang menyusun
sekitar 58% dari sebuah telur, dibandingkan dengan kuning telur yang hanya 31% saja.
Komponen putih telur terdiri dari air (87%), protein (12%), dan lemak (0,3%). Kuning
telur memiliki komponen protein lebih tinggi (17%) namun juga memiliki lemak yang
jauh lebih besar (32,2%). Putih telur juga dinilai sebagai sumber protein yang baik
karena mampu diserap tubuh secara sempurna untuk digunakan sebagai bahan
pembentuk otot. Putih telur juga kaya akan asam amino esensial seperti Lisin,
Threonin, Valin, Isoleusin, Leusin, Metionin, Fenilalanin, Tryptophan, dan Histidin.
Putih telur juga disarankan sebagai sumber asupan protein berkualitas tinggi dalam pola
diet. Konsumsi asupan tinggi protein telur dapat merangsang pembentukan otot (muscle
protein synthesis).
Penentuan Konsentrasi Protein
Penentuan konsentrasi protein merupakan proses yang rutin digunakan dalam kerja
Biokimia. Ada beberapa metoda yang biasa digunakan dalam rangka penentuan
konsentrasi protein, yaitu metoda Biuret, Lowry dan lain sebagainya. Pemilihan metoda
yang terbaik dan tepat untuk suatu pengukuran bergantung pada beberapa faktor, seperti
2
Penentuan Kadar Protein Metoda Lowry
banyaknya material atau sampel yang tersedia, waktu yang tersedia untuk melakukan
pengukuran dan alat spektrofotometer yang tersedia (VIS atau UV).
a. Metoda Kjeldahl
Metoda Kjeldahl merupakan metoda yang sederhana untuk penetapan nitrogen total
pada asam amino, protein dan senyawa yang mengandung nitrogen. Sampel
didestruksi dengan asam sulfat dan dikatalisis dengan katalisator yang sesuai
sehingga akan menghasilkan amonium sulfat. Setelah pembebasan dengan alkali
kuat, amonia yang terbentuk disuling uap secara kuantitatif ke dalam larutan
penyerap dan ditetapkan secara titrasi. Metoda ini telah banyak mengalami
modifikasi. Metoda ini cocok digunakan secara semimikro, sebab hanya
memerlukan jumlah sampel dan pereaksi yang sedikit dan waktu analisa yang
pendek.
Cara Kjeldahl digunakan untuk menganalisis kadar protein kasar dalam bahan
makanan secara tidak langsung, karena yang dianalisis dengan cara ini adalah kadar
nitrogennya. Dengan mengalikan hasil analisis tersebut dengan angka konversi
6,25; diperoleh nilai protein dalam bahan makanan itu. Untuk beras, kedelai, dan
gandum angka konversi berturut-turut sebagai berikut: 5,95; 5,71 dan 5,83. Angka
6,25 berasal dari angka konversi serum albumin yang biasanya mengandung 16%
nitrogen. Prinsip cara analisis Kjeldahl adalah sebagai berikut: mula-mula bahan
didestruksi dengan asam sulfat pekat menggunakan katalis selenium oksiklorida
atau butiran Zn. Amonia yang terjadi ditampung dan dititrasi dengan bantuan
indikator. Cara Kjeldahl pada umumnya dapat dibedakan atas dua cara, yaitu cara
makro dan semimakro. Cara makro Kjeldahl digunakan untuk contoh yang sukar
dihomogenisasi dan besar contoh 1-3 g, sedang semimikro Kjeldahl dirancang
untuk contoh ukuran kecil yaitu kurang dari 300 mg dari bahan yang homogen.
Cara analisis tersebut akan berhasil baik dengan asumsi nitrogen dalam bentuk
ikatan N-N dan N-O dalam sampel tidak terdapat dalam jumlah yang besar.
Kekurangan cara analisis ini ialah bahwa purina, pirimidina, vitamin-vitamin, asam
amino besar, kreatina, dan kreatinina ikut teranalisis dan terukur sebagai nitrogen
protein. Walaupun demikian, cara ini kini masih digunakan dan dianggap cukup
teliti untuk pengukuran kadar protein dalam bahan makanan.
Analisa protein cara Kjeldahl pada dasarnya dapat dibagi menjadi tiga tahapan yaitu
proses destruksi, proses destilasi dan tahap titrasi.
Penentuan Kadar Protein Metoda Lowry
1. Tahap destruksi
Pada tahapan ini sampel dipanaskan dalam asam sulfat pekat sehingga terjadi
destruksi menjadi unsur-unsurnya. Elemen karbon, hidrogen teroksidasi menjadi
CO, CO2 dan H2O. Sedangkan nitrogennya (N) akan berubah menjadi
(NH4)2SO4. Untuk mempercepat proses destruksi sering ditambahkan
katalisator berupa campuran Na2SO4dan HgO (20:1). Gunning menganjurkan
menggunakan K2SO4 atau CuSO4. Dengan penambahan katalisator tersebut titk
didih asam sulfat akan dipertinggi sehingga destruksi berjalan lebih cepat.
Selain katalisator yang telah disebutkan tadi, kadang-kadang juga diberikan
Selenium. Selenium dapat mempercepat proses oksidasi karena zat tersebut
selain menaikkan titik didih juga mudah mengadakan perubahan dari valensi
tinggi ke valensi rendah atau sebaliknya.
2. Tahap destilasi
Pada tahap destilasi, ammonium sulfat dipecah menjadi ammonia (NH3) dengan
penambahan NaOH sampai alkalis dan dipanaskan. Agar supaya selama
destilasi tidak terjadi superheating ataupun pemercikan cairan atau timbulnya
gelembung gas yang besar maka dapat ditambahkan logam zink (Zn). Ammonia
yang dibebaskan selanjutnya akan ditangkap oleh asam khlorida atau asam borat
4 % dalam jumlah yang berlebihan. Agar supaya kontak antara asam dan
ammonia lebih baik maka diusahakan ujung tabung destilasi tercelup sedalam
mungkin dalam asam. Untuk mengetahui asam dalam keadaan berlebihan maka
diberi indikator misalnya BCG + MR atau PP.
3. Tahap titrasi
Apabila penampung destilat digunakan asam khlorida maka sisa asam khorida
yang bereaksi dengan ammonia dititrasi dengan NaOH standar (0,1 N). Akhir
titrasi ditandai dengan tepat perubahan warna larutan menjadi merah muda dan
tidak hilang selama 30 detik bila menggunakan indikator PP.
%N = N. NaOH 14,008 100%
Apabila penampung destilasi digunakan asam borat maka banyaknya asam borat
yang bereaksi dengan ammonia dapat diketahui dengan titrasi menggunakan
asam khlorida 0,1 N dengan indikator (BCG + MR). Akhir titrasi ditandai
dengan perubahan warna larutan dari biru menjadi merah muda.
Penentuan Kadar Protein Metoda Lowry
%N = N.HCl 14,008 100 %
Setelah diperoleh % N, selanjutnya dihitung kadar proteinnya dengan
mengalikan suatu faktor. Besarnya faktor perkalian N menjadi protein ini
tergantung pada persentase N yang menyusun protein dalam suatu bahan.
b. Metoda Biuret
Uji Biuret adalah tes yang digunakan untuk mendeteksi adanya ikatan
peptida. Bersama peptida, ion tembaga (II) membentuk kompleks berwarna ungu
dalam larutan alkali. Beberapa varian pada tes telah dikembangkan. Reaksi biuret
dapat digunakan untuk uji konsentrasi protein karena ikatan peptida terjadi dengan
frekuensi yang sama per asam amino dalam peptida. Intensitas warna, dan
karenanya serapan pada 540 nm, berbanding lurus dengan konsentrasi protein,
menurut hukum Beer-Lambert.
Terlepas dari namanya, reagen tidak ternyata mengandung biuret ((H2N-CO-)
2NH). Tes ini dinamakan demikian karena ia juga memberikan reaksi positif
terhadap ikatan peptida dalam molekul biuret.
c. Metoda Bradfod
Metoda Bradford didasarkan pada pengikatan zat warna Coomassie Blue G-250 ke
protein, dimana zat warna ini memiliki empat formasi ion berbeda dengan nilai pKa
1,15; 1,82 dan 12,4. Bentuk kationik zat warna ini berwarna merah dan hijau
dengan panjang gelombang serapan (absorbansi) maksimum pada 470 dan 650 nm.
Sedangkan bentuk anioniknya berwarna biru dengan absorbansi maksimum 590
nm. Pengukuran proteinnya sendiri dilakukan dengan menentukan jumlah zat warna
dalam bentuk anionik (biru), dan biasanya hal ini dilakukan dengan mengukur
absorbansi larutan pada 595 nm.
Zat warna Coomassie Blue G-250 bereaksi cepat dengan residu arginil dan lysil dari
protein, sehingga hal ini menyebabkan adanya variasi hasil pengukuran untuk jenis
protein yang berbeda-beda. Protein dengan residu arginil dan lysil yang lebih
banyak tentu akan menghasilkan warna biru yang lebih intens dibanding protein
yang residu arginil dan lysilnya lebih sedikit meskipun jumlah proteinnya sama.
Namun secara umum metoda Bradford masih merupakan metoda yang paling sesuai
dan paling umum digunakan.
Penentuan Kadar Protein Metoda Lowry
Ada dua jenis assay protein dengan metoda Bradford, yaitu Standard Assay , cocok
untuk pengukuran kadar protein antara 10 sampai 100 g dan Microassay yang
dapat mendeteksi antara 1 sampai 10 g protein. Konsekuensinya microassay lebih
rentan terhadap interferensi senyawa nonprotein.
Pereaksi yang digunakan dibuat dengan melarutkan 100 mg Coomassie Blue G-250
dalam 50 ml ethanol 95%. Larutan ini kemudian dicampurkan dengan 100 ml asam
fosfat 85% dan diencerkan sampai volume 1 L dengan aquadest. Pereaksi ini harus
difilter dengan kertas saring Whatman No. 1 dan disimpan dalam botol amber
(gelap) di suhu ruang. Pereaksi ini stabil hingga beberapa minggu, namun jika
terbentuk endapan ketika penyimpanan, maka harus difilter lagi saat hendak
digunakan.
Standar protein yang digunakan adalah Bovine -globulin dengan konsentrasi 1
mg/ml (atau 100 g/ml untuk microassay) digunakan sebagai larutan stok
(disimpan beku pada suhu -20C). Konsentrasi protein larutan standar harus diukur
sebelum digunakan dengan mengukur absorbansinya pada 280 nm. Absorbansi
larutan Bovine -globulin 1mg/ml pada cuvet 1 cm adalah 1,35. Jika yang
digunakan adalah Bovine Serum Albumin (BSA) atau Ovalbumin, maka
absorbansinya masing-masing adalah 0,66 dan 0,75.
d. Metoda Dumas
Metoda Dumas dalam bidang adalah metoda untuk penentuan kuantitatif dari zat
nitrogen berdasarkan metoda pertama yang dijelaskan oleh Jean-Baptiste Dumas
lebih dari satu abad setengah yang lalu. Teknik ini telah dikembangkan sehingga
mampu dengan cepat mengukur konsentrasi crude protein sampel makanan dan
mulai bersaing dengan metoda Kjeldahl sebagai metoda standar untuk analisis
kandungan protein untuk beberapa bahan makanan.
Metoda ini terdiri dari pembakaran sampel massa dalam suhu tinggi (sekitar 900
C) ruang dalam kehadiran oksigen. Hal ini menyebabkan pelepasan karbon, air
dioksida dan nitrogen. Gas tersebut kemudian melewati kolom khusus yang
menyerap karbon dioksida dan air. Sebuah kolom yang berisi detektor konduktivitas
termal di akhir kemudian digunakan untuk memisahkan nitrogen dari sisa karbon
dioksida dan air dan kandungan nitrogen yang tersisa diukur. Instrumen pertama
harus dikalibrasi dengan menganalisis bahan yang murni dan memiliki konsentrasi
nitrogen dikenal. Sinyal diukur dari detektor konduktivitas termal untuk sampel
yang tidak diketahui kemudian dapat diubah menjadi kandungan nitrogen. Seperti
Penentuan Kadar Protein Metoda Lowry
dengan metoda Kjeldahl, konversi konsentrasi nitrogen dalam sampel dengan
kandungan protein mentah dilakukan dengan menggunakan faktor konversi yang
bergantung pada urutan asam amino tertentu dari protein diukur. Metoda Dumas
memiliki keuntungan menjadi mudah digunakan dan otomatis. Metoda ini juga jauh
lebih cepat daripada metoda Kjeldahl, mengambil beberapa menit per pengukuran,
dibandingkan dengan jam atau lebih untuk Kjeldahl. Ini juga tidak menggunakan
bahan kimia beracun atau katalis. Salah satu kelemahan utama adalah tingginya
biaya awal. Juga, seperti dengan Kjeldahl, tidak memberikan ukuran protein yang
benar, karena nitrogen nonprotein register, dan faktor koreksi yang berbeda
diperlukan untuk protein yang berbeda karena mereka memiliki urutan asam amino
yang berbeda. Akhirnya, ukuran sampel yang kecil meningkatkan risiko
memperoleh sampel tidak representatif.
e. Metoda Lowry
Uji protein Lowry adalah tes biokimia unutuk menentukan tingkat total protein
dalam suatu larutan. Konsentrasi total protein ditunjukkan oleh perubahan warna
larutan sampel yang sebanding dengan konsentrasi protein, yang kemudian dapat
diukur dengan menggunakan teknik kolorimetri.
Oliver H. Lowry yang mengembangkan teknik ini pada tahun 1940-an. Metoda
ini menggabungkan reaksi ion tembaga dengan ikatan peptida dalam suasana
basa (uji biuret) dengan residu protein oksidasi aromatik. Metoda Lowry paling
baik digunakan dengan konsentrasi protein dari 0,01-1,0 mg / mL dan didasarkan
pada reaksi Cu + yang dihasilkan oleh oksidasi ikatan peptida, dengan reagen Folin
Ciocalteu (campuran asam fosfotungstat dan asam fosfomolibdat dalam reaksi
Folin-Ciocalteu).
Mekanisme reaksi melibatkan pengurangan reagen Folin dan oksidasi residu asam
amino aromatik (terutama triptofan dan tirosin).
Berkurangnya konsentrasi reagen Folin diukur dengan absorbansi pada 600 700 nm.
Akibatnya, konsentrasi total protein dalam sampel dapat disimpulkan dari
konsentrasi residu Triptofan dan Tirosin yang mengurangi reagen Folin.
Adapun metoda lain yang dapat digunakan, yaitu Metoda Dumas, Radiochemical
methods, Formol titration, Alkaline distilation, Dye-binding dan NIR.
Standar Bovine Serum Albumin
Bovine serum albumin (BSA juga dikenal sebagai atau "Fraksi V") adalah protein
albumin aserum yang berasal dari sapi. BSA sering digunakan sebagai standar
Penentuan Kadar Protein Metoda Lowry
konsentrasi protein. Julukan "Fraksi V" mengacu pada albumin yang menjadi fraksi
kelima metodologi pemurnian Cohn oleh Edwin yang memanfaatkan karakteristik
kelarutan diferensial dari protein plasma.
BSA memiliki banyak aplikasi dalam biokimia, termasuk ELISA (Enzyme-Linked
Immunosorbent Assay), immunoblots dan imunohistokimia. Hal ini juga digunakan
sebagai nutrisi dalam sel dan kultur mikroba.
Penentuan Kadar Protein Metoda Lowry
IV.
Alat dan Bahan
Alat:
Tabung reaksi
Pipet mikron
Spektrofotometer
Stop watch
Vortex
Sampel 2 g/50 mL putih telur ayam ras
Bahan:
Standar BSA (Bovine Serum Albumin) dengan konsntrasi 1000 g/mL
H2O
Reagen Biuret
Reagen Folin Ciocalteu (Fenol)
V.
Prosedur
1. 0,6 mL larutan standar BSA dilarutkan dalam 0,4 mL air. Dicampurkan pula
sampel putih telur dengan air sehingga volume akhirnya 1,0 mL,
2. Ditambahkan 5 mL larutan biuret yang telah disiapkan kedalam masing-masing
tabung,
3. Secara tepat 10 menit kemudian, dilakukan inkubasi pada suhu kamar. Selang
waktu tersebut sangat kritis. Digunakan stopwatch (dinyalakan sebekum
menambahkan larutan Biuret pada tabung 2). Setelah 10 menit, ditambahkan 0,5
mL reagen Fenol kedalam masing-masing tabung dan dikocok dengan segera
dengan alat vortex,
4. Dilakukan inkubasi selama 30 menit pada suhu kamar. Waktu inkubasi ini dapat
dimulai setelah penambahan/pencampuran reagen Fenol kedalam tabung terakhir,
5. Absorbansi dibaca pada panjang gelombang 700 nm dengan alat spektrofotometer
dengan menggunakan tabung 1 sebagai blanko.
Penentuan Kadar Protein Metoda Lowry
VI.
Pengamatan
a. Data
KURVA BAKU
1200
1000
f(x) = 1634.39x + 8.11
R = 0.99
800
Absorbansi (700 nm)
600
Konsentrasi
Linear (Konsentrasi)
400
200
0
0
0.1 0.2 0.3 0.4 0.5 0.6 0.7
y = bx + a
a = -5,063 x 10-3
b = 6,108 x 10-4
10
Penentuan Kadar Protein Metoda Lowry
r = 0,995
r2 = 0,9909
Persamaan y = 6,108x10-4x - 5,053x10-3
Volume Sampel
(mL)
0,3
0,3
0,5
0,5
0,6
0,6
Jumlah Sampel
(mg)
12
12
20
20
24
24
Absorbansi
(700 nm)
0,306
0,346
0,346
0,168
0,041
0,491
Kadar Protein
(g)
509,271
574,765
574,759
283,338
812,153
Rata-rata
542,018
429,049
812,153
b. Perhitungan
Pengambilan sampel
BSA 1000 g/mL
50 mg
5000 g
=
50 mL
50 mL
= 1000 g/mL
Sampel putih telur
2 g/50 mL = 2000 mg/50 mL = 40 mg/mL
Kadar protein
y = 6,108x10-4x - 5,053x10-3
x = Absorbansi
y = Kadar protein
Untuk sampel 12 mg:
y = 6,108x10-4x - 5,053x10-3
0,306 = 6,108x10-4x - 5,053x10-3
6,108x10-4x = 0,306 + 5,053x10-3
6,108x10-4x = 0,311
x = 509,271
0,346 = 6,108x10-4x - 5,053x10-3
6,108x10-4x = 0,346 + 5,053x10-3
6,108x10-4x = 0,351
x = 574,765
11
Penentuan Kadar Protein Metoda Lowry
509,271+574,765
= 542,018
2
542, o 18
dalam 1 mg =
= 45,168 g
12
x=
Untuk sampel 20 mg:
y = 6,108x10-4x - 5,053x10-3
0,346 = 6,108x10-4x - 5,053x10-3
6,108x10-4x = 0,346 + 5,053x10-3
6,108x10-4x = 0,351
x = 574,765
0,168 = 6,108x10-4x - 5,053x10-3
6,108x10-4x = 0,168 + 5,053x10-3
6,108x10-4x = 0,173
x = 283,338
x=
574,759+283,338
2
dalam 1 mg =
429,049
20
= 429,049
= 21,452 g
Untuk sampel 24 mg:
y = 6,108x10-4x - 5,053x10-3
0,491 = 6,108x10-4x - 5,053x10-3
6,108x10-4x = 0,491 + 5,053x10-3
6,108x10-4x = 1,01
x = 812,152
dalam 1 mg =
812,152
24
= 33,84 g
12
Penentuan Kadar Protein Metoda Lowry
VII.
Pembahasan
Pada percobaan kali ini, dilakukan penentuan kadar protein pada putih telur ayam
ras dengan metoda Lowry. Penentuan kadar protein dengan metoda ini
didasarkan pada reaksi antara Cu2+dengan ikatan peptida dan reduksi asam osfotungstat
dan asam fosfomolibdat oleh tirosin dan triptofan yang merupakan residu protein yang
akan memberikan warna biru. Warna yang diperoleh akan diukur absorbannya dengan
menggunakan spektrofotometer pada panjang gelombang maksimum antara 600-700
nm. Pembanding yang digunakan adalah standar Bovine Serum Albumin (BSA) dengan
konsentrasi 100, 200, 400, 600, 800 dan 1000 g. Adapun tujuan dari pembuatan
larutan standar dengan berbagai konsentrasi adalah untuk menentukan kadar protein
dalam suatu sampel (multi point method) dengan menggunakan persamaan garis lurus
yang diperoleh dari grafik larutan standar.
Dari tujuh tabung BSA dengan satu tabung sebagai blanko, diperoleh angkaangka absorbansi yang menjadi sumbu y pada kurva baku dan konsentrasi BSA sebagai
x. Kurva menunjukkan slop positif dengan gradien garis mendekati 1 (0,9909). Dengan
regresi linear, diperoleh pula nilai a = -5,063 x 10-3 dan b = 6,108 x 10-4. Sehingga,
untuk persamaan garis y = bx + a diperoleh persamaan y = 6,108x10-4x - 5,053x10-3.
Pengujian dilakukan pada tiga volume sampel yang berbeda, yaitu 0,3 mL (12
mg); 0,5 mL (20 mg) dan 0,6 mL (24 mL). Pada masing-masing volume, dilakukan
pengujian secara duplo. Pada tabung sampel, ditambahkan reagen Biuret yang terdiri
dari larutan Na2CO3 2% dalam NaOH 0,1 N, Na-K-Tartrat 2,7% dan CuSO4 1%.5H2O
dengan perbandingan 100:1:1. Larutan Na2CO3 berfungsi sebagai garam yang
mengkoordinasikan reaksi dalam suasana basa bersama NaOH, larutan Na-K-Tartrat
berfungsi mencegah terjadinya pengendapan kuprooksida dalam reagen Biuret,
sedangkan larutan CuSO4 berfungsi untuk mereduksi fosfotungstat fosfomolibdat.
Adapun reagen Biuret untuk memberi suasana basa. Sehingga akan menghasilkan
warna biru dimana intensitas warna ini bergantung dari kadar protein yang akan
ditentukan.
Larutan standar, sampel, dan blanko sebanyak 1 mL ditambahkan dengan 5 mL reagen
Biuret, dikocok agar homogen dan diinkubasi selama 10 menit pada suhu kamar agar
13
Penentuan Kadar Protein Metoda Lowry
reaksi berjalan sempurna. Reaksi yang terjadi adalah reduksi Cu2+ menjadi Cu+ pada
reagen Biuret oleh asam amino aromatik dalam protein (Tirosin, Triptofan atau
Fenilalanin)
Kompleks protein dengan ion Cu2+ dalam reagen Biuret
Setelah itu, ditambahkan reagen Fenol (folin ciocalteu) sebanyak 0,5 mL,
dihomogenkan dengan vortex dan diinkubasi lagi selama 30 menit. Hal ini dilakukan
agar kepekatan larutan tersebut lebih maksimal. Kompleks protein dengan ion Cu+ akan
mereduksi fosfomoblidat dan fosfostungstat (fosfomolibdotungstat), menghasilkan
tungsten dan heteropolimolibdenum blue akibat reaksi oksidasi gugus aromatik (rantai
samping asam amino) terkatalis Cu, yang memberikan warna biru yang dapat dideteksi
secara kolorimetri, kekuatan warna biru terutama bergantung pada kandungan residu
Triptofan dan Tirosinnya. Absorbansinya kemudian dapat diukur dengan
spektrofotometer pada panjang gelombang 700 nm.
Pembentukan heteropolimolibdenum blue dari reduksi fosfomolibdat dan fosfotungstat oleh
komplek Cu+ dan protein.
14
Penentuan Kadar Protein Metoda Lowry
Banyaknya produk tungsten dan heteropolimolibdenum blue sebanding dengan
banyaknya residu protein, semakin tinggi konsentrasi protein, maka produk yang
dihasilkan juga semakin banyak, ditandai dengan warna biru yang semakin pekat.
Hasil yang diperoleh untuk volume 0,5 mL menunjukkan selisih yang cukup
besar antara absorbansi tabung 1 dengan absorbansi tabung 2, yaitu 0,346 dan 0,168.
Hal ini dapat disebabkan karena pada pipet yang digunakan untuk memipet sampel ke
tabung 1 volume 0,5 mL masih terdapat sisa detergen yang dapat mereduksi tungstat,
sehingga absorbansi yang dibaca oleh spektrofotometer menjadi lebih besar.
Selisih nilai absorbansi terjadi pula pada volume 0,6 mL, dapat dikarenakan
masih terdapat sisa detergen maupun kesalahan dalam teknik memipet sampel dengan
pipet micron. Nilai absorbansi yang diperoleh pada kedua tabung adalah 0,041 dan
0,491. Karena selisih yang terlampau jauh, maka untuk volume 0,6 mL hanya
digunakan satu nilai absorbansi, bukan nilai rata-ratanya, yaitu 0,346.
VIII. Kesimpulan
Kadar protein dalam 0,6 mL putih telur ayam ras adalah sebanyak 33,84 g/mg.
15
Penentuan Kadar Protein Metoda Lowry
DAFTAR PUSTAKA
Biuret Test. http://en.wikipedia.org/wiki/Biuret_test
Dumas Methode. http://en.wikipedia.org/wiki/Dumas methode
Girindra, A. 1986. Biokimia I. Jakarta: Gramedia.
Hawab, HM. 2004. Pengantar Biokimia. Jakarta : Bayu Media Publishing.
Kjeldahl Methode. http://en.wikipedia.org/wiki/Kjeldahl methode
Lowry Protein Assay. http://en.wikipedia.org/wiki/Lowry_protein_assay
Poedjiyadi, Anna dkk. 2006. Dasar-DasarBiokimia. Jakarta : UI-Press.
16
Penentuan Kadar Protein Metoda Lowry
LAMPIRAN
Tugas Pendahuluan
1. Jelaskan prinsip percobaan ini!
Reduksi Cu2+ menjadi Cu+ oleh asam amino aromatik dalam protein. Ion Cu+ bersama
dengan Fosfostungsat dan Fosfomoblidat dalam reagen Fenol membentuk warna biru
sehingga dapat menyerap cahaya dan dapat diamati secara spektrofotometri.
2. Gambarkan
Struktur asam amino-asam amino penyusun protein yang mengandung gugus
Fenolik
(Tirosin)
(Triptofan)
(Fenilalanin)
17
Penentuan Kadar Protein Metoda Lowry
Kompleks Cu-protein hasil reaksi Biuret
3. Mengapa metoda Lowry lebih peka dibandingkan dengan metoda Biuret dalam
menganalisa protein?
Karena pada metoda Lowry, warna yang terbentuk dapat diukur absorbansinya dengan
spektrofotometer, sehingga hanya memerlukan sedikit sampel.
18
Anda mungkin juga menyukai
- Penentuan Kadar Protein Metode KjeldahlDokumen21 halamanPenentuan Kadar Protein Metode Kjeldahlelly febriyantiBelum ada peringkat
- Makalah Kadar ProteinDokumen16 halamanMakalah Kadar ProteinDwiwanra Ibnu Umar67% (3)
- Laporan Praktikum Biokimia KjeldahlDokumen14 halamanLaporan Praktikum Biokimia KjeldahlAyu Sukerti100% (1)
- Modul 5-Analisis ProteinDokumen11 halamanModul 5-Analisis ProteinALMA CHRISTINE FEBRIANIBelum ada peringkat
- Titrasi FormolDokumen7 halamanTitrasi FormolDiah AyuBelum ada peringkat
- Biokimia LL GlikolisisDokumen15 halamanBiokimia LL Glikolisisendang lestariBelum ada peringkat
- Analisa Protein Dengan Metode KjeldahlDokumen7 halamanAnalisa Protein Dengan Metode KjeldahlSuriani MbojosumiBelum ada peringkat
- Lemak Dalam Susu BubukDokumen11 halamanLemak Dalam Susu BubukSri AnggunBelum ada peringkat
- Laporan BiuretDokumen22 halamanLaporan BiuretAulia Cita SiswantiBelum ada peringkat
- Laporan Praktikum PENGENALAN GCDokumen18 halamanLaporan Praktikum PENGENALAN GCRini RositaBelum ada peringkat
- Laporan Analisis KarbohidratDokumen13 halamanLaporan Analisis KarbohidratSalsabila alyaBelum ada peringkat
- Uji Pengaruh PHDokumen10 halamanUji Pengaruh PHyeyen38Belum ada peringkat
- Uji BarfoedDokumen2 halamanUji BarfoedZahra FirdausBelum ada peringkat
- Pembahasan Enzim Lipase GitaDokumen4 halamanPembahasan Enzim Lipase Gitasagitawidiyastuti100% (2)
- Pembentukan Ikatan PeptidaDokumen8 halamanPembentukan Ikatan Peptidataul75% (4)
- Praktikum Analisis Kadar GulaDokumen6 halamanPraktikum Analisis Kadar GulaAnisa Darma BriliantBelum ada peringkat
- PRINSIP ViskositasDokumen8 halamanPRINSIP ViskositasAyyu WidyazmaraBelum ada peringkat
- PEMBAHASAN Bilangan PeroksidaDokumen6 halamanPEMBAHASAN Bilangan Peroksidadevi kartikaBelum ada peringkat
- Pembahasan ProteinDokumen9 halamanPembahasan ProteinLavenia Yuanita100% (1)
- Laporan Praktikum Kimia Pertanian 5Dokumen7 halamanLaporan Praktikum Kimia Pertanian 5Rizki Arifani 'IkiBelum ada peringkat
- Lap. Praktikum Minyak IkanDokumen10 halamanLap. Praktikum Minyak IkanDewi SetiyowatiBelum ada peringkat
- Analisis Kadar ProteinDokumen8 halamanAnalisis Kadar Proteinanon_866087406Belum ada peringkat
- Dessy - Nursetia: PENENTUAN KADAR KARBOHIDAT DENGAN METODE ANTHRONEDokumen7 halamanDessy - Nursetia: PENENTUAN KADAR KARBOHIDAT DENGAN METODE ANTHRONEAsep Iwan PurnawanBelum ada peringkat
- Tugas Analisis Kualitatif KarbohidratDokumen6 halamanTugas Analisis Kualitatif KarbohidratItsAndrioBelum ada peringkat
- Biokimia Protein 2Dokumen21 halamanBiokimia Protein 2Khoirul AnumBelum ada peringkat
- Enzim PullulanaseDokumen4 halamanEnzim PullulanaseNurmayanti YantiBelum ada peringkat
- Praktikum Dasar BiokimiaDokumen9 halamanPraktikum Dasar BiokimiaAchaa HarsalBelum ada peringkat
- Analisis Protein KLP 3Dokumen5 halamanAnalisis Protein KLP 3Benny TresnandaBelum ada peringkat
- 042 - Azka Rahma - 12 - L6Dokumen8 halaman042 - Azka Rahma - 12 - L6Azka Rahma MeisyaBelum ada peringkat
- Soal UTS Analisis PanganSM Ganjil 2019Dokumen4 halamanSoal UTS Analisis PanganSM Ganjil 2019Nara QuiannaBelum ada peringkat
- Laporan Biokimia Acara 3 EnzimDokumen10 halamanLaporan Biokimia Acara 3 EnzimFarhan Aditya0% (1)
- Laporan Praktikum Biokimia Lipid Kelompok 2Dokumen19 halamanLaporan Praktikum Biokimia Lipid Kelompok 2Sabina ValechkaBelum ada peringkat
- Penentuan Kadar ProteinDokumen7 halamanPenentuan Kadar ProteinEny Dewi FortunaBelum ada peringkat
- Jurnal Enzim Lisozim - BIOKIMIADokumen10 halamanJurnal Enzim Lisozim - BIOKIMIAalifa adzkaBelum ada peringkat
- 25 Uji Salting OutDokumen19 halaman25 Uji Salting OutJuwita DesturiaBelum ada peringkat
- Analisis Kadar ProteinDokumen29 halamanAnalisis Kadar ProteinAndrey JayantoBelum ada peringkat
- Titrasi Karl FischerDokumen4 halamanTitrasi Karl FischerCheryl Harris100% (1)
- Laporan Isolasi Enzim Bromelin Dari NanasDokumen7 halamanLaporan Isolasi Enzim Bromelin Dari NanasBerly Dwikaryani0% (1)
- Kadri R Lawa - POKD7Dokumen8 halamanKadri R Lawa - POKD7KADRIBelum ada peringkat
- 1Dokumen4 halaman1Jonathan SianturiBelum ada peringkat
- Kelompok 6 - Kinetika Fermentasi - Makalah FermentasiDokumen16 halamanKelompok 6 - Kinetika Fermentasi - Makalah Fermentasilaritma ratna safitriBelum ada peringkat
- Analisis Kadar Abu Bahan PanganDokumen3 halamanAnalisis Kadar Abu Bahan PanganPUTU SEKAR AYU SHARADHITABelum ada peringkat
- Praktikum ImmobilisasiDokumen16 halamanPraktikum ImmobilisasiPutra Rajawali100% (2)
- Percobaan 5 Penentuan Bilangan AsamDokumen14 halamanPercobaan 5 Penentuan Bilangan AsamVakhot SantikaBelum ada peringkat
- Uji NyalaDokumen8 halamanUji NyalanaufalBelum ada peringkat
- Biosintesis SteroidDokumen3 halamanBiosintesis SteroidbadriyatunnikmahBelum ada peringkat
- Analisis Kuantitatif Bahan PanganDokumen5 halamanAnalisis Kuantitatif Bahan PanganMedina Deanti Sari100% (1)
- APENDIKSDokumen31 halamanAPENDIKSMitchell SmithBelum ada peringkat
- Laporan Praktikum Uji ProteinDokumen11 halamanLaporan Praktikum Uji ProteinWindiBelum ada peringkat
- Uji MolischDokumen7 halamanUji MolischPascalis PrayudiBelum ada peringkat
- Karakteristik Intrinsik Dan Ekstrinsik Kornet Sapi PronasDokumen7 halamanKarakteristik Intrinsik Dan Ekstrinsik Kornet Sapi PronasRika Syarifah FajrinBelum ada peringkat
- Modul AsiditasDokumen10 halamanModul AsiditasFikri Maulana100% (1)
- Ekstraksi Dengan PelarutDokumen2 halamanEkstraksi Dengan PelarutSafar Daulay Ibnu SatioBelum ada peringkat
- Kel 10 - Penentuan Mutu Pangan Berdasarkan Uji Kimia (Soft Drink)Dokumen26 halamanKel 10 - Penentuan Mutu Pangan Berdasarkan Uji Kimia (Soft Drink)Fathimah RaidatulBelum ada peringkat
- MayonaiseDokumen14 halamanMayonaiseNdenk' Muw CllwBelum ada peringkat
- Analisa Vitamin C Metode IodimetriDokumen6 halamanAnalisa Vitamin C Metode IodimetriOgi RosadiBelum ada peringkat
- Kelompok 10 Anfispang (PMIP) - Penerapan Materi PraktikumDokumen4 halamanKelompok 10 Anfispang (PMIP) - Penerapan Materi PraktikumNurananda galuh syahputriBelum ada peringkat
- Nentuan Kadar Protein Metode Kjeldahl DanDokumen51 halamanNentuan Kadar Protein Metode Kjeldahl DanDianSwaraPiliang100% (2)
- Penentuan Kadar Protein Metode Kjeldahl DanDokumen23 halamanPenentuan Kadar Protein Metode Kjeldahl DanNayspisces Nyea NoelupthflenttheaBelum ada peringkat
- Penentuan Kadar Protein Metode Kjeldahl Dan LowryDokumen27 halamanPenentuan Kadar Protein Metode Kjeldahl Dan LowryNurin AuliaBelum ada peringkat