Sistem Buffer Tubuh Manusia
Diunggah oleh
barbarHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Sistem Buffer Tubuh Manusia
Diunggah oleh
barbarHak Cipta:
Format Tersedia
Nama Kelompok :
1. Afita Budya Ningrum (1902012769)
2. Apriliana Khoirun Nisa’ (1902012762)
3. Ayu Astutika Anggraini (1902012780)
4. Dhiajeng Widya Ningrum (1902012779)
5. Egi Satio Subekti (1902012761)
6. Fitria Asmoro Sari (1902012743)
7. Habib Minhaj Attoriq (1902012767)
8. Ilham Akbar Maulana (1902012756)
9. Naili LuthfiAti (1902012741)
10. Natasya Widya Rahma (1902012770)
11. Puji Rahayu (1902012777)
12. Ulfa Humairah (1902012781)
13. Yunita Fitasari (1902012764)
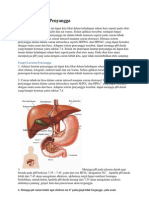
Sistem Buffer Tubuh Manusia
Buffer adalah zat yang dapat mempertahankan pH ketika ditambah sedikit asam/basa atau
ketika diencerkan. Buffer memiliki dua macam : asam lemah dan garamnya atau basa lemah dan
garamnya. Buffer dalam tubuh manusia adalah darah. Jika darah tidak memiliki buffer maka
ketika minum jus jeruk yang asam , tubuh kita dapat mengalami asidosis ( pH darah asam ).
Buffer dalam darah adalah jenis buffer yang terdiri dari asam lemah dan garamnya. Asam lemah
nya adalah asam karbonat H2CO3 ( asam lemah ) dan garamnya adalah HCO3-. Buffer tersebut
dapat mempertahankan pH darah sekitar 7,35 – 7,45 dengan reaksi sebagai berikut : H2CO3 +
OH- => HCO3- + H2OHCO3- + H+ => H2CO3 Ketika masuk zat asam dalam tubuh maka yang
bertugas menetralisir adalah asam lemah (asam karbonat). Jika masuk zat basa, yang bertugas
menetralisisr adalah garamnya. Ketika masuk zat asam ketika hal ini terjadi asam karbonatlah
yang menjadi pahlawan. Ia akan menghadapi si asam ini dan bereaksi dengannya. Hasil reaksi ini
membuat keadaan kembali netral dan menghasilkan hasil reaksi berupa garam yang banyak.
Garam ini sebagain disimpan dan jika lebih akan dibuang melalui urin. Jadi kalo banyak makan
atau minum yang asam asam, kita akan banyak menghasilkan urin. Karena asam karbonat
bereaksi dengan asam untuk menetralkan tadi, maka jumlah asam karbonat akan berkurang
sehingga kita perlu mempeorlhnya dari pernafasan CO2.
Ketika masuk zat basa ketika hal ini terjadi garam lah yang menjadi pahlawan. Ia akan
menghadapi si basa ini dan bereaksi dengannya. Hasil reaksi ini membuat keadaan kembali
netral dan menghasilkan hasil reaksi berupa asam karbonat yang banyak. Asam karbonat ini
sebagain disimpan dan jika lebih akan dibuang melalui nafas (CO2). Jadi kalo banyak makan
atau minum yang basa basa, kita akan banyak menghasilkan CO2.
Fungsi Larutan Penyangga
Larutan penyangga dalam kehidupan sehari-hari :
Fungsi Larutan dalam tubuh manusia Reaksi kimia yang terjadi di dalam tubuh manusia
merupakan reaksi enzimatis, yaitu reaski yang melibatkan enzim sebagai katalis. Enzim sebagai
katalis hanya dapat bekerja dengan baik pada pH tertentu (pH optimumnya). Agar enzim tetap
bekerja secara optimum, diperlukan lingkungan reaksi dengan pH yang relative tetap, unutk itu
maka diperlukan larutan penyangga. Didalam setiap cairan tubuh terdapat pasangan asam-basa
konjugasi yang berfungsi sebagai larutan penyangga. Cairan tubuh, baik sebagai cairan intra sel
(dalam sel) dan cairan ekstra sel (luar sel) memerlukan system penyangga tersebut unutk
mempertahankan harga pH cairan tersebut. System penyangga ekstra sel yang penting adalah
penyangga karbonat ( H2CO3/HCO3-) yang berperan dalam menjaga pH darah, dan system
penyangga fosfat (H2PO4-/HPO42-) yang berperan menjaga pH cairan intra sel. Fungsi Larutan
penyangga dalam industry Dalam indutri farmasi, larutan penyangga berperan untuk pembuatan
obat-obatan agar zat aktif dari obat tersebut mempunya pH tertentu.
Selain itu larutan penyangga juga digunakan unutk industri makanan dan minuman ringan seperti
yang sering digunakan adalah Natrium asetat dan asam sitrat.
Contohnya pada asam sitrat : Asam sitrat merupakan asam organik lemah yang ditemukan pada
daun dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet
yang baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan dan
minuman ringan. Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam siklus asam
sitrat, yang penting dalam metabolisme makhluk hidup, sehingga ditemukan pada hampir semua
makhluk hidup. Zat ini juga dapat digunakan sebagai zat pembersih yang ramah lingkungan dan
sebagai antioksidan. Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun
ditemukan pada konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan
limau (misalnya jeruk nipis dan jeruk purut). Rumus kimia asam sitrat adalah C6H8O7
(strukturnya ditunjukkan pada tabel informasi di sebelah kanan). Struktur asam ini tercermin
pada nama IUPAC-nya, asam 2-hidroksi-1,2,3-propanatrikarboksilat. Sifat-sifat fisis asam sitrat
dirangkum pada tabel di sebelah kanan. Keasaman asam sitrat didapatkan dari tiga gugus
karboksil COOH yang dapat melepas proton dalam larutan. Jika hal ini terjadi, ion yang
dihasilkan adalah ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk
mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam
sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan
sebagai pengawet dan penghilang kesadahan air
Fungsi Larutan Penyangga
Larutan penyangga sangat penting dalam kehidupan; misalnya dalam analisis kimia, biokimia,
bakteriologi, zat warna, fotografi, dan industri kulit. Dalam bidang biokimia, kultur jaringan dan
bakteri mengalami proses yang sangat sensitif terhadap perubahan pH. Darah dalam tubuh
manusia mempunyai kisaran pH 7,35 sampai 7,45, dan apabila pH darah manusia di atas 7,8
akan menyebabkan organ tubuh manusia dapat rusak, sehingga harus dijaga kisaran pHnya
dengan larutan penyangga.
1. Darah Sebagai Larutan Penyangga
Ada beberapa faktor yang terlibat dalam pengendalian pH darah, diantaranya penyangga
karbonat, penyangga hemoglobin dan penyangga fosfat.
A. Penyangga Karbonat Penyangga karbonat berasal dari campuran asam karbonat (H 2 CO 3 )
dengan basa konjugasi bikarbonat (HCO 3 ). H 2 CO 3 (aq) –> HCO 3(aq) + H + (aq)
Penyangga karbonat sangat berperan penting dalam mengontrol pH darah. Pelari maraton
dapat mengalami kondisi asidosis, yaitu penurunan pH darah yang disebabkan oleh
metabolisme yang tinggi sehingga meningkatkan produksi ion bikarbonat. Kondisi asidosis
ini dapat mengakibatkan penyakit jantung, ginjal, diabetes miletus (penyakit gula) dan diare.
Orang yang mendaki gunung tanpa oksigen tambahan dapat menderita alkalosis, yaitu
peningkatan pH darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki
bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak, padahal CO 2
dapat larut dalam air menghasilkan H 2 CO 3 . Hal ini mengakibatkan pH darah akan naik.
Kondisi alkalosis dapat mengakibatkan hiperventilasi (bernafas terlalu berlebihan, kadang-
kadang karena cemas dan histeris).
B. Penyangga Hemoglobin Pada darah, terdapat hemoglobin yang dapat mengikat oksigen
untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari larutan penyangga
oksi hemoglobin adalah: HHb + O 2 (g) HbO 2 - + H + Asam hemoglobin ion aksi
hemoglobin Keberadaan oksigen pada reaksi di atas dapat memengaruhi konsentrasi ion H +,
sehingga pH darah juga dipengaruhi olehnya. Pada reaksi di atas O 2 bersifat basa.
Hemoglobin yang telah melepaskan O 2 dapat mengikat H + dan membentuk asam
hemoglobin. Sehingga ion H + yang dilepaskan pada peruraian H 2 CO 3 merupakan asam
yang diproduksi oleh CO 2 yang terlarut dalam air saat metabolisme. c. Penyangga Fosfat
Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam mengatur pH darah.
Penyangga ini berasal dari campuran dihidrogen fosfat (H 2 PO 4 - ) dengan monohidrogen
fosfat (HPO 3 2- ). H 2 PO 4 - (aq) + H + (aq) –> H 2 PO 4(aq) H 2 PO 4 - (aq) + OH - (aq) –
> HPO 4 2- (aq) ) + H 2 O (aq) Penyangga fosfat dapat mempertahankan pH darah 7,4.
Penyangga di luar sel hanya sedikit jumlahnya, tetapi sangat penting untuk larutan
penyangga urin.
C. Penyangga Fosfat Pada cairan intra sel, kehadiran penyangga fosfat sangat penting dalam
mengatur pH darah. Penyangga ini berasal dari campuran dihidrogen fosfat (H 2 PO 4 - )
dengan monohidrogen fosfat (HPO 3 2- ). H 2 PO 4 - (aq) + H + (aq) –> H 2 PO 4(aq) H 2
PO 4 - (aq) + OH - (aq) –> HPO 4 2- (aq) ) + H 2 O (aq)
Penyangga fosfat dapat mempertahankan pH darah 7,4. Penyangga di luar sel hanya
sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin.Seperti:
1. Air Ludah sebagai Larutan Penyangga
Gigi dapat larut jika dimasukkan pada larutan asam yang kuat. Email gigi yang rusak
dapat menyebabkan kuman masuk ke dalam gigi. Air ludah dapat mempertahankan pH
pada mulut sekitar 6,8. Air liur mengandung larutan penyangga fosfat yang dapat
menetralisir asam yang terbentuk dari fermentasi sisa-sisa makanan.
2. Menjaga keseimbangan pH tanaman.
Suatu metode penanaman dengan media selain tanah, biasanya ikerjakan dalam kamar
kaca dengan menggunakan mendium air yang berisi zat hara, disebut dengan hidroponik .
Setiap tanaman memiliki pH tertentu agar dapat tumbuh dengan baik. Oleh karena itu
dibutuhkan larutan penyangga agar pH dapat dijaga.
3. Larutan Penyangga pada Obat-Obatan
Asam asetilsalisilat merupakan komponen utama dari tablet aspirin, merupakan obat
penghilang rasa nyeri. Adanya asam pada aspirin dapat menyebabkan perubahan pH pada
perut. Perubahan pH ini mengakibakan pembentukan hormon, untuk merangsang
penggumpalan darah, terhambat; sehingga pendarahan tidak dapat dihindarkan. Oleh
karena itu, pada aspirin ditambahkan MgO yang dapat mentransfer kelebihan asam.
Anda mungkin juga menyukai
- Fungsi Larutan Penyangga Dalam KehidupanDokumen2 halamanFungsi Larutan Penyangga Dalam KehidupanKiki Kirun100% (1)
- pH DarahDokumen6 halamanpH DarahUpEngBelum ada peringkat
- Fungsi Larutan Penyangga UpDokumen4 halamanFungsi Larutan Penyangga Up7yuanBelum ada peringkat
- Aplikasi Larutan PenyanggaDokumen6 halamanAplikasi Larutan PenyanggaMariati AbdullahBelum ada peringkat
- Larutan Penyangga dalam Kehidupan Sehari-hariDokumen6 halamanLarutan Penyangga dalam Kehidupan Sehari-hariSevriadyBelum ada peringkat
- Aplikasi Larutan Buffer PDFDokumen6 halamanAplikasi Larutan Buffer PDFYuliaDelestiBelum ada peringkat
- Aplikasi Larutan Buffer Dalam Kehidupan SehariDokumen5 halamanAplikasi Larutan Buffer Dalam Kehidupan SehariAnonymous iXl3xk0% (1)
- Aplikasi Larutan Buffer Dalam Kehidupan SehariDokumen11 halamanAplikasi Larutan Buffer Dalam Kehidupan SehariQorri HartantoBelum ada peringkat
- Fungsi Larutan PenyanggaDokumen3 halamanFungsi Larutan PenyanggaleajulianaBelum ada peringkat
- Fungsi Larutan PenyanggaDokumen4 halamanFungsi Larutan Penyanggarafi_17Belum ada peringkat
- pH REGULASIDokumen5 halamanpH REGULASIDani IbrahimBelum ada peringkat
- Fungsi Larutan Penyangga Dalam Kehidupan SehariDokumen8 halamanFungsi Larutan Penyangga Dalam Kehidupan SehariDusfirah MajidBelum ada peringkat
- Fungsi Larutan Penyangga Dan Hidrolisis Dalam KehidupanDokumen5 halamanFungsi Larutan Penyangga Dan Hidrolisis Dalam Kehidupanfaqih fatoni50% (2)
- Fungsi Larutan PenyanggaDokumen4 halamanFungsi Larutan PenyanggaNur Desi YaniBelum ada peringkat
- Fungsi Larutan Penyangga Dalam Tubuh Makhluk HidupDokumen4 halamanFungsi Larutan Penyangga Dalam Tubuh Makhluk HidupAlvinFloppeeBelum ada peringkat
- Tugas Portofolio - Galih Taufik Nugraha 11 Ipa 4Dokumen6 halamanTugas Portofolio - Galih Taufik Nugraha 11 Ipa 4aristiawan herdiansyahBelum ada peringkat
- Tugas Perbaikan PKMBDokumen23 halamanTugas Perbaikan PKMBgusti ayuBelum ada peringkat
- Fungsi Larutan PenyanggaDokumen2 halamanFungsi Larutan PenyanggacindyokhotanBelum ada peringkat
- Laporan Pendahuluan Ketidak Seimbangan Asam BasaDokumen24 halamanLaporan Pendahuluan Ketidak Seimbangan Asam BasaAbdul LatiifBelum ada peringkat
- Makalah Sistem Buffer TubuhDokumen9 halamanMakalah Sistem Buffer TubuhMaulyda Nurul FaizahBelum ada peringkat
- UNTUK ARTIKEL KIMIA LARUTAN PENYANGGADokumen5 halamanUNTUK ARTIKEL KIMIA LARUTAN PENYANGGAAndinifth100% (2)
- Sistem Buffer Pada Tubuh ManusiaDokumen3 halamanSistem Buffer Pada Tubuh ManusiaAgil CrBelum ada peringkat
- Sistem BufferDokumen20 halamanSistem BufferMust AgenkBelum ada peringkat
- Larutan PenyanggaDokumen3 halamanLarutan Penyanggadevilbath15Belum ada peringkat
- FUNGSI LARUTAN PENYANGGA DALAM TUBUHDokumen11 halamanFUNGSI LARUTAN PENYANGGA DALAM TUBUHDesi Sari100% (1)
- Larutan Penyangga Dalam Tubuh ManusiaDokumen4 halamanLarutan Penyangga Dalam Tubuh ManusiaMirna HariatiBelum ada peringkat
- Makalah Gangguan Keseimbangan Asam BasaDokumen22 halamanMakalah Gangguan Keseimbangan Asam BasaNabila Ulfany Ulfa75% (4)
- MANFAAT BUFFERDokumen6 halamanMANFAAT BUFFERRyzal AzizBelum ada peringkat
- RPP Larutan PenyanggaDokumen9 halamanRPP Larutan PenyanggaBurhan CfBelum ada peringkat
- Larutan PenyanggaDokumen8 halamanLarutan PenyanggaBlue ManiaczBelum ada peringkat
- Fungsi Larutan Penyangga Dalam IndustriDokumen4 halamanFungsi Larutan Penyangga Dalam IndustriYanuar Eka Raditya20% (5)
- Larutan Penyangga TubuhDokumen13 halamanLarutan Penyangga TubuhLida PratamaBelum ada peringkat
- Keseimbangan Asam Basa Dalam Tubuh Dan BiolistrikDokumen32 halamanKeseimbangan Asam Basa Dalam Tubuh Dan Biolistrikputrianisepti154Belum ada peringkat
- Materi Uts BesokDokumen37 halamanMateri Uts BesokLiendah AruMiBelum ada peringkat
- Materi Kimia Kelas Xi .Dokumen27 halamanMateri Kimia Kelas Xi .Tali JagatBelum ada peringkat
- KimiaDokumen2 halamanKimiaRanti RahmawatiBelum ada peringkat
- Makalah Asam Basa Dan EKGDokumen27 halamanMakalah Asam Basa Dan EKGYuliana BawenduBelum ada peringkat
- Penerapan Larutan Penyangga Dalam KehidupanDokumen8 halamanPenerapan Larutan Penyangga Dalam KehidupanZefanya PapingkayBelum ada peringkat
- ASAM BASA DAN PENYAKITDokumen15 halamanASAM BASA DAN PENYAKITEliza GhazaliBelum ada peringkat
- Komponen Larutan PenyanggaDokumen10 halamanKomponen Larutan PenyanggaInes Saraswati RudiantoBelum ada peringkat
- Sistem BufferDokumen8 halamanSistem Buffer-Erna Kirei-Belum ada peringkat
- SISTEM BUFFER TUBUHDokumen14 halamanSISTEM BUFFER TUBUHMuhammad WahyuBelum ada peringkat
- Fungsi Larutan PenyanggaDokumen2 halamanFungsi Larutan PenyanggaNoorfatin Fadhilah100% (1)
- Makalah Gangguan Keseimbangan Asam BasaDokumen28 halamanMakalah Gangguan Keseimbangan Asam BasaAuRora D' ORaBelum ada peringkat
- LARUTAN BUFFERDokumen14 halamanLARUTAN BUFFERRizki AdistaBelum ada peringkat
- Biokimia 1Dokumen14 halamanBiokimia 1Sri sartini MuniahaBelum ada peringkat
- ASAM BASADokumen8 halamanASAM BASALinda AriasihBelum ada peringkat
- Fungsi LarutanDokumen2 halamanFungsi Larutancalz97Belum ada peringkat
- KESEIMBANGAN ASAM BASADokumen27 halamanKESEIMBANGAN ASAM BASAdeadspaceBelum ada peringkat
- Ilmu Dasar Keperawatan Khasbi HusainDokumen25 halamanIlmu Dasar Keperawatan Khasbi HusainHusain BankBelum ada peringkat
- Fungsi Larutan Buffer Pada Tubuh ManusiaDokumen2 halamanFungsi Larutan Buffer Pada Tubuh ManusiaNidaIdzniBelum ada peringkat
- Fungsi Larutan Penyangga Dalam Kehidupan Sehari-HariDokumen7 halamanFungsi Larutan Penyangga Dalam Kehidupan Sehari-HariPrima RiliayundaBelum ada peringkat
- Asam Basa TubuhDokumen15 halamanAsam Basa TubuhRizka VeliaBelum ada peringkat
- KimiaDokumen2 halamanKimiaPaskal StevanezBelum ada peringkat
- Lap 3aDokumen22 halamanLap 3aPelajaran ParsaBelum ada peringkat
- Pengertian Air dan BufferDokumen2 halamanPengertian Air dan BufferUmamBelum ada peringkat
- Larutan Penyangga BufferDokumen20 halamanLarutan Penyangga BufferHeksa GGBelum ada peringkat