PETA KONSEP - SPU Dan MENENTUKAN PERIODE DAN GOLONGAN - 2020
Diunggah oleh
Muhammad Mufti0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
128 tayangan2 halamanSistem Periodik Unsur (SPU) mengatur unsur kimia berdasarkan nomor atom dan sifat periodiknya. Teori ini berkembang dari ide-ide awal seperti hukum oktaf John Newlands dan tabel Mendeleev sampai sistem periodik modern berdasarkan nomor atom Henry Moseley. SPU membagi unsur ke dalam periode dan golongan berdasarkan konfigurasi elektron mereka.
Deskripsi Asli:
Judul Asli
PETA KONSEP_SPU dan MENENTUKAN PERIODE DAN GOLONGAN_2020
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniSistem Periodik Unsur (SPU) mengatur unsur kimia berdasarkan nomor atom dan sifat periodiknya. Teori ini berkembang dari ide-ide awal seperti hukum oktaf John Newlands dan tabel Mendeleev sampai sistem periodik modern berdasarkan nomor atom Henry Moseley. SPU membagi unsur ke dalam periode dan golongan berdasarkan konfigurasi elektron mereka.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
128 tayangan2 halamanPETA KONSEP - SPU Dan MENENTUKAN PERIODE DAN GOLONGAN - 2020
Diunggah oleh
Muhammad MuftiSistem Periodik Unsur (SPU) mengatur unsur kimia berdasarkan nomor atom dan sifat periodiknya. Teori ini berkembang dari ide-ide awal seperti hukum oktaf John Newlands dan tabel Mendeleev sampai sistem periodik modern berdasarkan nomor atom Henry Moseley. SPU membagi unsur ke dalam periode dan golongan berdasarkan konfigurasi elektron mereka.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 2
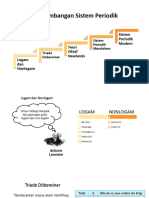
PETA KONSEP
SISTEM PERIODIK UNSUR (SPU)
1. Teori Atom
Antonie avoisier (1787): JW Dobeeiner (1829): John Newlands (1863):
Membagi Unsur menjadi 4 Unsur2 disusun berdasarkan : kemiripan sifat, setiap Unsur dissun berdasarkan:
kelompok: Gas, Tanah, kelpk. Terdiri 3 unsur, Ar unsure ditengah 1. Kenaikan Ar
Logam dan Non Logam merupakan rata2 kedua unsur yang mengapitnya di 2. Pengulanagan sifat setiap 8
kenal sebagai Hukum Triad unsur (Hk. Oktaf). Unsur I
Contoh: memiliki sifat mirip dengan
Li = 7, Na = …. K 19. Ar Na= (7+39)/2 = 23 unsure VIII
Ca-Sr-Ba; S-Se-Te; Cl-Br-I dan Mn-Cr-Fe
Lothar Meyer (1866):
Henry Moseley (1913): Diitri I. Mendeleev (1869):
Unsur disusun berdasarkan:
Unsur disusun berdasarkan: Unsur disusun berdasarkan:
1. Kenaikan Ar
Kenaikan Nomor Atom dan 1. Kenaikan Ar
muatan inti. 2. Sifat kimia 2. Sifat fisik
SPU panjang atau Sistem Meramalkan unsur2 baru yg blm
Periodik Panjang ditemukan dan diberikan tempat
kosong. SPU pendek.
2. Tabel Periodik
BESAR:
1. Energi Ionisasi
2. Afinitas Elektron
3. Keelektronegatifan
4. Sifat Non Logam
5. Kereaktifan Non Logam
BESAR:
1. Jari-jari
2. Sifat Logam
3. Kereaktifan Logam
3. Periode dan Golongan
Harom Dilupakan !!!
Untuk Golongan Utama (Golongan A) Untuk Golongan Transisi (Golongan B)
1. Jumlah Kulit yang terisi electron menyatakan Periode. 1. Unsur transisi memiliki konfigurasi electron pada
2. Jumlah Elektron Valensi menyatakan Golongan. sub kulit d dan s.
2. Tidak memiliki EV < 3
3. EV 8,9 dan 10 termasuk golongan VIII B.
4. EV 11 termasuk golongan I B
5. EV 12 termasuk golongan II B
Menentukan Periode dan Golongan atom 6. EV
bermuatan:
@ Untuk atom bermuatan + : Jumlah
electron ditambahkan sebanyak muatannya.
@ Untuk atom bermuatan - : Jumlah
electron dikurangi sebanyak muatannya.
IA VIIIA
IIA IIIA
Gol. B
Blok s Blok d Blok p
Anda mungkin juga menyukai
- Bab 3 Sistim Periodik Unsur Sem1Dokumen5 halamanBab 3 Sistim Periodik Unsur Sem1nadnod620Belum ada peringkat
- Materi Kimia Kelas X Bab 3 PDFDokumen5 halamanMateri Kimia Kelas X Bab 3 PDFMohamad Nor AufaBelum ada peringkat
- Materi Kimia Kelas XI Bab 3Dokumen5 halamanMateri Kimia Kelas XI Bab 3Zoe.FiversBelum ada peringkat
- Materi Kimia Kls X Semester 1 Bab 3Dokumen5 halamanMateri Kimia Kls X Semester 1 Bab 3-Nduuh Newbie-Belum ada peringkat
- SISTEM PERIODIK UNSUR 2021 pdf1663556877Dokumen15 halamanSISTEM PERIODIK UNSUR 2021 pdf1663556877Iqis nisaBelum ada peringkat
- Sistem Periodik UnsurDokumen3 halamanSistem Periodik Unsurtik RivaiBelum ada peringkat
- Ringkasan Materi SPUDokumen5 halamanRingkasan Materi SPUSiti SarwaniBelum ada peringkat
- Sistem Periodik Unsur, Struktur AtomDokumen36 halamanSistem Periodik Unsur, Struktur AtomMiftahul JannahBelum ada peringkat
- Kelas X - Bab 2.2 - Sistem Periodik UnsurDokumen22 halamanKelas X - Bab 2.2 - Sistem Periodik UnsurHenokh Efrad SaputroBelum ada peringkat
- Diskusi 2 Kimia Dasar 1Dokumen11 halamanDiskusi 2 Kimia Dasar 1DadanBelum ada peringkat
- Hubungan Periodik Antar ElemenDokumen48 halamanHubungan Periodik Antar ElemenAnnas KurniawanBelum ada peringkat
- KD 1, Struktur Atom, Sistem Periodik Unsur Dan Ikatan KimiaDokumen11 halamanKD 1, Struktur Atom, Sistem Periodik Unsur Dan Ikatan KimiaAprya NingsihBelum ada peringkat
- Struktur AtomDokumen13 halamanStruktur AtomWiwikKartikaSariBelum ada peringkat
- Sistem Periodik UnsurDokumen14 halamanSistem Periodik UnsurWahyudiBaenlahBelum ada peringkat
- Modul Ikatan Kimia Dan Bentuk MolekulDokumen25 halamanModul Ikatan Kimia Dan Bentuk MolekulRirin Agustin DjBelum ada peringkat
- LuthfiaQalby FisModDokumen9 halamanLuthfiaQalby FisModLuthfia QalbyBelum ada peringkat
- LKPD Konfigurasi ElektronDokumen17 halamanLKPD Konfigurasi Elektronolivia090106Belum ada peringkat
- Pertanyaan Dan JawabanDokumen13 halamanPertanyaan Dan JawabanUmmulBelum ada peringkat
- Revision Note-Kimia Kelas 10-Struktur AtomDokumen8 halamanRevision Note-Kimia Kelas 10-Struktur AtomAprilian ABelum ada peringkat
- Partikel AtomDokumen41 halamanPartikel Atomsekolah tkalishlahBelum ada peringkat
- Perkembangan Teori Atom Dan Konfigurasi Elektron 23Dokumen35 halamanPerkembangan Teori Atom Dan Konfigurasi Elektron 23MGR GAMINGBelum ada peringkat
- Isotop Isobar Isoton Dan Konfigurasi ElektronDokumen4 halamanIsotop Isobar Isoton Dan Konfigurasi ElektronPubg MobileBelum ada peringkat
- LK 1 Modul 1 Profesional EditDokumen6 halamanLK 1 Modul 1 Profesional Editellsha septyawantiBelum ada peringkat
- Bahan Ajar Sistem Periodik UnsurDokumen16 halamanBahan Ajar Sistem Periodik UnsurNita NurBelum ada peringkat
- AtomDokumen31 halamanAtomMaro MendoncaBelum ada peringkat
- LKPD STUKTUR ATOM MinimalDokumen47 halamanLKPD STUKTUR ATOM MinimalDea Olivia AyyasyBelum ada peringkat
- LK 1 Modul 1 ProfesionalDokumen7 halamanLK 1 Modul 1 ProfesionalDian Ubaedillah NuraeniBelum ada peringkat
- Laporan Praktikum Kimia - SpuDokumen11 halamanLaporan Praktikum Kimia - SpuAfrina Dearny DamanikBelum ada peringkat
- Lecture Note Sesi 10 Sistem Periodik UnsurDokumen13 halamanLecture Note Sesi 10 Sistem Periodik UnsurberkasmengajardanangBelum ada peringkat
- Materi Kimia Kelas X Bab 3Dokumen10 halamanMateri Kimia Kelas X Bab 3AnakLeta AnulBelum ada peringkat
- 41 - Menentukan Konfigurasi Elektron, Golongan Dan PerodeDokumen5 halaman41 - Menentukan Konfigurasi Elektron, Golongan Dan PerodeYudia SandiannaBelum ada peringkat
- Bab 2. Sistem Periodik 2Dokumen21 halamanBab 2. Sistem Periodik 2siti nuryantiBelum ada peringkat
- Kelas X - Materi SMADokumen28 halamanKelas X - Materi SMASaniyyah SuaibBelum ada peringkat
- Sifat Periodik UnsurDokumen40 halamanSifat Periodik Unsuremiliolukman34Belum ada peringkat
- Materi Pengenalan Ilmu Kimia Dan Perkembangan Teori AtomDokumen31 halamanMateri Pengenalan Ilmu Kimia Dan Perkembangan Teori AtomTrisda MilaBelum ada peringkat
- Resume Struktur AtomDokumen4 halamanResume Struktur Atomyuvita siswantiBelum ada peringkat
- Struktur Atom Dan Sistem Periodik UnsurDokumen27 halamanStruktur Atom Dan Sistem Periodik UnsurAnisa VikaBelum ada peringkat
- Struktur Atom Ikatan Kimia Dan SpuDokumen8 halamanStruktur Atom Ikatan Kimia Dan SpuFarikhahtinBelum ada peringkat
- Makalah Kimia Fisika Irma Melati 1Dokumen27 halamanMakalah Kimia Fisika Irma Melati 1Irma melatiBelum ada peringkat
- Struktur Atom LksDokumen10 halamanStruktur Atom LksVinda Cory100% (4)
- LK 0.1 Modul 1 ProfesionalDokumen5 halamanLK 0.1 Modul 1 ProfesionalAlfa Dina PrianotoBelum ada peringkat
- Sistem Periodik UnsurDokumen27 halamanSistem Periodik Unsurfatimahmaali38Belum ada peringkat
- Sistem Periodik Unsur-1Dokumen10 halamanSistem Periodik Unsur-1Rifqi BahriBelum ada peringkat
- 6 LKS SpuDokumen4 halaman6 LKS SpuNadya RianasariBelum ada peringkat
- Struktur AtomDokumen32 halamanStruktur AtomsyarahagisnaBelum ada peringkat
- Bab I Kimia PDFDokumen25 halamanBab I Kimia PDFDavid Julianto SiraitBelum ada peringkat
- Bahan Ajar Struktur AtomDokumen15 halamanBahan Ajar Struktur AtomFredrikBelum ada peringkat
- BARU PERKEMBANGAN TABEL PERIODIK UNSUR - PPT (Autosaved)Dokumen36 halamanBARU PERKEMBANGAN TABEL PERIODIK UNSUR - PPT (Autosaved)Samudra ArifBelum ada peringkat
- LK 0.1 Modul 1 Kimia Eli SofiatiDokumen3 halamanLK 0.1 Modul 1 Kimia Eli SofiatielisofiatiBelum ada peringkat
- Makalah Kimia Sma - SpuDokumen7 halamanMakalah Kimia Sma - Spu18. Ni Nyoman Sri WahyuniBelum ada peringkat
- Kelas X - Materi SMADokumen28 halamanKelas X - Materi SMASaniyyah SuaibBelum ada peringkat
- Tugas Periodik UnsurDokumen6 halamanTugas Periodik UnsurmahesBelum ada peringkat
- Kuliah #2 B Tabel+PeriodikDokumen15 halamanKuliah #2 B Tabel+PeriodikMondesHutapeaBelum ada peringkat
- Strukturatomsistem PeriodikDokumen45 halamanStrukturatomsistem PeriodikErin FebrianBelum ada peringkat
- Diktat Kimia DasarDokumen126 halamanDiktat Kimia DasarWilli Yaohandy ChandraBelum ada peringkat
- SKL Kimiaa Renal!!!!!!!!!!Dokumen123 halamanSKL Kimiaa Renal!!!!!!!!!!Yuyun WahyudinBelum ada peringkat
- RPP Kimia 10Dokumen23 halamanRPP Kimia 10Fadel Mu'amarBelum ada peringkat
- PPTsistem Periodik Unsur-IinDokumen18 halamanPPTsistem Periodik Unsur-IinMichel IskandarBelum ada peringkat
- KeagunganuranDokumen81 halamanKeagunganuranMuhammad MuftiBelum ada peringkat
- Surat MGMP Koga 18 Maret 2020Dokumen1 halamanSurat MGMP Koga 18 Maret 2020Muhammad MuftiBelum ada peringkat
- Latihan Soal Prakarya Kelas XiDokumen5 halamanLatihan Soal Prakarya Kelas XiDansBelum ada peringkat
- Matriks RTL Bimtek KHA SRA-1 (MUHAMMAD MUFTI - SMAN 1 BUMI NABUNG)Dokumen4 halamanMatriks RTL Bimtek KHA SRA-1 (MUHAMMAD MUFTI - SMAN 1 BUMI NABUNG)Muhammad Mufti100% (3)
- Latihan Soal Prakarya Kelas XiDokumen5 halamanLatihan Soal Prakarya Kelas XiDansBelum ada peringkat
- Reaksi Pada Sel Elektrolisis (Elektrolisis Bagian 1)Dokumen53 halamanReaksi Pada Sel Elektrolisis (Elektrolisis Bagian 1)Muhammad MuftiBelum ada peringkat
- LKS - KOLOID - XI IPA - SMAN 1 BuminabungDokumen1 halamanLKS - KOLOID - XI IPA - SMAN 1 BuminabungMuhammad MuftiBelum ada peringkat
- JADWAL SMAN 1 BUMI NABUNG 2019-2020 Semester 2 - RevDokumen1 halamanJADWAL SMAN 1 BUMI NABUNG 2019-2020 Semester 2 - RevMuhammad MuftiBelum ada peringkat
- Biloks Dan RedoksDokumen6 halamanBiloks Dan RedoksMuhammad MuftiBelum ada peringkat
- MATERI 2 DAN 3 - MUHAMMAD MUFTI - KMOBatch29Dokumen3 halamanMATERI 2 DAN 3 - MUHAMMAD MUFTI - KMOBatch29Muhammad MuftiBelum ada peringkat
- Jadwal Lus Sma Lampung 2021Dokumen1 halamanJadwal Lus Sma Lampung 2021Muhammad MuftiBelum ada peringkat
- Kmo 10Dokumen1 halamanKmo 10Muhammad MuftiBelum ada peringkat
- JADWAL SMAN 1 BUMI NABUNG 2019-2020 Semester 2 - RevDokumen1 halamanJADWAL SMAN 1 BUMI NABUNG 2019-2020 Semester 2 - RevMuhammad MuftiBelum ada peringkat
- Bahaslatihan Un Sma KimiaDokumen6 halamanBahaslatihan Un Sma KimiaDaniel IciousBelum ada peringkat
- Bahaslatihan Un Sma KimiaDokumen6 halamanBahaslatihan Un Sma KimiaDaniel IciousBelum ada peringkat
- GF It Rukim LTDokumen37 halamanGF It Rukim LTMuhammad MuftiBelum ada peringkat
- Permendikbud No 43 Tahun 2019Dokumen13 halamanPermendikbud No 43 Tahun 2019amiruddinBelum ada peringkat
- Jadwal Lus Sma Lampung 2021Dokumen1 halamanJadwal Lus Sma Lampung 2021Muhammad MuftiBelum ada peringkat
- POS Koreksi UN 2012 2013Dokumen48 halamanPOS Koreksi UN 2012 2013Slam AdiBelum ada peringkat
- SE KADIS TTG PAT & US 2020-2021 Kirim SekolahDokumen24 halamanSE KADIS TTG PAT & US 2020-2021 Kirim SekolahMuhammad MuftiBelum ada peringkat
- (0048) POS USBN 2018-2019 Versi 29 Nov FinalDokumen95 halaman(0048) POS USBN 2018-2019 Versi 29 Nov FinalFlorentinus Bone100% (4)
- SK YAyasanDokumen4 halamanSK YAyasanJhosafatHastokoBelum ada peringkat
- Acuan Pembuatan Soal TO 2020 SDokumen10 halamanAcuan Pembuatan Soal TO 2020 SMuhammad MuftiBelum ada peringkat
- Contoh Soal Hidrolisis GaramDokumen32 halamanContoh Soal Hidrolisis GaramMuhammad Mufti75% (4)
- Butir Butir Pancasila Sila Ke 1Dokumen5 halamanButir Butir Pancasila Sila Ke 1Hener NetBelum ada peringkat
- Usul Isbn Buku 1. Lilis SetyaningsihDokumen4 halamanUsul Isbn Buku 1. Lilis SetyaningsihMuhammad MuftiBelum ada peringkat
- 2020 Surat Penawaran ZisDokumen1 halaman2020 Surat Penawaran ZisMuhammad Mufti100% (1)
- Buku Khutbah Idul Fitri 1441 H4Dokumen110 halamanBuku Khutbah Idul Fitri 1441 H4Muhammad MuftiBelum ada peringkat
- Kata Pengantar: Panduan Pelaksanaan Ansyithoh Ramadhan 1441H - Imani PusatDokumen17 halamanKata Pengantar: Panduan Pelaksanaan Ansyithoh Ramadhan 1441H - Imani PusatMuhammad MuftiBelum ada peringkat