Hasil Pengamatan Kalorimeter
Diunggah oleh
Indah tri wahyuni0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
149 tayangan4 halamanHak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
149 tayangan4 halamanHasil Pengamatan Kalorimeter
Diunggah oleh
Indah tri wahyuniHak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 4
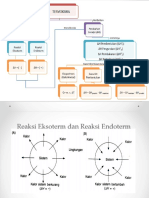
G.
Hasil Pengamatan
No. Hasil Pengamatan
Prosedur Percobaan Dugaan/reaksi Kesimpulan
Perc. Sebelum Sesudah
H2O (air Air dingin Terjadi perubahan Perubahan suhu
1. Penentuan Tetapan Kalorimeter dingin) dengan air suhu setelah air menjadi 36°C : 309 K
tidak yang dingin dicampurkan Diperoleh tetapan
-15 ml H2O 15 ml H2O berwarna dipanaskan air yang dipanaskan kalorimeter 31,5 J/K
- Dimasukkan dalam berwujud dicampur, T air dingin : 32°C
- Dipanaskan sampai
kalorimeter dengan pipet cair tidak T air panas : 42°C
kenaikan suhu kira-
ukur kira 10°C dari suhu berwarna Terjadi
- Dicatat temperaturnya kamar dan kesetimbangan
- Dicatat berwujud termal
T1 cair dan
temperaturnya
memiliki
T2
suhu
T1 : 32°C :
- Dicampurkan dalam kalorimeter 305 K ( Keenan, Charles W,
- Dikocok T2 : 42°C : dkk.1984. Ilmu Kimia
315 K Untuk Universitas.
ΔT
ΔT : 36°C : Jakarta)
309 K
Dihitung tetapan kalorimeter
Q3
K=
ΔT −T 1
CuSO4 (aq) Zn + CuSO4 Zn (s) + CuSO4 Reaksi ini mengalami
2. Penentuan kalor reaksi Zn – CuSO4 larutan : larutan (aq) → ZnSO4 (aq) reaksi eksoterm
berwarna berwarna + Cu (s) karena mengalami
10 ml CuSO4 1M 0,5 gram serbuk Zn biru biru dan Larutan ZnSO4 kenaikan suhu dan
- Dimasukkan dalam Zn (s), terdapat berwarna biru ΔH yang bernilai
Dimasukkan ke dalam
kalorimeter serbuk endapan Cu (s) berwarna negatif
kalorimeter yang berisi
berwarna warna hitam merah bata dan Terdapat endapan Cu
hitam ke Suhu mengendap Suhu campuran: 34°C
T3 abu-abuan campuran, ΔHr : -27.000 J/mol
Suhu T4 : 34°C
CuSO4, ΔHr :
ZnSO4 + Cu T3 : 31°C -27.0000
J/mol
T4 ( Keenan, Charles W,
dkk.1984. Ilmu Kimia
q6 Untuk Universitas.
ΔHr =
mol reaksi pembatas Jakarta)
HCl (aq) : NaCl (aq): HCl (aq) + NaOH Reaksi ini mengalami
3. Penentuan kalor penetralan HCl - NaOH larutan tidak larutan tidak (aq) → NaCl (aq) + reaksi eksoterm
berwarna berwarna H2O (l) karena mengalami
10 ml HCl 1 M 10 ml NaOH 1 M
NaOH (aq): Suhu Larutan tidak kenaikan suhu dan
- Dimasukkan Diatur suhunya sehingga larutan tidak campuran , berwarna ΔH yang bernilai
dalam kalorimeter sama dengan temperatur berwarna T6: 37°C negatif
Suhu HCl, ΔHn : -52,65 Suhu campuran: 37°C
T5: 32°C J/mol ΔHn : -52,65 J/mol
T5
- Dicampurkan larutan NaOH dengan
larutan HCl ke dalam kalorimeter
( Keenan, Charles W,
- Dicatat suhunya
dkk.1984. Ilmu Kimia
T6 Untuk Universitas.
Dihitung kalor penetralan Jakarta)
q9
ΔHn =
mol reaksi pembatas
Anda mungkin juga menyukai
- Alat, Bahan, Dan Alur TermokimiaDokumen3 halamanAlat, Bahan, Dan Alur Termokimiafani dewiBelum ada peringkat
- Laporan Resmi TermokimiaDokumen22 halamanLaporan Resmi TermokimiaKafitaBelum ada peringkat
- Praktikum Kimfis Panas NetralisasiDokumen7 halamanPraktikum Kimfis Panas NetralisasiTarissah JanuartiBelum ada peringkat
- TermokimiaDokumen46 halamanTermokimiaNadia Gusti Ami PutriBelum ada peringkat
- Laporan Praktikum TermokimiaDokumen15 halamanLaporan Praktikum TermokimiaSiti Nafsiyah RokhmaniaBelum ada peringkat
- Efek Panas ReviewDokumen19 halamanEfek Panas ReviewFadil ituBelum ada peringkat
- TermokimiaDokumen7 halamanTermokimiaFatonaRifkyPBelum ada peringkat
- Efek PanasDokumen24 halamanEfek PanasDiah Puspita SariBelum ada peringkat
- Suhu Dan Kalor NewDokumen40 halamanSuhu Dan Kalor NewyuliagitaadityaBelum ada peringkat
- Hukum Dasar Termodinamika (Pertemuan 3)Dokumen22 halamanHukum Dasar Termodinamika (Pertemuan 3)Fairus Salam KhemBelum ada peringkat
- A1F020014 - Lesa Maharani - Sifak Koligatif Kenaikan Titik DidihDokumen37 halamanA1F020014 - Lesa Maharani - Sifak Koligatif Kenaikan Titik DidihLetri Agu Maya SariBelum ada peringkat
- TermokimiaDokumen49 halamanTermokimianoorkeyoBelum ada peringkat
- Laporan Praktikum Kimia Fisika Ii EntropiDokumen16 halamanLaporan Praktikum Kimia Fisika Ii Entropiellyana firdausBelum ada peringkat
- CF7A2 SUHUrevDokumen6 halamanCF7A2 SUHUrevsofa fikriyahBelum ada peringkat
- Kalorimeter LaporanDokumen9 halamanKalorimeter LaporanTiara HarindarputriBelum ada peringkat
- (FIX) Soal FormatifDokumen2 halaman(FIX) Soal Formatifmuhammad reza pahlawanBelum ada peringkat
- Bab 6 Perubahan Dari Senyawa MurniDokumen10 halamanBab 6 Perubahan Dari Senyawa MurniKiki KikiBelum ada peringkat
- 4 Efek Panas 1Dokumen33 halaman4 Efek Panas 1MusyarrofBelum ada peringkat
- Laporan Praktikum Entropi Sistem Part 3Dokumen18 halamanLaporan Praktikum Entropi Sistem Part 3ImaBelum ada peringkat
- Termodinamika KimiaDokumen29 halamanTermodinamika KimiapaktanigamsBelum ada peringkat
- Praktek Perc.3Dokumen10 halamanPraktek Perc.3have funBelum ada peringkat
- Lapres TermokimiaDokumen14 halamanLapres TermokimiaTsabitamia IrbaBelum ada peringkat
- Kalor Dan SuhuDokumen26 halamanKalor Dan SuhuWinda AmeliaBelum ada peringkat
- Suhu Dan KalorDokumen24 halamanSuhu Dan Kalorkhairina rinaBelum ada peringkat
- Pertemuan Ke 10 Suhu Dan PanasDokumen46 halamanPertemuan Ke 10 Suhu Dan PanasMuhammad Alvin AlfiqriBelum ada peringkat
- 3 TermokimiaDokumen32 halaman3 TermokimiaernaBelum ada peringkat
- Stefany Rionelly - Laporan Praktikum Kimia Dasar 4Dokumen18 halamanStefany Rionelly - Laporan Praktikum Kimia Dasar 4Stefanyyy.Belum ada peringkat
- Percobaan TermokimiaDokumen9 halamanPercobaan TermokimiaNur Chalim MaulidahBelum ada peringkat
- Bab 1 HE PDFDokumen37 halamanBab 1 HE PDFsasuke vs baidowiBelum ada peringkat
- Laporan - M6 - Novia Ramadhina - K6 - 1A TENDokumen17 halamanLaporan - M6 - Novia Ramadhina - K6 - 1A TENIneu NurhalimahBelum ada peringkat
- EFEK PANAS (6 Dan 7)Dokumen13 halamanEFEK PANAS (6 Dan 7)Andika TriwibowoBelum ada peringkat
- 10 KalorDokumen17 halaman10 KalorIndriBelum ada peringkat
- Materi Bab 4 Suhu Dan KalorDokumen13 halamanMateri Bab 4 Suhu Dan KalorRanggaBelum ada peringkat
- Suhu Dan KalorDokumen19 halamanSuhu Dan KalorDiana FadillaBelum ada peringkat
- Problem Set Suhu Dan Kalor-2Dokumen18 halamanProblem Set Suhu Dan Kalor-2Hanifah WicaksonoBelum ada peringkat
- 1 Suhu Pengertian Suhu Pengukuran Suhu Skala SuhuDokumen32 halaman1 Suhu Pengertian Suhu Pengukuran Suhu Skala SuhuKhalil GibranBelum ada peringkat
- 04-Suhu Dan Kalor-Pert-9Dokumen30 halaman04-Suhu Dan Kalor-Pert-9MAFTAZANI FIRDAUSBelum ada peringkat
- Suhu Dan KalorDokumen16 halamanSuhu Dan Kaloranisa MandagiBelum ada peringkat
- Panas Laten Cara Mengestimasi Panas LatenDokumen6 halamanPanas Laten Cara Mengestimasi Panas LatenAnnisa IchaBelum ada peringkat
- TermodinamikaDokumen27 halamanTermodinamikaluphieimoBelum ada peringkat
- Modul 8 (Suhu Dan Kalor)Dokumen16 halamanModul 8 (Suhu Dan Kalor)Eva FaridaBelum ada peringkat
- Efek PanasDokumen26 halamanEfek PanasFX Krisna Putra TapanganBelum ada peringkat
- Termokimia Bahan AjarDokumen38 halamanTermokimia Bahan Ajarra_puspitaBelum ada peringkat
- Lampiran TermokimiaDokumen1 halamanLampiran TermokimiaTari GagaBelum ada peringkat
- Format Laporan Virtual TermokimiaDokumen12 halamanFormat Laporan Virtual TermokimiaIFA SAHILA ABD LATIF 18Belum ada peringkat
- TermofisikaDokumen20 halamanTermofisikabintang toruBelum ada peringkat
- Penentuan Entalpi Reaksi Penetralan Dengan Menggunakan KalorimeterDokumen3 halamanPenentuan Entalpi Reaksi Penetralan Dengan Menggunakan Kalorimeterananda safiraBelum ada peringkat
- BAB 3 Kelas 7Dokumen36 halamanBAB 3 Kelas 7Rini Nur AsyiahBelum ada peringkat
- Suhu Dan Kalor - 20231129 - 111741 - 0000Dokumen31 halamanSuhu Dan Kalor - 20231129 - 111741 - 0000anggahusein996Belum ada peringkat
- Suhu Dan KalorDokumen47 halamanSuhu Dan KalorNoviantiBelum ada peringkat
- Termokimia - Laporan Praktikum Kimia Dasar Lanjutan - Universitas MataramDokumen40 halamanTermokimia - Laporan Praktikum Kimia Dasar Lanjutan - Universitas MataramMuhammad Rafi100% (1)
- Penentuan Entalpi Reaksi Dan Energi DalamDokumen5 halamanPenentuan Entalpi Reaksi Dan Energi DalamBad boyBelum ada peringkat
- 5 - TermokimiaDokumen26 halaman5 - Termokimiapopyafifah00Belum ada peringkat
- 10 KalorDokumen17 halaman10 KalorHoer MutaqinBelum ada peringkat
- Alur Analitik 2 KationDokumen18 halamanAlur Analitik 2 KationIndah tri wahyuniBelum ada peringkat
- Jurnal Titrasi PenetralanDokumen9 halamanJurnal Titrasi PenetralanIndah tri wahyuniBelum ada peringkat
- Reaksi-Reaksi KimiaDokumen16 halamanReaksi-Reaksi KimiaIndah tri wahyuniBelum ada peringkat
- Jurnal Titrasi PengendapanDokumen14 halamanJurnal Titrasi PengendapanIndah tri wahyuniBelum ada peringkat
- Laporan Visko FixDokumen43 halamanLaporan Visko FixIndah tri wahyuniBelum ada peringkat
- Pembuatan LarutanDokumen12 halamanPembuatan LarutanIndah tri wahyuniBelum ada peringkat
- Jurnal Titrasi PengompleksanDokumen16 halamanJurnal Titrasi PengompleksanIndah tri wahyuniBelum ada peringkat
- JAWABAN PERTANYAAN PermanganometriDokumen2 halamanJAWABAN PERTANYAAN PermanganometriIndah tri wahyuniBelum ada peringkat
- Jurnal Titrasi PermanganometriDokumen15 halamanJurnal Titrasi PermanganometriIndah tri wahyuni100% (1)
- Dokumentasi Isolasi JaheDokumen7 halamanDokumentasi Isolasi JaheIndah tri wahyuniBelum ada peringkat
- Alur Titrasi PermanganometriDokumen3 halamanAlur Titrasi PermanganometriIndah tri wahyuniBelum ada peringkat
- Makalah DestilasiDokumen16 halamanMakalah DestilasiIndah tri wahyuni0% (1)
- Gambar PermanganometriDokumen4 halamanGambar PermanganometriIndah tri wahyuniBelum ada peringkat
- Lampiran GambarDokumen31 halamanLampiran GambarIndah tri wahyuniBelum ada peringkat
- Gambar Titrasi IodometriDokumen5 halamanGambar Titrasi IodometriIndah tri wahyuniBelum ada peringkat
- Daster Protein FixDokumen9 halamanDaster Protein FixIndah tri wahyuniBelum ada peringkat
- Hasil Pengamatan KesetimbanganDokumen7 halamanHasil Pengamatan KesetimbanganIndah tri wahyuniBelum ada peringkat
- Hasil Pengamatan KarbonDokumen5 halamanHasil Pengamatan KarbonIndah tri wahyuniBelum ada peringkat