Sri Wahyuni - g1c019067 - Laporan Sementara Anstru Acara 2-Review
Diunggah oleh
Maharani Mhr0460 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
27 tayangan18 halamanLaporan ini membahas analisis ion kompleks [Fe(SCN)n]3-n dengan metode spektrofotometri. Dilakukan variasi perbandingan mol ion Fe3+ dan SCN- serta variasi kontinu konsentrasi kedua ion untuk menentukan rumus kompleksnya. Hasil pengukuran absorbansi larutan kompleks pada panjang gelombang 480 nm kemudian dianalisis untuk menentukan nilai n dalam rumus [Fe(SCN)n]3-n
Deskripsi Asli:
Judul Asli
Sri Wahyuni_g1c019067_laporan Sementara Anstru Acara 2-Review
Hak Cipta
© © All Rights Reserved
Format Tersedia
PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniLaporan ini membahas analisis ion kompleks [Fe(SCN)n]3-n dengan metode spektrofotometri. Dilakukan variasi perbandingan mol ion Fe3+ dan SCN- serta variasi kontinu konsentrasi kedua ion untuk menentukan rumus kompleksnya. Hasil pengukuran absorbansi larutan kompleks pada panjang gelombang 480 nm kemudian dianalisis untuk menentukan nilai n dalam rumus [Fe(SCN)n]3-n
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
27 tayangan18 halamanSri Wahyuni - g1c019067 - Laporan Sementara Anstru Acara 2-Review
Diunggah oleh
Maharani Mhr046Laporan ini membahas analisis ion kompleks [Fe(SCN)n]3-n dengan metode spektrofotometri. Dilakukan variasi perbandingan mol ion Fe3+ dan SCN- serta variasi kontinu konsentrasi kedua ion untuk menentukan rumus kompleksnya. Hasil pengukuran absorbansi larutan kompleks pada panjang gelombang 480 nm kemudian dianalisis untuk menentukan nilai n dalam rumus [Fe(SCN)n]3-n
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 18
LAPORAN MINGGUAN PRAKTIKUM 2/2
ANALISIS INSTRUMEN
ACARA II
ANALISIS ION KOMPLEKS [Fe(SCN)n]3-n
DISUSUN OLEH
NAMA : SRI WAHYUNI
NIM : G1C019067
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS MATARAM
TAHUN 2021
ACARA II 2/2
ANALISIS ION KOMPLEKS [Fe(SCN)n]3-n
A. PELAKSANAAN PRAKTIKUM 3/3
1. Tujuan Praktikum
Untuk menentukan rumus kimia ion kompleks yang tersusun dari ion Fe3+
dan SCN- secara spektrofotometri.
2. Waktu Praktikum
Jum’at, 15 Oktober 2021.
3. Tempat Praktikum
Lantai II, Laboratorium Kimia Lanjut dan Kimia Analitik, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Universitas Mataram.
B. LANDASAN TEORI 10/15
Senyawa koordinasi diartikan sebagai senyawa yang mengandung ion
atau molekul kompleks. Ion kompleks yang ada di dalam senyawa koordinasi
tersebut dapat berupa kation, anion atau keduanya. Misalnya kalium
heksasianoferat (II), adalah senyawa koordinasi yang mengandung kation
sederhana K+ dan anion kompleks. Oleh karena senyawa koordinasi selalu
memiliki ion atau molekul kompleks, sehingga senyawa koordinasi sering
juga disebut senyawa kompleks. Kata senyawa yang dimaksudkan dalam
senyawa koordinasi atau senyawa kompleks tidak lain adalah berupa garam.
Sehubungan dengan pengertian ini, maka senyawa koordinasi atau senyawa
kompleks sering juga dinamakan garam kompleks (Yusuf, 2018: 64).
Penentuan kadar Fe(II) menggunakan Spektrofotometer UV-Vis dapat
dilakukan dengan mereaksikan sampel dengan agen pengkompleks sehingga
akan menghasilkan warna yang spesifik sesuai dengan pengkompleks yang
digunakan. Pengkompleks yang digunakan adalah ligan fenantrolin.
Fenantrolin menyumbangkan dua atom donor dalam pembentukan ikatan
kovalen koordinat. Ketika Fe(II) direaksikan dengan ligan fenantrolin dapat
membentuk senyawa kompleks yang menghasilkan warna merah jingga
dengan menyerap daerah sinar tampak pada panjang gelombang 509 nm.
Dalam reaksi pengkompleksan antara Fe(III) dengan ligan SCN- ditambahkan
larutan HCl 4M. Penambahan ini bertujuan untuk membuat suasana asam
karena Fe(III) dalam suasana asam dapat membentuk kompleks dengan ion
SCN- menjadi [Fe(SCN)6] 3- (Hidayah, dkk., 2019).
Konsentrasi ion Fe3+ sebelum dan sesudah adsorpsi dideteksi dengan
menggunakan spektrofotometer UV-vis, dengan menambahkan reagen
tiosinat. Pada pembentukan senyawa kompleks Fe-tiosianat ditambahkan
larutan HNO3 65% sebanyak 1 tetes. Hal ini berfungsi untuk menjaga
kestabilan senyawa kompleks [Fe(SCN)6] 3- agar tetap pada kondisi optimum
(suasana asam). Larutan kompleks [Fe(SCN)6] 3- relatif stabil pada pH 2 dan
waktu optimum untuk pencampuran larutan ion Fe3+ dengan tiosianat adalah
15 menit. Pengaruh massa adsorben terhadap ion Fe3+ menunjukkan semakin
besar massa adsorben, efisiensi adsorpsi semakin tinggi (Sulistyani, dkk.,
2019).
Analisis FT-IR bertujuan untuk menentukan atom donor dan gugus
fungsi pada ligan. Hasil analisis dalam bentuk spektrum memberikan
informasi tentang jumlah gelombang dan pita serapan khas untuk setiap
kelompok fungsional. ligan tiosianat berkoordinasi dengan ion logam melalui
atom donor N dan menunjukkan adanya ikatan H2O dalam senyawa kompleks
dari KCu[Fe(SCN)6]. Analisis EDX senyawa kompleks dengan perbandingan
mol reaktan FeCl3.6H2O:KSCN = 1 : 6 menghasilkan persentase massa
(%Wt) dan persentase atom (%At) kompleks komposer elemen. Persentase
massa menyatakan perbandingan jumlah total komposer kompleks atom.
Sedangkan persentase atom adalah perbandingan jumlah atom dalam keadaan
kompleks senyawa yang dapat digunakan untuk menentukan rumus empiris
(Jayanti, dkk., 2019).
Kompleks besi(III) netral 3 dan 4 disiapkan dengan mereaksikan
prekursor kloro-Fe(III) yang sesuai dengan natrium tiosianat dalam refluks
etanol selama 8 jam. Kedua kompleks diisolasi dengan sangat baik
menghasilkan (> 80%) sebagai padatan mikrokristalin berwarna coklat tua.
Mereka stabil di bawah udara dan kelembaban, menunjukkan kelarutan yang
baik dalam pelarut organik polar seperti etanol, diklorometana, asetonitril dan
dimetilsulfoksida (DMSO), tetapi tidak larut dalam dietil eter dan
hidrokarbon. Spektrum serapan UV-vis kompleks 3 dan 4 dicatat dalam
media CH2Cl2 pada suhu kamar di kisaran 200-800 nm. Pita energi tinggi
dalam kisaran 248-342 nm dikaitkan menjadi transisi transfer muatan (ILCT)
intra-ligan -π∗/n-π∗ dari cincin aromatik dan gugus imina dan tiosianat.
(Cisterna, dkk., 2021).
C. ALAT DAN BAHAN PRAKTIKUM 4/5
1. Alat-alat Praktikum
a. Gelas kimia 600 ml
b. Kuvet
c. Labu ukur 10 mL
d. Pipet tetes
e. Pipet volume 1 mL
f. Pipet volume 2 mL
g. Pipet volume 5 Ml
h. Rubber bulb
i. spektrofotometer UV-Vis
2. Bahan-bahan Praktikum
a. Aquades (H2O(l))
b. Larutan asam nitrat (HNO3(aq)) 4 M
c. Larutan besi (III) (Fe3+(aq)) 0,0025 M
d. Larutan kalium tiosianat (KSCN(aq)) 0,0025 M
e. Larutan kalium tiosianat (KSCN(aq)) 0,02 M
D. SKEMA KERJA 5/8
1. Metode Perbandingan Mol
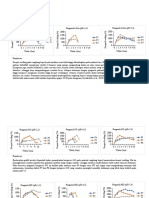
Tabel 1 : Perbandingan volume pembentuk ion kompleks [Fe(SCN)n]3-n
dan absorbansinya.
4 mL larutan Fe3+ 0,0025 M
• Disiapkan sebanyak 5 larutan
• Dimasukkan ke dalam labu takar
100 mL
• + 1 mL larutan HNO3 4 M
Larutan 1: tidak ditambahkan KSCN 0,02 M
Larutan 2: + 0,5 mL KSCN 0,02 M
Larutan 3: + 1,0 mL KSCN 0,02 M
Larutan 4: + 1,5 mL KSCN 0,02 M
Larutan 5: + 2,0 mL KSCN 0,02 M
• Diberi label labu 1, 2, 3, 4, dan 5
• Ditambahkan aquades hingga
tanda batas
• Dikocok hingga homogen
Hasil
• Diambil larutan 1 mL dari tiap
labu takar
• Diencerkan kembali hingga tanda
batas
Hasil
• Dimasukkan dalam kuvet
• Diukur absorbansinya pada λ =
480 nm
Hasil
2. Metode Variasi Kontinu
Tabel 2 : seri larutan-larutan ion Fe3+ dan absorbansinya.
0 mL, 1 ml, 2 mL, 3 mL, 4 mL larutan Fe3+ 0,0025 M
• Diberi label labu 1, 2, 3, 4, dan 5
• Dimasukkan ke dalam labu takar 10 mL
• + 1 mL larutan HNO3 4 M
• Diencerkan dengan aquades hingga tanda
batas
• Dikocok hingga homogen
Hasil
• Dimasukkan dalam kuvet
• Diukur absorbansinya pada λ = 480 nm
Hasil
Tabel 3 : seri-seri larutan ion SCN- dan absorbansinya.
0 mL, 1 ml, 2 mL, 3 mL, 4 mL larutan KSCN 0,02 M
• Diberi label labu 1, 2, 3, 4, dan 5
• Dimasukkan ke dalam labu takar 10 mL
• + 1 mL larutan HNO3 4 M
• Diencerkan dengan aquades hingga tanda
batas
• Dikocok hingga homogen
Hasil
• Dimasukkan dalam kuvet
• Diukur absorbansinya pada λ = 480 nm
Hasil
Tabel 4: seri-seri larutan ion kompleks [Fe(SCN)n]3-n dan absorbansinya.
0 mL, 1 ml, 2 mL, 3 mL, 4 mL larutan Fe3+ 0,0025 M
• Dimasukkan ke dalam labu takar 10 mL
• +1 mL larutan HNO3 4 M
Larutan 1: + 3 mL KSCN 0,02 M
Larutan 2: + 4 mL KSCN 0,02 M
Larutan 3: + 5 mL KSCN 0,02 M
Larutan 4: + 6 mL KSCN 0,02 M
Larutan 5: + 7 mL KSCN 0,02 M
• Dikocok hingga homogen
• Diberi label labu 1, 2, 3, 4, dan 5
Hasil
• Dimasukkan dalam kuvet
• Diukur absorbansinya pada λ = 480 nm
Hasil
DAFTAR PUSTAKA 4/5
Cisterna, J., Artigas, V., Fuentealba, M., Manzur, C., Hamon, J. R., & Carrillo, D.
(2021). Pentacoordinated isothiocyanate iron (III) complexes supported by
asymmetric tetradentate donor and acceptor Schiff base ligands: Spectral,
Structural and Hirshfeld Surface Analyses. Journal of Molecular
Structure, 1230, 129864.
Hidayah, Dede, S., Tety, S., & Emay, M. (2019). Studi keadaan oksidasi besi pada
air hujan. Jurnal Al-Kimiya. 6(1). 15-21.
Jayanti, W.D., Subakti., & Wayan, D. (2019). Synthesis and Characterization
Complex Compound of K3[Fe(SCN)6] and Copper(II) Chloride as K-Ion
Battery Electrode. Journal Materials Science and Engineering. 5(15). 1-8.
Sulistyani, Endang, D.S., Susila, K., Annisa, F., & Isnaini, S. (2019). Uji
efektivitas arang aktif daun pandan laut yang diaktivasi dengan natrium
3+
hidroksida untuk adsorpsi ion fe secara sistem kolom. Jurnal Sains
Dasar. 8(1). 25-29.
Yusuf, Y. 2018. Kimia Dasar. Jakarta: Edu Center Indonesia.
LAMPIRAN 5/5
Anda mungkin juga menyukai
- Yulida Tsania (g1c019071) - Laporan Anstru 2-Dikonversi-ReviewDokumen16 halamanYulida Tsania (g1c019071) - Laporan Anstru 2-Dikonversi-ReviewMaharani Mhr046Belum ada peringkat
- Laporan Anstru 2 - Sutri-ReviewDokumen17 halamanLaporan Anstru 2 - Sutri-ReviewMaharani Mhr046Belum ada peringkat
- Ni Putu Fanty Demastita - g1c019052 - Analisis Instrumen Acara 2-ReviewDokumen21 halamanNi Putu Fanty Demastita - g1c019052 - Analisis Instrumen Acara 2-ReviewMaharani Mhr046Belum ada peringkat
- Acara 2 Anstru - 1Dokumen6 halamanAcara 2 Anstru - 1Alya hadranitaBelum ada peringkat
- Acara IiiDokumen22 halamanAcara IiiRizkaBelum ada peringkat
- Laprak 3Dokumen23 halamanLaprak 3Nanda RizqiBelum ada peringkat
- Percobaan I PDFDokumen6 halamanPercobaan I PDFYasmin GumilarBelum ada peringkat
- Modul IvDokumen14 halamanModul IvRipan MalanuaBelum ada peringkat
- Laporan Acara Iii KimiaDokumen13 halamanLaporan Acara Iii Kimiaaan ucihaBelum ada peringkat
- Praktikum Kidas II 2020-2021Dokumen41 halamanPraktikum Kidas II 2020-2021Septiani LuxitaaBelum ada peringkat
- Hasil Kali Kelarutan (KSP)Dokumen20 halamanHasil Kali Kelarutan (KSP)Muhammad_YusiAnzky100% (4)
- Petunjuk Praktikum 5. Kesetimbangan Reaksi Kimia-DikonversiDokumen14 halamanPetunjuk Praktikum 5. Kesetimbangan Reaksi Kimia-Dikonversidwi handayaniBelum ada peringkat
- Titrasi RedoksDokumen16 halamanTitrasi RedoksGunawan SinabangBelum ada peringkat
- Kekuatan Medan LiganDokumen19 halamanKekuatan Medan LiganRahmin KimBelum ada peringkat
- Titrasi RedoksDokumen16 halamanTitrasi RedoksMaitsa Alya FakhirahBelum ada peringkat
- 6 - Tiara Hadi Ashari - 11180960000097Dokumen17 halaman6 - Tiara Hadi Ashari - 11180960000097Nanda ChaerunnisaBelum ada peringkat
- StokiometriDokumen12 halamanStokiometrikesha adityaBelum ada peringkat
- Laporan Tetap Praktikum Kimia Analisis 8-13Dokumen75 halamanLaporan Tetap Praktikum Kimia Analisis 8-13Arif AbdurrahmanBelum ada peringkat
- Laporan Reaksi Kualitatif Anorganik Kimanor 2Dokumen14 halamanLaporan Reaksi Kualitatif Anorganik Kimanor 2Yunika Marsyah PutriBelum ada peringkat
- LAPRES Percobaan 2Dokumen15 halamanLAPRES Percobaan 2QurrotaA'yunBelum ada peringkat
- LAPORAN TETAP UAS Kelompok 1-4 Kelas 1kd 2020-2021Dokumen268 halamanLAPORAN TETAP UAS Kelompok 1-4 Kelas 1kd 2020-2021Mohamad Taufik (abang topek)Belum ada peringkat
- Stoikiometri Reaksi Logam Cu Dengan Garam Fe 3Dokumen9 halamanStoikiometri Reaksi Logam Cu Dengan Garam Fe 3RosyidaBelum ada peringkat
- Laporan Kesetimbangan KimiaDokumen16 halamanLaporan Kesetimbangan Kimianurdianm100% (1)
- Jurnal PermanganoDokumen9 halamanJurnal PermanganoradityaBelum ada peringkat
- Unit. 3 Kmno4Dokumen14 halamanUnit. 3 Kmno4rabiantiBelum ada peringkat
- Titrasi RedoksDokumen12 halamanTitrasi Redoksbuistu Arba' a nuyuh putriBelum ada peringkat
- FIX DKA Kelompok 7 (Ekstraksi Pelarut) - 1Dokumen31 halamanFIX DKA Kelompok 7 (Ekstraksi Pelarut) - 1Bagus RahmanBelum ada peringkat
- Laporan Resmi Percobaan 2 - Offering J - Kelompok 3Dokumen19 halamanLaporan Resmi Percobaan 2 - Offering J - Kelompok 3IKRIMA 'ALIMATUL HANIFAHBelum ada peringkat
- LAPORAN PRAKTIKUM AKP (FE & MN) - Kelompok 2 - 3fa2Dokumen10 halamanLAPORAN PRAKTIKUM AKP (FE & MN) - Kelompok 2 - 3fa2Mia Meliana GrandisaBelum ada peringkat
- Makalah PHB Kelompok 5Dokumen47 halamanMakalah PHB Kelompok 5Eva RefitaBelum ada peringkat
- Anisa Fitriani - Penentuan UnsurDokumen11 halamanAnisa Fitriani - Penentuan UnsurAnisa FitrianiBelum ada peringkat
- Laporan Praktikum Kimia Anorganik IIDokumen19 halamanLaporan Praktikum Kimia Anorganik IIGrace PatiungBelum ada peringkat
- LKM Metode Penambahan Standar - SakinahDokumen12 halamanLKM Metode Penambahan Standar - SakinahAnisa WahidBelum ada peringkat
- Analisis Instrumentasi Perc 3Dokumen13 halamanAnalisis Instrumentasi Perc 3QurrotaA'yun100% (1)
- Tipe A - Soal Remed Responsi UTS Praktikum Kimia Dasar Tahun 2022Dokumen3 halamanTipe A - Soal Remed Responsi UTS Praktikum Kimia Dasar Tahun 2022Guard of DawnBelum ada peringkat
- Laporan Metode JobsDokumen11 halamanLaporan Metode JobsSanti Ramadani50% (2)
- Penentuan Kandungan NikelDokumen14 halamanPenentuan Kandungan NikelLea AfrianaBelum ada peringkat
- Laporan PraktikumDokumen6 halamanLaporan PraktikummirnawatiimBelum ada peringkat
- Laporan Praktikum Kesetimbangan KimiaDokumen22 halamanLaporan Praktikum Kesetimbangan KimiaSepthya Nurul NissaBelum ada peringkat
- Pemisahan Kation Golongan KloridaDokumen12 halamanPemisahan Kation Golongan Kloridaeka nurBelum ada peringkat
- Laporan Praktikum Kimia Dasar IDokumen21 halamanLaporan Praktikum Kimia Dasar IInggit GarnasihBelum ada peringkat
- Laporan Praktikum Sintesa Senyawa Koordinasi Mengandung Besi Dan Analisa Menggunakan RedoxDokumen17 halamanLaporan Praktikum Sintesa Senyawa Koordinasi Mengandung Besi Dan Analisa Menggunakan RedoxFransiskus Tri Wahyu HanantoBelum ada peringkat
- Laporan Praktikum ResmiDokumen10 halamanLaporan Praktikum ResmiTARMO100% (1)
- Laporan DdkaDokumen16 halamanLaporan Ddka20 039Elvi SafitriBelum ada peringkat
- Analisis Logam Di LingkunganDokumen5 halamanAnalisis Logam Di LingkungandizaBelum ada peringkat
- PDF Laporan Praktikum Analisis Kimia Zat Padat Penentuan Konsentrasi Kalsium Ca Dalam Sampel Kacang Dengan Metode Titrimetri - CompressDokumen10 halamanPDF Laporan Praktikum Analisis Kimia Zat Padat Penentuan Konsentrasi Kalsium Ca Dalam Sampel Kacang Dengan Metode Titrimetri - CompressShafa DillaBelum ada peringkat
- Praktikum Kimia Dasar Stokiometri Dan Kesertimbangan KimiaDokumen5 halamanPraktikum Kimia Dasar Stokiometri Dan Kesertimbangan KimiaTegar BagusPBelum ada peringkat
- Reaksi Pengenal Beberapa KationDokumen10 halamanReaksi Pengenal Beberapa KationReva Dwi50% (2)
- TITRASI REDOKS Besi2Dokumen5 halamanTITRASI REDOKS Besi2septiani wulandariBelum ada peringkat
- Elisa Yuliana 19104060050 Sintesis Dan Penentuan Rumus Molekul Senyawa Kompleks Besi (Ii) OksalatDokumen17 halamanElisa Yuliana 19104060050 Sintesis Dan Penentuan Rumus Molekul Senyawa Kompleks Besi (Ii) OksalatElisa YulianaBelum ada peringkat
- Laporan Kimia Acara 3Dokumen15 halamanLaporan Kimia Acara 3Rizki FadlikaBelum ada peringkat
- Arithmetic LessonDokumen31 halamanArithmetic LessonWahyuddin FarmasiBelum ada peringkat
- Amalia KF - K3322009 - Laprak Anor Judul 4Dokumen20 halamanAmalia KF - K3322009 - Laprak Anor Judul 4Amalia Khusnul FadhilahBelum ada peringkat
- Laporan Praktikum Kimia Umum 2Dokumen16 halamanLaporan Praktikum Kimia Umum 2Rijal FauziBelum ada peringkat
- Percobaan IDokumen15 halamanPercobaan IrimaindriBelum ada peringkat
- ManganDokumen15 halamanManganREVATIAN AHNAF HIBBANULLAH 1Belum ada peringkat
- ACARA II1 HDokumen12 halamanACARA II1 Halin fadlinaBelum ada peringkat
- Time ReleaseDokumen2 halamanTime ReleaseMaharani Mhr046Belum ada peringkat
- SwellingDokumen11 halamanSwellingMaharani Mhr046Belum ada peringkat
- Swelling FullDokumen2 halamanSwelling FullMaharani Mhr046Belum ada peringkat
- Laporan Tetap Praktikum Kimia Bahan Alam Acara Iii Skrining Fitokimia Bahan AlamDokumen4 halamanLaporan Tetap Praktikum Kimia Bahan Alam Acara Iii Skrining Fitokimia Bahan AlamMaharani Mhr046100% (1)
- LAPORAN KERJA PRAKTEK (MAHARANI) RevisiDokumen33 halamanLAPORAN KERJA PRAKTEK (MAHARANI) RevisiMaharani Mhr046Belum ada peringkat