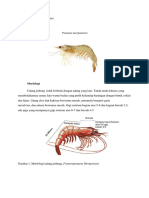
II TINJAUAN PUSTAKA Ragil
Diunggah oleh
smkn 1 kasimbarJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
II TINJAUAN PUSTAKA Ragil
Diunggah oleh
smkn 1 kasimbarHak Cipta:
Format Tersedia
ADLN Perpustakaan Universitas Airlangga
II TINJAUAN PUSTAKA
2.1 Ikan Nila
2.1.1 Klasifikasi dan Morfologi
Ikan nila (Oreochromis niloticus) merupakan komoditas penting dalam
ekologi perairan tropis, subtropis, dan termasuk famili ikan Cichlidae (Offem et
al., 2007). Klasifikasi ikan nila menurut Saanin (1984) adalah :
Phylum : Vertebrata
Kelas : Pisces
Sub Kelas : Teleostei
Ordo : Percomorphi
Sub Ordo : Percoidea
Famili : Cichlidae
Genus : Oreochromis
Species : Oreochromis niloticus
Gambar 1. Ikan nila Jatimbulan (Oreochromis niloticus)
(Kep. Men. Kelautan dan Perikanan R.I., 2008)
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
Ikan nila mempunyai ciri-ciri ada garis warna tegak pada sirip ekor dan
mulut mengarah ke atas (Kottelat et al., 1993 dalam Pamungkas, 2013). Garis
vertikal yang berwarna gelap di sirip ekor sebanyak enam buah. Garis vertikal
juga terdapat di sirip punggung dan sirip anus (Wahyuningsih, 2009). Ikan nila
mempunyai lima sirip, yaitu sirip punggung (dorsal fin), sirip dada (pectoral fin),
sirip perut (ventral fin), sirip anus (anal fin), dan sirip ekor (caudal fin) (Setyo,
2006). Morfologi ikan nila dapat dilihat pada Gambar 1.
Ikan nila Jatimbulan memiliki karakteristik morfometrik dan morfologi
berupa panjang total 25-32 cm, panjang standar 23-26,7 cm dan lebar mata 1,5-2
cm. Ikan nila Jatimbulan memiliki warna punggung abu-abu kehijauan, warna
perut putih keabu-abuan, dan warna operculum abu-abu kemerahan. Jumlah jari-
jari sirip dorsal XVI-XVII. 12-13, jumlah jari-jari sirip dada 12-13, jumlah jari-
jari sirip anal III. 9-10, jumlah jari-jari sirip perut I. 5, dan jumlah jari-jari sirip
ekor 16-17 (BPBAT Umbulan, 2008).
2.1.2 Biologi Ikan Nila
Ikan nila dapat hidup di air tawar, air payau, dan air laut. Ikan nila tahan
terhadap perubahan lingkungan, bersifat omnivora, dan mampu mencerna
makanan secara efisien. Pertumbuhan cepat dan tahan terhadap serangan penyakit.
Perkembangbiakan ikan nila terjadi setiap tahun sekali tanpa ada musim tertentu
dengan interval kematangan telur sekitar dua bulan. Bila telah tiba saat memijah,
ikan jantan membuat sarang berbentuk cekungan di dasar kolam. Diameter
cekungan antara 30-50 cm sesuai dengan besar tubuh ikan, kemudian ikan jantan
dan betina masuk ke dalam cekungan tersebut, sehingga ikan betina mengeluarkan
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
telur dan pada saat yang sama ikan jantan mengeluarkan sperma. Pembuahan
tersebut terjadi di dasar cekungan (Wahyuningsih, 2009).
2.2 Spermatozoa
2.2.1 Proses Pembentukan Spermatozoa
Testis ikan berbentuk memanjang dalam rongga badan di bawah
gelembung renang di atas usus. Jaringan pengikat yang disebut mesentrium
menempelkan testis ini pada rongga badan di bagian depan gelembung renang
(Mar’ati, 2007). Testis ikan ada sepasang, dapat sama panjang dan ada pula yang
satu lebih panjang dari yang lain (Japet, 2011). Struktur testis terdiri dari tubula
longitudinalis, dan di dalam tubula longitudinalis terdapat cyste seminiferis. Sel
penghasil sperma terdapat dalam cyste seminiferis. Sel penghasil sperma ini
dikelilingi oleh sel-sel sertoli yang berfungsi nutritif (Richter dan Rustidja, 1985
dalam Mar’ati, 2007).
Spermatogenesis diklasifikasikan menjadi 4 tahap yaitu spermatogonium,
spermatosit, spermatid, dan spermatozoon. Pada tahap spermatozoon, diferensiasi
spermatozoa selesai (Moharram, 2014).
2.2.2 Morfologi Spermatozoa
Morfologi spermatozoa pada sebagian ikan teleostei yaitu pendek, kepala
bulat tanpa akrosom, midpiece yang berisi sejumlah mitokondria, dan ekor dengan
flagela sederhana (Jamieson, 1991 dalam Musa, 2010). Rata-rata panjang total
spermatozoa ikan teleostei adalah 40-60 μm dengan panjang kepala hanya 2-3 μm
(Rahardhianto, 2012). Morfologi spermatozoa ikan dapat dilihat pada Gambar 2.
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
Gambar 2. Bagian longitudinal spermatozoa ikan (Musa, 2010)
2.3 Tingkat Motilitas Spermatozoa Ikan
Menurut Japet (2011) persentase spermatozoa yang motil progresif
merupakan parameter kuantitas spermatozoa sebagai kesanggupan membuahi sel
telur. Untuk melakukan fertilisasi, spermatozoa harus bergerak mencapai tempat
pembuahan dengan menggunakan energi yang diperoleh dari pengencer, sehingga
motilitas sering dijadikan indikator fertilitas spermatozoa namun demikian
pergerakan spermatozoa dipengaruhi oleh integritas struktur morfologi
spermatozoa (Hardyana, 2012). Menurut Mar’ati (2007) persentase sperma yang
motil normalnya 70% sampai 90%.
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
2.4 Lama Gerak Spermatozoa Ikan
Spermatozoa ikan air tawar dapat motil tidak lebih dari 2-3 menit setelah
bersentuhan dengan air. Kriteria kualitas sperma yang baik adalah sperma dengan
lama gerak lebih dari dua menit (Fujaya, 2004). Pergerakan spermatozoa ikan air
tawar seperti ikan mas pada salinitas yang lebih tinggi berlangsung dengan waktu
yang lebih singkat daripada selama spermatozoa di air tawar (Drabkina, 1961
dalam Ginzburg, 1972).
2.5 Pengaruh Tekanan Osmotik pada Aktivasi Spermatozoa
Salinitas merupakan total konsentrasi ion-ion Na+, K+, Mg2+, Ca2+, Sr2+,
Cl-, SO42-, HCO-3, CO32-, CO2, Br-, B (OH)3, B(OH)-4, dan F- yang ada dalam air
(Pilson, 2013). Nilai salinitas air untuk perairan tawar <0,5 ppt, perairan payau
0,5-30 ppt, dan perairan laut 30-40 ppt (Ezenwa et al., 1987 dalam Komi and
Sikoki, 2013). Salinitas mempengaruhi tekanan osmotik pada lingkungan
pemijahan. Salinitas berhubungan erat dengan tekanan osmotik dan ionik.
Semakin tinggi salinitas akan semakin tinggi pula tekanan osmotik air
(Nugrahaningsih, 2008). Osmolalitas adalah konsentrasi dari jumlah total partikel
zat terlarut (misalnya ion atau molekul) ditinjau dari berat pelarut (Worthley,
1999). Sel sperma pada ikan biasanya aktif karena dipicu oleh kondisi osmolalitas
lingkungan perairan dan pada saat sel sperma berada dalam kantung sperma,
osmolalitas dari cairan seminal plasma pada tingkat tertentu dapat menjaga
sperma untuk tidak aktif (Irawan, 2010).
Menurut Morita et al. (2003) dalam sel spermatozoa ikan mujair telah
mengandung ion Ca2+, namun untuk memulai aktivasi motilitas spermatozoa
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
maka dibutuhkan peningkatan ion Ca2+ dalam sel spermatozoa, sehingga terjadi
fosforilasi protein flagellar. Sperma ikan mujair tidak memiliki kemampuan untuk
meningkatkan intraseluler [Ca2+] dalam lingkungan osmotik yang tinggi. Mumu
(2009) menambahkan bahwa larutan yang hipertonik dapat menyebabkan osmosis
pada sel spermatozoa, sehingga sel spermatozoa mengkerut. Efek yang
ditimbulkan saat sel spermatozoa mengkerut yakni kerusakan pada membran
plasma. Kerusakan membran plasma spermatozoa bisa terjadi di bagian ekor yang
menyebabkan enzim aspartat aminotransferase yang berfungsi untuk merombak
adenosin trifosfat (ATP) menjadi adenosin difosfat (ADP) dan adenosin
monofosfat (AMP) hilang, sehingga spermatozoa nonmotile (Hardyana, 2012).
Menurut Morita et al. (2003) aktivasi motilitas spermatozoa ikan mujair
yang terbiasa di air tawar ini diawali dengan adanya kejutan lingkungan yang
hipotonik yang memicu terjadinya osmosis dari luar sel menuju ke dalam sel
spermatozoa. Hal ini menyebabkan penambahan ion Ca2+ dalam sitoplasma sel.
Menurut Zilli et al. (2012) aktivasi motilitas spermatozoa pada sea bream
diawali dengan ada kejutan lingkungan yang hipertonik yang memicu osmosis
spermatozoa melalui aquaporins. Osmosis menyebabkan pengurangan volume
sel, kemudian mengakibatkan ion intraseluler [Ca2+] masuk dan mengalami
kenaikan konsentrasi karena peran dari aquaporins. Peningkatan ini bisa
mengarah pada aktivasi membrane-emmbedded adenilat siklase atau soluble
adenylyl cyclase (sAC) dan memberi sinyal pada jalur cAMP. Hal ini
menyebabkan terjadinya fosforilasi protein flagellar, sehingga spermatozoa
menjadi motil seperti terlihat pada Gambar 3.
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
ADLN Perpustakaan Universitas Airlangga
Gambar 3. Aktivasi motilitas spermatozoa pada sea bream (Zilli et al., 2012)
(Keterangan : PKA, protein kinase A; RS, regulatory subunits; CS, catality subunits; ACS, acetyl-
CoA synthetase)
Skripsi TINGKAT MOTILITAS DAN LAMA GERAK SPERMATOZOA DEWI KINTANI
IKAN NILA JATIMBULAN (Oreochromis niloticus) PADA SALINITAS BERBEDA
Anda mungkin juga menyukai
- Teknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Dari EverandTeknik Asas Pembiakan Hibrid Ikan Keli Thailand (Clarias sp.)Penilaian: 5 dari 5 bintang5/5 (2)
- Tanaman Pepohonan Untuk Menjernihkan & Menetralisir Air Limbah Beracun Berbahaya Dari Kawasan Perairan Laut Sungai DanauDari EverandTanaman Pepohonan Untuk Menjernihkan & Menetralisir Air Limbah Beracun Berbahaya Dari Kawasan Perairan Laut Sungai DanauBelum ada peringkat
- Bab 2 TinpusDokumen9 halamanBab 2 TinpusAldi Iman Fahroezi100% (1)
- Laporan Praktikum OsmoregulasiDokumen15 halamanLaporan Praktikum OsmoregulasiTisar DodiBelum ada peringkat
- Bab IiDokumen18 halamanBab IiAmi FianiBelum ada peringkat
- Laporan OsmoDokumen18 halamanLaporan OsmoNurmi MBelum ada peringkat
- Laporan Praktikum AnestesiDokumen17 halamanLaporan Praktikum AnestesiRanhii'siiepoetriforget MaaharaniiyBelum ada peringkat
- Proposal Penelitian Ikan Nila - Aisyah Nurfadillah Abdullah - 1Dokumen16 halamanProposal Penelitian Ikan Nila - Aisyah Nurfadillah Abdullah - 1Aisyah Nurfadhillah AbdullahBelum ada peringkat
- Laporan HistologiDokumen18 halamanLaporan Histologiboykie03Belum ada peringkat
- Wa0006Dokumen32 halamanWa0006Adhitya PranandaBelum ada peringkat
- Bahan 2Dokumen12 halamanBahan 2frischilia almuksiBelum ada peringkat
- SOTONGDokumen20 halamanSOTONGadi riantoBelum ada peringkat
- TKG IkgDokumen9 halamanTKG IkgRin Askandi SelulerBelum ada peringkat
- Proposal K8Dokumen14 halamanProposal K8Ismail SunniBelum ada peringkat
- Laporan Fisiologi Biota AirDokumen17 halamanLaporan Fisiologi Biota AirNurdilah FadilahBelum ada peringkat
- Praktikum Parasit KepitingDokumen9 halamanPraktikum Parasit KepitingLhala RizkaBelum ada peringkat
- Makalah IkanDokumen12 halamanMakalah IkanAyrah RaufBelum ada peringkat
- Laporan Praktikum Fisa TiaDokumen13 halamanLaporan Praktikum Fisa TiaRos TianiBelum ada peringkat
- Laporan Avertebrata AirDokumen21 halamanLaporan Avertebrata Airnovita sari100% (1)
- Tugas Pak TauhidDokumen16 halamanTugas Pak TauhidAndi Ilma ApriantiBelum ada peringkat
- Rakhmad Ndaru Pratama - 195080500111055 - B03 - FRIDokumen10 halamanRakhmad Ndaru Pratama - 195080500111055 - B03 - FRIRakhmad NBelum ada peringkat
- Bab IiDokumen9 halamanBab IiPurna Qurrotia'yunBelum ada peringkat
- Kerapu Macan TinpusDokumen12 halamanKerapu Macan TinpusTrafalgarSeieiBelum ada peringkat
- Tinjauan PustakaDokumen18 halamanTinjauan Pustakaindar dewaBelum ada peringkat
- Awal AnugrahDokumen9 halamanAwal AnugrahAwal AnugrahBelum ada peringkat
- 0210dab2-6dd5-4e38-8f17-89259c2033e0Dokumen36 halaman0210dab2-6dd5-4e38-8f17-89259c2033e0AimBelum ada peringkat
- Bab Ii Tinjauan PustakaDokumen15 halamanBab Ii Tinjauan PustakagalkosBelum ada peringkat
- Laporan Dasar Dasar BudidayaDokumen20 halamanLaporan Dasar Dasar BudidayaLinna Heriana PandianganBelum ada peringkat
- BAB II Tinjauan Pustaka PDFDokumen14 halamanBAB II Tinjauan Pustaka PDFAsep AldiBelum ada peringkat
- LAPORAN Fisiologi JulDokumen19 halamanLAPORAN Fisiologi JulNia cumetBelum ada peringkat
- Klasifikasi Ikan Nila MerahDokumen8 halamanKlasifikasi Ikan Nila MerahtiarBelum ada peringkat
- Laporan Praktikum Fisiologi Biota Laut Kelompok 3Dokumen11 halamanLaporan Praktikum Fisiologi Biota Laut Kelompok 3Easter SitumorangBelum ada peringkat
- Laporan Praktikum Fisiologi - 024829Dokumen22 halamanLaporan Praktikum Fisiologi - 024829dw06072004Belum ada peringkat
- Bioper 2Dokumen18 halamanBioper 2iela-seleneBelum ada peringkat
- Laporan FHA 2 (Bawaljd)Dokumen14 halamanLaporan FHA 2 (Bawaljd)Menik NeeAnag BungsueBelum ada peringkat
- Laporan FHA Keragaan Spermatozoa - AudryDokumen4 halamanLaporan FHA Keragaan Spermatozoa - AudryAudry TambunanBelum ada peringkat
- Domestikasi Ikan Rainbow SulawesiDokumen14 halamanDomestikasi Ikan Rainbow SulawesiNur aliani100% (1)
- Fertilisasi Ikan MasDokumen10 halamanFertilisasi Ikan Masacha007Belum ada peringkat
- PENGARUH EKTOPARASIT Argulus Sp. YANG MENYERANG IKAN KOMET (Carassius Auratus)Dokumen12 halamanPENGARUH EKTOPARASIT Argulus Sp. YANG MENYERANG IKAN KOMET (Carassius Auratus)Firda Maulida Imaniar100% (1)
- Laporan OsmoregulasiDokumen24 halamanLaporan OsmoregulasiYULIANI_FIXHOT50% (2)
- 1170 Full TextDokumen35 halaman1170 Full Textudy rahidinBelum ada peringkat
- Bab IiDokumen21 halamanBab IiAbdul AzizBelum ada peringkat
- MKLH IkhtioDokumen14 halamanMKLH IkhtioDewi Maya Sari SihombingBelum ada peringkat
- Laporan Praktikum Fha 2 - CompressDokumen14 halamanLaporan Praktikum Fha 2 - CompressKurnia PutriBelum ada peringkat
- Makalah IkhtiologiDokumen12 halamanMakalah IkhtiologiADIMA GULOBelum ada peringkat
- Proposal Parasit IcaDokumen17 halamanProposal Parasit IcaKHAIRUNNISA R. ISMAIL UNG0% (1)
- 7 Bab IiDokumen9 halaman7 Bab Iiyuspita dwi rezkyBelum ada peringkat
- Penaeus Merguiensis - NURUL AMALIA PRATIWI - K1A1 17081Dokumen7 halamanPenaeus Merguiensis - NURUL AMALIA PRATIWI - K1A1 17081Muh TaqwinBelum ada peringkat
- Bab IIDokumen11 halamanBab IIFAYKA MUTHMAINNAHBelum ada peringkat
- LiteraturDokumen11 halamanLiteraturwinda lestarimBelum ada peringkat
- Sukma Laporan Sistem Pencernaan Dan Reproduksi Ikan NilaDokumen9 halamanSukma Laporan Sistem Pencernaan Dan Reproduksi Ikan NiladawiwabulaBelum ada peringkat
- Praktikum Materi 1 Fisiologi Hewan AirDokumen20 halamanPraktikum Materi 1 Fisiologi Hewan AirnovitaBelum ada peringkat
- Materi HematokritDokumen26 halamanMateri HematokritAli RahmanBelum ada peringkat
- I. Pendahuluan: 1.1 Latar BelakangDokumen12 halamanI. Pendahuluan: 1.1 Latar BelakangAdiim KasimBelum ada peringkat
- Laporan RespirasiDokumen55 halamanLaporan RespirasiMaria Ulfa Nofitasari0% (1)
- Laporan Fha Praktikum 2Dokumen28 halamanLaporan Fha Praktikum 2Puji Putri PardiBelum ada peringkat
- MAKALAH FISIOLOGI HEWAN AIR SISTEM REPRODUKSI PADA IKAN. Disusun Oleh - LAELATUN NADIFAH-dikonversiDokumen13 halamanMAKALAH FISIOLOGI HEWAN AIR SISTEM REPRODUKSI PADA IKAN. Disusun Oleh - LAELATUN NADIFAH-dikonversiahmad ropekBelum ada peringkat
- Ikan Bawal LengkapDokumen19 halamanIkan Bawal LengkapEdy Edy PratamaBelum ada peringkat
- Buku Kosakata Bahasa Italia: Pendekatan Berbasis TopikDari EverandBuku Kosakata Bahasa Italia: Pendekatan Berbasis TopikBelum ada peringkat
- Karya Tulis PKLDokumen22 halamanKarya Tulis PKLsmkn 1 kasimbarBelum ada peringkat
- Laporan RiskaDokumen33 halamanLaporan Riskasmkn 1 kasimbarBelum ada peringkat
- SALSABILADokumen18 halamanSALSABILAsmkn 1 kasimbarBelum ada peringkat
- Laporan (Afdal)Dokumen16 halamanLaporan (Afdal)smkn 1 kasimbarBelum ada peringkat