Bab Iv1
Diunggah oleh
mita maharani0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
12 tayangan7 halamanpembahasan
Judul Asli
BAB IV1
Hak Cipta
© © All Rights Reserved
Format Tersedia
DOCX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen Inipembahasan
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
12 tayangan7 halamanBab Iv1
Diunggah oleh
mita maharanipembahasan
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 7
BAB IV
HASIL DAN PEMBAHASAN
4.1 Tabel Hasil
- Tabel perubahan fisik yang terjadi
No Perlakuan Hasil pengamatan
a. Pembuatan AgNO3 Warna AgNO3 : putih
- Ditimbang AgNO3 9 gram Warna larutan : bening
- Dilarutkan dalam 500 mL aquades
b. Standarisasi larutan AgNO3 Warna larutan : bening
- Diambil 25 mL larutan NaCl Warna larutan : bening
- Ditambahkan 1 mL indicator Warna larutan : kuning susu da nada
K2Cr2O4 5 % endapan putih
- Dititrasi dengan AgNO3
c. Penetapan kadar NaCl dalam Warna larutan setelah titrasi : kuning
sampel dengan endapan berwarna putih
1 gram garam dapur
Dilarutkan hingga 250 mL
Diambil 25 mL larutan
+ 1 mL indikator K2CrO4 2 %
Dititrasi dengan AgNO3
- Tabel volume titran yang digunakan
No. Perlakuan Volume titran
a. Standarisasi larutan AgNO3 15 mL
b. Penetapan kadar NaCl dalam sampel 15,4 mL
4.2 Pembahasan
Argentometri atau titrasi pengendapan adalah penetapan kadar zat yang
didasarkan atas reaksi pembentukan endapan dari komponen zat uji dengan titran
larutan perak nitrat (AgNO3). Hal dasar yang diperlukan dari titrasi jenis ini adalah
pencapaian keseimbangan pembentukan yang cepat setiap kali titran ditambahkan
pada analit, tidak adanya interferensi yang mengganggu titrasi dan titik akhir titrasi
yang diamati. Pada argentometri ion perak memegang peranan penting dalam
pembentukan
endapan, cara ini dipakai untuk penetapan ion halida, anion yang dapat membentuk
endapan garam perak, atau untuk penetapan kadar perak tersebut. Pada praktikum kali
ini bertujuan untuk menstandarisasi larutan AgNO3, dengan NaCl, dan penetapan
kadar
NaCl dalam sampel garam dapur.
Dalam praktikum kali ini memiliki tujuan sebagai berikut: membuat larutan
AgNO3 0,1 N, standarisasi larutan AgNO3 dengan NaCl, dan penetapan kadar NaCl
dalam sampe garam dapur. Pada percobaan pertama yaitu membuat larutan AgNO 3
0,1 N. dimana 9 gram AgNO3.xH2O ditimbang, kemudian dioven selama 1 jam.
Proses pengovenan bertujuan untuk memisahkan hidratnya yang terperangkat pada
butiran/Kristal AgNO3.xH2O, dimana air (hidratnya) dan pengotor yang terperangkap
pada hidratnya menguap, sehingga didapatkan AgNO3 yang murni. Namun percobaan
pertama tidak dilakukan pada praktikum kali ini.
Pada percobaan kedua yaitu, standarisasi larutan AgNO3 dengan NaCl.
Standarisasi larutan AgNO3 bertujuan untuk mengetahui konsentrasi larutan AgNO3
agar dapat dijadikan larutan baku sekunder. Meskipun pada percobaan pertama telah
dilakukan pembuatan larutan AgNO3 0,1 N, namun supaya konsentrasi AgNO 3 lebih
tepat dan akurat sehingga diperlukan standarisasi. Dalam hal ini, larutan AgNO 3
distandarisasi dengan larutan standar primer NaCl 0,1 N. Kemudian untuk dapat
mengetahui titik akhir titrasi, digunakan larutan kalium kromat (K 2CrO4) encer.
Indicator kalium kromat digunakan karena beberapa hal diantaranya, dapat
berlangsung pada suasana netral, nilai Ksp (hasil kali kelarutan). Jika indicator kalium
kromat digunakan dalam suasana asam, maka ion CrO 4, sebagian akan berubah
menjadi Cr2O72- menurut reaksi;
2 H+(aq) + 2CrO4 2+(aq) Cr2O72-(aq) + H2O(l)
Dan jika pada suasana basa maka akan terbentuk endapan AgOH yang selanjutnya
teruari menjadi Ag2O sehingga titran terlalu banyak terpakai. Menurut reaksi
2Ag+(aq) + 2OH–(aq) AgOH(s) + Ag2O(s) + H2O(l)
Reaksi tersebutlah yang mengurangi konsentrasi indicator dan menyebabkan tidak
timbul endapannya atau sangat terlambat. Namun jika suasananya netral antara (6 dan
10) pada saat titrasi akan terbentuk endapan putih AgCl dan indikasi titik akhir
tercapai terbentuknya endapan berwarna putih yang berasal dari . Kemudian ditinjau
dari hasil kali kelarutannya, Ksp AgCl lebih rendah dibandingkan Ag 2CrO4. Dimana
Ksp yang lebih rendah akan lebih mudah bereaksi dan membentuk endapan, dimana
pada praktikum ini terbentuk endapan putih AgCl, dan volume yang dibutuhkan
mencapai titik akhir titrasi adalah 15 ml, sehingga didapatkan normalitas AgNO 3
sebesar 0,1198 N.
Pada percobaan ketiga, prinsipnya sama dengan pada percobaan kedua.
Namun, pada percobaan ketiga ini larutan AgNO 3 yang telah distandarisasi digunakan
untuk menentukan kadar NaCl dari sampel garam dapur. Berdasarkan hasil percobaan
volume titrasi yang digunakan adalah 15,4 ml, hal yang sama juga terjadi antara
percobaan kedua dan ketiga. Kemudian kadar NaCl dalam sampel sebesar 1,8 %.
BAB V
KESIMPULAN
- Berdasarkan hasil percobaan yang telah dilakukan, maka dapat kesimpulan bahwa:
Untuk membuat larutan AgNO3 0,1 N dapat dilakukan dengan mengoven
AgNO3.xH2O selama 1 jam untuk memurnikan AgNO3 dari pengotor-pengotornya
kemudian dilarutkan dalam aquades.
- Pada standarisasi AgNO3 digunakan indicator K2CrO4 , karena lebih dan untuk
mengetahui titik akhir titrasi yang ditandai terbentuknya endapan putih yang berasal
dari AgCl dan indicator K2CrO4 juga bereaksi pada suasana netral. Sehingga
didapatkan normalitas AgNO3 sebesar 0,1 N.
- Penentuan kadar NaCl dalam garam dapur dilakukan dengan cara titrasi argentometri
dimana diperoleh kadarnya 1,8 %.
DAFTAR PUSTAKA
Brahmana, Satyanarayan, dkk. 2008. Spatial Variation in Hydrologycal
Characteristics of Chilika – A Coastal Lagoon of Indi. India : Depatment of
Marine Sciences, Berhampur University.
Chang, Raymond. 2005. Kimia Dasar Konsep-Konsep Inti Edisi Ketiga Jilid 1. Jakarta :
Erlangga.
Harjadi, W. 1986. Ilmu Kimia Analitik Dasar. Jakarta : Gramedia.
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Jakarta : Universitas Indonesia Press.
Tilawati, Wahyu, dkk. 2015. Identifikasi dan Penetapan Kadar Klorin (Cl 2) dalam Beras
Putih di Pasar Tradisional Klepu dengan Metode Argentometri. Klaten : Prodi D
III Farmasi, STIKES Muhammadiyah Klaten.
LAMPIRAN PERHITUNGAN
Standarisasi Larutan AgNO3
Vtitrasi x NAgNO3 = VNaCl x NNaCl
15 mL x NAgNO3 = 25 mL x 0,1 N
25 mL x 0,1 N
NAgNO3 =
15 mL
= 0,1 N
Penentuan Kadar NaCl
( V x N ) AgNO 3 x BE NaCl
% NaCl = x 100%
mg sampel
( 15,4 mL x 0,1 N ) AgNO 3 x 58,5
= x 100%
5000 mg
= 1,8 %
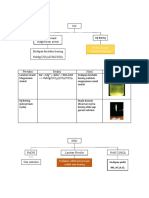
Dokumentasi
Sebelum dititrasi dengan AgNO3 Kanan: Indikator K2CrO4 Sesudah dititrasi dengan AgNO3
Kiri: Larutan/sampel
NaCl
Anda mungkin juga menyukai
- Laporan Praktikum Argentometri MohrDokumen10 halamanLaporan Praktikum Argentometri MohrNina RishantiBelum ada peringkat
- PRAKTIKUM X Argentometri NaCl Pada InfusDokumen8 halamanPRAKTIKUM X Argentometri NaCl Pada InfusCyanmenth Hemoglobin50% (6)
- ArgentometriDokumen7 halamanArgentometriNadia SaputriBelum ada peringkat
- Ebook SBMPTN SaintekDokumen343 halamanEbook SBMPTN SaintekindriBelum ada peringkat
- Laporan Tetap Titrasi PengendapanDokumen8 halamanLaporan Tetap Titrasi PengendapanAyi Putri Arifin100% (1)
- Laporan Praktikum ArgentometriDokumen14 halamanLaporan Praktikum Argentometripuja wijatna55% (11)
- Laporan Praktikum ARGENTOMETRIDokumen7 halamanLaporan Praktikum ARGENTOMETRIRima NurhasanahBelum ada peringkat
- Praktikum Kuantitatif Kel 2Dokumen21 halamanPraktikum Kuantitatif Kel 2Healthy SeptianaBelum ada peringkat
- UNTUK TITRASI PENGENDAPANDokumen9 halamanUNTUK TITRASI PENGENDAPANClarisa ArviantiBelum ada peringkat
- Acara V Titrasi Pengendapan Penetapan Kadar Nacl (Titrasi Argentometri)Dokumen8 halamanAcara V Titrasi Pengendapan Penetapan Kadar Nacl (Titrasi Argentometri)Rizki Amalia PBelum ada peringkat
- Laprak Kimanal II Argentometri Ferdiansyah - CopyDokumen9 halamanLaprak Kimanal II Argentometri Ferdiansyah - Copyzolakripto01Belum ada peringkat
- Praktikum Kimia Analitik Penetapan KadarDokumen5 halamanPraktikum Kimia Analitik Penetapan KadarMuh Zuhdi MulkianBelum ada peringkat
- Fix Acara 5 KimnalDokumen9 halamanFix Acara 5 KimnalAndyBelum ada peringkat
- Laporan Tetap (Penentuan Klorida)Dokumen10 halamanLaporan Tetap (Penentuan Klorida)Yolanda Dwi ArisandiBelum ada peringkat
- Titrasi Argentometri Tuti FixDokumen5 halamanTitrasi Argentometri Tuti FixChahyanti SimanjuntakBelum ada peringkat
- Argento MetriDokumen14 halamanArgento MetriSumix OshinBelum ada peringkat
- PENETAPAN CL SECARA TITRIMETRI-1Dokumen11 halamanPENETAPAN CL SECARA TITRIMETRI-1Silvia Ratna AnggraeniBelum ada peringkat
- LAPORAN ArgentometriDokumen8 halamanLAPORAN ArgentometriMuhammad RidwanBelum ada peringkat
- Kimia Analisis Dasar Kelompok 3Dokumen59 halamanKimia Analisis Dasar Kelompok 3Sulthan FaqihBelum ada peringkat
- ARGENTOMETRI TITRASIDokumen6 halamanARGENTOMETRI TITRASIastianindBelum ada peringkat
- Laporan Praktikum Argentometri - Kelompok 2Dokumen18 halamanLaporan Praktikum Argentometri - Kelompok 2Antania VariantiBelum ada peringkat
- Laprak Titrasi ArgentometriDokumen11 halamanLaprak Titrasi ArgentometriEkaayuBelum ada peringkat
- Analisis Kuantitatif NaCl dengan Titrasi ArgentometriDokumen8 halamanAnalisis Kuantitatif NaCl dengan Titrasi ArgentometriNanda MulyaniBelum ada peringkat
- ArgentometriDokumen10 halamanArgentometriRadesi Sauli Nurjannah IhmBelum ada peringkat
- KADAR_NAKLODokumen3 halamanKADAR_NAKLOKaoru SagitaBelum ada peringkat
- Titrasi PengendapanDokumen11 halamanTitrasi PengendapanMuhammad Gilang RamadhanBelum ada peringkat
- Lapran ArgentometriDokumen8 halamanLapran ArgentometriDevi JuliyantyBelum ada peringkat
- KADAR NACL INFUSDokumen7 halamanKADAR NACL INFUSCahyarani ZahraBelum ada peringkat
- Argento MetriDokumen2 halamanArgento MetriSuci Ika PratiwiBelum ada peringkat
- ArgentometriDokumen3 halamanArgentometrimstkaftrBelum ada peringkat
- TITRASI PENGENDAPAN DAN PENENTUAN KADAR KLORIDADokumen13 halamanTITRASI PENGENDAPAN DAN PENENTUAN KADAR KLORIDASarah Swasti PBelum ada peringkat
- Argento MetriDokumen8 halamanArgento MetriCyanmenth HemoglobinBelum ada peringkat
- ANALISIS KADAR NACLDokumen6 halamanANALISIS KADAR NACLMuhammad Syaifullah100% (2)
- LAPORAN PC 8 FahiraDokumen8 halamanLAPORAN PC 8 FahiraFakhira KhairanaBelum ada peringkat
- Laporan ArgentometriDokumen7 halamanLaporan ArgentometriRahima Khalya AnugrahBelum ada peringkat
- Laporan Argentometri Bab 7Dokumen12 halamanLaporan Argentometri Bab 7Laily Tresna0% (1)
- Laporan Praktikum Kimia AnalitikDokumen30 halamanLaporan Praktikum Kimia AnalitikCahyadi SuratmanBelum ada peringkat
- Laporan Praktikum ArgentometriDokumen7 halamanLaporan Praktikum ArgentometriAsih SetianiBelum ada peringkat
- Kelompok 7-Percobaan 3 Titrasi ArgentometriDokumen25 halamanKelompok 7-Percobaan 3 Titrasi ArgentometriMunira AidheaBelum ada peringkat
- Acara2 Kimia AnalitikDokumen29 halamanAcara2 Kimia AnalitikMaulana ArdianBelum ada peringkat
- Laprak Kitik Reaksi PengendapanDokumen12 halamanLaprak Kitik Reaksi PengendapanMatilda ChriztineBelum ada peringkat
- untuk ArgentometriDokumen11 halamanuntuk ArgentometrighinaBelum ada peringkat
- Analisis PengendapanDokumen7 halamanAnalisis PengendapanYoriska PutriBelum ada peringkat
- ArgentometriDokumen19 halamanArgentometriAnggit FitriaBelum ada peringkat
- Laporan Kimia AirDokumen7 halamanLaporan Kimia Airfilia EdokudoBelum ada peringkat
- Argentometri Metode Mohr dan VolhardDokumen11 halamanArgentometri Metode Mohr dan Volhardhana rafilah julianaBelum ada peringkat
- TITRASI PENGENDAPAN UNTUK MENENTUKAN KADAR NaClDokumen33 halamanTITRASI PENGENDAPAN UNTUK MENENTUKAN KADAR NaClFebri Nanda PriantiningtiasBelum ada peringkat
- Laporan Analitik ArgentometriDokumen8 halamanLaporan Analitik ArgentometriAnonymous TBdNBAkmBelum ada peringkat
- Jurnal KimanDokumen5 halamanJurnal KimanNurlelaSundariZBelum ada peringkat
- LKA5 - Argentometri - Nabila Zhavira - F1G020034Dokumen21 halamanLKA5 - Argentometri - Nabila Zhavira - F1G020034nabila zhaviraBelum ada peringkat
- Laporan Praktikum ArgentometriDokumen5 halamanLaporan Praktikum ArgentometriSjane Rosje KopeuwBelum ada peringkat
- Argentometri FixDokumen15 halamanArgentometri FixHealthy SeptianaBelum ada peringkat
- Analisis Kadar NaClDokumen5 halamanAnalisis Kadar NaClNurlelaSundariZBelum ada peringkat
- TitrasiDokumen5 halamanTitrasitary_nuryanaBelum ada peringkat
- Laporan Praktikum ArgentometriDokumen9 halamanLaporan Praktikum ArgentometriNina RishantiBelum ada peringkat
- Laporan Praktikum 5 ArgentometriDokumen12 halamanLaporan Praktikum 5 ArgentometriyantiBelum ada peringkat
- Bab IvDokumen5 halamanBab Ivmita maharaniBelum ada peringkat
- Na Dan NH4Dokumen2 halamanNa Dan NH4mita maharaniBelum ada peringkat
- Penggunaan Tanda Baca I-LDokumen6 halamanPenggunaan Tanda Baca I-Lmita maharaniBelum ada peringkat
- Bagian CDokumen1 halamanBagian Cmita maharaniBelum ada peringkat
- BAB IV Sintesis Kalium DikromatDokumen2 halamanBAB IV Sintesis Kalium Dikromatmita maharaniBelum ada peringkat
- Grafik Naftalen Dan Zat XDokumen2 halamanGrafik Naftalen Dan Zat Xmita maharaniBelum ada peringkat
- 48-Article Text-98-2-10-20180307Dokumen9 halaman48-Article Text-98-2-10-20180307pindy cuteBelum ada peringkat
- Generasi CerdasDokumen2 halamanGenerasi Cerdasmita maharaniBelum ada peringkat
- Tabel 5 & 6Dokumen1 halamanTabel 5 & 6mita maharaniBelum ada peringkat
- Nama: Mita Maharani NIM: 11210960000104 7. Massa Atom Relative/ Massa Atom Rata RataDokumen3 halamanNama: Mita Maharani NIM: 11210960000104 7. Massa Atom Relative/ Massa Atom Rata Ratamita maharaniBelum ada peringkat
- Tabel 5 & 6Dokumen1 halamanTabel 5 & 6mita maharaniBelum ada peringkat
- Teks EksplanasiDokumen3 halamanTeks Eksplanasimita maharaniBelum ada peringkat
- FisikaDokumen41 halamanFisikaNoviarin Cerahwati100% (1)
- 5 OKT 2020 RUU Cipta Kerja - ParipurnaDokumen905 halaman5 OKT 2020 RUU Cipta Kerja - ParipurnaJabbar Ramdhani85% (13)
- MutasiDokumen4 halamanMutasimita maharaniBelum ada peringkat
- Proset EdulebDokumen15 halamanProset EdulebIm SongAnBelum ada peringkat
- Qurdis BG XiiDokumen166 halamanQurdis BG Xiiabi_gheitsaBelum ada peringkat
- GELMEKDokumen10 halamanGELMEKmita maharaniBelum ada peringkat
- MutasiDokumen4 halamanMutasimita maharaniBelum ada peringkat