Golongan VI
Diunggah oleh
Fitri AnggraeniHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Golongan VI
Diunggah oleh
Fitri AnggraeniHak Cipta:
Format Tersedia
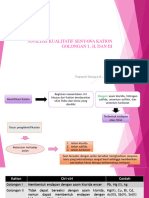
PEMISAHAN GOLONGAN VI MENURUT SISTEM H2S Magnesium, Mg (Ar: 24,305) Magnesium adalah logam putih, dapat ditempa dan
diliat. Ia melebur pada 650 0C. logam ini mudah terbakar dalam udara atau oksigen dengan mengeluarkan cahaya putih yang cemerlang, membentuk oksida MgO dan beberapa nitrida Mg3N2. Logam ini perlahan-lahan terurai oleh air pada suhu biasa, tetapi titik didih air reaksi berlangsung dengan cepat: Mg + 2H2O Mg(OH)2 + H2
Magnesium hidroksida, jika tak ada garam amonium, praktis tak larut. Magnesium larut dengan mudah dalam asam: Mg + 2H+ Mg2+ + H2
Magnesium membentukkation bivalen Mg2+. Oksida, hidroksida, karbonat, dan fosfatnya tak larut; garam-garam lainnya larut. Rasanya pahit. Beberapa dari garam-garam ini adalah higroskopis. Reaksi-reaksi ion magnesium, untuk mempelajari reaksi-reaksi inidapat dipakai larutan 0.5M dari magnesium klorida, MgCl6.6H2O atau magnesium sulfat MgSO4.7H2O 1. Larutan amonia: pengendapan parsial magnesium hidroksida yang putih dan seperti gelatin: Mg2+ + 2 NH3 + 2 H2O Mg(OH)2 + 2NH4+
Endapan larut sangat sedikit sekali dalam air (12 mg/l, Ks= 3.4 x 10-11), tetapi mudah larut dalam garam-garam amonium. Selagi reaksi berjalan,konsentrasi ino amonium, yang disebabkan oleh disosiasi garamgaram amoniumyang terionisasi sempruna, bertambah, dan akibatnya, konsentrasi ion-ion hidroksil berkurang karena efek ion sekutu . konsentrasi ion hidroksil yang kecil, yang memang sudah rendah, masih makin berkurang lagi, sehingga banyak dari garam magnesium itu tetap beraada dalam larutan. Dengan adanya konsentrasi garam amonium, konsentrasi ion-hidroksil akan brkurang sampai sedemikian sehingga hasil kali kelarutan Mg(OH)2 tak terlampaui: maka magnesium tak terendapkan oleh larutan amonia dengan adanya amonium klorida atau garam amonium lainnya. 2. Larutan natrium hidroksida: Endapan putih magnesium hidroksida,yang tak larut dalam reagensia berlebihan,tetapi mudah larut dalam garam-garam amonium: Mg2+ + 2OHMg(OH)2
3. Larutan amonium karbonat Jika tak ada serta garam-garam amonium,terjadi endapan putih magnesium karbonat basa: 5 Mg2+ + 6 CO32- + 7H2O 4MgCO3.Mg(OH)2.5H2O + 2 HCO3-
dengan adanya garam-garam amonium,tak terjadi pengendapan karena kesetimbangan NH4+ + CO32NH3 + HCO3-
bergeser ke arah pembentukan ion hidrogen karbonat.karena hasil kali kelarutan tinggi (Ks, MgCO3, murni adalah 1x10-5),konsentrasi ion karbonat yang perlu untuk menghasilkan endapan,tak tercapai. 4. Larutan natrium karbonat: Endapan putih,bervolume besar,yaitu karbonat basa , yang tak larut dalam larutan basa, tetapi mudah larut dalam asam dan larutan garam amonium. 5. Larutan natrium hidrogen fosfat: Endapan kritalin putih magnesium amonium fosfat Mg(NH4)PO4.6H2O jika ada serta amonium klorida (untuk mencegah pegendapan magnesium hidroksida) dan larutan amonium: Mg2+ + NH3 + HPO42Mg(NH4)PO4
Endapan larut sangat sedikit dalam air, larut dalam asam asetat dan dalam asam-asam mineral. Kelarutan yang normal dari Mg(NH4)PO4.6H2O bertambah karena garam ini terhidrolisis dalam air: Mg(NH4)PO4 + H2O Mg2+ + HPO42- +NH3 + H2O
Kecenderungan ini akan berkurang oleh adanya amonia dalam jumlah yang sedang(didapatkan bahwa senyawa ini sangat sedikit sekali larut dalam amonia 2.5 persen). Endapan memisah dengan lambat dari larutan yang encer, karena kecenderungannya untuk membentuk larutan lewat jenuh; ini biasanya diatasi dengan mendinginkan dan dengan menggosok-gosok tabung uji atau gelas piala (beaker) di bawah permukaan cairan dengan sebatang kaca. Gumpalan (seperti kapas) putih magnesium hidrogen fosfat, MgHPO4, dihasilkan dalam larutan yang netral. Mg2+ + HPO42MgHPO4
6. Reagensia difenilkarbazida (C6H5.NH.NHCO.NH.NH.C6H5) Larutan garam magnesium itu diolah dengan larutan natrium hidroksida- akan terbentuk endapan magnesium hidroksida- lalu dengan beberapa tetes reagensia difenilkarbazida dan larutan disaring. Setelah endapan dicuci dengan air panas, akan terlihat bahwa ia telah memperoleh warna lembayung-merah karena pembentukan suatu garam kompleks adsorpsi. Logam golongan II dan III mennganggu, maka tak boleh ada.
7.
Uji asam tanat-perak nitrat Dari dasar uji ini adalah sifat mereduksi dari asam tanat (suatu glukosida dari asam digalat) atas kompleks perak amina [Ag(NH3)2]+ untuk menghasilkan perak hitam: karena itu asam tanat mengendapkan perak dengan adanya amonia, tetapi tidak dari larutan perak nitrat yang sedikit asam. Campuran 2 tetes larutan asam tanat (tanin) 5% dengan 2 tetes larutan perak nitrat 20%, dan taruh campuran di atas kertas reaksi-tetes atau di atas sedikit kapas. Pegang kertas dalam uap yang dihasilkan pada pemanasan suatu garam amonium dengan larutan natrium hidroksida. Terbentuk noda hitam di atas kertas atau di atas kapas itu. Uji ini adalah uji yang peka.
8. Reagensia p-nitrobenzena-diazonium klorida Reagensia(I) menghasilkan pewarnaan merah (ditimbulkan oleh II) dengan garam amonium, bila terdapat larutan natrium hidroksida. Taruh setetes larutan uji yang netral atau sedikit asam di atas lempeng bercak, diikuti oleh setetes reagensia dan sebutir (granul) kalsium oksida diantara kedua tetes itu. Terbentuk suatu zona merah sekitar kalsium oksida. Uji blanko harus dilakukan terhadap setetes air . Kepekaan: 0,7 g NH3. Batas konsentrasi: 1 dalam 75.000. Reagensia (kadang-kadang disebut larutan Riegler) dibuat sebagai berikut . Larutkan 1 g p-nitroanilina dalam 25 ml asam klorida 2m (mungkin perlu dipanaskan), dan encerkan dengan 160 ml air. Dinginkan, tambahkan 20 ml larutan natrium nitrit 2-5% sambil dikocok kuat-kuat. Terus kocok sampai semuanya melarut. Reagensia menjadi keruh setelah disimpan, tetapi bisa dipakai lagi sesudah disaring. 9. Uji pembentukan-amonia Ini adalah suatu modifikasi dari reaksi 1, yang disesuaikan untuk analisis yang peka. Alat diperlihatkan pada Gambar. II .55,d an terdiri dari sebuah tabung-uji kecil dengan kapasitas 1 ml, yang dapat ditutup dengan penutup kecil dari kaca-asahan yang pada ujung bawahnya terdapat kait kaca kecil. Taruh setetes larutan uji atau sedikit zat padat dalam tabung-uji mikro itu, dan tambahkan setetes larutan natrium hidroksida 2M. Pasang sepotong kecil kertas lakmus merah pada
kait kaca, dan masukkan penutup ke tempatnya. Panaskan sampai 400C selama 5 menit. Kertas jadi berwarna biru. Kepekaan; 0,01 g NH3. Batas konsentrasi: 1 dalam 5.000.000. sianida tak boleh ada, karena zat-zat ini menghasilkan amonia dengan alkali: CN- + 2H2O HCOO- + NH3 Tetapi, jika ditambahkan sedikit merkurium (II) oksida, atau garam merkurium(II), terbentuk merkurium (II) sianida, Hg(CN)2, yang stabil terhadap alkali, sehingga efek mengganggu dari sianida telah sebagian besar dihilangkan. Cara lain untuk melakukan uji ini adalah dengan memakai reagensia mangan(II) nitratperak nitrat. Dengan mengolah larutan netral garam-garam mangan(II) dan perak dengan amonia, terbentuk endapan hitam. 4NH3 + Mn2+ + 2Ag+ + 3H2OMnO(OH)2 + 2Ag + 4NH3+4 Kepekaan dapat ditingkatkan dengan mengolah endapan yang dihasilkan dengan suatu larutan benzidina dalam asam asetat, pada mangan dioksida itu mengoksidasikan benzidina menjadi suatu propuk oksidasi yang berwarna biru (BAHAYA: REAGENSIA ADALAH KARSINOGEN(dapat menimbulkan kanker)). Gunakan alat yang diperlihatkan pada gambar II.53 atau pada gambar II.54. taruh setets larutan uji dan setetes natrium hidroksida 2M dalam tabung-uji mikro; juga taruh setetes reagensia pada tombol kaca dari penutup, dan tutuplah alat. Panaskan pada 400C selama 5 menit. Cuci tetesan reagensia ini di atas sehelai kertas saring kuantitatif, pada mana sebuah bintik hitam atau abu-abu akan membayang; ini akan berubah menjadi biru ketika dibubuhi benzidina atau hidrokloridanya dalam 10 ml asam asetat glasial, mengencerkan sampai 100 ml dengan air, dan menyaring). Kepekaan: 0,005 g NH3. Batas konsentrasi: 1 dalam 10.000.000. Reagensia mangan(II) nitrat-perak nitrat dibuat demikian: larutkan 2,87 g mangan(II) nitrat dalam 40 ml air, dan saring. Tambahkan larutan dari 3,55 g perak nitrat dalam 40 ml air, dan encerkan campuran sampai menjadi 100 ml. Netralkan asam yang terbentuk karena hidrolisis, dengan menambahkan alkali encer setets demi setetes, sampai terbentuk endapan hitam, dan saring. Simpan reagensia dalam botol berwarna gelap. 10. Uji kering Semua logam amonium menguap atau terurai, bila dipanaskan sampai sesaat sebelim berpijar. Pada beberapa kasus, dimana asamnya mudah menguap, uapnya akan bergabung kembali setelah mendingin dengan membentuk sublimat garam itu, misalnya amonium klorida.
III. 36. Kalium, K (Ar : 39,098). Kaliumn adalah logam putih perak yang lunak. Logam ini melebur pada 63,5oC. Ia tetap tak berubah dalam udara kering, tetapi dengan cepat teroksidasi dengan cepat di udara lembab, menjadi tertutup dengan suatu lapisan biru. Logam ini menguraikan air dengan dasyat, sambil melepaskan hydrogen dan terbakar dengan nyala lembayung : 2K+ + 2H2O 2K+ + 2OH- + H2 Kalium biasanya disimpan dalam pelarut nafta. Garam-garam kalium mengandung kation monovalen K+. Garam-garam ini biasanya larut dan membentuk larutan yang tak berwarna, kecuali bila anionnya berwarna. Reaksi-reaksi ion kalium Larutan kalium klorida, KCL, M dapat dipakai dalam uji-uji ini. 1. Larutan natrium heksanitritokobaltat(III) Na3[Co(NO2)6]: endapan kuning kalium zheksanitritokobaltat(III): 3K+ + [Co(NO2)6]3- K3[Co(NO2)6] Endapan atk larut dalam asam asetat encer. Jika ada natrium dalam jumlah yang lebih banyak (atau jika reagensia ditambahkan berlebihan) terbentuk suatu garam campuran, K2Na [Co(NO2)6]. Endapan terbentuk dengan segera dalam larutan-larutan pekat, dan lambat dalam larutan encer; pengendapan dapat dipercepat dengan pemanasan. Garamgaram ammonium member endapan yang serupa dan tak boleh ada. Dalam larutan yang basa, kita memperoleh endapa coklat atau hitam, yaitu kobalt(III) hidroksida Co(OH)3. Iodida dan zat pereduksi yang lain mengganggu, maka harus dihilangkan sebelum menguji. 2. Larutan asam tartarat (atau larutan natrium hydrogen tartrat): endapan kristal putih kalium hydrogen tartrat: K+ + H2C4H4O6 Dan K+ + H.C4H4O6KHC4H4O6 KHC4H4O6 + H+
Jika asam tertarat yang dipakai,larutan harus di bufferkan dengan natrium asetat,karena asam kuat yang terbentuk dalam reaksi (a),melarutkan endapan.basa-basa (alkali) kuat juga melarutkan endapan. Endapan larut sedikit dalam air (3,26 g -1, Ks = 3 x 10-4), tetapi sanggat tidak larut dalam etanol 50%. Pengendapan di percepat dengan mengaduk keras-keras , dengan mengosokgosok dinding dalam bejana dengan sebatang kaca dan dengan menambahkan alkohol. Garam-garam ammonium menghasilkan endapan yang serupa, maka tak boleh ada.
3. Larutan asam perklorat (HClO4): endapan kristalin putih kalium perklorat KClO4 dari larutan yang tak begitu encer. K+ + ClO4 KClO4 Endapan larut dalam air (3,2 g -1 dan 198 g -1 masing masing pada 00 dan 1000C) dan praktis tak larut dalam alkohol mutlak. Larutan dalam alkohol tak boleh dipanaskan, karena bisa menimbulkan ledakan yang berbahaya.reaksi tak dioengaruhi oleh adanya garam-garam ammonium. 4. Reaksi asam heksakloroplatina(IV) heksakloroplatina(IV): 2K+ + [PtCl6]2- K2[PtCl6] Pengendaan terjadi seketika dari larutan yang pekat; dalam larutan encer, pengendapan berlangsung perlahan-lahan kalau didiamkan, tetapi dapat diercepat dengan mendinginkan dan dengan mengosok-gosok dinding dalam bejana memakai sebatang kaca. Endapan larut sedikit dalam air, tetapi hampir ta larut dalam alkohol 75%. Garamgaram ammonium member endapan yang serupa, dan tak boleh ada. Reagen dibuat dengan melarutkan 2,6 g asam kloroplatinat terhidrasi, H2[PtCl6].6H2O, dalam 10 ml air. Karena mahalnya reagensia hendaklah dipakai daam jumlah yang hanya sedikit saja, dan semua endapan ditaruh dalam botol residu platinum. 5. Uji natrium heksanitritokobatat (III)-perak nitrat. Ini adalah suatu modifikasi dari reaksi 1 dan dapat dipakai untuk larutan yang bebashalogen. Pengendapan garam-garam kalium dengan larutan natrium heksanitritikobaltat(III) dan larutan perak nitrat, menghasilkan senyawa K2Ag[Co(NO)6], yang kurang larut dibanding senyawa natrium padanannya K2Na[Co(NO2)6], maka uji ini adalah lebih peka. Garam-garam litium, talium, dan ammonium tak boleh ada, karena mereka memberi endapan dengan larutan heksanitritokobaltat(III). Taruh setetes larutan uji yang netral atau asam dengan asam asetat, diatas lempeng bercak hitam, dan tambahkan setetes larutan perak nitat 0,1 M dan sejumlah kecil sekali natrium heksanitritokobaltat(III) yang berbentak bubuk halus. Muncul endapan atau kekeruhan yang berwarna kuning. Kepekaan: 1g K. Batas konsentrasi: 1 dalam 50000. Jika larutan perak nitrat tak ditambahkan. Kepekatan adalah 4 g K. 6. Reagensia dipikrilamina (atau heksanitrodifenilamina). Atom hydrogen dari gugus NH dapat diganti dengan logam, garam natriumnya larut dalam air dengan menghasilkan larutan yang kuning. Dengan larutan garam-garam kalium, garam-garam kalium, garam-gaeam ini menghasilkan endapan kristalin dari turunan (derivate) kaliumnya yang merah jingga. Uji ini dapat dipakai dengan hadirnya (H2[PtCl6]) : endapan kuning kalium
natrium sebanyak 80 kali dan litium sebanyak 130 kali lipat kalium. Garam-garam ammonium harus dihilangkan sebelum menguji. Magnesium tak mengganggu. Taruh setetes larutan uji yang netral di atas kertas reaksi-tetes dan segera tambahkan setetes reagensia yang sedikit basa itu. Diperoleh suatu bercak merah-jingga yang tak terpengaruh oleh pembubuhan 1-2 tetes asam klorida 2M. Kepekaan: 3 g K. Batas konsentrasi: 1 dalam 10.000. Reagensia dibuat dengan melarutkan 0,2 g dipikrilamina dalam 20 ml natrium karbonat 0,05M dan menyaring cairan yang telah didinginkan ini. 7. Uji natrium tetrafenilboron Kalium membentuk endapan putih dalam larutan netral atau dengan adanya asam asetat: K+ + [B(C6H5)4]- K[(C6H5)4] Endapan hampir tak larut dalam air (0,053 g -1, Ks= 2,25 x 10-8); kalium mengendap secara kuantitatif jika dipakai reagensia yang sedikit berlebihan (0,1-0,2%). Endapan larut dalam asam kuat dan alkali-alkali, dan juga dalam aseton. Ion-ion rubidium, caesium, talium(I), dan amonium mengganggu. Reagensia dibuat dengan melarutkan 3,42 g natrium tetrafenilboron Na[B(C6H5)4] (Mr: 342,2) dalam air, dan mengencerkannya sampai 100 ml. Larutan yang kira-kira 0,1M ini dapat tahan selama 2 minggu. Jika larutan tidak jernih harus kering. 8. Uji kering(pewarnaan nyala) Senyawa-senyawa kalium, sebaiknya kloridanya, mewarnai nyala bunsen yang tak cemerlang menjadi lembayung(lila). Nyala kuning yang dihasilkan oleh natrium dalam jumlah sedikit, mengganggu warna lembayung itu, tetapi dengan memandang nyala melalui 2 lapisan kaca kobalt yang biru, sinar-sinar natrium yang kuning akan diserap sehingga nyala kalium yang lembayung kemerahan jadi terlihat. Larutan tawas krom (310 g -1) setebal 3 cm, juga merupakan penyaring yang baik.
III.37.NATRIUM, Na (Ar: 22,9). Natrium adalah logam putih-perak yang lunak, yang melebur pada 97,50C. Natrium teroksidasi dengan cepat dalam udara lembab, maka harus disimpan terendam seluruhnya dalam pelarut nafta atau silena. Logam ini bereaksi keras dengan air, membentuk natrium hidroksida dan nitrogen. 2Na + 2H2O 2Na+ + 2OH- + H2 Dalam garam-garamnya, natrium berada sebagai kation monovalen Na+. Garam-garam ini membentuk larutan tak berwarna; hampir semua garam natrium larut dalam air.
Reaksi-reaksi ion natrium Untuk mempelajari reaksi-reaksi ini dapat dipakai larutan natrium klorida NaCl, 1M. 1. Larutan uranil magnesium asetat: endapan kristalin kuning, natrium magnesium uranil asetat NaMg(UO2)3(CH3COO)9.9H2O, dari larutan pekat. Penambahan kira-kira sepertiga volume alkohol akan membantu pengendapan: Na+ + Mg2+ + 3UO2+ + 9CH3COO- NaMg(UO2)3(CH3COO)9 Reagensia dibuat sebagai berikut. Larutkan 10 g uranil asetat dalam 6 g dalam 10 g asam asetat dan 100 ml air (larutan b). Campurkan kedua larutan a dan b, diamkan selama 24 jam, dan saring. Sebagai alternatif, reagensia dari konsentrasi yang ekivalen, dapat dibuat dengan melarutkan uranil magnesium asetat dalam air atau dalam asam asetat M dengan volume yang sesuai. 2. Larutan asam kloroplatinat, asam tartaurat atau natrium heksanitritokobaltat(III): tak ada endapan dengan larutan garam natrium. 3. Reagensia uranil zink asetat. Sebagai uji yang peka terhadap natrium, reagensia uranil zink asetat kadang-kadang lebih disukai ketimbang memakai uranil magnesium asetat. Kita memperoleh kristal-kristal kuning natrium zink uranil asetat, NaZn(UO2)3(CH3COO)9.H20. Reaksi ini cukup selektif untuk natrium Kepekaan reaksi dipengaruhi oleh tembaga, merkurium, kadnium, aluminium, kobalt, nikel, mangan, zink, kalsium , strontium, barium, dan ammonium jika terdapat dalam konsentrasi yang melebihi 5 g -1, garam-garam kalium dan litium mengendap jika konsentrasi dalam larutan masing-masing melebihi 5 g -1 dan 1 g -1. Taruh setetes larutan uji yang netral diatas lempang bercakyang hitam atau diatas kaca arloji, tambahkan 8 tetes reagensia, dan aduk dengan sebatang kaca. Terbentuk kekeruhan atau endapan kuning. Kepekaan: 12,5 g Na. Batas konsentrasi: 1 dalam 4.000. Reagensia dibuat sebagai berikut. Larutan 10 g uranil asetat dalam 25 mlasam asetat 30%, bila perlu dipanaskan, dan encerkan dengan air sampai 50ml (larutan a). Dalam bejana terpisah, aduk 30 g zink asetat dengan 25 ml asam asetat 30 % dan encerkan dengan air sampai 50 ml(larutan b). Campurkan kedua larutan a dan b, dan tambahkan sedikit natrium kloruda. Diamkan selama 24jam, dan sering dari natrium zink uranil asetat yang mengendap. Cara lain adalah, reagensia dengan konsentrasi yang equivalen dapat dibuat dengan melarutkan uranil zink asetat dalam air atau dalam asam asetat M, dengan volume yang sesuai. 4. Uji kering (pewarnaan nyala). Nyala bunsen yang tak-cemerlang akan diwarnai kuning kuat oleh garam natrium. Warna ini tak terlihat bila dipandang melalui 2 lapisan lempeng kaca kobalt yang biru. Garam natrium dalam jumlah yang sedikit sekali member hasil yang positif pada uji ini, dan hanya warna yang kuat dan bertahan lama yang menunjukan bahwa natrium terdapat dalam jumlah yang berarti.
III. 38. ION AMONIUM, NH4+ (Mr : 18,038). Ion-ion ammonium diturunkan dari ammonia, NH3 dan ion hydrogen H+. Ciri-ciri khas ion ini adalah serupa dengan cirri-ciri khas ion logam-logam alkali. Dengan elektrolisis memakai katode dari merkurium dapat dibuat ammonium amalgam, yang mempunyai sifat-sifat serupa dengan amal gam dari natrium atau kalium. Garam-garam ammonium umumnya adalah senyawa-senyawa yang larut dalam air, dengan membentuk larutan yang tak berwarna (kecuali bila Anionya berwarna). Dengan pemanasan, semua garam ammonium terurai menjadi amonia dan asam yang sesuai. Kecuali jika asamnya tak mudah menguap, garam ammonium dapat dihilangkan secara kuantitatif dari campuran kering dengan memanaskan. Reaksi-reaksi ammonium umumnya serupa dengan reaksi-reaksi kalium, karena ukuran kedua ion itu hamper identik. Raksi-reaksi ion ammonium, untuk mempelajari reaksi-reaksi ini, dapat dipakai larutan amonium klorida NH4Cl, M. Reaksi-reaksi ion ammonium umumnya serupa dengan reaksi-reaksi kalium, karena ukuran kedua ion itu hampei identik. Reaksi-reaksi ion amonium untuk memepelajari reaksi-reaksi ini, dapat dipakai larutan ammonium klorida NH4Cl, M. 1. Larutan Natrium Hidroksida NH4+ + OH- NH3 + H2O Ini dapat diidentifikasikan melalui: a. Baunya, dengan hati-hati ciumlah uap setelah mengangkat tabung uji atau gelas kimia dari api b. Terbentuknya uap putih amonium klorida bila sebuah batang kaca yang dibasahi asam klorida pekat dipegangi uapnya c. Fakta bahwa gas ini menyebabkan kertas lakmus merah berubah menjadi biru atau kertas kunyit berubah menjadi coklat d. Kemampuannya untuk mengubah kertas saring yang dibasahi larutan merkuri (I) nitrat menjadi hitam
e. Kertas saring yang dibasahi larutan mangan (II) klorida dan hydrogen peroksida member warna coklat, karena oksidasi terhadap mangan oleh larutan basa yang terbentuk itu Dalam uji 1(d), terbentuk campuran merkuri (II) amidonirat atau endapan putih dan merkurium (endapan hitam): 2 NH3 + Hg22+ + NO3- Hg(NH2)NO3 + Hg + NH4+ Dalam uji 1 (e) terbentuk mangan (IV) oksida berhidrat: 2 NH3 + Mn2+ + H2O2 + H2O MnO(OH2) + 2NH4+ 2. Reagensia Nessler atau larutan basa dari kalium tetraiodomerkurat (II): endapan coklat atau pewarnaan coklat atau kuning dihasilkan sesuai dengan jumlah amonium atau ion amonium yang terdapat. Endapan adalah merkuri (II) amidoiodida basa: NH4+ + 2[HgI4]2- + 4 OH- HgO.Hg(NH2)I + 7 I- + 3 H2O Rumus endapan coklat yant yang ditulis sebagai 3 HgO.Hg(NH3)2 I2 (Britton dan Wilson, 1993) sebagai NH2Hg2I3 (Nichols dan Willits, 1934. Uji ini luar biasa peka, dan akan menditeksi runutan ammonia yang terdapat dalam air minum. Semua logam, kecuali natrum dan kalium, tak boleh ada.reagensia dibuat dengan melarutkan 10 gr kalium iodide dalam 10 ml air bebas ammonia, lalu tambahkan larutan merkuria (II) klorida jenuh (60 g l-1) sedikit demi sedikit, sambil dikocok, sampai terbentuk endapan yang sedikit dan tetap, lalu tambahkan 80 ml larutan kalium hidroksida 9 M dan encerkan sampai 200 ml. diamkan semalam, dan dekantasi cairan yang jernih. Maka reagensia terdiri dari larutan kalium tetraiodomerkurat (II), K2(HgI4) yang basa. Reagensia Nessler yang asli pernah diuraikan sebagai larutan yang terdiri dari kalium tetraiodomerkurat (II), K2(HgI4) kira-kira 0,09 M, dan kalium hidroksida 2,5 M. cara lain untuk membuat larutan reagensia ini adalah sebagai berikut. Larutan 23 g merkuri (II) iodida dan 16 gr kalium iodide dalam air yang bebas ammonia, dan tambahakan sampai volume 100 ml natrium hidroksida 6 M. diamkan selama 24 jam, dan dekantasi larutan dari setiap endapan yang mungkin terbentuk. Larutan harus disimpan dalam tempat yang gelap. Teknik bercaknya adalah sebagai berikut. Campurkan setetes larutan uji dengan setetes larutan natrium hidroksida pekat di atas kaca arloji. Pindahkan setetes mikro larutan atau suspense yang
dihasilkan ke atas kertas reaksi-tetes dan tambahkan setetes reagensia Nessler. Dihasilkan noda atau cicin berwarna kuning atau merah-jingga. Kepekaan: 0,25 g NH3. 3. Natrium Heksanitritokobaltat (III), (Na3[Co(No2)6I]), terdapat endapan warna kuning amonium heksanitritokobaltat (III), (NH4)3[Co(No2)6], yang serupa dengan yang diahsilkan oleh ion kalium: 3 NH4+ + [Co(NO2)6]3- + (NH4)3[Co(NO2)6] 4. Asam Heksakloroplatinat (IV) (H2[PtCl6]: endapan kuning amonia yang serupa heksakloroplatinat (IV) 2 NH4+ + [PtCi6]2- (NH4)2[PtCI6] Ciri khas endapan adalah serupa dengan cirri-ciri garam kalium yang bersangkutan, tetapi berbeda darinya dalam hal endapan ini terurai ketika dipanaskan dengan larutan natrium hidroksida, dengan melepaskan gas amonia. 5. Larutan natrium hydrogen tartat (NaH.C4H4O6)* jenuh: endapan putih amonium tartat asam Na.H.C4H4O6, yang serupa tetapi sedikit lebih larut daripada garam kalium yang bersangkutan, dari zat mana endapan itu dapat dibedakan karena dilepaskannya gas amonia, sewaktu endapan dipanaskan dengan larutan natrium hidroksida. NH4+ + HC4H4O6- NH4HC4H4O6 * atau larutan asam tartarat, meski ini kurang efektif. 6. Larutan asam perklorat atau natrium perklorat: tak ada pengendapan (perbedaan dari kalium) 7. Uji asam tanat-perak nitrat. Dasar dari uji ini adalah sifat mereduksi dari asam tanat (suatu glukosida dari asam digalat) atas kompleks perak amina [Ag(NH3)2]+ untuk menghasilkan perak hitam: karena itu asam tanat mengendapkan perak dengan adanya amonia, tetapi tidak dari larutan perak nitrat yang sedikit asam. Campuran 2 tetes larutan asam tanat (tanin) 5% dengan 2 tetes larutan perak nitrat 20%, dan taruh campuran di atas kertas reaksi-tetes atau di atas sedikit kapas. Pegang kertas
dalam uap yang dihasilkan pada pemanasan suatu garam amonium dengan larutan natrium hidroksida. Terbentuk noda hitam di atas kertas atau di atas kapas itu. Uji ini adalah uji yang peka.
8. Reagensia p-nitrobenzena-diazonium klorida. Reagensia(I) menghasilkan pewarnaan merah (ditimbulkan oleh II) dengan garam amonium, bila terdapat larutan natrium hidroksida. Taruh setetes larutan uji yang netral atau sedikit asam di atas lempeng bercak, diikuti oleh setetes reagensia dan sebutir (granul ) kalsium oksida diantara kedua tetes itu. Terbentuk suatu zona merah sekitar kalsium oksida. Uji blanko harus dilakukan terhadap setetes air . Kepekaan: 0,7 g NH3. Batas konsentrasi: 1 dalam 75.000. Reagensia (kadang-kadang disebut larutan Riegler) dibuat sebagai berikut . Larutkan 1 g p-nitroanilina dalam 25 ml asam klorida 2m (mungkin perlu dipanaskan), dan encerkan dengan 160 ml air. Dinginkan, tambahkan 20 ml larutan natrium nitrit 2-5% sambil dikocok kuat-kuat. Terus kocok sampai semuanya melarut. Reagensia menjadi keruh setelah disimpan, tetapi bisa dipakai lagi sesudah disaring. 9. Uji pembentukan-amonia. Ini adalah suatu modifikasi dari reaksi 1, yang disesuaikan untuk analisis yang peka. Alat diperlihatkan pada Gambar. II .55,d an terdiri dari sebuah tabung-uji kecil dengan kapasitas 1 ml, yang dapat ditutup dengan penutup kecil dari kaca-asahan yang pada ujung bawahnya terdapat kait kaca kecil. Taruh setetes larutan uji atau sedikit zat padat dalam tabung-uji mikro itu, dan tambahkan setetes larutan natrium hidroksida 2M. Pasang sepotong kecil kertas lakmus merah pada kait kaca, dan masukkan penutup ke tempatnya. Panaskan sampai 400C selama 5 menit. Kertas jadi berwarna biru. Kepekaan; 0,01 g NH3. Batas konsentrasi: 1 dalam 5.000.000. sianida tak boleh ada, karena zat-zat ini menghasilkan amonia dengan alkali: CN- + 2H2O HCOO- + NH3 Tetapi, jika ditambahkan sedikit merkurium (II) oksida, atau garam merkurium(II), terbentuk merkurium (II) sianida, Hg(CN)2, yang stabil terhadap alkali, sehingga efek mengganggu dari sianida telah sebagian besar dihilangkan. Cara lain untuk melakukan uji ini adalah dengan memakai reagensia mangan(II) nitratperak nitrat. Dengan mengolah larutan netral garam-garam mangan(II) dan perak dengan amonia, terbentuk endapan hitam. 4NH3 + Mn2+ + 2Ag+ + 3H2OMnO(OH)2 + 2Ag + 4NH3+4 Kepekaan dapat ditingkatkan dengan mengolah endapan yang dihasilkan dengan suatu larutan benzidina dalam asam asetat, pada mangan dioksida itu mengoksidasikan
benzidina menjadi suatu propuk oksidasi yang berwarna biru (BAHAYA: REAGENSIA ADALAH KARSINOGEN(dapat menimbulkan kanker)). Gunakan alat yang diperlihatkan pada gambar II.53 atau pada gambar II.54. taruh setets larutan uji dan setetes natrium hidroksida 2M dalam tabung-uji mikro; juga taruh setetes reagensia pada tombol kaca dari penutup, dan tutuplah alat. Panaskan pada 400C selama 5 menit. Cuci tetesan reagensia ini di atas sehelai kertas saring kuantitatif, pada mana sebuah bintik hitam atau abu-abu akan membayang; ini akan berubah menjadi biru ketika dibubuhi benzidina atau hidrokloridanya dalam 10 ml asam asetat glasial, mengencerkan sampai 100 ml dengan air, dan menyaring). Kepekaan: 0,005 g NH3. Batas konsentrasi: 1 dalam 10.000.000. Reagensia mangan(II) nitrat-perak nitrat dibuat demikian: larutkan 2,87 g mangan(II) nitrat dalam 40 ml air, dan saring. Tambahkan larutan dari 3,55 g perak nitrat dalam 40 ml air, dan encerkan campuran sampai menjadi 100 ml. Netralkan asam yang terbentuk karena hidrolisis, dengan menambahkan alkali encer setets demi setetes, sampai terbentuk endapan hitam, dan saring. Simpan reagensia dalam botol berwarna gelap. 10. Uji kering. Semua logam amonium menguap atau terurai, bila dipanaskan sampai sesaat sebelim berpijar. Pada beberapa kasus, dimana asamnya mudah menguap, uapnya akan bergabung kembali setelah mendingin dengan membentuk sublimat garam itu, misalnya amonium klorida.
Anda mungkin juga menyukai
- Pemisahan Kation Golongan IIIDokumen6 halamanPemisahan Kation Golongan IIIHening HerziatraBelum ada peringkat
- Identifikasi Kation Gol.5Dokumen8 halamanIdentifikasi Kation Gol.5Ireny PutriBelum ada peringkat
- HipokloritDokumen25 halamanHipokloritJunitriSuariBelum ada peringkat
- Kel.6 Kimia Analisis Tugas AnionDokumen17 halamanKel.6 Kimia Analisis Tugas AnionCelin GracelaBelum ada peringkat
- Format Dan Kalium PermanganatDokumen4 halamanFormat Dan Kalium PermanganatMuhammad Husni HakimBelum ada peringkat
- Kalium Golongan VDokumen4 halamanKalium Golongan VPUTRI WIDATIKA ANDRIANIBelum ada peringkat
- Identifikasi Kation Golongan VDokumen5 halamanIdentifikasi Kation Golongan VMarina Aizzatun NisaBelum ada peringkat
- PERMANGANOMETRIDokumen7 halamanPERMANGANOMETRIratnaBelum ada peringkat
- KromiumDokumen5 halamanKromiumRifki Ramadhan HilmiBelum ada peringkat
- BAB II R AnionDokumen7 halamanBAB II R AnionEKA WAHYU TIAN NINGSIHBelum ada peringkat
- Analisis Kualitatif Berdasarkan Metode h2sDokumen8 halamanAnalisis Kualitatif Berdasarkan Metode h2sWahyuni RahmatBelum ada peringkat
- Identifikasi Kation Golongan VDokumen3 halamanIdentifikasi Kation Golongan Vfitroh_adjah50% (2)
- LA ArrheniusDokumen27 halamanLA Arrheniuseli eliBelum ada peringkat
- Analisis Kation Dan AnionDokumen16 halamanAnalisis Kation Dan Anionfrizki taufiqBelum ada peringkat
- Golongan Kation Ke DuaDokumen16 halamanGolongan Kation Ke DuaFitriyaniBelum ada peringkat
- DAFDokumen11 halamanDAFElisa SumbayakBelum ada peringkat
- RX Kation Gol 1 & 2Dokumen46 halamanRX Kation Gol 1 & 2Lisa AndrianiBelum ada peringkat
- Kation Golongan III - BDokumen20 halamanKation Golongan III - BAmy SmithBelum ada peringkat
- Sianida CNDokumen4 halamanSianida CNusagniaBelum ada peringkat
- Materi KA1 Minggu 1Dokumen28 halamanMateri KA1 Minggu 1Arnes TataBelum ada peringkat
- JJXJDKSMXDokumen15 halamanJJXJDKSMXAufa QaysBelum ada peringkat
- Sifat-Sifat Anion Dalam Gugus Klorida CL-, BRDokumen15 halamanSifat-Sifat Anion Dalam Gugus Klorida CL-, BRMuhammad RizalBelum ada peringkat
- Reaksi Identifiksi Dan Analisis Kation Golongan VDokumen21 halamanReaksi Identifiksi Dan Analisis Kation Golongan VDian Khairunisa Nurdien93% (27)
- Kimia Analisi1 Kel 5Dokumen11 halamanKimia Analisi1 Kel 5RatnasarizaldiBelum ada peringkat
- Indah Fahreini Tambusay - 11191020000012 - Kation Golongan VDokumen8 halamanIndah Fahreini Tambusay - 11191020000012 - Kation Golongan VIndaBelum ada peringkat
- VOGELDokumen74 halamanVOGELJagad RayaBelum ada peringkat
- Makalah PermanganoDokumen9 halamanMakalah PermanganoRossie AriyaniBelum ada peringkat
- REaksi KMnO4Dokumen2 halamanREaksi KMnO4Asriandy Ramadhan50% (2)
- Kelompok 4Dokumen34 halamanKelompok 4AryMasDewiWiantiniBelum ada peringkat
- Kimia AnalitikDokumen20 halamanKimia AnalitikYannieApriyani50% (2)
- Ion SulfitDokumen4 halamanIon SulfitHestiDiahPrahastiwiBelum ada peringkat
- Identifikasi KationDokumen38 halamanIdentifikasi KationfasyaurfaniBelum ada peringkat
- Third-LectureDokumen18 halamanThird-LectureevaBelum ada peringkat
- Lap Kimlis 2Dokumen20 halamanLap Kimlis 2Alfina Putri PertiwiBelum ada peringkat
- 27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIDokumen22 halaman27 Sept ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I, II, IIIMawar RamadhaniBelum ada peringkat
- Reaksi Dari Persenyawaan PerakDokumen3 halamanReaksi Dari Persenyawaan PerakLatifah Umi50% (2)
- CBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDokumen12 halamanCBR Kimia Analitik - Desima Samosir - 4191131009 - PSPK 19eDesima SamosirBelum ada peringkat
- 6Dokumen4 halaman6Salsabila HandayaniBelum ada peringkat
- Tugas KLORIDADokumen3 halamanTugas KLORIDAsetiawan_214172811Belum ada peringkat
- Kation Dan AnionDokumen52 halamanKation Dan AnionLulu Marjannah ArifBelum ada peringkat
- Skematika Pemisahan Kation Golongan IDokumen14 halamanSkematika Pemisahan Kation Golongan IEka PratiwiBelum ada peringkat
- Analisis Kation Golongan IV Dan V.Dokumen3 halamanAnalisis Kation Golongan IV Dan V.Vthree YsBelum ada peringkat
- Kel 3 - Analisis Kualitatif Anion 1Dokumen31 halamanKel 3 - Analisis Kualitatif Anion 1khiyarotunnafisah0Belum ada peringkat
- Analisis Kation Golongan IiDokumen17 halamanAnalisis Kation Golongan Iiilliyin75% (4)
- Pemisahan Kation Golongan IIIBDokumen6 halamanPemisahan Kation Golongan IIIBTri AdiantiBelum ada peringkat
- Analisis Kualitatif Berdasarkan Metode h2sDokumen10 halamanAnalisis Kualitatif Berdasarkan Metode h2sPaulPranvedj100% (1)
- Percobaan 2Dokumen15 halamanPercobaan 2Rere MaulidinaBelum ada peringkat
- Identifikasi Kation Golongan 2Dokumen7 halamanIdentifikasi Kation Golongan 2ervhintia mkBelum ada peringkat
- Identifikasi Kation Golongan 1 Dan 2Dokumen26 halamanIdentifikasi Kation Golongan 1 Dan 2Muhammad Alfi Syahri 1607112225Belum ada peringkat
- Analisis Kation Ca2+ Dan Analisis Anion CLDokumen20 halamanAnalisis Kation Ca2+ Dan Analisis Anion CLAfgan Reni67% (3)
- Identifikasi Suatu Garam SederhanaDokumen25 halamanIdentifikasi Suatu Garam SederhanaPratama AdiBelum ada peringkat
- Pembuatan LarutanDokumen3 halamanPembuatan LarutanRizki Putri RahmadaningsihBelum ada peringkat
- KadmiumDokumen3 halamanKadmiumcindyBelum ada peringkat
- Titrasi PermanganometriDokumen8 halamanTitrasi PermanganometriQori Aina IndriantiBelum ada peringkat
- Makalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Dokumen22 halamanMakalah Analisis Kualitatif Kation Dan Anion (Ira&Japer)Fajar Yusya Ramadhan94% (33)
- Ka MagnesiumDokumen2 halamanKa MagnesiumFitri AnggraeniBelum ada peringkat
- MSDS CP, Asam Nitrat K2Cr2O7Dokumen3 halamanMSDS CP, Asam Nitrat K2Cr2O7Fitri AnggraeniBelum ada peringkat
- AASDokumen3 halamanAASWiwil SyukmaliandaBelum ada peringkat
- Aas Dan KesadahanDokumen13 halamanAas Dan KesadahanFitri AnggraeniBelum ada peringkat
- Aas Dan KesadahanDokumen13 halamanAas Dan KesadahanFitri AnggraeniBelum ada peringkat
- Golongan VIDokumen13 halamanGolongan VIFitri AnggraeniBelum ada peringkat
- MSDS CP, Asam Nitrat K2Cr2O7Dokumen3 halamanMSDS CP, Asam Nitrat K2Cr2O7Fitri AnggraeniBelum ada peringkat
- Ka MagnesiumDokumen2 halamanKa MagnesiumFitri AnggraeniBelum ada peringkat
- Reaksi AmoniumDokumen3 halamanReaksi AmoniumFitri AnggraeniBelum ada peringkat
- Pertukaran KationDokumen19 halamanPertukaran KationSiti MarwasofaBelum ada peringkat
- Msds p4 Analisa Kesadahan TotalDokumen6 halamanMsds p4 Analisa Kesadahan TotalFitri AnggraeniBelum ada peringkat
- Apakah Kredit Karbon ItuDokumen7 halamanApakah Kredit Karbon ItuFitri AnggraeniBelum ada peringkat
- Msds p4 Analisa Kesadahan TotalDokumen6 halamanMsds p4 Analisa Kesadahan TotalFitri AnggraeniBelum ada peringkat
- Pertukaran KationDokumen19 halamanPertukaran KationSiti MarwasofaBelum ada peringkat
- NUKLIRDokumen14 halamanNUKLIRFitri AnggraeniBelum ada peringkat
- Pengertian ZakatDokumen18 halamanPengertian ZakatFitri AnggraeniBelum ada peringkat
- Titrassi KompleksometriDokumen10 halamanTitrassi KompleksometriFitri AnggraeniBelum ada peringkat
- 200 Kata Galau TerbaruDokumen10 halaman200 Kata Galau TerbaruFitri AnggraeniBelum ada peringkat
- Bab 2Dokumen16 halamanBab 2Fitri AnggraeniBelum ada peringkat
- Titrassi PengendapanDokumen1 halamanTitrassi PengendapanFitri AnggraeniBelum ada peringkat
- Pertukaran KationDokumen19 halamanPertukaran KationSiti MarwasofaBelum ada peringkat
- Titra SiDokumen4 halamanTitra SiFitri AnggraeniBelum ada peringkat
- Msds hcl22Dokumen7 halamanMsds hcl22Fitri AnggraeniBelum ada peringkat
- 1233Dokumen9 halaman1233Fitri AnggraeniBelum ada peringkat