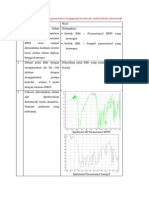
Alkana Adalah Senyawa Hidrokarbon Yang Hanya Memiliki Ikatan Tunggal
Diunggah oleh
Alhamzah Rachmat FadjarHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Alkana Adalah Senyawa Hidrokarbon Yang Hanya Memiliki Ikatan Tunggal
Diunggah oleh
Alhamzah Rachmat FadjarHak Cipta:
Format Tersedia
Alkana adalah senyawa hidrokarbon yang hanya memiliki ikatan tunggal.
Struktur alkana dapat ditulis sebagai serangkaian gugus -CH2-(gugus metilen) yang tiap ujungnya diakhiri dengan atom hidrogen.Inimerupakanrumusumumuntuksenyawaalkanarantaikontinyu/ tak bercabang. Senyawa kelompok ini hanya berbeda pada jumlah gugus metilen yang dimilikinya. Jika suatu molekul alkana memiliki atom C, maka jumlah atom H adalah(2n + 2), sehingga rumus molekul untuk alkana secara umum adalah CnH2n+2. Untuk senyawa alkana bercabang, juga mengikuti rumus molekul CnH2n+2.( http://tekim.undip.ac.id/staf/ratnawati/files/2011/09/BAB-5ALKANA3.pdf)
Alkana biasa disebut dengan senyawa hidrokarbon jenuh. Disebut hidrokarbon karena di dalamnya hanya terkandung atom karbon dan hidrogen. Disebut jenuh karena hanya memiliki ikatan tunggal C-H dan C-C saja. Alkana memiliki rumus umu CnH2n+2, di mana n adalah bilangan asli yang menyatakan jumlah atom karbon. Alkana juga sering disebut sebagai senyawa alifatik (Yunani = aleiphas yang berarti lemak). Hal ini dikarenakan lemak-lemak hewani mengandung karbon rantai panjang yang mirip dengan alkana . Alkana dengan satu formula dapat membentuk beberapa struktur molekul. Misalnya alkana dengan empat atom karbon dapat membentuk normal butana dan isobutana, keduanya sama-sama memiliki rumus molekul C4H10. Hal yang sama juga terjadi untuk C5H12, dan seterusnya. Suatu senyawa yang memiliki jumlah dan macam atom sama tetapi berbeda dalam penataannya disebut dengan isomer. Isomer berasal dari bahasa Yunani; isos + meros yang berarti terbuat dari bagian yang sama. Senyawa seperti butana dan isobutana hanya berbeda pada urutan atom yang terikat satu sama lainnya, disebut isomer konstitusional. Isomer konstitusional tidak terbatas hanya untuk alkana, tetapi juga pada sebagian besar senyawa organik. Isomer konstitusional bisa berbeda pada susunan kerangka atom karbon (seperti pada butane dan isobutana), perbedaan gugus fungsi (seperti pada etanol dan dimetil eter), atau berbeda pada penempatan gugus fungsi (isopropilamina dan propilamina). Meskipun memiliki formula yang sama, sifat-sifat fisika kimia dari isomer biasanya berbeda. Alkana dapat digambarkan dengan menggunakan struktur terkondensasi. Semua ikatan dalam molekul diabaikan/ dihilangkan. Jika ada tiga atom hidrogen terikat pada satu karbon, digambar dengan CH3, jika dua hidrogen digambar dengan CH2, dan seterusnya. Dengan demikian kita dapat menggambar butana dengan struktur CH3CH2CH2CH3 atau CH3(CH2)2CH3. Alkana diberi nama berdasarkan jumlah atom karbonnya. Penamaan diambil dari bahasa Yunani, kecuali untuk satu hingga empat atom karbon, yaitu
metana, etana, propana, dan butana. Akhiran ana ditambahkan pada akhir tiap nama untuk memberikan ciri bahwa senyawa tersebut adalah alkana. Selanjutnya, pentane berarti terdiri dari lima atom karbon, heksana terdiri dari enam karbon, dan seterusnya.
Rumus molekul Alkana merupakan kelompok hidrokarbon yang paling sederhana yaitu senyawa-senyawa yang hanya mengandung karbon dan hidrogen. Alkana hanya mengandung ikatan C-H dan ikatan tunggal C-C. Enam senyawa alkana yang pertama adalah:
metana etana propana butana pentana heksana
CH4 C2H6 C3H8 C4H10 C5H12 C6H14
Anda bisa menentukan rumus molekul dari senyawa alkana manapun dengan menggunakan rumus umum: CnH2n+2 Isomeri Semua alkana yang memiliki 4 atau lebih atom karbon akan memiliki isomeri bangun. Ini berarti bahwa ada dua atau lebih rumus bangun yang bisa dibuat untuk masing-masing rumus molekul. Sebagai contoh, C4H10 bisa menjadi salah satu dari dua molekul berbeda berikut ini:
Molekul-molekul ini masing-masing disebut butana dan 2-metilpropana. Sikloalkana Sikloalkana juga hanya mengandung ikatan C-H dan ikatan tunggal C-C, hanya saja atom-atom karbon tergabung dalam sebuah cincin. Sikloalkana yang paling kecil adalah siklopropana.
Jika anda menghitung jumah karbon dan hidrogen pada gambar di atas, anda akan melihat bahwa jumlah atom C dan H tidak lagi memenuhi rumus umum CnH2n+2. Dengan tergabungnya atomatom karbon dalam sebuah cincin, ada dua atom hidrogen yang hilang. Dua atom hidrogen yang hilang memang tidak diperlukan lagi, sebab rumus umum untuk sebuah sikloalkana adalah CnH2n. Jangan anda berpikir bahwa molekul-molekul yang terbentuk dari rumus ini adalah molekulmolekul biasa. Semua sikloalkana mulai dari siklopentana keatas terdapat sebagai "cincin yang berkerut". Sikloheksana misalnya, memiliki sebuah struktur cincin yang terlihat seperti ini:
Struktur ini dikenal sebagai bentuk "kursi" dari sikloheksana sesuai dengan bentuknya yang sedikit menyerupai sebuah kursi. Sifat-Sifat Fisik Titik Didih Fakta-Fakta
Titik-titik didih yang ditunjukkan pada gambar di atas semuanya adalah titik didih untuk isomerisomer "rantai lurus" dimana terdapat lebih dari satu atom karbon. Perhatikan bahwa empat alkana pertama di atas berbentuk gas pada suhu kamar. Wujud padat baru bisa terbentuk mulai dari struktur C17H36. Alkana dengan atom karbon kurang dari 17 sulit diamati dalam wujud padat karena masingmasing isomer memiliki titik lebur dan titik didih yang berbeda. Jika ada 17 atom karbon dalam alkana, maka sangat banyak isomer yang bisa terbentuk! Sikloalkana memiliki titik didih yang sekitar 10 20 K lebih tinggi dibanding alkana rantai lurus yang sebanding. Penjelasan-Penjelasan
Perbedaan keelektronegatifan antara karbon dan hidrogen tidak terlalu besar, sehingga terdapat polaritas ikatan yang sangat tinggi. Molekul-molekul sendiri memiliki polaritas yang sangat kecil. Bahkan sebuah molekul yang simetris penuh seperti metana tidak polar sama sekali. Ini berarti bahwa satu-satunya gaya tarik antara satu molekul dengan molekul tetangganya adalah gaya dispersi Van der Waals. Gaya ini sangat kecil untuk sebuah molekul seperti metana, tapi akan meningkat apabila molekul bertambah lebih besar. Itulah sebabnya mengapa titik didih alkana semakin meningkat seiring dengan bertambahnya ukuran molekul. Semakin bercabang rantai suatu isomer, maka titik didihnya akan cenderung semakin rendah. Gaya dispersi Van der Waals lebih kecil untuk molekul-molekul yang berantai lebih pendek, dan hanya berpengaruh pada jarak yang sangat dekat antara satu molekul dengan molekul tetangganya. Molekul dengan banyak cabang tapi berantai pendek lebih sulit berdekatan satu sama lain dibanding molekul yang sedikit memiliki cabang. Sebagai contoh, titik didih tiga isomer dari C5H12 adalah:
Titik didih (K) pentana 2-metilbutana 2,2-dimetilpropana 309.2 301.0 282.6
Titik didih yang sedikit lebih tinggi untuk sikloalkana kemungkinan diakibatkan karena molekulmolekul bisa saling mendekati akibat struktur cincin yang membuatnya lebih rapi dan kurang "mengerut"! Kelarutan Fakta-fakta Kelarutan alkana tidak berbeda dengan kelarutan sikloalkana. Alkana hampir tidak dapat larut dalam air, tapi larut dalam pelarut organik. Alkana dalam bentuk cair merupakan pelarut yang baik untuk berbagai senyawa kovalen yang lain. Penjelasan-penjelasan Kelarutan dalam air Apabila sebuah zat molekular larut dalam air, maka terjadi hal-hal berikut:
gaya tarik antar-molekul dalam zat menjadi hilang. Untuk alkana, gaya tarik tersebut adalah gaya dispersi Van der Waals.
gaya tarik antar-molekul dalam air menjadi hilang sehingga zat bisa bercampur dengan molekul-molekul air. Dalam air, gaya tarik antar-molekul yang utama adalah ikatan hidrogen.
Diperlukan energi untuk meghilangkan gaya tarik antar-molekul tersebut, meskipun jumlah energi yang diperlukan untuk menghilangkan gaya dispersi Van der Waals pada molekul seperti metana sangat kecil dan bisa diabaikan. Akan tetapi, ini tidak berlaku bagi ikatan hidrogen dalam air, dimana diperlukan banyak energi untuk memutus ikatan hidrogen. Dengan kata lain, sebuah zat akan larut jika ada cukup energi yang dilepaskan ketika ikatanikatan baru terbentuk antara zat dan air untuk mengganti energi yang digunakan dalam memutus gaya tarik awal. Satu-satunya gaya-tarik yang baru terbentuk antara alkana dan molekul air adalah gaya Van der Waals. Pembentukan gaya tarik ini tidak melepaskan banyak energi untuk mengganti energi yang diperlukan untuk memutus ikatan hidrogen dalam air. Olehnya itu alkana tidak larut. Kelarutan dalam pelarut-pelarut organik Pada kebanyakan pelarut organik, gaya tarik utama antara molekul-molekul pelarut adalah gaya Van der Waals baik gaya dispersi maupun gaya tarik dipol-dipol. Ini berarti bahwa apabila sebuah alkana larut dalam sebuah pelarut organik, maka gaya tarik Van der Waals terputus dan diganti dengan gaya Van der Waals yang baru. Pemutusan gaya tarik yang lama dan pembentukan gaya tarik yang baru saling menghapuskan satu sama lain dari segi energi sehingga tidak ada kendala bagi kelarutannya. Kereaktifan kimiawai Alkana Alkana mengandung ikatan tunggal C-C yang kuat dan ikatan C-H yang juga kuat. Ikatan C-H memiliki polaritas yang sangat rendah sehingga tidak ada molekulnya yang membawa jumlah ion positif atau negatif yang signifikan untuk menarik molekul lainnya. Olehnya itu alkana-alkana memiliki reaksi yang cukup terbatas. Beberapa hal yang bisa dilakukan pada alkana:
alkana bisa dibakar, yakni memusnahkan seluruh molekulnya; alkana bisa direaksikan dengan beberapa halogen yakni memutus ikatan C-H; alkana bisa dipecah, yakni dengan memutus ikatan C-C.
Reaksi-reaksi ini akan dibahas secara rinci pada halaman terpisah (lihat berikut). Sikloalkana
Sikoalkana memiliki kereaktifan yang sangat mirip dengan alkana, kecuali untuk sikloalkana yang sangat kecil khususnya siklopropana. Siklopropana jauh lebih reaktif dibanding yang mungkin anda kira. Alasannya karena sudut-sudut ikatan dalam cincin. Normalnya, apabila karbon membentuk empat ikatan tunggal, maka sudut-sudut ikatannya adalah sekitar 109,5. Pada siklopropana sudut ini sebesar 60.
Dengan pasangan-pasangan elektron yang saling berdekatan, terjadi tolak menolak antara pasangan-pasangan elektron yang menghubungkan atom-atom karbon. Ini membuat ikatanikatan lebih mudah terputus. Pengaruh dari tolak-menolak ini akan dibahas lebih lanjut pada halaman tentang reaksi-reaksi dari senyawa-senyawa ini dengan halogen. (www.chem-is-try.org/materi_kimia/sifat_senyawa_organik/alkana1/pengantar_alkana_dan_sikloalkana/)
Fungsi alkana Alkana-alkana penting sebagai bahan bakar dan sebagai bahan mentah untuk mensintesis senyawa-senyawa karbon lainnya. Alkana banyak terdapat dalam minyak bumi, dan dapat dipisahkan menjadi bagian-bagiannya dengan distilasi bertingkat. Suku pertama sampai dengan keempat senyawa alkana berwujud gas pada temperatur kamar. Metana biasa disebut juga gas alam yang banyak digunakan sebagai bahan bakar rumah tangga/industri. Gas propana, dapat dicairkan pada tekanan tinggi dan digunakan pula sebagai bahan bakar yang disebut LPG (liquified petroleum gas). Gas butana lebih mudah mencair daripada propana dan digunakan sebagai geretan rokok. Oktana mempunyai titik didih yang tempatnya berada dalam lingkungan bahan bakar motor. Alkana-alkana yang bersuhu tinggi terdapat dalam kerosin (minyak tanah), bahan bakar diesel, bahan pelumas, dan parafin yang banyak digunakan untuk membuat lilin.
(ilmupengetahuan.info/2012/01/14/jenis-ikatan-karbon-alkana.htm)
Anda mungkin juga menyukai
- Pengantar Alkana Dan SikloalkanaDokumen26 halamanPengantar Alkana Dan Sikloalkanaismi adeyaniBelum ada peringkat
- Alkana Dan SikloalkanaDokumen20 halamanAlkana Dan SikloalkanaWigati Nuraeni0% (2)
- Pembuatan Senyawa AlkanaDokumen9 halamanPembuatan Senyawa Alkanarizki raniBelum ada peringkat
- 4.alkana Dan SikloalkanaDokumen10 halaman4.alkana Dan SikloalkanaZishy AjjaBelum ada peringkat
- Kimia Organik: AsetaldehidDokumen19 halamanKimia Organik: AsetaldehidAlif Hidayatullah AminBelum ada peringkat
- Alkena AlkunaDokumen27 halamanAlkena AlkunaMuhammad Fajar AlGhifariBelum ada peringkat
- Pembuatan AlkanaDokumen10 halamanPembuatan AlkanaKimmy AyukawaBelum ada peringkat
- Perbaikan HidrokarbonDokumen11 halamanPerbaikan HidrokarbonAudry JesicaBelum ada peringkat
- ALDEHIDDokumen26 halamanALDEHIDyolandBelum ada peringkat
- Alkana, Alkena, AlkunaDokumen17 halamanAlkana, Alkena, AlkunaLidya Faj'rianti100% (1)
- Aldehid Dan Keton Sebagai Senyawa KarbonilDokumen4 halamanAldehid Dan Keton Sebagai Senyawa KarbonilAdinda NatasyaBelum ada peringkat
- Pembuatan Senyawa AlkanaDokumen14 halamanPembuatan Senyawa AlkanaHilda RBelum ada peringkat
- AKUNADokumen17 halamanAKUNANanang BudiantoBelum ada peringkat
- Aldehid Dan KetonDokumen21 halamanAldehid Dan KetonAtma Ikhtiarsa Putra GintingBelum ada peringkat
- BAB - Aldehid Dan KetonDokumen26 halamanBAB - Aldehid Dan KetonDianIswari100% (2)
- AlkenaDokumen15 halamanAlkenaarnyhrsBelum ada peringkat
- Aldehid Dan KetonDokumen22 halamanAldehid Dan KetonAllensius Karelsta Harefa100% (1)
- AlkanaDokumen6 halamanAlkanaDwika Puspa Wardhani 'Vreundschap'Belum ada peringkat
- Alkana TambahanDokumen11 halamanAlkana TambahanDiah AyuningrumBelum ada peringkat
- HIDROKARBONDokumen10 halamanHIDROKARBONMiko Niko TikoBelum ada peringkat
- Alkana CareyDokumen8 halamanAlkana CareyMalaBelum ada peringkat
- CBR Buku IlaDokumen11 halamanCBR Buku IlaYolanda Yosevina TariganBelum ada peringkat
- Penamaan SikloalkanaDokumen23 halamanPenamaan SikloalkanaMonika PutriBelum ada peringkat
- Fix KimorDokumen41 halamanFix Kimorrahmah nabilahBelum ada peringkat
- AlkanaDokumen12 halamanAlkanaAmaliatul KhusnaBelum ada peringkat
- Makalah AldehidDokumen34 halamanMakalah Aldehidmaulida100% (2)
- AlkanaDokumen6 halamanAlkanaernaBelum ada peringkat
- AlkanaDokumen39 halamanAlkanaDwii 'uwiiq' ApriyantiiBelum ada peringkat
- Alkena Dan AlkunaDokumen10 halamanAlkena Dan AlkunafajarBelum ada peringkat
- Alkana, Alkena Dan AlkunaDokumen28 halamanAlkana, Alkena Dan AlkunaAsrun AckermanBelum ada peringkat
- Aldehid Dan KetonDokumen10 halamanAldehid Dan KetonChilfanny SumantiBelum ada peringkat
- Tugas Remedial KimiaDokumen26 halamanTugas Remedial KimiaKharisma AlifahBelum ada peringkat
- Hidrokabron Beserta Alkana Alkena Alkuna1Dokumen7 halamanHidrokabron Beserta Alkana Alkena Alkuna1Risma Indah ArdiyanaBelum ada peringkat
- Pengertian AlkenaDokumen4 halamanPengertian AlkenaMuhamad Ikhsan NurmansyahBelum ada peringkat
- Kimia OrganikDokumen13 halamanKimia OrganikSaralina SihotangBelum ada peringkat
- ALKENADokumen7 halamanALKENALia N. AyuningtyasBelum ada peringkat
- MKLH KimlngDokumen12 halamanMKLH KimlngRachmat Ardi TamBelum ada peringkat
- Satuan ProsesDokumen106 halamanSatuan ProsesAristy MirandaBelum ada peringkat
- HIDROKArbon JenuhDokumen11 halamanHIDROKArbon JenuhDwi PrayogiBelum ada peringkat
- AlkenaDokumen22 halamanAlkenaErsa Nurul YarizsaBelum ada peringkat
- ALkanaDokumen10 halamanALkanaArdynaApriSapoetriBelum ada peringkat
- Kekhasan Atom Karbon, Hidro Karbon, Alkena, Alkana, AlkunaDokumen7 halamanKekhasan Atom Karbon, Hidro Karbon, Alkena, Alkana, AlkunaFitria Feb.Belum ada peringkat
- Penggolongan Dan TatanamaDokumen20 halamanPenggolongan Dan TatanamaDamainsaBelum ada peringkat
- Diskusi 3 Kimia Organik 1Dokumen23 halamanDiskusi 3 Kimia Organik 1Riva Aprilia KurniawanBelum ada peringkat
- OktanaDokumen13 halamanOktanaMohammad SyarifudinBelum ada peringkat
- Bab 2 SENYAWA HIDROKARBONDokumen37 halamanBab 2 SENYAWA HIDROKARBONraju fredyBelum ada peringkat
- Pengertian Alkana, Deret Homolog, Keisomeran Dan Sifat NyaDokumen14 halamanPengertian Alkana, Deret Homolog, Keisomeran Dan Sifat NyaBang OtBelum ada peringkat
- Materi 3.1 Alkana SikloalkanaDokumen30 halamanMateri 3.1 Alkana SikloalkanaMoonlight SonataBelum ada peringkat
- Kimia OrganikDokumen11 halamanKimia Organikkhoid nur adliBelum ada peringkat
- Materi Senyawa HidrokarbonDokumen12 halamanMateri Senyawa Hidrokarbonmuja dilahBelum ada peringkat
- HIDROKARBONDokumen7 halamanHIDROKARBONSARAH MUZDALIFAHBelum ada peringkat
- Hidrokarbon Tak JenuhDokumen10 halamanHidrokarbon Tak JenuhLuxun GregetBelum ada peringkat
- Sifat AlkanaDokumen7 halamanSifat AlkanaabrarBelum ada peringkat
- Artikel AlkanaDokumen15 halamanArtikel AlkanaMerlitha Puspa DewiBelum ada peringkat
- Tugas Kimia Dasar 1Dokumen7 halamanTugas Kimia Dasar 1Cynthia CynBelum ada peringkat
- Materi Sifat Senyawa Hidrokarbon - Riazul Muna - 190720026Dokumen7 halamanMateri Sifat Senyawa Hidrokarbon - Riazul Muna - 190720026Shahira Salsabilla SalsaBelum ada peringkat
- Penyiapan Bahan Baku CpotbDokumen3 halamanPenyiapan Bahan Baku CpotbAlhamzah Rachmat FadjarBelum ada peringkat
- Lapak UV VisDokumen19 halamanLapak UV VisAlhamzah Rachmat Fadjar0% (1)
- Analisis STP KOPMA (Kopi Mahasiswa)Dokumen3 halamanAnalisis STP KOPMA (Kopi Mahasiswa)Alhamzah Rachmat FadjarBelum ada peringkat
- Pengobatan Entamoeba GingivalisDokumen1 halamanPengobatan Entamoeba GingivalisAlhamzah Rachmat FadjarBelum ada peringkat
- Pemba Has AnDokumen2 halamanPemba Has AnAlhamzah Rachmat FadjarBelum ada peringkat
- PerhitunganDokumen5 halamanPerhitunganAlhamzah Rachmat FadjarBelum ada peringkat
- Tugas Mandiri ToksisitasDokumen4 halamanTugas Mandiri ToksisitasAlhamzah Rachmat FadjarBelum ada peringkat
- Uu Psikotropika 1997Dokumen14 halamanUu Psikotropika 1997Alhamzah Rachmat FadjarBelum ada peringkat
- Mekanisme AntiinflamasiDokumen2 halamanMekanisme AntiinflamasiAlhamzah Rachmat FadjarBelum ada peringkat
- Lapak ElektroforesisDokumen12 halamanLapak ElektroforesisAlhamzah Rachmat FadjarBelum ada peringkat
- PP No. 51 TH 2009 TTG Pekerjaan Kefarmasian PDFDokumen41 halamanPP No. 51 TH 2009 TTG Pekerjaan Kefarmasian PDFILma NafiaBelum ada peringkat
- Undang - Udang Narkotika No.35 THN2009Dokumen92 halamanUndang - Udang Narkotika No.35 THN2009Anugrah Novianti100% (1)
- Analisis Bahan Baku ObatDokumen6 halamanAnalisis Bahan Baku ObatAlhamzah Rachmat FadjarBelum ada peringkat
- Aturan MarkovnikovDokumen31 halamanAturan MarkovnikovAlhamzah Rachmat FadjarBelum ada peringkat
- Retrosintesis Dan DiskoneksiDokumen1 halamanRetrosintesis Dan DiskoneksiAlhamzah Rachmat FadjarBelum ada peringkat
- 3.1.4 IrDokumen1 halaman3.1.4 IrAlhamzah Rachmat FadjarBelum ada peringkat
- PKM-GT Emisi Gas Co2 REVISED Edit Gita Nanda PALING BARUDokumen11 halamanPKM-GT Emisi Gas Co2 REVISED Edit Gita Nanda PALING BARUAlhamzah Rachmat FadjarBelum ada peringkat
- Chitosan IkanDokumen11 halamanChitosan IkanEka Putri AsrialniBelum ada peringkat
- Reaksi Elektrofilik Dan Reaksi NukleofilikDokumen35 halamanReaksi Elektrofilik Dan Reaksi NukleofilikDewi Oetary Balian100% (3)
- Analisis HPLCDokumen3 halamanAnalisis HPLCAlhamzah Rachmat FadjarBelum ada peringkat
- Tujuan PrinsipDokumen10 halamanTujuan PrinsipAlhamzah Rachmat FadjarBelum ada peringkat
- V - Reaksi WarnaDokumen1 halamanV - Reaksi WarnaAlhamzah Rachmat FadjarBelum ada peringkat
- Arti No. Registrasi Obat PDFDokumen4 halamanArti No. Registrasi Obat PDFAlhamzah Rachmat Fadjar75% (4)
- Data Pengamatan Dan Perhitungan BORAKSDokumen2 halamanData Pengamatan Dan Perhitungan BORAKSAlhamzah Rachmat FadjarBelum ada peringkat
- Data Pengamatan Dan Perhitungan BORAKSDokumen2 halamanData Pengamatan Dan Perhitungan BORAKSAlhamzah Rachmat FadjarBelum ada peringkat
- Lapak Analisis Sampel Obat ParacetamolDokumen2 halamanLapak Analisis Sampel Obat ParacetamolAlhamzah Rachmat FadjarBelum ada peringkat
- Pengambilan & Pengujian SampelDokumen3 halamanPengambilan & Pengujian SampelAlhamzah Rachmat FadjarBelum ada peringkat
- A-Karbohidrat & DM KImia Klinik PDFDokumen47 halamanA-Karbohidrat & DM KImia Klinik PDFAlhamzah Rachmat FadjarBelum ada peringkat
- 3.1.4 IrDokumen1 halaman3.1.4 IrAlhamzah Rachmat FadjarBelum ada peringkat
- Paracetamol PDFDokumen17 halamanParacetamol PDFAlhamzah Rachmat FadjarBelum ada peringkat