Bab II Aslee
Diunggah oleh
SISKAHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Bab II Aslee
Diunggah oleh
SISKAHak Cipta:
Format Tersedia
7
BAB II
TINJAUAN PUSTAKA
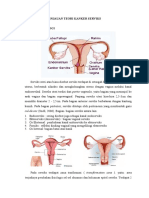
2.1. Anatomi Serviks Uteri
Serviks adalah bagian khusus dari uterus yang terletak di bawah isthmus.
Pada sisi anterior, batas atas serviks, ostium interna letaknya kurang lebih setinggi
lipatan refleksi peritoneum antar uterus dan kandung kemih (Cunningham, 1989).
Serviks adalah bagian dari rahim yang paling sempit, terhubung ke fundus
uteri oleh uterine isthmus. Serviks berasal dari bahasa latin yang berarti leher.
Bentuknya silinder atau lebih tepatnya kerucut. Batas atas serviks adalah ostium
interna. Serviks letaknya menonjol melalui dinding vagina anterior atas. Bagian
yang memproyeksikan ke dalam vagina disebut sebagai portio vaginalis. Rata-rata
ukurannya adalah 3cm panjang dan 2,5cm lebar portio vaginalis. Ukuran dan
bentuk serviks bervariasi sesuai usia, hormon, dan paritas. Sebelum melahirkan,
ostium eksternal masih sempit, hanya berbentuk lingkaran kecil di tengah serviks.
Bagian luar dari serviks menuju ostium eksternal disebut ektoserviks. Lorong
antara ostium eksterna ke rongga endometrium disebut sebagai kanalis
endoservikalis (Julian, 1997).
Pasokan darah dari sekviks berasal dari arteri iliaka internal, yang
membentuk uterine arteri. Serviks dan cabang arteri vagina dari uterus mensuplai
bagian vagina bagian atas (Julian, 1997).
Drainase sistem limfatik dari serviks sangat kompleks yang meliputi nodus
iliaka internal dan eksternal, nodus obturatorius dan parametrial, dan banyak lagi.
Rute utama penyebaran sistem limfatik dari kanker serviks adalah melalui limfatik
pelvis. Maka radikal histerektomi yang dilakukan secara invasif untuk mengobati
kanker serviks meliputi penghapusan sebagian besar sistem limfatik di daerah
pelvis (Anderson, 1991).
Gambar 2.1. Anatomi Serviks Uteri (Sumber : Djamilah, 2012)
Pasokan darah dari sekviks berasal dari arteri iliaka internal, yang
membentuk uterine arteri. Serviks dan cabang arteri vagina dari uterus mensuplai
bagian vagina bagian atas (Julian, 1997).
Bagian- bagian serviks:
a. Endoserviks: sering disebut juga sebagai kanal endoserviks.
b. Ektoserviks (eksoserviks): bagian vaginal serviks
c. Os Eksternal: pembukaan kanal endoserviks ke ektoserviks
d. Forniks: refleksi dinding vaginal yang mengelilingi ektoserviks
e. Os Internal: bagian batas atas kanal
Serviks merupakan bagian bawah uterus yang menonjol ke dalam liang
vagina sebagai porsio vaginalis dan menghubungkan organ ini ke vagina melalui
kanalis servikalis. Ini dibagi atas porsio yang menonjol ke dalam vagina (porsio
vaginalis) dan di atas vagina (porsio supravaginal). Kanalis servikalis yang
bermuara ke dalam uterus adalah orifisium internum, dan yang bermuara ke dalam
vagina adalah orifisium eksternum. Permukaan luar dari porsio vaginalis dikenal
sebagai ektoserviks dan porsio yang berhubungan dengan kanal endoservik adalah
endoservik.
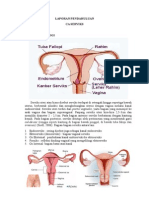
2.1.2. Histologi Serviks
Serviks adalah bagian inferior uterus yang struktur histologinya berbeda dari
bagian lain uterus. Struktur histologi serviks terdiri dari:
a. Endoserviks: Epitel selapis silindris penghasil mukus
b. Serabut otot polos polos hanya sedikit dan lebih banyak jaringan ikat padat
(85%).
c. Ektoserviks: Bagian luar serviks yang menonjol ke arah vagina dan memiliki
lapisan basal, tengah, dan permukaan. Ektoserviks dilapisi oleh sel epitel
skuamos nonkeratin. Pertemuan epitel silindris endoserviks dengan epitel
skuamos eksoserviks disebut taut skuamokolumnar (squamocolumnar
junction, SCJ). Epitel serviks mengalami beberapa perubahan selama
perkembangannya sejak lahir hingga usia lanjut. Sehingga, letak taut
skuamokolumnar ini juga berbeda pada perkembangannya, yaitu:
1) Saat lahir, seluruh serviks yang terpajan dilapisi oleh epitel skuamos.
2) Saat dewasa muda, terjadi pertumbuhan epitel silindris yang melapisi
endoserviks. Epitel ini tumbuh hingga ke bawah ektoserviks, sehingga
epitel silindris terpajan dan letak taut berada di bawah eksoserviks.
3) Saat dewasa, dalam perkembangannya terjadi regenerasi epitel skuamos
dan silindris. Sehingga epitel skuamos kembali melapisi seluruh
ektoserviks dan terpajan, dan letak taut kembali ke tempat awal.
Area tempat bertumbuhnya kembali epitel skuamos atau tempat antara letak taut
saat lahir dan dewasa muda disebut zona transformasi (Junqueira, 2007).
2.2 Konsep Dasar Kanker
2.2.1 Definisi Kanker
Kanker atau neoplasma ganas adalah penyakit yang ditandai dengan
kelainan siklus sel khas yang menimbulkan kemampuan sel untuk: tumbuh tidak
terkendali (pembelahan sel melebihi batas normal), menyerang jaringan biologis
di dekatnya, bermigrasi ke jaringan tubuh yang lain melalui sirkulasi darah atau
sistem limfatik, disebut metastasis. Tiga karakter ganas inilah yang membedakan
kanker dari tumor jinak. Sebagian besar kanker membentuk tumor, tetapi beberapa
tidak, seperti leukemia. Kanker dapat menyebabkan banyak gejala yang berbeda,
10
bergantung pada lokasi dan karakter keganasan, serta ada tidaknya metastasis.
Kebanyakan kanker menyebabkan kematian (Kufe, et al, 2003).
2.2.2 Proses Karsinogenesis
Karsinogenesis pada manusia adalah sebuah proses berjenjang sebagai
akibat paparan karsinogen yang sering dijumpai dalam lingkungan, sepanjang
hidup, baik melalui konsumsi, maupun infeksi. Keturunan (genetik) merupakan
salah satu faktor penting dalam pembentukan kanker. Adanya faktor genetik
dalam pembentukan kanker ini adalah mutasi DNA yang memang diturunkan dari
orangtua kepada anaknya, akan tetapi tidak semua jenis kanker dapat diturunkan.
hal tersebut dipengaruhi oleh letak mutasi pada DNA yang dialami dan juga
genotipe dari mutasi yang terjadi (Kufe, et al, 2003).
Perubahan sel normal menjadi sel kanker melalui 3 tahap yaitu tahap
inisiasi, promosi dan progesi. Pada tahap inisiasi, terdapat faktor inisiator yang
memulai pertumbuhan sel yang abnormal seperti radiasi, bahan kimia mutagenic,
virus, mutasi spontan. Pada tahap promosi dipicu oleh promoter seperti tumor
promoter, growth factor, dan virus sehingga terbentuk sel-sel yang polimorfis dan
anaplastik. Pada tahap progresi ditandai dengan adanya invasi sel ganas ke
membran basalis atau kapsul (Sjamsuhidayat, 1997).
2.2.3 Mutasi Gen
Mutasi adalah perubahan materi genetik yang dapat diwariskan dan
memunculkan berbagai bentuk alternatif dari gen yang disebut sebagai allele.
Mutasi yang terjadi pada DNA didalam gen yang meregulasi siklus sel akan
mengakibatkan penyimpangan yang berdampak pada pembentukan kanker atau
karsinogenesis (McKelvey et al., 2003).
Berbagai mutasi dapat saja terjadi sepanjang kehidupan sel oleh bahan yang
bersifat karsinogen. Satu sel dapat saja mengalami mutasi beberapa kali sehingga
akhirnya sel tersebut menjadi abnormal dan berproliferasi tanpa kendali atau
kontrol dari tubuh. Mutasi yang dialami oleh sel dapat berupa point mutation,
translokasi, amplifikasi gen, dan delesi (Nott et al., 2008).
Ada 2 macam letak mutasi yang memicu terbentuknya kanker, yaitu mutasi
pada gen-gen onkogen dan mutasi pada gen-gen pensupresi tumor. mutasi pada
11
gen pensupresi tumor yang biasanya memicu penurunan kanker disebabkan
karena zigot yang mengalami mutasi pada gen onkogen biasanya tidak dapat
bertahan hidup sehingga tidak dapat diturunkan (Kufe, et al, 2003).
2.2.4 Onkogen
Onkogen adalah gen yang berkaitan dengan terjadinya transformasi
neoplastik. Onkogen ini berasal dari proto-onkogen yang mengalami mutasi.
Proto-onkogen adalah gen-gen normal yang mengatur dan mengontrol
pertumbuhan sel yang akan memproduksi protein. Protein yang diproduksi ini
mempunyai efek biologi, seperti gen yang memproduksi reseptor faktor
pertumbuhan (growth factor receptor), non receptor kinase, signal tranducer,
transcription factor, dan nuclear protein (Kufe, et al, 2003).
2.2.5 Apoptosis
Apoptosis adalah kematian sel terprogram yang terjadi baik pada beberapa
proses fisiologik maupun proses neoplasma. Penumpukan sel pada neoplasma
tidak hanya terjadi sebagai akibat aktifasi gen perangsang pertumbuhan atau tidak
aktifnya gen penekan tumor, tetapi juga oleh gen perangsang dan gen penghambat
apooptosis (Carolyn, 2005).
Apoptosis terjadi melalui dua jalur utama yaitu, jalur ekstrinsik atau Death
Reseptor (DR) dan jalur instrinsik atau jalur mitokondria. Apoptosis dan gen yang
mengontrol mempunyai efek besar pada fenotip keganasan. Gangguan pada
program apoptosis akan menyebabkan kematian sel (Carolyn, 2005).
2.3. Kanker Serviks
2.3.1. Definisi Kanker Serviks
Kanker serviks adalah tumor ganas primer yang berasal dari sel epitel
skuamosa. Kanker serviks merupakan kanker yang terjadi pada serviks atau leher
rahim, suatu daerah pada organ reproduksi wanita yang merupakan pintu masuk
ke arah rahim, letaknya antara rahim (uterus) dan liang senggama atau vagina
(Notodiharjo, 2002). Kanker serviks biasanya menyerang wanita berusia 35 55
tahun. Sebanyak 90% dari kanker serviks berasal dari sel skuamosa yang melapisi
12
serviks dan 10% sisanya berasal dari sel kelenjar penghasil lendir pada saluran
servikal yang menuju ke rahim.
2.3.2. Etiologi Kanker Serviks
Munoz (2003) menyatakan dengan jelas bahwa HPV merupakan penyebab
utama kanker serviks. Pada 90,7% sampel penderita kenker serviks ditemukan
DNA HPV. Komponen DNA virus HPV telah terdeteksi dalam lebih dari 90%
Lesi Intarepitel Skuamosa (LIS) dan karsinoma serviks uteri invasive
dibandingkan dengan persentase yang lebih rendah didapat pada kontrol (Garcia,
2007).
Lebih dari 80 tipe HPV telah ditemukan, dan sekitar 40 tipe dapat
menginfeksi saluran genitalia (Munoz, 2003). Tipe HPV yang menginfeksi saluran
genitalia dapat dibedakan menjadi tipe risiko-rendah, yang banyak ditemukan
pada penyakit kutil genitalis, dan tipe resiko-tinggi yang biasanya berasosiasi
dengan kejadian karsinoma sekviks uteri. Adapaun HPV ganitalis yang
merupakan tipe risiko-tinggi adalah HPV tipe 16, 18, 31, 33, 35, 39, 45, 51, 52,
56, 58, 59, 68, 73, dan 82. Sedangkan HPV tipe 26, 53, dan 66 diduga
karsinogenik (Munoz, 2003).
2.3.4. Faktor Risiko Kanker Serviks
Menurut Diananda (2007), faktor yang mempengaruhi kanker serviks yaitu:
1.
Usia > 50 tahun mempunyai risiko tinggi terhadap kanker serviks.
Semakin tua usia seseorang, maka semakin meningkat risiko terjadinya
kanker serviks. Meningkatnya risiko kanker serviks pada usia lanjut
merupakan gabungan dari meningkatnya dan bertambah lamanya waktu
pemaparan terhadap karsinogen serta makin melemahnya sistem kekebalan
tubuh akibat usia.
2.
Usia pertama kali menikah. Menikah pada usia 20 tahun dianggap terlalu
muda untuk melakukan hubungan seksual dan berisiko terkena kanker leher
13
rahim 10-12 kali lebih besar daripada mereka yang menikah pada usia > 20
tahun. Hubungan seks idealnya dilakukan setelah seorang wanita benar-benar
matang. Ukuran kematangan bukan hanya dilihat dari sudah menstruasi atau
belum. Kematangan juga bergantung pada sel-sel mukosa yang terdapat di
selaput kulit bagian dalam rongga tubuh. Umumnya sel-sel mukosa baru
matang setelah wanita berusia 20 tahun ke atas. Jadi, seorang wanita yang
menjalin hubungan seks pada usia remaja, paling rawan bila dilakukan di
bawah usia 16 tahun. Hal ini berkaitan dengan kematangan sel-sel mukosa
pada serviks. Pada usia muda, sel-sel mukosa pada serviks belum matang.
Artinya, masih rentan terhadap rangsangan sehingga tidak siap menerima
rangsangan dari luar. Termasuk zat-zat kimia yang dibawa sperma. Karena
masih rentan, sel-sel mukosa bias berubah sifat menjadi kanker. Sifat sel
kanker selalu berubah setiap saat yaitu mati dan tumbuh lagi. Dengan adanya
rangsangan, sel bisa tumbuh lebih banyak dari sel yang mati, sehingga
perubahannya tidak seimbang lagi. Kelebihan sel ini akhirnya bisa berubah
sifat menjadi sel kanker. Lain halnya bila hubungan seks dilakukan pada usia
di atas 20 tahun, dimana sel-sel mukosa tidak lagi terlalu rentan terhadap
perubahan.
3.
Wanita dengan aktivitas seksual yang tinggi, dan sering berganti-ganti
pasangan. Berganti-ganti pasangan akan memungkinkan tertularnya penyakit
kelamin, salah satunya Human Papilloma Virus (HPV). Virus ini akan
mengubah sel-sel di permukaan mukosa hingga membelah menjadi lebih
banyak dan tidak terkendali sehingga menjadi kanker.
4.
Penggunaan antiseptik. Kebiasaan pencucian vagina dengan menggunakan
obat-obatan antiseptik maupun deodoran akan mengakibatkan iritasi di
serviks yang merangsang terjadinya kanker.
5.
Wanita yang merokok. Nikotin, mempermudah semua selaput lendir selsel tubuh bereaksi atau menjadi terangsang, baik pada mukosa tenggorokan,
paruparu, maupun serviks. Namun tidak diketahui dengan pasti berapa
banyak jumlah nikotin yang dikonsumsinya bias menyebabkan kanker leher
14
rahim. Risiko wanita perokok terkena 4-13 kali lebih besar dibandingkan
wanita bukan perokok.
6.
Riwayat penyakit kelamin seperti kutil genitalia. Wanita yang terkena
penyakit akibat hubungan seksual berisiko terkena virus HPV, karena virus
HPV diduga sebagai penyebab utama terjadinya kanker leher rahim sehingga
wanita yang mempunyai riwayat penyakit kelamin berisiko terkena kanker
leher rahim.
7.
Paritas (jumlah kelahiran). Semakin tinggi risiko pada wanita dengan
banyak anak, apalagi dengan jarak persalinan yang terlalu pendek. Dari
berbagai literatur yang ada, seorang perempuan yang sering melahirkan
(banyak anak) termasuk golongan risiko tinggi untuk terkena penyakit kanker
serviks. Dengan seringnya seorang ibu melahirkan, maka akan berdampak
pada seringnya terjadi perlukaan di organ reproduksinya yang akhirnya
dampak dari luka tersebut akan memudahkan timbulnya Human Papilloma
Virus (HPV) sebagai penyebab terjadinya penyakit kanker serviks.
8.
Penggunaan kontrasepsi oral dalam jangka waktu lama. Penggunaan
kontrasepsi oral yang dipakai dalam jangka lama yaitu lebih dari 4 tahun
dapat meningkatkan risiko kanker serviks 1,5 2,5 kali. Kontrasepsi oral
mungkin dapat meningkatkan risiko kanker serviks karena jaringan leher
rahim merupakan salah satu sasaran yang disukai oleh hormon steroid
perempuan. Hingga tahun 2004, telah dilakukan studi epidemiologis tentang
hubungan antara kanker serviks dan penggunaan kontrasepsi oral. Meskipun
demikian, efek penggunaan kontrasepsi oral terhadap risiko kanker serviks
masih kontroversional. Sebagai contoh, penelitian yang dilakukan oleh
Khasbiyah (2004) dengan menggunakan studi kasus kontrol. Hasil studi tidak
menemukan adanya peningkatan risiko pada perempuan pengguna atau
mantan
pengguna
kontrasepsi
oral
karena
hasil
penelitian
tidak
memperlihatkan hubungan dengan nilai p > 0,05.
2.3.5. Patogenesis Kanker Serviks
Kausa utama karsinoma serviks adalah infeksi virus Human Papilloma yang
onkogenik. Risiko terinfeksi HPV sendiri meningkat setelah melakukan aktivitas
15
seksual. Pada kebanyakan wanita, infeksi ini akan hilang dengan spontan. Tetapi
jika infeksi ini persisten maka akan terjadi integrasi genom dari virus ke dalam
genom sel manusia, menyebabkan hilangnya kontrol normal dari pertumbuhan sel
serta ekspresi onkoprotein E6 atau E7 yang bertanggung jawab terhadap
perubahan maturasi dan differensiasi dari epitel serviks (WHO, 2008). Menurut
Budiningsih (2007) dalam Sawono (2007), lokasi awal dari terjadinya karsinoma
serviks biasanya pada atau dekat dengan pertemuan epitel kolumner di
endoserviks dengan epitel skuamous di ektoserviks atau yang juga dikenal dengan
squamocolumnar junction. Terjadinya karsinoma serviks yang invasif berlangsung
dalam beberapa tahap. Tahapan pertama dimulai dari lesi pre-invasif, yang
ditandai dengan adanya abnormalitas dari sel yang biasa disebut dengan displasia.
Displasia ditandai dengan adanya anisositosis (sel dengan ukuran yang
berbedabeda), poikilositosis (bentuk sel yang berbeda-beda), hiperkromatik sel,
dan adanya gambaran sel yang sedang bermitosis dalam jumlah yang tidak biasa.
Displasia ringan bila ditemukan hanya sedikit sel-sel abnormal, sedangkan jika
abnormalitas tersebut mencapai setengah ketebalan sel, dinamakan displasia
sedang. Displasia berat terjadi bila abnormalitas sel pada seluruh ketebalan sel,
namun belum menembus membrana basalis. Perubahan pada displasia ringan
sampai sedang ini masih bersifat reversibel dan sering disebut dengan Cervical
Intraepithelial Neoplasia (CIN) derajat 1 2. Displasia berat (CIN 3) dapat
berlanjut menjadi karsinoma in situ. Perubahan dari displasia ke karsinoma in situ
sampai karsinoma invasif berjalan lambat (10 sampai 15 tahun). Gejala pada CIN
umumnya asimptomatik, seringkali terdeteksi saat pemeriksaan kolposkopi.
Sedangkan pada tahap invasif, gejala yang dirasakan lebih nyata seperti
perdarahan intermenstrual dan post koitus, discharge vagina purulen yang
berlebihan berwarna kekuning-kuningan terutama bila lesi nekrotik, berbau dan
dapat bercampur dengan darah , sistisis berulang, dan gejala akan lebih parah pada
stadium lanjut di mana penderita akan mengalami cachexia, obstruksi
gastrointestinal dan sistem renal (Edianto, 2006).
16
2.3.6. Patologi dan Stadium Kanker Serviks
Kanker serviks timbul di T-Zone atau Squamous-Collumnar Junction (SCJ)
yaitu daerah peralihan epitel skuamosa yang terdapat di ektoserviks (porsio)
menjadi epitel kolumnar yang terdapat di endoserviks. Serviks yang normal,
secara alami mengalami proses metaplasia (erosion) akibat saling desakmendesanya kedua jenis epitel yang melapisi. Dengan masuknya mutagen, porsio
yang mengalami metaplasia fisiologik dapat berubah menjadi patologik
(displastik-diskariotik). Penyakit ini diawali oleh lesi prakanker, yang disebut juga
neoplasia interepitel serviks/NIS (Cervical Intraephitelial Neoplasia/CIN) dengan
tingkatan NIS-I, II, III, dan KIS (karsinoma in situ). Periode dari NIS-I sampai
dengan KIS disebut periode laten atau fase prainvasif yang masih mengalami
regresi spontan dengan atau tanpa pengobatan. Namun bila lesi sudah menjadi
mikro invasive atau invasive, proses keganasan akan terus berlanjut (Mardjikoen,
2007).
Staging karsinoma seviks merunut pada sistem klasifikasi dari FIGO
(Federation of Gyenaecologic and Obstetrics) tahun 2000 dilihat berdasarkan
lokasi tumor primer, ukuran besar tumor, dan adanya penyebaran keganasan (table
2.1) oleh Sulaini (2006) dalam Sarwono (2007). Staging ini dibuat untuk
mempermudah perencanaan terapi yang efektif dan optimal bagi pasien dan
memperkirakan prognosis pasien.
Table 2.1 Pembagian Stadium Kanker Serviks berdasarkan FIGO
Stadium FIGO %
Tumor utama tidak bisa diperiksa
Tidak ada bukti tentang tumor utama
Karsinoma prainvasif
Kategori
5-year
TNM
survival
Tx
T0
Tis
1A
Karsinoma terbatas pada kandungan
T1
Karsinoma serviks berdasar pemeriksaan T1a
1A1
mikroskopis
Invasi stroma dengan kedalaman 3,00 mm
dan invasi horizontal 7,00mm
T1a1
90-95%
17
1A2
Invasi stroma >3,00 mm dan 5,00 dengan
T1a2
suatu invasi horizontal 7,00 atau lebih
1B
sedikit
Tampak lesi secara klinis, terbatas pada
T1b
80-85%
serviks, atau lesi mikrokopis yang lebih
1B1
1B2
2
besar dari 1A1/1A2
Lesi < 4,00 mm
Lesi > 4,00 mm
T1b1
T1b2
Tumor invasif di luar kandungan, tapi tidak
T2
sampai dinding panggul atau sepertiga
2A
2B
3
bawah vagina
Tanpa invasi ke parametrium
Dengan invasi ke parametrium
Tumor meluas ke dinding panggul dan atau
T2a
T2b
T3
50-65%
40-50%
25-30%
melibatkan sepertiga bawah vagina dan atau
menyebabkan hidronefrosis
atau tidak berfungsinya ginjal
3A
Tumor melibatkan sepertiga bawah vagina
T3a
tanpa perluasan ke dinding panggul
3B
Tumor meluas ke dinding panggul dan atau
T3b
menyebabkan hidronefrosis atau tidak
berfungsinya ginjal
Tumor meluas ke luar pelvis atau secara
T4
<5%
klinis melibatkan mukosa kandung kemih
4A
dan atau rektum
Tumor invasi ke mukosa kandung kemih
T4a
atau rektum dan atau meluas di luar tulang
4B
panggul
Metastasis jauh
T4b
2.3.7. Gambaran Klinis Kanker Serviks
Kanker serviks umumnya tidak memunculkan gejala hingga sel-sel serviks
yang abnormal dan mengganas mulai menginvasi jaringan sekitar (American
Cancer Society, 2007). Gejala yang pertama muncul adalah perdarahan
pervaginam yang abnormal, biasanya setelah melakukan hubungan seksual
(Garcia, 2007). Selain itu, dapat pula terjadi perdarahan spontan yang terjadi di
antara dua siklus menstruasi (instrumenstrual bleeding) dan perdarahan pada
18
wanita yang sudah menopause (postmenopausal bleeding) (Pitkin, 2003). Secret
vagina berwarna kekuningan dan berbau busuk juga ditemukan, khususnya pada
pasien dengan nekrosis jaringan yang lama (Randall, 2005).
Perdarahan spontan saat defekasi dapat pula ditemukan. Hal ini terjadi
akibat tergesernya tomur eksofitik dari serviks oleh skibala. Adanya perdarahan
abnormal pervaginam saat devekasi perlu dicurigai kemungkinan adanya
karsinoma serviks uteri tingkat lanjut (Mardjikoen, 2007). Gejala-gejala hematuria
atau perdarahan per-rektal timbul bila tumor sudah menginvasi vesika urinaria
atau rektum. Jika terjadi perdarahan kronik, maka penderita akan mengalami
anemia, kehilangan berat badan, lelah dan gejala konstitusional lainnya (Randall,
2005).
Pasien dapat mengeluhkan nyeri yang hebat. Nyeri dapat dirasakan saat
pasien melakukan hubungan seksual. Nyeri di pelvik atau di hipogastrium dapat
disebabkan oleh tumor yang nekrotik atau radang panggul. Bila muncul nyeri di
daerah lumbosakral maka dapat dicurigai terjadi hidronefrosis atau penyebaran ke
kelenjar getah bening yang meluas ke akar lumbosakral. Nyeri di epigastrium
timbul bila penyebaran mengenai kelenjar getah bening yang lebih tinggi
(Randall, 2005).
Pada pemeriksaan fisik dapat terlihat lesi pada daerah serviks. Beberapa lesi
dapat tersembunyi di kanal bagian endoserviks, namun dapat diketahui melalui
pemeriksaan bimanual. Semakin lebar diameter lesi maka semakin sempit jarak
antara tumor dengan dinding perlvis (Randall, 2005).
2.3.8. Diagnosa dan Deteksi Dini Kanker Serviks
Deteksi dini kanker serviks secara teratur sangat dianjurkan bagi setiap
wanita, biasanya dimulai tiga tahun setelah wanita aktif secara seksual atau
berusia lebih dari 21 tahun (Zeller, 2007). Selain dari anamnesa dan pemeriksaan
fisik, diperlukan deteksi dini berupa :
1.
Pemeriksaan IVA (Inspeksi Visual dengan Asam Asetat) merupakan
metode inspeksi yang sangat sederhana, murah, nyaman, praktis, dan mudah.
Pemeriksaan ini dilakukan dengan cara mengoleskan larutan asam asetat 3% -
19
5% pada serviks sebelum melakukan inspeksi visual. Pemeriksaan ini disebut
positif bila terdapat area putih (acetowhite) didaerah sekitar porsi serviks.
2.
Pemeriksaan
pap
smear,
merupakan
pemeriksaan
sitologi
untuk
mendeteksi karsinoma serviks uteri. Pemeriksaan ini dilakukan dengan
mengambil contoh sel epitel serviks melalui kerokan dengan spatula khusus,
kemudia hasil kerokan dihapuskan pada kaca objek. Apusan sel pada kaca
obejek tersebut selanjutnya diamati di bawah mikroskop oleh ahli patologi
(American Cancer Society, 2008).
3.
Pemeriksaan DNA, HPV, merupakan suatu ter laboratorium yang dapat
mendeteksi tipe-tipe HPV yang dapat menyebabkan kanker serviks (Zeller,
2007).
Jika diperoleh hasil Pap Smear yang abnormal, maka dibutuhkan beberapa
pemeriksaan tambahan untuk mengkonfirmasi diagnosisi, mengetahui penyebaran
kanker, dan menentukan pilihan pengobatan (Zeller, 2007).
1.
Kolposkopi, merupakan pemeriksaan visual serviks uteri dengan
menggunakan alat optik khusus yang disebut kolposkop. Pemeriksaan ini
dapat mengenali dysplasia maupun karsinoma, baik in situ maupun invasive,
dengan baik (Randall, 2005)
2.
Biopsi, merupakan gold standart dalam menentukan diagnosis kanker
yaitu dengan mengambil sedikit jaringan lesi kemudia diperiksa secara
histopatologik (Zeller, 2007). Jaringan yang diambil harus cukup dalam serta
meliputi beberapa area di empat kuadran serviks dan beberapa area vagina
yang dicurigai (Randall, 2005).
Pemeriksaan visual kandung kemih dan kolon dengan sitoskopi dan protoskopi,
serta pemeriksaan imejing seperti chest X-ray, CT, MRI, dan PET untuk
mengetahui penyebaran dari kanker ke organ-organ sekitar (Zeller, 2007).
2.3.9. Penanganan Kanker Serviks
Pada tingkat klinik (KIS), tidak dibenarkan dilakukan elektrokoagulasi atau
elektrofulgerasi, bedah krio atau dengan sinar laser, kecuali penderitanya masih
muda dan belum memiliki anak. Biopsi kerucut juga bias digunakan baik sebagai
alat dianostik maupun terapi (Mardjikoen, 2007; Pitkin, 2003). Namun, bila
20
penderita sudah cukup tua dan sudah mempunyai cukup pemeriksaan, dapat
dilakukan histerektomi sederhana untuk mencegah kambuhnya penyakit
(Mardjikoen, 2007).
Pada tingkat klinik Ia, umumnya ditangani sebagai kanker yang invasif. Bila
kedalaman invasif kurang dari atau hanya 1mm dan tidak meliputi area yang luas
serta tidak melibatkan pembuluh limfa atau pembuluh darah, penanganannya
dilakukan seperti pada KIS di atas.
Pada tingkat
Ib dan
IIa dilakukan
histerektomi
radikal
dengan
limfadenektomi. Pasca bedah biasanya dilanjutkan dengan penyinaran, tergantung
ada atau tidaknya sel tumor dalam kelenjar linfa regional yang diangkat. Pada
tingkat IIb, III, dan IV tidak dibenarkan melakukan tindakan bedah, untuk primer
adalah radioterapi. Menurut National Cancer Institute (2008), penanganan
standart untuk tingkat IIb sampai Iva adalah radiasi dan kemoterapi. Pada tingkat
IVb radiasi hanya bersifat paliatif. Pemberian kemoterapi dapat dipertimbangkan,
walaupun belum ada standart kemoterapi yang dapat diberikan.
Untuk mencegah rekuren, umumnya pasien akan menjalani pemeriksaan
rutin yang meliputi perabaan pembesaran kelenjar getah bening supraklavikula,
pemeriksaan rekto-vaginal, dan sitologi setiap 3 4 bulan dalam dua tahun
pertama. Setelah dua tahun, pemeriksaan dapat dilakukan lebih jarang, enam
bulan hingga 5 tahun paska terapi, untuk selanjutnya satu tahun sekali.
2.3.10. Prognosa Kanker Serviks
Faktor-faktor yang mempengaruhi prognosis antara lain unsure penderita,
keadaan umum, tingkat klinik keganasan, ciri-ciri histologik sel tumor,
kemampuan ahli atau tim ahli yang menangani, serta sarana pengobatan yang ada
(Mardjikoen, 2007).
Tabel 2.2. Five year survival rate
Stadium
Ia 1
Ia 2
Ib 1
Ib 2
IIa
IIb
Five year survival rate
95,1 %
94,9 %
80,1 %
66,3 %
63,5 %
21
IIIa
IIIb
Iva
Ivb
33,3 %
38,7 %
17,1 %
9,4 %
2.3.11. Rekurensi Kanker Serviks
Kanker serviks primer yang telah diterapi lalu dievaluasi selama 3 bulan
untuk melihat respon terapi, setelah itu ditentukan apakah pasien mengalami
remisi atau tidak. Penentuan ini dilakukan berdasarkan pemeriksaan histopatologi
dan klinis. Bila setelah pengobatan (radiasi/operasi) dan pasien dinyatakan remisi
16 kemudian kanker timbul kembali baik secara histopatologis maupun terlihat
secara klinis maka disebut kanker rekuren. Proses rekurensi dapat terjadi lokal
yaitu, bila mengenai serviks, vagina 2/3 atau 1/3 proksimal parametrium, regional
bila mengenai distal vagina/panggul atau organ disekitarnya yaitu rektum atau
vesika urinaria. Metastasis jauh bila timbul jauh di luar panggul (Moeloek, 2006).
Kasus rekurensi umumnya terjadi dalam 2 tahun pertama setelah terapi primer
sehingga diperlukan pengamatan lanjut setiap 3 bulan selama 2 tahun pertama,
kemudian setiap 6 bulan sampai 5 tahun dan 1 tahun sekali sesudahnya (Aziz,
2006; Moeloek, 2006). Rekurensi terutama ditentukan dengan pemeriksaan
histopatologi, akan tetapi pemeriksaan lain tetap dilakukan sebagai prosedur
diagnostik. Pemeriksaan ini meliputi anamnesis, laboratorium, kolposkopi,
radiologik (foto toraks, bone survey/scan, CT Scan atau MRI), sistoskopi, dan
rektoskopi bila ada indikasi (Leitao, 2002).
Kanker serviks dapat timbul kembali karena dipengaruhi oleh beberapa
faktor. Pasien dengan persistensi infeksi HPV memiliki resiko rekurensi sampai 5
kali lebih tinggi dibandingkan dengan pasien tanpa infeksi (Nagai, 2004). Resiko
rekurensi juga meningkat pada wanita yang lebih tua 50 tahun, penderita
stadium lanjut, infeksi HIV, penggunaan modalitas terapi yang berbeda, dan
adanya infiltrasi sel tumor pada batas konisasi endoserviks dan ektoserviks
(Ramchandani, 2007). Sedangkan, pemakaian antiretroviral aktivitas tinggi dapat
menurunkan resiko rekurensi (Robinson, 2001).
22
Kasus rekurensi biasanya memiliki respon imun yang rendah dan penderita
dapat meninggal kurang dari 1 tahun semenjak kekambuhan. Terapi untuk kasus
rekurensi terbatas, belum ada terapi yang benar-benar efektif untuk mengatasinya
(Aziz, 2006; Leitao, 2001). Terapi untuk kasus rekurensi kanker serviks antara
lain kemoterapi atau operasi histerektomi total/histerektomi radikal modifikasi
bila sebelumnya pasien telah menjalani terapi radiasi, dan radiasi atau kemoradiasi
bila sebelumnya pasien telah menjalani terapi operasi. Namun bila rekurensi
terjadi di tempat yang jauh (metastasis) maka dilakukan reseksi atau radiasi bila di
paru, radiasi atau kemoterapi bila di otak, dan hanya kemoterapi bila di
intraabdominal (Moeloek, 2006).
2.3.12. Pencegahan Kanker Serviks
Sebagian besar kanker dapat dicegah dengan kebiasaan hidup sehat dan
menghindari faktor-faktor penyebab kanker meliputi (Dalimartha, 2004) :
1. Menghindari berbagai faktor risiko, yaitu hubungan seks pada usia muda,
pernikahan pada usia muda, dan berganti-ganti pasangan seks.
2. Wanita usia di atas 25 tahun, telah menikah, dan sudah mempunyai anak
perlu melakukan pemeriksaan pap smear setahun sekali atau menurut
petunjuk dokter.
3. Pilih kontrasepsi dengan metode barrier, seperti diafragma dan kondom,
karena dapat memberi perlindungan terhadap kanker leher rahim.
4. Dianjurkan untuk berperilaku hidup sehat, seperti menjaga kebersihan alat
kelamin dan tidak merokok.
5. Memperbanyak makan sayur dan buah segar.
2.4 Konsep Gen p53
2.4.1 Gen p53
Gen p53 merupakan protein yang multi-tasking. Setidaknya ada 3 fungsi
terkait p53 yang utama yaitu dalam hal: siklus sel, cell cycle arrest, dan
apoptosis. Gen p53 adalah tumor suppressor gen yang sering termutasi pada
kanker manusia. Prevalensi mutasi p53 menurut IARC database R7, mutasi
23
tertinggi pada kanker ovary, disusul esofagus, kolorektum, kepala dan leher,
pankreas, lidah, dan kulit (Moko, 2013).
Introduksi p53 mutant pada sel dengan p53 normal menghasilkan
polipeptida p53 berlebihan yang membentuk kompleks dengann p53 normal.
Kompleks polipeptida yang terdiri dari p53 normal dan p53 mutant merupakan
kompleks yang inaktif dan menyebabkan disfungsi p53 sehingga dapat berakibat
terjadinya transformasi sel (Moko, 2013).
Mutasi p53 dapat disebabkan oleh banyak hal antara lain bahan
karsinogenik seperti aflatoksin pada kanker hepar, atau sinar UV pada kanker
kulit. Selain karena mutasi, inaktivasi p53 juga disebabkan akibat pengikatan p53
dengan produk onkogen lain misal protein E6 HPV, protein E1B adenovirus,
protein onkogen virus DNA tumor (antigen T SV40) (Moko, 2013).
2.4.2 Struktur gen p53
Gen p53 merupakan phosphoprotein yang berukuran 53 kD (Kilodalton) dan
berlokasi pada lengan pendek kromosom 17 (17p13.1) dan mengandung 393 asam
amino, 11 exon,dan mempunyai panjang 20 kilobasa. Proteini ini terdiri atas 5
domain yaitu:
a. TAD: N-terminal transcription-activation domain, mengaktivasi faktor
transkripsi, asam amino 1-42.
b. PRD: Proline Rich Domain, residu asam amino 80-94.
c. DBD: Central DNA-Binding Core Domain, mengandung 1 atom Zn dan
beberapa asam amino arginine, residu asam amino 100-300.
d. OD: Homo-Oligomerisation Domain, asam amino 307-355. Tetramerasi
penting untuk aktifasi p53 in-vivo.
e. C-terminal: terlibat dalam regulasi pengikatan DNA pada central domain,
residu asam amino 356-393. (Pines, Gangopadhyay, 1997).
Domain amino-terminal diperlukan untuk kegiatan transactivation dan
berinteraksi dengan berbagai faktor transkripsi termasuk acetyltransferases dan
MDM2 (Murine Double Minute 2, yang pada manusia diidentifikasi sebagai
Hdm2). Daerah yang kaya akan prolin berperan dalam stabilitas p53 yang diatur
oleh MDM2, dimana p53 menjadi lebih rentan terhadap degradasi oleh MDM2
jika terjadi penghapusan. Inti utama dari protein ini terdiri dari domain DNA-yang
24
mengikat diperlukan untuk mengikat DNA-urutan tertentu (urutan konsensus
berisi dua salinan motif 10-bp 5'-PuPuPuC (A/T) - (T/A) GPyPyPy-3 ', dipisahkan
oleh 0-13 bp). Dasar C-terminus p53 juga berfungsi sebagai domain regulasi
negatif, dan juga telah terlibat dalam induksi kematian sel (Ling Bai dan Wei-Guo
Zhu, 2006).
Gambar 2.2. Skema Representasi struktur p53 (dikutip dari Ling Bai dan We i-Guo
Zhu, 2006)
2.4.3 Fungsi Fisiologis p53
Sebagai penekan tumor, p53 sangat penting untuk mencegah proliferasi sel
yang tepat dan menjaga integritas genom serta stres genotoksik. Setelah berbagai
rangsangan intraseluler dan ekstraseluler, seperti kerusakan DNA (dengan cara
radiasi pengion, radiasi UV, penerapan obat sitotoksik atau agen kemoterapi, dan
virus yang menular), heat shock, hipoksia, dan onkogen berlebih, wild type p53
diaktifkan dan muncul sebagai regulator protein penting yang memicu respons
biologis beragam, baik pada tingkat sel tunggal maupun dalam seluruh organisme
(Ling Bai dan Wei-Guo Zhu, 2006).
Gen p53 mempunyai peran utama dalam modulasi transkripsi gen, mengatur
siklus sel, mengaktifkan apoptosis, dan mempertahankan stabilitas genomik. Pada
sel-sel normal, gen p53 bertanggung jawab untuk mem-perbaiki DNA abnormal.
Bila DNA tidak dapat diperbaiki oleh gen p53, gen tersebut memberi sinyal pada
25
sel yang memiliki DNA abnormal untuk melakukan apoptosis. Pada sel-sel
kanker, gen p53 menjadi abnormal dan tidak dapat menyebabkan apoptosis pada
sel-sel abnormal. Diperkirakan 50% hingga 60% kanker pada manusia berkaitan
dengan gen p53 yang bermutasi atau tidak adanya ekpresi p53 (Murjono, 1996).
2.4.4 Pengaturan p53
Gen p53 menjadi aktif dalam menanggapi berbagai tekanan, termasuk
namun tidak terbatas pada kerusakan DNA (yang disebabkan oleh baik UV, IR,
atau bahan kimia seperti hidrogen peroksida), stres oksidatif, syok osmotik,
penipisan ribonucleotide, dan ekspresi onkogen dideregulasi. Aktivasi ini ditandai
dengan dua peristiwa besar. Pertama, paruh protein p53 meningkat drastis,
menyebabkan akumulasi cepat p53 dalam sel stres. Kedua, p53 pasukan
perubahan konformasi harus diaktifkan sebagai regulator transkripsi dalam sel-sel
ini. Peristiwa kritis yang mengarah ke aktivasi p53 adalah fosforilasi domain Nterminal. N-terminal domain aktivasi transkripsi mengandung sejumlah besar situs
fosforilasi dan dapat dianggap sebagai target utama untuk protein kinase
pentransduksi sinyal stres (Schmitt, et al, 2002).
2.4.5 Gen Penekan Tumor (Gen Supresor)
Gen penekan tumor diperlukan untuk mengontrol siklus perkembangbiakan
sel, replikasi DNA dan pembelahan sel. Jika gen supresor ini tidak berfungsi
dengan baik maka perkembangbiakan sel tidak dapat terkendali dan menimbulkan
kanker (Syaifudin, 2007).
Kelainan pada gen supresor ini bersifat resesif artinya baru menimbulkan
tumor bila kedua allele menunjukkan kelainan atau hilang (Pusztai et al., 1996).
Ada beberapa gen yang berperan sebagai supresor, antara lain pada
retinoblastoma (Rb), TP53 (p53),
dan BRC (BRCA1 dan BRCA2), DCC
(Deleted in Cell Colorectal Carsinoma), APC (Adenomatous Polyposis Colli),
WT-1
(Wilms
Tumor-1),
NF-1(Neurofibromatosis
(Neurofibroma-tosis type-2) (Shengli, 2001).
type-1),
dan
NF-2
26
Jika Apoptosis tidak terjadi karena adanya mutasi gen p53 maka sel dapat
berkembang kearah keganasan. Aktivasi protein p53 wild type sebagai tumor
supresor dapat diturunkan atau dihambat oleh protein Mdm2 yang mengakibatkan
terjadinya degredasi dari p53 wild type lebih cepat (Carolyn, 2005).
2.4.6 p53 pathway
Pada checkpoint G1/S, kerusakan DNA dapat memacu cell cycle arrest dan
proses ini adalah p53-dependent. Secara umum, level p53 sel rendah karena
diregulasi negatif oleh mdm2 yang mentarget degradasi p53, namun kerusakan
DNA dapat menginduksi aktivitas p53 dengan cepat.
p53 dikontol oleh mdm2 dan p19ARF. Level protein p53 secara normal
adalah pada konsentrasi rendah di dalam sel. Namun, sekali distimulasi, level
protein secara cepat akan meningkat sepanjang waktu paruhnya, sedangkan level
mRNA relatif tidak berubah, sehingga dapat dibayangkan di sini ada loop umpan
balik negatif di sini. p53 teraktifkan dan kemudian meningkatkan level mdm2.
Mdm2 kemudian menginaktifkan p53 dengan cara mengikat kompleks atau
mendegradasi p53. Jika sel ingin menaikkan level protein p53 maka sel perlu
menghambat mdm2.
Bagaimana sel menghambat mdm2? Itu tergantung pada rangsangan misal
adalah agen perusak DNA (radiasi, UV, obat kemoterapi). DNA damage agent
akan menginduksi aktivasi kinase (seperti ATM dan DNA-PK) yang dapat
memfosforilasi critical residu serin dalam domain Mdm2-binding domain dari
p53.
27
Gambar 2.3. Skematik dari domain p53 termasuk situs modifikasi post translasi
(fosforilasi dan asetilasi) yang terlibat dalam stabilisasi, aktivasi,
atau penekanan.
(Sumber : Giaccia, and Kastan, 1998)
Fosforilasi p53 pada serin-15 dan serin-37 oleh ATM atau protein kinase
lain setelah terjadi kerusakan DNA dapat mencegah ikatan MDM2 dengan p53.
Jadi, ketika p53 terfosforilasi sini (Gambar 3), dia tidak bisa lagi mengikat mdm2.
Kemudian, inilah yang mampu menghilangkan penghambatan p53 dimediasi
mdm2. Mengapa DNA damage agent mengaktifkan p53? Karena jika DNA Anda
rusak, Anda tidak ingin untuk memperbanyak, bukan? Jika Anda melakukannya,
Anda bisa menghasilkan sel sel dengan mutasi yang merusak, yang kemudian
dapat mengakibatkan kanker. Jadi, p53 mengenali ketika sel telah mengalami
kerusakan DNA dan menghentikan siklus sel (cell cycle arrest) sehingga sel dapat
memperbaiki kerusakan (repair), atau dalam banyak kasus, hanya memberitahu sel
untuk bunuh diri (apoptosis), yaitu dengan cara menstimulasi transkripsi gen
seperti p21 dan Bax sehingga siklus sel berhenti atau terjadi apoptosis (Siu et al.,
1999).
28
Gambar 2.4. Onkogen dan DNA damage agent mengaktifkan p53 melalui
mekanisme yang berbeda. p19ARF bertindak sebagai perantara dalam aktivasi
p53 oleh onkogen mitogenik seperti E1A, Ras, c-myc. Sebaliknya, aktivasi p53
karena DNA damage agent melibatkan de novo fosforilasi serin 15 pada domain
p53 (dan residu lainnya) oleh kinase seperti protein kinase DNA-dependent
(DNA-PK) atau produk dari gen ataksia-telangiectasia (ATM).
(Sumber : de Stanchina et al, 1998).
Mekanisme lain untuk menghambat mdm2 adalah dengan onkogen, suatu
protein mutan konstitutif aktif yang terus-menerus memberitahu sel untuk tumbuh
(E1A, Ras, c-Myc). Mengapa onkogen mengaktifkan p53? Sekali lagi, Anda tidak
ingin sel untuk tumbuh tak terkendali, bukan? Jadi, p53 mengenali ketika hal ini
terjadi dan menghentikan siklus sel. Namun, onkogen tidak mengarah pada
pengaktifan ATM atau DNA-PK, pada kenyataannya, onkogen bahkan tidak
mengarah pada fosforilasi p53 pada domain MDM2-binding. Jadi, bagaimana
onkogen menghambat mdm2? Dengan cara menginduksi ekspresi protein supresor
tumor disebut p19ARF.
29
Gambar 2.5. Regulasi p53 dilakukan oleh mdm2 dan p19ARF (alternate reading frame
dari lokus INK4a/ARF (CDKN2A))
(Sumber : Giaccia, and Kastan, 1998)
Oleh karena itulah, mudah di pahami bahwa p53 adalah gen yang paling
sering termutasi pada kanker. Dan dari sini, Anda bisa mengetahui pentingnya gen
ini. Pada sel normal, p53 penting pada kontrol ada kesalahan terjadi, sebagai
contoh kerusakan DNA atau sel terstimulasi oleh onkogen, dan segera
mengentikan siklus sel untuk mencegah sel menjadi kanker. Jadi, jika sel
kehilangan p53, sel akan kehilangan fungsi hanya mutasi p53 termutasi saja yang
ditemukan pada sel kanker, tetapi juga overekspresi mdm2 (yang menghambat
p53), juga hilangnya p19ARF. pada jalur Rb, bahwa p16 p19ARF (alternate
reading yang sama, dan pada ka p19ARF hilang.
Checkpoint selanjutnya terdapat pada fase S yang berfungsi mendeteksi
kerusakan DNA yang direplikasi. Checkpoint pada G2 mencegah inisiasi mitosis
sebelum replikasi DNA selesai. Checkpoint utama dalam fase S/G2/M adalah
Chk1, ketika terdapat kerusakan DNA, protein kinase ATR akan memfosforilasi
Chk1, kemudian Chk1 memfosforilasi Cdc25C pada serin kompleks cycB-Cdk1
yang bertanggung jawab pada progresi fase G Selain itu, Chk1 juga
memfosforilasi Cdc25A yang bertugas mengaktifkan kompleks cycE-Cdk2 dan
30
cycA-Cdk2 yang berperan pada progresi fase S. Dengan difosforilasinya Cdc25A
oleh Chk1, kompleks cyc-Cdk menjadi tidak aktif dan terjadi Sarrest (Xiao et al.,
2003; Beckerman et al., 2009).
Checkpoint yang terakhir, disebut spindle checkpoint, bertugas menjaga
integritas genom menjelang akhir mitosis. Jika terjadi kegagalan pada penempatan
pasangan kromosom pada spindle, akan terjadi mitosis arrest. Pada sel kanker,
checkpoint tidak berfungsi dengan baik dan siklus sel berlangsung tanpa kendali
(Cooper and Hausman, 2004).
2.4.6 Peran p53 dalam Penyakit
Jika gen p53 rusak, penekanan tumor sangat berkurang. Orang-orang yang
mewarisi hanya satu salinan fungsional dari gen p53 kemungkinan besar akan
mengembangkan tumor pada awal masa dewasa, gangguan yang dikenal sebagai
sindrom Li-Fraumeni. Gen p53 juga dapat rusak dalam sel dengan mutagen
(bahan kimia, radiasi, atau virus). Lebih dari 50 persen dari tumor manusia
mengandung mutasi atau penghapusan gean p53. Meningkatkan jumlah p53, yang
awalnya mungkin tampak cara yang baik untuk mengobati tumor atau mencegah
mereka dari penyebaran, dalam kenyataannya bukan metode yang dapat
digunakan pengobatan, karena dapat menyebabkan penuaan dini. Namun,
memulihkan fungsi p53 endogen dapat membuat pertumbuhan sel menjadi normal
(Schmitt et al, 2002).
31
Gambar 2.6. Peran p53 dalam mempertahankan Integritas Genom (Kumar et al., 2007).
2.5 Polimorfisme Genetik
2.5.1 Konsep Polimorfisme
Polimorfisme gen adalah perbedaan sekuen DNA diantara individu,
kelompok atau populasi. Polimorfisme bisa disebabkan mutasi pada basa
nukleotida tunggal atau Single Nucleotide Polymorphisms (SNPs), pengulangan
sekuen, insersi, delesi dan rekombinasi. SNPs adalah suatu mutasi pada basa
nukliotida tunggal yang paling sering menjadi penyebab polimorfisme pada
genom manusia (Nott et al., 2008).
Ada dua tipe substitusi basa nukleotida yang menghasilkan SNPs, yaitu
substitusi transisi antar purin (A,G) atau antar pirimidin (C,T) dan transversi
antara purin dengan pirimidin. SNPs merupakan hasil dari kesalahan pada
replikasi atau perbaikan DNA yang bisa terjadi pada regio ekson maupun intron.
Polimorfisme pada intron atau ekson dapat mempengaruhi pemotongan (spilicing)
intron atau ekson sehingga dapat menyebabkan heterogenisitas pada produk
protein yang dihasilkan. Polimorfisme pada intron atau ekson mempunyai peran
yang signifikan pada perkembangan suatu keganasan (Nott et al., 2008).
32
2.5.2 PCR (Polymerase Chain Reaction)
Polymerase Chain Reaction (PCR), merupakan suatu metode untuk
mengamplifikasi DNA spesifik secara enzimatik dengan menggunakan mediasi
primer. Amplifikasi ini dilakukan secara invitro (di luar sistem biologis). Pada
prinsipnya, mesin PCR memanfaatkan perubahan suhu secara cepat, karena
dengan adanya perubahan suhu tersebut, maka reaksi enzimatik dapat terjadi,
penempelan primer dan bahan baku juga dapat berlangsung (Murray,2003)
PCR digunakan secara luas dalam biologi molekular dan dalam penelitian
penyakit genetik untuk mengidentifikasi gen baru. Selain itu juga, PCR banyak
digunakan dalam bioforensik, pathogen makanan dan lingkungan, analisis
kehalalan jenis dll. Terdapat beberapa tahapan dalam PCR:
a. Tahap denaturasi.
Pada tahap ini, temperatur dinaikan pada suhu mendekati titik didih. Hal ini
dilakukan dengan tujuan double strand DNA akan terpisah sebagian, yang
nantinya berfungsi untuk menyisipkan primer. Waktu yang digunakan biasanya
tidak lama, sehingga memungkinkan DNA untuk dapat kembali ke bentuk double
heliks. DNA kembali lg ke posisi double helix karena adanya ikatan hidrogen
pada masing-masing basa DNA-nya, sehingga dengan penurunan suhu, DNA akan
saling berikatan kembali.
b. Tahap annealing
Ketika suhu diturunkan di sekitar suhu 50-650 C, DNA mulai berikatan
kembali. Pada saat inilah kesempatan dari primer untuk menyerang posisinya,
sehingga akan terbatasi jumlah penempelan dari DNA awal. Suhu annealing ini
berbeda-beda untuk masing-masing proses PCR, ini bergantung pada masingmasing primer yang digunakan.
c. Tahap ekstensi
Tahap ini disebut juga tahap perpanjangan. Dengan bantuan enzim taq
Polymerase, DNA baru disusun dengan menggunakan dNTP sebagai bahan baku.
Taq polymerase ini membutuhkan kation bivalen dalam aktifitasnya, biasanya
menggunaka MgCl2 sebagai ko faktornya (Murray, 2003).
2.5.3 RFLP ( Restriction Fragment Length Polymorphism)
33
Perbedaan sekuens basa nukleotid pada situs pengenalan yang pada
umumnya disebabkan oleh sbstitusi basa tunggal akan menghasilkan pola fragmen
yang berbeda disebut RFLP. Perubahan susunan basa nukleotida akibat suatu
mutasi menyebabkan berubahnya situs pengenalan oleh enzim endonuklease
restriksi yang spesifik. Hal ini dapat mengakibatkan hilangnya suatu situs restriksi
atau terjadi situs retreksi baru. Enzim retreksi tertentu akan memotong DNA
secara spesifik pada DNA normal berdasarkan perbedaan panjang fragmennya.
Teknik RFLP ini berguna untuk diagnosis dan identifikasi variasi atau mutasi pada
DNA inti maupun mitokondria. PCR-RFLP merupakan metoda yang paling umum
untuk identifikasi polimorfisme, tetapi teknik ini mempunyai prosedur yang relatif
lama yang meliputi beberapa tahap yaitu PCR, waktu inkubasi dalam digesti
enzim restriksi tergantung pada suhu optimum tiap-tiap enzim berkisar 1-3 jam
dan visualisasi hasil pemotongan fragmen DNA dengan elektroforesis pada gel
agarose (Wahyono, 2005).
2.5.4 Elektroforesis Gel
Setelah kita mendapatkan sampel DNA yang homogen, yang masing-masing
mengandung segmen identik dari suatu genom dalam jumlah besar, akhirnya kita
perlu untuk mengetahui urutan nukleotida yang lengkap dari gen tersebut.
Caranya adalah dengan menggunakan teknik elektroforesis gel. Elektroforesis gel
memisahkan makromolekul berdasarkan laju perpindahannya melewati suatu gel
dibawah pengaruh medan listrik. Gel ini ditahan oleh pelat kaca dan direndam
dalam larutan aqueous (dengan pelarut air). Elektrode dilekatkan pada kedua
ujung dan diberi tegangan.setiap makromolekul kemudian bermigrasi kearah
elektrode yang bermuatan berlawanan pada laju yang sebagian besar ditentukan
oleh muatan dan ukuran molekulnya. Biasanya beberapa sampel yang berbeda
masing-masing merupakan campuran molekul, dimasukkan secara bersamaan
kedalam lajur majemuk pada gel lempeng (Campbell et al., 2002).
Untuk asam nukleat, laju migrasi-berapa jauh yang ditempuh molekul itu
ketika diberi arus berbanding terbalik dengan ukuran molekulnya. Asam nukleat
membawa muatan negatif (pada gugus fosfat) yang proporsional dengan
panjangnya, tetapi belukar serat polimer didalam gel lebih menghambat fragmen
34
yang lebih panjang dari pada fragmen yang lebih pendek. Gel dalam foto telah
diberi perlakuan setelah elektroforesis dengan pewarna pengikat DNA yang
berpendar merah jambu dibawah cahaya ultraviolet. Pada setiap lajur dapat dilihat
sejumlah pita merah jambu, yanh berkaitan dengan molekul DNA yang berbeda
ukuran. Molekul yang lebih besar bergerak lebih lambat melalui gel ini dan
ditempatkan diarah kanan dalam foto. Pita mengandung fragmen restriksi DNA
restriksi (Campbell et al., 2002).
2.5.6 Polimorfisme Gen p53
Seperti halnya genom manusia secara keseluruhan (di mana lebih 3,1 juta
variasi urutan telah dipetakan, yang merupakan 25-35% dari total perkiraan
SNPs39, 40). Berbagai SNP dan urutan lainnya variasi yang hadir pada lokus
TP53. Sebagian besar dari variasi ini intronic dan dapat dianggap tidak memiliki
kanker yang berhubungan dengan konsekuensi biologis. Beberapa dari
polimorfisme p53 telah dinilai untuk diubah secara biokimia dan atau fungsi
biologis, atau untuk efek pada risiko kanker pada populasi studi.
Lebih dari 90% dari polimorfisme di p53 terjadi di urutan bukan pengkode.
Yang paling baik ditandai intronic p53 polimorfisme adalah penyisipan 16
pasangan basa dalam intron 3. Ini adalah satu-satunya polimorfisme intronic yang
telah dikaitkan dengan peningkatan risiko beberapa jenis kanker. Namun,
polimorfisme ini untuk kodon 72 polimorfisme ekson 4 sebagian mungkin
menjelaskan hubungan alel ini dengan kanker. Salah satu studi menunjukkan
bahwa alel ini dikaitkan dengan tingkat yang lebih rendah transkrip p53,
menunjukkan bahwa polimorfisme yang menyebabkan perubahan dalam
pengolahan mRNA, dapat menyebabkan dasar molekuler untuk meningkatkan
risiko kanker (Gati A Goel, 2014).
35
Gambar 2.7. Jalur Loss of Heterozygocity (LOH) pada perkembangan kanker kolon dan
rectum (Sumber : Gati A Goel, 2014).
2.5.7 Polimorfisme Gen p53 terhadap Kanker Serviks
Dalam sel kanker paru-paru, p53 kodon 72 Pro alel yang bermutasi akan
berhubungan dengan peningkatan risiko perkembangan tumor dan kecil
kemungkinan untuk kelangsungan hidup pasien. Dengan demikian, polimorfisme
p53 kodon 72 dapat berkontribusi pada perbedaan antara individu atau kelompok
ras dalam kerentanan dan keparahan penyakit (Katkoori, et.al, 2009).
Polomorfisme letak/restriction fragment length polymorphism (RFLP)
merupakan variasi panjang fragmen pada sekuen DNA yang mengenai 1
nukleotida setiap 200-500 rentang pasang basa. Salah satu bentuk dari RFLP
adalah SNP yang menjadi penanda genetic dalam meneliti suatu sifat genetic. Gen
TP53 sering mengalami polimorfisme nukleotida tunggal (SNP) yang merupakan
suatu bentuk dari polimorfisme letak (Kumar, 2012).
Polimorfisme nukleotida tunggal (SNP) di p53 exon 4 kodon 72, baik CGC
(arginin) atau CCC (prolin), terdeteksi HPV pertama dan memainkan peran dalam
pengembangan HPV terkait Status HPV ditentukan baik sebagai HPV negatif,
HPV rendah kanker oleh Storey dan rekan kerja pada tahun 1998.
Beberapa Polimorfisme pada gen wild type telah di identifikasi dan
ditemukan sedikit tiga polimorfisme dari kasus kanker yang dilaporkan, yaitu
duplikasi pada 16bp intron 3, intron 6, dan variasi arginine/prolin pada codon 72
di exon 4.
Studi menggunakan enzim restriksi BstFNI melaporkan bahwa didpatkan
distribusi prolin homozigot (Pro/Pro) sekitar 5,7 % arginine prolin heterozigot
(Arg/Pro) 31,4% dan arginine homozigot (Arg/Arg) 40,0% dengan demikian dapat
36
disimpulkan bahwa prevalensi genotip homozigot arginine lebih tinggi pada
kanker serviks (onrat, 2009).
Gambar 2.6 Gel Elektroforesis gen p53 Arg 72 Pro menggunakan enzimrestriksi
BstU1 marker DNA 100 bp (Doosti, 2011)
AP; Arg/Pro genotype heterozygote ( 199 bp, 113 bp dan 86 bp).
Dalam kasus adenokarsinoma, bahwa protein E6 berisiko tinggi memiliki
selektif untuk diklasifikasikan gen p53 pada kation dibuat untuk di jenis HPV
berisiko tinggi 16 dan 18. Deteksi HPV tipe risiko tinggi dan rendah yang
menyertai jenis arginine dan individu yang arginin sejenis dilikasikan dengan PCR
dan SHARP Signal Sistem ELISA berbasis adalah 7 kali lebih rentan untuk
mengembangkan HPV terkait Singkatnya, rendah atau berisiko tinggi tertentu
RNA hibridisasi untuk kanker. Hubungan ke SCC serviks adalah hubungan dalam
(Katkoori, et.al, 2009).
Human Papilloma Virus sangat mudah beradaptasi pada jaringan seperti
pejamu seperti sel epitel atau mukosa yang masih berdeferensiasi; hal itu terjadi
karena menggunakan mesin selular yang ada pada sel sel pejamu untuk
kepentingannya. Siklus virus bermula ketika partikel virus mencapai lapisan basal
epitel untuk berikatan dan kemudian memasuki sel melalui celah luka (mikro
trauma) yang bias terjadi setelah melakukan hubungan seksual. Proses replikasi
yang terjadi di dalam epitel dapat dibagi menjadi dua bagian.pertama terjadi
37
replikasi dalam jumlah yang rendah yang mencapai 100, kondisi ini dipertahankan
untuk beberapa periode waktu di dalam sel sel yang terinfeksi, sel sel yang
kompeten. Protein virus E1 dan E2 mempunyai peran penting untuk proses diatas.
Kondisi persisten ini dipertahankan oleh system imun pada status tersebut. Kedua,
setelah lapisan basal didorong menjadi lapisan suprabasal, sel akan kehilangan
kemampuan untuk membelah diri dan masuk ke program diferensiasi. Virus ini
akan bereplikasi didalam kompartemen dan dilepas disekelilingnya akibat
konsekuensi perubahan alamiah apada lapisan superfisial (Dwipoyono, 2007).
Molekul molekul yang penting pada proses replikasi adalah protein
virus E6 dan E7 yang akan berinteraksi dengan sejumlah protein protein selular
lainnya. hasil interaksi ini akan menginduksi hasil proses proliferasi, imortalisasi,
dan tarnsformasi kearah keganasan. Interaksi yang sudah dikenal adalah iteraksi
antara protein E6 dan E7 dengan Prb DAN p53 terhadap kontrol proses siklus sel,
ikatan E7 dengan pRB akan mengaktifkan yang akan merangsang ekspresi protein
yang penting untuk replikasi DNA. Fase - S yang tidak terjadwal
akan
mendorong terjadinya proses apoptosis akibat aksi p53, pada sel sel yang
terinfeksi, proses tersebut akan dihambat oleh protein E6 yang mempunyai target
mendegradasi p53. Sebagai konsekuensinya kontrol siklus sel yang dependen
akan hilang dan diferensiasi keratinosit akan terhambat. Aktifitas E6 dan E7 virus
yang terus menerus akan mendorong terjadinya peningkatan instabilitas genomik,
akumulasi mutasi onkogen, kehilangan control pertumbuhan sel dan akhirnya
memicu terjadinya kanker, selama proses perkembangan tumor, genom virus akan
berintegrasi pada kromosom pejamu, dengan protein E6 dan E7 yang menetap
melalui mRNA akibat dipengaruhinya struktur kromatin atau hilangnya regulasi
negative dari proses transkripsi (Dwipoyono, 2007).
HPV yang merupakan faktor inisiator dari kanker serviks yang
menyebabkan terjadinya terjadinya gangguan sel serviks. Onkoprotein E6 dan E7
yang berasal dari HPV merupakan terjadinya degenerasi keganasan. Integrasi
DNA virus dengan genom sel tubuh merupakan awal dari proses yang mengarah
transformasi. Integrasi DNA virus dimulai pada daerah E1 E2. Integrasi
menyebabkan E2 tidak berfungsi, tidak berfungsinya E2 menyebabkan
38
rangsangan terhadap E6 dan E7 yang akan menghambat p53 dan pRb Hambatan
kedua TSG (Tumor Supressor Gene) menyebabkan siklus sel tidak terkontrol,
perbaikan DNA tidak terjadi, dan apoptosis tidak terjadi. E6 akan mengikat p53
sehingga Tumor Supressor Gene (TSG) p53 akan kehilangan fungsinya yaitu
untuk menghentikan siklus sel pada fase G 1. Sedangkan Onkoprotein E7 akan
mengikat TSG Rb, ikatan ini menyebabkan terlepasnya E2F, yang merupakan
faktor transkripsi sehingga siklus sel berjalan tanpa kontrol(Andrijono, 2007).
Penghentian siklus pada fase G1 oleh p53 bertujuan memberi kesempatan
kepada sel untuk memperbaiki kerusakan yang timbul. Setelah perbaikan selesai
maka sel akan masuk ke fase S. P53 menghentikan siklus sel dengan cara
menghambat kompleks cdk cyclin yang berfungsi merangsang siklus sel untuk
memasuki fase selanjutnya. Jika penghentian sel pada fase G1 tidak terjadi, dan
perbaikan tidak terjadi, maka sel akan terus masuk ke fase S tanpa ada perbaikan.
Sel yang abnormal ini akan terus membelah dan berkembang tanpa kontrol. Selain
itu p53 juga berfungsi sebagai perangsang apoptosis, yaitu proses kematian sel
yang dimulai dari kehancuran gen intrasel. Apoptosis merupakan upaya fisiologis
tubuh untuk mematikan sel yang tidak dapat diperbaiki. Hilangnya fungsi p53
menyebabkan proses apoptosis tidak berjalan (Andrijono, 2007).
2.6 Kerangka Teori
Faktor Sosiodemografi
Faktor Lingkungan
HPV
Umur
Paritas
Menikah
Riwayat Kanker
Polimorfisme Gen
Usia Muda
Serviks
p53 codon 72
Onkoprotein
2
melahirkan
35 tahun
E6 &E7
Tahun
25
Kanker Serviks
Uncontrolled
Inaktivasi
Cell Cycle
TSG
Anda mungkin juga menyukai
- LP Ca UTERIDokumen14 halamanLP Ca UTERIIman Saeful0% (1)
- BAB 1 Anatomi Definisi Epide Kanker ServiksDokumen9 halamanBAB 1 Anatomi Definisi Epide Kanker ServiksAnca ArdiBelum ada peringkat
- Laporan Pendahuluan Ca ServiksDokumen25 halamanLaporan Pendahuluan Ca ServiksAbunabilBelum ada peringkat
- Askep CA ServiksDokumen10 halamanAskep CA ServiksBayu SuryadaniBelum ada peringkat
- Asuhan Keperawatan CA Serviks Stadium 2bDokumen28 halamanAsuhan Keperawatan CA Serviks Stadium 2bEsterBelum ada peringkat
- Asuhan Keperawatan CA Serviks Stadium 2bDokumen28 halamanAsuhan Keperawatan CA Serviks Stadium 2bEsterBelum ada peringkat
- Laporan Pendahuluan CA ServiksDokumen26 halamanLaporan Pendahuluan CA Serviksima dwiBelum ada peringkat
- Askep CA ServiksDokumen9 halamanAskep CA ServiksAan Nak BorneoBelum ada peringkat
- Laporan Pendahuluan CA Serviks FirmaDokumen47 halamanLaporan Pendahuluan CA Serviks FirmaArdie FratamaBelum ada peringkat
- Ahmad Assiddiqy - LP, RKM, Askep, Analisis JurnalDokumen37 halamanAhmad Assiddiqy - LP, RKM, Askep, Analisis JurnalQuotes berkarya WawanBelum ada peringkat
- Laporan Pendahuluan Ca ServiksDokumen24 halamanLaporan Pendahuluan Ca ServiksElaBelum ada peringkat
- Askep CA ServikDokumen43 halamanAskep CA ServikIkhwan Suryah SurmanBelum ada peringkat
- Erosi, Ulkus & Trauma PorsioDokumen18 halamanErosi, Ulkus & Trauma PorsioSOFIA SETIABelum ada peringkat
- Mioma UteriDokumen19 halamanMioma UteriMaria PalanBelum ada peringkat
- Laporan Pendahuluan CA ServiksDokumen10 halamanLaporan Pendahuluan CA ServiksNikenAriskaPrawestiBelum ada peringkat
- Bab 2 ADokumen26 halamanBab 2 ANurul syafiyatul hayatiBelum ada peringkat
- LP Ca Serviks PrintDokumen18 halamanLP Ca Serviks PrintNipri NifreeBelum ada peringkat
- Laporan Kasus Radioterapi Ca CervixDokumen43 halamanLaporan Kasus Radioterapi Ca CervixnurazizahintanBelum ada peringkat
- LP Ca Recti PDFDokumen26 halamanLP Ca Recti PDFVivi SafitriBelum ada peringkat
- Makalah BuliDokumen15 halamanMakalah BuliWinBelum ada peringkat
- Makalah Fitoterapi Kanker ServiksDokumen41 halamanMakalah Fitoterapi Kanker ServiksAndi.Fira100% (1)
- LP Kista OvariumdocxDokumen28 halamanLP Kista OvariumdocxSyaa AisyahBelum ada peringkat
- GinekDokumen22 halamanGinekfersaBelum ada peringkat
- LP Ca ServiksDokumen21 halamanLP Ca ServiksLevito MaitaleBelum ada peringkat
- Laporan Pendahuluan Ca ServiksDokumen20 halamanLaporan Pendahuluan Ca ServiksMuhammad ShofiyuddinBelum ada peringkat
- Askep CA ServiksDokumen5 halamanAskep CA ServiksAnisa RismayantiBelum ada peringkat
- Askep CA Servic 1Dokumen20 halamanAskep CA Servic 1Nurul HidayatiBelum ada peringkat
- Bab IiDokumen23 halamanBab IiEsti Nur EkasariBelum ada peringkat
- Referat Ca CervixDokumen51 halamanReferat Ca Cervixshella mailindriBelum ada peringkat
- LP CA ServiksDokumen28 halamanLP CA ServiksImat TeesBelum ada peringkat
- PM DK 5 Blok 6 2019Dokumen17 halamanPM DK 5 Blok 6 2019Hisyam0% (1)
- CA ServiksDokumen16 halamanCA ServiksLaisah JamalaBelum ada peringkat
- LP OnkologiDokumen16 halamanLP OnkologiDilla Dwi RahmadhaniBelum ada peringkat
- Kasus Seminar - Ca Serviks - EdelwesDokumen70 halamanKasus Seminar - Ca Serviks - EdelwesElisabeth TahaparyBelum ada peringkat
- Ca ServiksDokumen46 halamanCa ServiksPutri NurwidayaningtyasBelum ada peringkat
- 1114098103-3-Bab IiDokumen33 halaman1114098103-3-Bab IiFaisalBelum ada peringkat
- LP Ca Serviks Ydn NewDokumen38 halamanLP Ca Serviks Ydn NewDuwi MardalennyBelum ada peringkat
- LP CA ServiksDokumen26 halamanLP CA ServiksdhiennyBelum ada peringkat
- Referat Ca UteriDokumen29 halamanReferat Ca UteriAnggaBelum ada peringkat
- Makalah Tumor Jinak Dan GanasDokumen14 halamanMakalah Tumor Jinak Dan GanasAstri Lestari LimanBelum ada peringkat
- Laporan Modul Perdarahan KontakDokumen32 halamanLaporan Modul Perdarahan KontakAnonymous L9D1I7DZBelum ada peringkat
- Makalah Ca - Serviks OkeDokumen22 halamanMakalah Ca - Serviks OkeArliangra Duana Putri0% (1)
- Referat Ca UteriDokumen28 halamanReferat Ca UteriAnggaBelum ada peringkat
- Askep Kanker Ovarium PDFDokumen32 halamanAskep Kanker Ovarium PDFvegaabdillahBelum ada peringkat
- NABELLA AYU IMANI - Tugas Ibu Nurhikmah NewDokumen19 halamanNABELLA AYU IMANI - Tugas Ibu Nurhikmah NewNazimatul FitriyahBelum ada peringkat
- LP Ca ServiksDokumen19 halamanLP Ca ServiksIka PurnamasariBelum ada peringkat
- LP Kista OvariumDokumen28 halamanLP Kista OvariumfitriyaniBelum ada peringkat
- LP - Askep - Ca Serviks - Ners M.quraisyDokumen56 halamanLP - Askep - Ca Serviks - Ners M.quraisymuhazzab100% (1)
- Tinjauan Pustaka 2.1 Anatomi Organ Serviks 2.1.1 Uterine CervixDokumen16 halamanTinjauan Pustaka 2.1 Anatomi Organ Serviks 2.1.1 Uterine CervixDeyfa RehadiBelum ada peringkat
- Handout Patologi (Perdarahan Diluar Haid)Dokumen13 halamanHandout Patologi (Perdarahan Diluar Haid)sosya mona sepriantiBelum ada peringkat
- Laporan 2Dokumen47 halamanLaporan 2Dea AnnisaBelum ada peringkat
- LAPORAN PENDAHULUAN Ca Serviks Nessa 059Dokumen11 halamanLAPORAN PENDAHULUAN Ca Serviks Nessa 059Nessa EcaBelum ada peringkat
- Kel 1 Neoplasma Ovarium KistikDokumen42 halamanKel 1 Neoplasma Ovarium KistikSridia Awalia100% (1)
- Laporan Kasus Dan Askep CA Serviks M.rezky AryadieDokumen38 halamanLaporan Kasus Dan Askep CA Serviks M.rezky AryadieRezky Aryadie100% (1)
- BAB 1 & BAB 2 CA Ovarium FIX BARUDokumen12 halamanBAB 1 & BAB 2 CA Ovarium FIX BARURirin abasBelum ada peringkat
- ServixDokumen40 halamanServixayu fitri astutiBelum ada peringkat
- LP CA OvariumDokumen19 halamanLP CA OvariumFivi Jordi RestyanaBelum ada peringkat
- Mikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaDari EverandMikrobiologi Perubatan I: Patogen dan Mikrobiologi ManusiaPenilaian: 2.5 dari 5 bintang2.5/5 (2)
- Mikrobiologi Medis I: Patogen dan Mikrobioma ManusiaDari EverandMikrobiologi Medis I: Patogen dan Mikrobioma ManusiaPenilaian: 4 dari 5 bintang4/5 (11)
- Coronavirus Covid-19. Membela diri. Cara menghindari penularan. Bagaimana melindungi keluarga dan pekerjaan Anda. Diperbarui edisi keempat.Dari EverandCoronavirus Covid-19. Membela diri. Cara menghindari penularan. Bagaimana melindungi keluarga dan pekerjaan Anda. Diperbarui edisi keempat.Penilaian: 5 dari 5 bintang5/5 (2)
- Data Dosen Tetap Pengampu Mata KuliahDokumen5 halamanData Dosen Tetap Pengampu Mata KuliahSISKABelum ada peringkat
- Nama Angkatan XivDokumen3 halamanNama Angkatan XivSISKABelum ada peringkat
- Soal Biomedik Dasar From SiskaDokumen8 halamanSoal Biomedik Dasar From SiskaSISKABelum ada peringkat
- Prinsip Prinsip AskebDokumen41 halamanPrinsip Prinsip AskebSISKABelum ada peringkat
- Tgs Bu Fauziah Imunobiologi Pada Invertebrata, KELOMPOK 2Dokumen11 halamanTgs Bu Fauziah Imunobiologi Pada Invertebrata, KELOMPOK 2SISKABelum ada peringkat
- Makalah Imun OkeDokumen53 halamanMakalah Imun OkeSISKA100% (1)
- Mean Median ModusDokumen22 halamanMean Median ModusSISKABelum ada peringkat