0% menganggap dokumen ini bermanfaat (0 suara)
345 tayangan6 halamanIvp
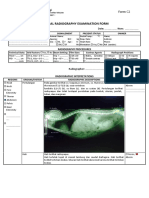
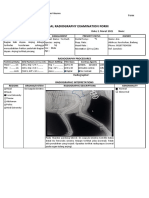
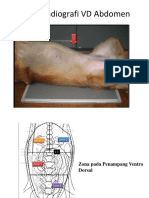
Teks tersebut merupakan laporan praktikum Intravenous Pyelography (IVP) yang menjelaskan prosedur pemeriksaan sistem urinari kucing menggunakan bahan kontras iodin. Prosedur IVP dilakukan dengan menganestesi kucing terlebih dahulu sebelum melakukan pemberian bahan kontras iodin secara intravena dan mengambil gambar radiografi pada menit ke-1, 3, dan 5."
Diunggah oleh
YuutaHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd
0% menganggap dokumen ini bermanfaat (0 suara)
345 tayangan6 halamanIvp
Teks tersebut merupakan laporan praktikum Intravenous Pyelography (IVP) yang menjelaskan prosedur pemeriksaan sistem urinari kucing menggunakan bahan kontras iodin. Prosedur IVP dilakukan dengan menganestesi kucing terlebih dahulu sebelum melakukan pemberian bahan kontras iodin secara intravena dan mengambil gambar radiografi pada menit ke-1, 3, dan 5."
Diunggah oleh
YuutaHak Cipta
© © All Rights Reserved
Kami menangani hak cipta konten dengan serius. Jika Anda merasa konten ini milik Anda, ajukan klaim di sini.
Format Tersedia
Unduh sebagai DOCX, PDF, TXT atau baca online di Scribd