Kimia Fisika Kelarutan Sistem Biner
Diunggah oleh
Al BaihaqiJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kimia Fisika Kelarutan Sistem Biner
Diunggah oleh
Al BaihaqiHak Cipta:
Format Tersedia
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
KELARUTAN TIMBAL BALIK FENOL-AIR
Muhammad Alviean Baihaqi
NPM. 19031010063
Legipson Panjaitan
NPM. 19031010064
Grup J / Sesi III
E-mail : 19031010063@student.upnjatim.ac.id
Abstrak
Larutan merupakan salah satu komponen penting dalam kehidupan. Manusia
sangat bergantung pada larutan untuk memenuhi kebutuhan sehari-hari, baik sebagai
bahan makanan dan minuman maupun kebutuhan primer atau sekunder lainnya. Larutan
adalah campuran dari dua (biner) atau lebih zat yang terdiri dari zat terlarut (solvent)
dan zat pelarut (solute). Larutan mempunyai suatu kemampuan untuk melarutkan suatu
zat yang disebut kelarutan. Selain memiliki kemampuan untuk melarutkan zat, larutan
juga memiliki sifat yang disebut sifat koligatif larutan. Sifat koligatif larutan adalah
sifat suatu larutan yang dipengaruhi oleh zat terlarutnya. Sifat koligatif meliputi
penurunan tekanan uap, penurunan titik beku, kenaikan titik didih, dan tekanan osmotik.
Kata kunci : Sistem biner, kelarutan timbal balik, temperatur kritis
Abstract
Solution is one of the important components in life. Humans are very dependent on the
solution to meet their daily needs, both as food and drink as well as other primary or
secondary needs. Solution is a mixture of two (binary) or more substances consisting of
solute (solvent) and solvent (solute). The solution has the ability to dissolve a substance
called solubility. Besides having the ability to dissolve substances, solutions also have a
property called the colligative nature of the solution. Colligative nature of the solution is
the nature of a solution that is affected by the solute. Colligative properties include a
decrease in vapor pressure, a decrease in freezing, an increase in boiling points, and
osmotic pressure.
Keyword : Binary system, reversible solubility, critical temperature
PENDAHULUAN dalam jumlah maksimum zat terlarut
Kelarutan adalah kemampuan dan yang larut dalam suatu pelarut pada
suatu zat kimia tertentu, zat terlarut kesetimbangan. Zat – zat tertentu dapat
(solute), untuk zat larut dalam suatu larut dalam perbandingan apapun
pelarut (solvent). Kelarutan dinyatakan terhadap suatu pelarut. Kelarutan timbal
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 1
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
balik adalah kelarutan dari suatu larutan Kelarutan bergantung pada jenis zat
yang bercampur sebagian bila terlarut, ada zat yang mudah larut tetapi
temperaturnya di bawah temperatur banyak juga yang sedikit larut.
kritis. Jika mencapai temperatur kritis, Konsentrasi dari larutan jenuh, yaitu
maka larutan tersebut dapat bercampur kelarutan, tergantung pada sifat
sempurna (homogen) dan jika solvent. Kelarutan yang besar terjadi
temperaturnya telah melewati bila molekul-molekul solute mem-
temperatur kritis maka sistem larutan punyai kesamaan dalam struktur dan
tersebut akan kembali dalam kondisi sifat-sifat kelistrikan dari molekul-
bercampur sebagian lagi. Salah satu molekul solvent. Bila ada kesamaan
contoh dari temperatur timbal balik dari sifat-sifat kelistrikan, misalnya
adalah kelarutan fenol dalam air yang momen dipol yang tinggi, antara
membentuk kurva parabola yang solvent-solvent, maka gaya-gaya tarik
berdasarkan pada bertambahnya. Jika yang terjadi antara solute-solvent adalah
temperatur dari dalam kelarutan fenol kuat. Sebaliknya, bila tidak ada
aquadest dinaikkan di atas 50 °C maka kesamaan, maka gaya-gaya tarik solute-
komposisi larutan dari sistem larutan solvent lemah. Secara umum, padatan
tersebut akan berubah. Pada saat suhu ionik mempunyai kelarutan yang lebih
kelarutan mencapai 66 °C maka tinggi dalam solvent polar daripada
komposisi sistem larutan tersebut dalam pelarut non-polar. Juga, jika
menjadi seimbang dan keduanya dapat solvent lebih polar, maka kelarutan dari
dicampur dengan sempurna. Oleh padatan-padatan ionik akan lebih besar.
karena itu, perlunya dilakukan Sifat solut Penggantian solute berarti
percobaan ini mengingat pentingnya pengubahan interaksi-interaksi solute-
memahami konsep kelarutan timbal solute dan solute-solvent. Suhu,
balik sistem biner dalam agar praktikan kelarutan gas dalam air biasanya
dapat mengetahui dan menerapkan menurun jika suhu larutan dinaikkan.
dalam dunia industri. Gelembung-gelembung kecil yang
dibentuk bila air dipanaskan adalah
TEORI kenyataan bahwa udara yang terlarut
Istilah kelarutan digunakan menjadi kurang larut pada suhu-suhu
untuk menyatakan jumlah maksimum yang lebih kecil. Hal yang serupa, tidak
zat yang dapat larut dalam sejumlah ada aturan yang umum untuk perubahan
tertentu zat pelarut atau larutan.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 2
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
suhu terhadap kelrutan cairan-cairan keduanya dapat dicampur dengan
dan padatan-padatan (Sumardjo, 2008). sempurna (Ramadhani, 2018)
Kelarutan Timbal Balik Jenis Larutan
Kelarutan timbal balik adalah Berdasarkan wujud pelarutnya,
kelarutan dari suatu larutan yang larutan dibedakan menjadi tiga macam,
bercampur sebagian bila temperaturnya yaitu larutan cair, larutan padat, dan
di bawah temperatur kritis. Jika larutan gas.
mencapai temperatur kritis, maka a. Larutan cair, adalah larutan yang
larutan tersebut dapat bercampur wujud pelarut (solvent) berupa zat
sempurna (homogen) dan jika cair. Contoh larutan cair antara lain
temperaturnya telah melewati larutan gula, larutan garam, dan
temperatur kritis maka sistem larutan sebagainya.
tersebut akan kembali dalam kondisi b. Larutan padat, adalah larutan yang
bercampur sebagian lagi. Salah satu wujud pelarutnya berupa zat padat.
contoh dari temperatur timbal balik Contoh larutan padat adalah emas
adalah kelarutan fenol dalam air yang 22 karat yang merupakan campuran
membentuk kurva parabola yang homogen antara emas dan perak
berdasarkan pada bertambahnya % atau logam lain.
fenol dalam setiap perubahan c. Larutan gas, adalah larutan yang
temperatur baik di bawah temperatur wujud pelarutnya berupa zat gas.
kritis maupun saat mencapai dan setelah Contoh larutan gas adalah udara
melewati temperatur kritis. Jika yang kita hirup sehari-hari untuk
temperatur dari dalam kelarutan fenol bernafas.
aquades dinaikkan di atas 50 °C, maka Berdasarkan banyak sedikitnya
komposisi larutan dari sistem larutan zat terlarut (solute), larutan dapat
tersebut akan berubah. Kandungan fenol dibedakan menjadi dua macam, yaitu
dalam air untuk lapisan atas akan larutan pekat dan larutan encer.
bertambah lebih dari 11,8% dan a. Larutan pekat, adalah larutan yang
kandungan fenol dari lapisan bawah mengandung relatif lebih
akan berkurang kurang dari 62,6%. banyak solute dibandingkan
Pada saat suhu kelarutan mencapai 66 dengan solvent.
°C maka komposisi sistem larutan b. Larutan encer, adalah larutan yang
tersebut menjadi seimbang dan mengandung relatif lebih
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 3
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
sedikit solute dibandingkan a. Larutan elektrolit adalah jenis
dengan solvent. larutan yang dapat menghantarkan
Berdasarkan zat terlarut dan arus listrik. Contoh larutan
pelarutnya, larutan dibedakan menjadi elektrolit adalah larutan amonia,
sembilan (9) jenis, yakni sebagai larutan HCl, larutan cuka, larutan
berikut. H2SO4, air laut, air kapur dan
a. Larutan gas dalam gas, contohnya: larutan H2S.
udara. b. Larutan nonelektrolit adalah jenis
b. Larutan gas dalam cairan, larutan yang tidak dapat
contohnya: air terkarbonisasi menghantarka arus listrik. Contoh
(CO2 dalam air). larutan nonelektrolit adalah larutan
c. Larutan gas dalam padatan, urea, larutan alkohol, dan larutan
contohnya: Hidrogen dalam logam glukosa.
(platina). Jenis larutan berdasarkan tingkat
d. Larutan cairan dalam gas, kejenuhannya digolongkan menjadi tiga
contohnya: uap air di udara. macam, yaitu larutan tak jenih, larutan
e. Larutan cairan dalam cairan, jenuh dan larutan sangat jenuh.
contohnya: alkohol dalam air (bir). a. Larutan tak jenuh
f. Larutan cairan dalam padatan, Yaitu larutan yang
contohnya: air dalam kayu, air mengandung solute (zat terlarut)
dalam buah-buahan, dan kurang dari yang diperlukan untuk
sebagainya. membuat larutan jenuh. Atau
g. Larutan padat dalam gas, dengan kata lain, larutan yang
contohnya: bau atau aroma. partikel- partikelnya tidak tepat
h. Larutan padat dalam cairan, habis bereaksi dengan pereaksi
contohnya: air gula. (masih bisa melarutkan zat).
i. Larutan padat dalam padatan, Larutan tak jenuh terjadi apabila
contohnya: baja (campuran besi dan bila hasil kali konsentrasi ion < Ksp
karbon). berarti larutan belum jenuh (masih
Jenis larutan berdasarkan dapat larut).
kemampuan menghantarkan arus listrik b. Larutan jenuh
dibedakan menjadi dua macam, yaitu Yaitu suatu larutan yang
larutan elektrolit dan larutan non mengandung sejumlah solute yang
elektrolit. larut dan mengadakan ke-
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 4
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
setimbangan dengan solute padat- antara komponen-komponennya.
nya. Atau dengan kata lain, larutan Contoh dari campuran homogen adalah
yang partikel- partikelnya tepat larutan garam dalam air dan larutan gula
habis bereaksi dengan pereaksi (zat dalam air. Campuran heterogen adalah
dengan konsentrasi maksimal). campuran yang setiap bagiannya tidak
Larutan jenuh terjadi apabila bila sama, baik warna, rasa serta
hasil konsentrasi ion = Ksp berarti perbandingan zat-zat tercampurnya
larutan tepat jenuh. tidak sama dan satu komonen dengan
c. Larutan sangat jenuh (kelewat komponen lainnya terdapat bidng batas,
jenuh) sehingga dapat dibedakan antara zat
Yaitu suatu larutan yang yang terlarut dan pelarutnya. Misalnya.
mengandung lebih Campuran minyak dengan air dan
banyak solute daripada yang campuran kopi dengan air (Tulenan,
diperlukan untuk larutan jenuh. 2019).
Atau dengan kata lain, larutan yang
Fase Dan Wujud
tidak dapat lagi melarutkan zat
Fase adalah keadaan materi yang
terlarut sehingga terjadi endapan.
seragam di seluruh bagiannya, bukan
Larutan sangat jenuh terjadi apabila
hanya dalam komposisi kimianya
bila hasil kali konsentrasi ion > Ksp
melainkan juga dalam keadaan fisiknya.
berarti larutan lewat jenuh atau
Komponen merupakan spesi yang ada
mengendap (Syukri, 1990).
dalam sistem, seperti zat terlarut dan zat
Campuran Homogen Dan Heterogen pelarut dalam larutan biner. Banyaknya
Campuran merupakan materi fase dalam sistem diberi notasi P
yang tersusun oleh dua macam zat atau (Atkins, 1996).
lebih yang tidak terikat secara kimia dan Sering istilah fasa diidentikkan
dapat dipisahkan kembali dengan cara dengan wujud atau keadaan suatu
fisika. Campuran teriri dari dua macam materi, misalnya es berwujud padat, air
yaitu campuran homogen dan berwujud cair atau uap air yang
heterogen. Campuran homogen adalah berwujud gas. Konsep ini tidak benar
campuran yang setiap bagiannya serba karena sistem padatan dan sistem cairan
sama, baik warna, rasa, serta dapat terdiri dari beberapa fasa.
perbandingan zat-zat tercampur juga Sedangkan gas cenderung bercampur
sama, serta tidak memiliki bidang batas sempurna sehingga dalam sistem gas
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 5
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
hanya terdapat satu fasa. Fasa dapat temperatur menyebabkan tidak larut, zat
didefinisikan sebagai setiap bagian tersebut dikatakan bersifat eksoterm,
sistem yang homogen dan dipisahkan karena pada proses kelarutannya
oleh batas yang jelas, sifat fisik dan menghasilkan. Kelima yaitu salting out.
sifat kimia berbeda dari bagian sistem Salting Out adalah peristiwa adanya zat
lain, juga dapat dipisahkan secara terlarut tertentu yang mempunyai
mekanik dari bagian lain sistem itu kelarutan lebih besar dibanding zat
(Hiskia, 1992). utama, akan menyebabkan penurunan
kelarutan zat utama atau terbentuknya
Faktor Yang Memengaruhi
endapan karena ada reaksi kimia.
Kelarutan
Keenam yaitu salting in. Salting in
Faktor-faktor yang
adalah adanya zat terlarut tertentu yang
mempengaruhi kelarutan timbal balik
menyebabkan kelarutan zat utama
meliputi pertama sifat dari solute (zat
dalam solvent menjadi lebih besar.
terlarut) dan solvent (pelarut). Zat
Ketujuh yaitu pembentukan kompleks
terlarut yang sifatnya polar akan mudah
yang merupakan peristiwa terjadinya
larut dalam solvent yang polar pula.
interaksi antara senyawa tak larut
Sedangkan zat terlarut yang nonpolar
dengan zat yang larut dengan
larut dalam solvent yang nonpolar pula.
membentuk garam kompleks (Sinila
Kedua yaitu cosolvensi (zat penambah
2016).
kelarutan). Cosolvensi adalah peristiwa
kenaikan kelarutan suatu zat karena Perhitungan Molaritas, Molalitas,
adanya penambahan pelarut lain atau dan Fraksi Mol Dan Persen Massa
modifikasi pelarut. Ketiga adalah
a. Molaritas
kelarutan. Zat yang mudah larut
Molaritas adalah jumlah mol
memerlukan sedikit pelarut, sedangkan
dalam 1 liter larutan
zat yang sukar larut memerlukan
banyak pelarut. Keempat yaitu
temperatur. Zat padat umumnya Keterangan :
bertambah larut bila suhunya dinaikkan, M = molaritas (M)
zat padat tersebut dikatakan bersifat n = mol zat terlarut (mol)
endoterm karena pada proses V = Volume larutan (ml)
kelarutannya membutuhkan panas.
Beberapa zat yang lain justru kenaikan
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 6
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
b. Molalitas fugasitas dari tiap komponen dalam
Molalitas adalah jumlah mol larutan yang sama dengan hasil kali dari
dalam 1 kg larutan fugasitasnya dalam keadaan murni pada
temperatur dan tekanan yang sama serta
fraksi molnya dalam larutan tersebut
Keterangan :
m = molalitas (m)
Keterangan rumus :
n = mol zat terlarut (mol)
= fugasitas larutan
W = massa larutan (gram)
= fugasitas pelarut murni
c. Fraksi mol
= fraksi mol
Fraksi mol adalah komponen
Sedangkan hubungan antara tekanan
dari suatu larutan atau mol
parsial dan komposisinya dalam larutan
terlarut dalam jumlah mol
merupakan pendekatan dalam hal
larutan
larutan yang mempunyai komponen
tekanan parsial kecil
Keterangan :
Xa = fraksi mol A Keterangan rumus :
na = mol A (mol) = tekanan larutan (atm)
nb = mol B (mol) = tekanan pelarut murni (atm)
d. Persen Massa = fraksi mol larutan
Persen massa (w/w) adalah Potensial kimia dari tiap komponen
perbandingan massa zat terlarut dalam larutan didefinisikan sebagai
dan massa larutan
Keterangan rumus :
= potensial kimia larutan (V)
Keterangan :
%W = Persen Massa = potensial kimia pelarut murni (V)
Wt = Massa zat terlarut (gr) = fraksi mol larutan
W = Massa larutan (gr) T = temperatur (K)
(Chang, 2004) Persamaan tersebut berlaku pada
tekanan dan temperatur yang sama dari
Hukum Raoult larutan tersebut (Dogra, 1990).
Hukum Raoult dalam bentuknya
yang lebih umum didefinisikan sebagai
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 7
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
Jenis Sistem Berdasarkan Komponen Jika hanya ada satu fase, F=2
Dalam system komponen dan P dan T dapat diubah-ubah dngan
tunggal (C =1), tekanan dan bebas. Dengan kata lain, fasa tunggal
temperature dapat diubah secara bebas digambarkan dengan daerah pada
jika hanya ada satu fasa (P = 1). Jika diagram fasa. Jika dua fasa ada dalam
kita mendefinisikan varian F system kesetimbangan, F=1, yang berarti
sebagai banyaknya variable intensif tekanan bukanlah variable bebas jika
yang dapat diubah dengan bebas tanpa kita sudah menentukan temperaturnya.
mengganggu banyaknya fasa yang Jadi, kesetimbangan dua dengan garis di
berada dalam kesetimbangan, dalam diagram fasa. Daripada memilih
maka F =2. Jadi, system itu bi- temperature, kita dapatmemilih tekanan,
varian dan mempunyai dua derajat tetapi dengan pemilihan itu, kedua fasa
kebebasan. Didalam satu perhitungan mencapai kesetimbangan pada
yang paling indah dalam keseluruhan temperature tertentu. Oleh karena itu,
termodinamika kimia, J.W. Gibbs pembekuan (atau transisi fasa yang lain)
menarik kesimpulan tentang aturan fasa, pada temperature tertentu pada tekanan
yang merupakan hubungan umum tertentu
antara varian F, jumlah komponen C, b. System Dua Komponen
dan jumlah fasa pada Jika dua komponen ada dalam
kesetimbangan P untuk suatu system system, C = 2 dan
dengan komposisi sembarang (Atkins, F = 4 – P.....................(10)
1996): Untuk penyederhanaan, kita
F = C – P + 2....................(8) akan membuat supaya tekanan tetap
Akan diketahui bahwa aturan ini (misalkan pada 1 atm),yang berarti
akan mewakili apa yang telah diketahui menghabiskan satu derajat kebebasan,
tentang system satu komponen, dan menuliskan F’ = 3 – P untuk varian
menjelaskan bagaimana aturan ini sisanya. Salah satu sisa derajat
diturunkan dan kemudian kebebasan ini adalah temperature, yang
menerapkannya pada kasus yang lebih lain adalah komposisi (yang dinyatakan
rumit. dengan fraksi mol satu komponen).
a. System satu-komponen Oleh karena itu, kita dapat
Untuk system satu komponen, menggambarkan kesetimbangan fasa
seperti air murni, system pada diagram temperature
F = 3 – P..................(9) komposisi. Garis vertical dalam
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 8
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
diagram mennjukkan system dengan berubah apabila dalam campuran itu
komposisi yang sama, pada temperature ditambahkan salah satu komponen
da, dan disebut dengan isotope (bahasa penyusunnya yaitu fenol atau air. Jika
yunani untuk “jumlah sama”). komposisi campuran fenol air
c. System tiga-komponen dilukiskan terhadap suhu akan diperoleh
Untuk system tiga- kurva sebagai berikut :
komponen, F = 5-P, sehingga variannya
dapat mencapai 4. Dengan menjaga
temperature dan tekanan tetap, masih
ada dua derajat kebebasan (yaitu fraksi
mol dua komponen). Salah satu cara
terbaik untuk memperlihatkan variasi
kesetimbangan fase dengan system
komposisi digunakan diagram fasa Gambar 1. Kurva Komposisi Campuran
segitiga. Fenol-Air
Fraksi mol tiga komponen dari L1 adalah fenol dalam air, L2
system terner (C = 3) sesuai dengan adalah air dalam fenol, XA dan XF
diagram fasa yang digambarkan sebagai masing – masing adalah mol fraksi air
segitiga sama sisi menjamin dan mol fraksi fenol, XC adalah mol
dipenuhinya sifat ini secara otomatis, fraksi komponen pada suhu kritis (TC)
sebab jumlah jarak ke sebuha titik di pada tekanan tetap, yaitu suhu
dalam segitiga sama sisi yang diukur minimum pada saat dua zat bercampur
sejajar dengan sisi-sisinya sama dengan secara homogen dengan komposisi Cc.
panjang sisi segitiga itu., yang diambil Pada suhu T1 dengan komposisi
sebagai satuan panjang (Atkins, 1996). diantara A1 dan B1 atau pada suhu T2
dengan komposisi diantara A2 dan B2.
Sistem Biner Fenol-Air
Sistem berada pada dua fase (keruh).
Sistem biner fenol – air
Sedangkan diluar daerah kurva (atau
merupakan sistem yang memperlihatkan
diatas suhu kritisnya, T0) sistem berada
sifat timbal balik antara fenol – air pada
pada satu fase (jernih). Temperatur atas
suhu tertentu dan tekanan tetap. Disebut
TC adalah temperatur batas atas, kedua
sistem biner karena jumlah komponen
komponen benar – benar bercampur.
campuran terdiri dari dua zat yaitu fenol
Temperatur ini ada gerakan termal yang
dan air. Fenol dan air kelarutannya akan
lebih besar pada kedua komponen.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 9
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
Sistem biner fenol – air tersebut kedua komponen membentuk
merupakan sistem yang memperlihatkan dua fase (Atkins, 1996).
sifat solubilitas timbal balik antara fenol
Campuran Biner Dan Azeotrop
dan air pada suhu tertentu dan tekanan
Ssitem biner terjadi jika dua
tetap. Solubilitas (kelarutan) adalah
komponen ada dalam system, C = 2 dan
kemampuan suatu zat kimia tertentu, zat
F = 4 – P untuk penyederhanaan, kita
terlarut (solute), untuk larut dalam suatu
akan membuat supaya tekanan tetap
pelarut (solvent). Kelarutan dinyatakan
(misalkan pada 1 atm), yang berarti
dalam jumlah maksimum zat terlarut
menghabiskan satu derajat kebebasan,
yang larut dalam suatu pelarut pada
dan menuliskan F’ = 3 – P untuk varian
kesetimbangan. Larutan hasil disebut
sisanya. Salah satu sisa derajat
larutan jenuh. Zat-zat tertentu dapat
kebebasan ini adalah temperature, yang
larut dengan perbandingan apapun
lain adalah komposisi (yang dinyatakan
terhadap suatu pelarut. Contohnya
dengan fraksi mol satu komponen).
adalah etanol di dalam air. Sifat ini
Oleh karena itu, kita dapat
lebih dalam bahasa Inggris lebih
menggambarkan kesetimbangan fasa
tepatnya disebut miscible. Pelarut
system pada diagram temperature
umumnya merupakan suatu cairan yang
komposisi. Garis vertical dalam
dapat berupa zat murni ataupun
diagram mennjukkan system dengan
campuran (Ikawati, 2018)
komposisi yang sama, pada
Temperatur Kritis temperature, dan disebut dengan iso-
Temperatur kritis atas Tc adalah tope (Atkins, 1996).
batas dimana terjadi pemisahan fase. Larutan yang menunjukkan
Diatas temperatur batas atas, kedua suatu maksima atau minima pada alur
komponen benar-benar bercampur. tekanan uapnya menunjukkan suatu
Temperatur ini ada karena gerakan maksima atau minima pada aluran titik
termal yang lebih besar pada kedua didihnya. Bila aluran titik didih
komponen. Beberapa sistem mempunyai suatu maksima atau
memperlihatkan temperatur kritis di minima, larutan yang mempunyai titik
bawah (Temperatur kritis bawah Tk), didih maksimum atau minimum itu
dimana dibawah suhu tersebut kedua disebut azeotrop. Larutan yang
komponen bercampur dalam segala demikian mendestilasi tanpa berubah
perbandingan dan diatas temperatur komposisinya karena cairan dan uapnya
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 10
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
memiliki komposisi yang sama suhunya (T1). Fenol bening didinginkan
(Daniels, 1992). dengan air mengalir sampai kembali
keruh, fenol keruh diukur suhunya (T2).
Aplikasi Kelarutan Timbal Balik
Langkah-langkah tersebut diulangi
Salah satu contoh
dengan menambah aquadest dengan
pengaplikasian dari kelarutan timbal
variasi volume.
balik adalah dalam produksi biofuel.
HASIL DAN PEMBAHASAN
Salah satu jenis-jenis biofuel yang
Tabel 1. Perhitungan Fraksi Mol Fenol-
dijadikan bahan bakar alternatif adalah
Air Terhadap Suhu
bio-etanol. Pada umumnya produksi
T (oC) Fraksi Fenol Fraksi Air
bioetanol dengan cara fermentasi dari
54,5 0,215 0,785
berbagai jenis bahan alam. Hasil
54 0,124 0,876
produksi bioetanol ini biasanya dari 56 0,089 0,911
terdiri dari campuran alkohol rantai C1 59 0,075 0,925
sampai C5. Proses pemisahan yang 58,5 0,066 0,934
umum digunakan dalam industri adalah 54 0,060 0,940
54 0,056 0,944
metode distilasi. Dalam mendesain
48 0,053 0,947
kolom distilasi diperlukan data
49 0,051 0,949
kesetimbangan yang akurat (Mustain, 41,5 0,048 0,952
2016). Pada tabel 1 diperoleh nilai data
yaang fluktuatif antara suhu dan fraksi
METODOLOGI mol fenol maupun air. Nilai suhu turun
Bahan yang digunakan pada pada fraksi air 0,785 hingga 0,876.
praktikum ini adalah fenol dan Namun ketika fraksi 0,911 hingga
aquadest. Sedangkan alat yang 0,925 mengalami kenaikan. Hingga
digunakan adalah tabung reaksi, penurunan yang sangat signifikan akan
pemanas, pengaduk, gelas kimia, buret, terjadi pada fraksi mol antara 0,934
termometer, statif dan klem. hingga 0,952. Kenaikan temperatur
Percobaan dilakukan dengan pada larutan bersamaan dengan
mengisi tabung kosong dengan fenol kenaikan fraksi air dan penurunan fraksi
lalu dititrasi dengan aquadest hingga fenol. Selanjutnya juga diperoleh grafik
keruh, catat volume aquadest yg yang naik turun. Nilai-nilai ini
didapat. Fenol keruh tersebut kemudian diubah dalam bentuk grafik
dipanaskan hingga bening dan diukur
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 11
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
hubungan fraksi mol air dan suhu bertambah larut bila suhunya dinaikkan,
seperti pada grafik (1). sehingga pada proses pemanasan untuk
menjernihkan dan pendinginan untuk
mengeruhkan terjadi perubahan suhu
yang signifikan dan tidak teratur.
KESIMPULAN
Berdasarkan data hasil
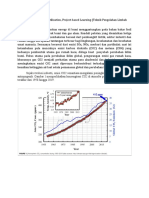
Grafik 1. Hubungan Fraksi Air dengan percobaan dapat disimpulkan bahwa
Suhu temperatur keitis larutan adalah 59 oC
Berdasarkan diperoleh hubung- pada fraksi mol air 0,925 dan fenol
an antara fraksi mol dan suhu yang 0,075. Kurva yang terbentuk dari data-
bersifat fluktuatif. Temperatur kristis data tersebut berupa kurva yang terbuka
yang diperoleh adalah pada suhu 59 oC. ke bawah. Hal ini terjadi karena
Grafik tersebut sedikit berbentuk penurunan dan kenaikan suhu yang
parabola. Menurut Rohayati (2013) signifikan namun tidak teratur pada saat
bentuk tersebut sudah sesuai dengan penjernihan dan pengeruhan.
teori yang menyatakan grafik hubungan
fraksi mol dengan temperatur. Namun,
temperatur kritis yang diperoleh
berdasarkan grafik tidak sesuai dengan
teori yang ada. Menurut penjelasan dari
Karyadi pada tahun 2002, apabila suhu
dari dalam kelarutan fenol-air dinaikkan
o
diatas 50 C maka fraksi mol akan
bertambah dan pada suhu 66 oC larutan
mencapai titik kritis (komposisi sistem
lautan seimbang dan bercampur
sempurna). Hal ini dapat terjadi karena
beberapa faktor. Faktor utama yang
sangat berpengaruh seperti penjelasan
dari Sinila (2016) adalah suhu dimana
suhu tersebut mengalami perubahan
(tidak stabil). Zat padat umumnya
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 12
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
DAFTAR PUSTAKA
Atkins, P.W, 1996, Kimia Fisika, Jakarta, Erlangga
Chang, 2004, Kimia Dasar Edisi Ketiga, Erlangga, Jakarta
Daniels, F, 1992, Kimia Fisika Edisi Kelima Jilid 1, Erlangga, Jakarta
Dogra, 1990, Kimia Fisik dan Soal-Soal, UI-Press, Jakarta
Hiskia A, 1996, Kimia Larutan. Bandung, Citra Aditya Bakti
Ikawati, A, 2018, „Kelarutan Timbal Balik Sistem Biner Fenol-Air‟, Jurnal Pendidikan
Mustain, A, 2016, „Parameter Interaksi Biner Kesetimbangan Uap-Cair Campuran
Alkohol untuk Optimasi Proses Pemurnian Bioetanol‟, Jurnal Bahan Alam
Terbarukan, Vol.5, No.2.
Ramadhani, A, 2018, „Kelarutan Dua Cairan yang Saling Bercampur Sebagian‟, Jurnal
Praktikum
Sinila, S, Farmasi Fisik, Pusdik SDM Kesehatan, Jakarta
Sumardjo, Damin., 2008, Pengantar Kimia Buku Panduan Kuliah Mahasiswa
Kedokteran. Jakarta, EGC.
Syukri, 1990, Kimia Dasar I, ITB, Bandung
Tim Dosen, 2020, Pengantar Teknik Kimia II, Kimia Fisika, UPN “Veteran” Jawa
Timur, Surabaya
Tulenan, V, 2019, „Aplikasi Game Edukasi Pengenalan Unsur dan Senyawa Kimia‟,
Jurnal Teknik Informatika
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 13
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
LAMPIRAN
I.Tabel Pengamatan
Tabel 1 Penambahan aquades sampai terjadi kekeruhan pertama
No Aquades (ml) Pengamatan T1 (oC) T2 (oC) T rata-rata
1 3,2 Larutan Jenuh 61 38 49,5
Tabel 2 Penambahan aquades setelah jadi kekeruhan
Aquades Massa (gram) Suhu (oC) % Massa Mol Fraksi Mol
No
(ml) Fenol Air T1 T2 T rata Fenol Air Fenol Air Fenol Air
1 2,8 4 6 58 51 54,5 40 60 0,04 0,33 0,11 0,89
2 2,6 4 8,6 58 50 54 31,75 68,25 0,04 0,48 0,08 0,92
3 2,4 4 11 60 52 56 26,67 73,33 0,04 0,61 0,06 0,93
4 1,6 4 12,6 64 54 59 24,10 75,90 0,04 0,70 0,06 0,94
5 1,4 4 14 62 55 58,5 22,22 77,78 0,04 0,78 0,05 0,95
6 1,2 4 15,2 64 44 54 20,83 79,17 0,04 0,84 0,05 0,95
7 0,8 4 16 72 36 54 20 80 0,04 0,89 0,05 0,96
8 0,8 4 16,8 54 42 48 19,23 80,77 0,04 0,93 0,04 0,96
9 0,6 4 17,4 52 46 49 18,69 81,31 0,04 0,97 0,04 0,96
10 1 4 18,4 50 33 41,5 17,86 82,14 0,04 1,02 0,04 0,96
II. Perhitungan
a. Perhitungan Persen Massa Fenol
1.
2.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 14
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
3.
4.
5.
6.
7.
8.
9.
10.
b. Perhitungan Persen Massa Air
1.
2.
3.
4.
5.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 15
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
6.
7.
8.
9.
10.
c. Perhitungan Mol Fenol
d. Perhitungan Mol Air
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
e. Perhitungan Fraksi Mol Fenol
1.
2.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 16
LABORATORIUM PENGANTAR TEKNIK KIMIA
II
3.
4.
5.
6.
7.
8.
9.
10.
f. Perhitungan Fraksi Mol Air
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
KELARUTAN TIMBAL BALIK SISTEM BINER FENOL-AIR 17
Anda mungkin juga menyukai
- Paper Kelarutan Timbal Balik Sistem Biner Fenol Dan AirDokumen16 halamanPaper Kelarutan Timbal Balik Sistem Biner Fenol Dan AirJihoBelum ada peringkat
- Sistem Dua Komponen Fasa Padat Cair, Priskila DokoDokumen12 halamanSistem Dua Komponen Fasa Padat Cair, Priskila DokoPrsklaDkBelum ada peringkat
- Adsorpsi Arang AktifDokumen13 halamanAdsorpsi Arang Aktifnailul husni100% (1)
- LarutanDokumen74 halamanLarutanKurnia AthiefBelum ada peringkat
- Diktat KF2Dokumen167 halamanDiktat KF2Winda Regita PratiwiBelum ada peringkat
- Garam Komplek Tetraamin TembagaDokumen6 halamanGaram Komplek Tetraamin TembagaSiti FatimahBelum ada peringkat
- Format Laporan Praktikum Kimia FisikaDokumen18 halamanFormat Laporan Praktikum Kimia FisikaWidi SrimulyaniBelum ada peringkat
- Kinetika KimiaDokumen17 halamanKinetika KimiaPtm ZhullivanBelum ada peringkat
- EKSTRAKSIDokumen54 halamanEKSTRAKSIelma watBelum ada peringkat
- KI1201 - Kesetimbangan KelarutanDokumen30 halamanKI1201 - Kesetimbangan KelarutanEnggelsBelum ada peringkat
- Penentuan PH Dan KaDokumen17 halamanPenentuan PH Dan KajusttytaaBelum ada peringkat
- Titrasi RedoksDokumen18 halamanTitrasi RedoksNina RishantiBelum ada peringkat
- Hukum RaoultDokumen4 halamanHukum RaoultAlmer SudhiartaBelum ada peringkat
- Fasa Padat CairDokumen3 halamanFasa Padat Cairchintya kewotBelum ada peringkat
- Hantaran Larutan ElektrolitDokumen34 halamanHantaran Larutan ElektrolitMarisa ZuardiBelum ada peringkat
- Identif I KasiDokumen14 halamanIdentif I KasiRahmat HidayatBelum ada peringkat
- Property PackageDokumen7 halamanProperty PackageRimalianiBelum ada peringkat
- Alur Percobaan Koefisien Distribusi IodDokumen10 halamanAlur Percobaan Koefisien Distribusi IodmayarfiBelum ada peringkat
- SABUNDokumen19 halamanSABUNifaBelum ada peringkat
- Reaksi Substitusi Nukleofilik Dan Radikal BebasDokumen7 halamanReaksi Substitusi Nukleofilik Dan Radikal BebasQisty Aulia KhoiryBelum ada peringkat
- Jurnal Kimia Permukaan PDFDokumen16 halamanJurnal Kimia Permukaan PDFlaila purnamaBelum ada peringkat
- Aplikasi Proses Ekstraksi Di IndustriDokumen5 halamanAplikasi Proses Ekstraksi Di IndustriindahadipuspitaBelum ada peringkat
- KF Kul02Dokumen24 halamanKF Kul02Dzaki AmaanullahBelum ada peringkat
- Percobaan 1 (Hidrogen & Oksigen)Dokumen33 halamanPercobaan 1 (Hidrogen & Oksigen)fifiBelum ada peringkat
- Diagram Fasa 2 KomponenDokumen2 halamanDiagram Fasa 2 Komponenchintya kewotBelum ada peringkat
- Lapres Entropi FixDokumen21 halamanLapres Entropi FixMawadah RiyaBelum ada peringkat
- Diagram Fasa Biner Fenol-AirDokumen16 halamanDiagram Fasa Biner Fenol-AirAssyakur100% (1)
- Diagram Fasa Biner Fenol-AirDokumen8 halamanDiagram Fasa Biner Fenol-AirRizal Febri ArdiansyahBelum ada peringkat
- Syarat Adsorpsi IsotermDokumen4 halamanSyarat Adsorpsi IsotermRizki Muharom100% (1)
- Anhidrida MaleatDokumen8 halamanAnhidrida MaleatIrwan Ir100% (1)
- Gusti Nugraha - Laporan Praaktikum Pembuatan Kalium NitratDokumen12 halamanGusti Nugraha - Laporan Praaktikum Pembuatan Kalium NitratGusti NugrahaBelum ada peringkat
- Laporan Molal ParsialDokumen22 halamanLaporan Molal ParsialimamBelum ada peringkat
- Bab 1Dokumen19 halamanBab 1Alexander Antonius EfendiBelum ada peringkat
- Volume Molar PDFDokumen14 halamanVolume Molar PDFYuvickho chanBelum ada peringkat
- Faktor Frekuensi (Ko)Dokumen5 halamanFaktor Frekuensi (Ko)Santi SavitriBelum ada peringkat
- Bab 1 SifatkoligatiflarutanDokumen16 halamanBab 1 Sifatkoligatiflarutansynthia arianiBelum ada peringkat
- Panas Netralisasi (Laporan II)Dokumen12 halamanPanas Netralisasi (Laporan II)tethahoiriahBelum ada peringkat
- Contoh Soal KimfissDokumen5 halamanContoh Soal KimfissMuhammad khairi ramadhan 021Belum ada peringkat
- Jurnal Kelarutan Sebagai Fungsi Suhu - Gede Wisnu Ambara PutraDokumen9 halamanJurnal Kelarutan Sebagai Fungsi Suhu - Gede Wisnu Ambara PutraBali32Gede Wisnu Ambara PutraBelum ada peringkat
- Lembar Kerja Siswa Buffer 1 FixxDokumen11 halamanLembar Kerja Siswa Buffer 1 FixxHani NabilaBelum ada peringkat
- MATERI 2 TermodinamikaDokumen3 halamanMATERI 2 TermodinamikaRosita KartikaBelum ada peringkat
- BAB I Kesetimbanagn Uap-CairDokumen17 halamanBAB I Kesetimbanagn Uap-CairFauzi Abdilah100% (1)
- Rangkuman Redoks - Tetapan KesetimbanganDokumen1 halamanRangkuman Redoks - Tetapan KesetimbanganTalitha Puspa Kencana100% (1)
- Kesadahan AirDokumen18 halamanKesadahan AirNikke ArdilahBelum ada peringkat
- Kesetimbangan Fase Padat-Cair - 4 KD - Kel. 4Dokumen17 halamanKesetimbangan Fase Padat-Cair - 4 KD - Kel. 4DanielBelum ada peringkat
- Macam ElektrodaDokumen6 halamanMacam ElektrodaAditya Herman PurwantoBelum ada peringkat
- Volume Molal ParsialDokumen12 halamanVolume Molal ParsialLailatul IsnaeniBelum ada peringkat
- Proses Industri KimiaDokumen2 halamanProses Industri KimiakristianBelum ada peringkat
- Level Control 2Dokumen30 halamanLevel Control 2Natalyas MarampaBelum ada peringkat
- Tugas2 14ADokumen29 halamanTugas2 14ANickenNiafaBelum ada peringkat
- Kesetimbangan Uap-CairDokumen9 halamanKesetimbangan Uap-CairAprillia wijayantiPBelum ada peringkat
- STOIKIOMETRIDokumen37 halamanSTOIKIOMETRIZulkifli MakuBelum ada peringkat
- Teori Orbital Molekul 1Dokumen19 halamanTeori Orbital Molekul 1Teti Aisyah100% (1)
- Praktikum 7 Kimia Dasar (Kesetimbangan Reaksi)Dokumen7 halamanPraktikum 7 Kimia Dasar (Kesetimbangan Reaksi)Alda Lumihi - FarmasiBelum ada peringkat
- Hasil Eksperimen Roult Menunjukan Bahwa Kenaikan Titik Didih Larutan Akan Semakin Besar Apabila KonsentrasiDokumen3 halamanHasil Eksperimen Roult Menunjukan Bahwa Kenaikan Titik Didih Larutan Akan Semakin Besar Apabila KonsentrasiAnnisa SeptianiBelum ada peringkat
- Kimia PermukaanDokumen13 halamanKimia PermukaansYahri100% (1)
- Kelarutan Timbal Balik Sistem Biner Fenol - AirDokumen13 halamanKelarutan Timbal Balik Sistem Biner Fenol - AirCindy Saskia100% (1)
- Alfina Noviyani Modul Ix Paralel CDokumen15 halamanAlfina Noviyani Modul Ix Paralel CMukhamad Nurul HudaBelum ada peringkat
- Laporan Praktikum Kelarutan Timbal Balik Sistem BinerDokumen16 halamanLaporan Praktikum Kelarutan Timbal Balik Sistem BinerZulfahBelum ada peringkat
- Mukhamad Nurul Huda - Paper FENOL - Par CDokumen15 halamanMukhamad Nurul Huda - Paper FENOL - Par CMukhamad Nurul HudaBelum ada peringkat
- NX Ye 1 JGPJ7 y GYj HFXSy P4 BVR 11 CRKG F9Dokumen6 halamanNX Ye 1 JGPJ7 y GYj HFXSy P4 BVR 11 CRKG F9Al BaihaqiBelum ada peringkat
- Tugas CO2 Capture & Utilization-PjBLDokumen5 halamanTugas CO2 Capture & Utilization-PjBLAl BaihaqiBelum ada peringkat
- Kimia Fisika Hukum NernstDokumen19 halamanKimia Fisika Hukum NernstAl BaihaqiBelum ada peringkat
- Kimia Fisika Sistem Kristal Dan Massa JenisDokumen12 halamanKimia Fisika Sistem Kristal Dan Massa JenisAl BaihaqiBelum ada peringkat