Unsur Transisi
Diunggah oleh
arfah0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan7 halamanUnsur transisi adalah unsur golongan 3 hingga 12 yang memiliki orbital d yang tidak terisi penuh, sehingga dapat membentuk ion stabil. Unsur-unsur ini memiliki sifat khas seperti membentuk senyawa kompleks berwarna, memiliki berbagai tingkat oksidasi, dan bersifat katalitik.
Deskripsi Asli:
Judul Asli
Unsur transisi
Hak Cipta
© © All Rights Reserved
Format Tersedia
PPTX, PDF, TXT atau baca online dari Scribd
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniUnsur transisi adalah unsur golongan 3 hingga 12 yang memiliki orbital d yang tidak terisi penuh, sehingga dapat membentuk ion stabil. Unsur-unsur ini memiliki sifat khas seperti membentuk senyawa kompleks berwarna, memiliki berbagai tingkat oksidasi, dan bersifat katalitik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
0 penilaian0% menganggap dokumen ini bermanfaat (0 suara)
6 tayangan7 halamanUnsur Transisi
Diunggah oleh
arfahUnsur transisi adalah unsur golongan 3 hingga 12 yang memiliki orbital d yang tidak terisi penuh, sehingga dapat membentuk ion stabil. Unsur-unsur ini memiliki sifat khas seperti membentuk senyawa kompleks berwarna, memiliki berbagai tingkat oksidasi, dan bersifat katalitik.
Hak Cipta:
© All Rights Reserved
Format Tersedia
Unduh sebagai PPTX, PDF, TXT atau baca online dari Scribd
Anda di halaman 1dari 7
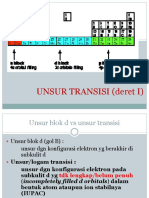
Unsur transisi
IUPAC DEFF :SEMUA UNSUR YANG ELEKTRON
ORBITAL D TIDAK LENGKAP ATAU DPL ,DAPAT
MEMBENTUK ION STABIL DENGAN ORBITAL
D YANG BELUM TERISI PENUH.
• Gol 3 s/d gol 12 pada tabel periodik
• Ada 40 unsur
• No atom 21 s/d 30
39 s/d 48
71 s/d 80
103 s/d 112
• Orbital 4s lebih dulu diisi sebelum orbital 3d karena
orbital 4s memiliki energi yang lebih rendah.
• Setelah elektron mengisi orbital,terjadi perubahan
tingkat energi.orbital 4s berkedudukan paling luar dan
tingkat energi orbital paling tinggi.
• Urutan terbalik ini ,4s duluan dari 3d,hanya terkait
penempatan elektron,tetapi e paling luar adalah
elektron pada 4s dan akan terlepas lebih dulu
• Hal ini menyebabkan unsur transisi periode 4 memiliki
sifat khas yang tak dimiliki oleh gol lain yi:
• Ber macam macam tingkat oksidasi
• Contoh : Mn MnO
MnO2
Mn O4-
• Pembentukan senyawa kompleks
Senyawa kompleks,memiliki ion Lo pada pusat ,dan sejumlah
ttt ion /mol mengelilinginya.
Ion/mol ini mengelilingi ion pusat Lo melalui ikatan koordinasi.
Mol/ion yang mengelilingi Lo pusat disebut Ligan.
Contoh dari ion komplekes :
{Fe (H2o)6}2+
{Co(NH3)6}2+
{Cr(OH)6}3+
{Cu(Cl4)}2-
• Pembentukan senyawa-senyawa berwarna
Ion-ion kompleks logam transisi .
{Cr(H2O)6}3+
{Fe(H2O06}2+
{Co(H2O)6}2+
{Ni(H2O)6}2+
{Cu(H2O)6}2+
Semuanya berwarna.unsur lain dpt juga
berwarnatetapi ini bersifat umum utk unsur transisi.
• Bersifat katalitik
Logam transisi dan
persenyawaannya,merupakan katalis yang
baik. Contoh :
Besi pada proses Haber
Ni pada hidrogenasi ikatan C=C
Vanadium pada proses Contact yaitu konversi
SO2 menjadi SO3.s
Anda mungkin juga menyukai
- 4 Unsur TransisiDokumen56 halaman4 Unsur TransisiDwi ArianiBelum ada peringkat
- Kimia Dasar Materi 3 K1 - 05.10.19Dokumen44 halamanKimia Dasar Materi 3 K1 - 05.10.19Satrio Dwi CahyoBelum ada peringkat
- Oksigen 1Dokumen44 halamanOksigen 1syafaiyah dj halidaBelum ada peringkat
- UNSUR TRANSISI BAGIAN 1 - CompressedDokumen55 halamanUNSUR TRANSISI BAGIAN 1 - CompressedBuyungPranajayaBelum ada peringkat
- Laporan Reaksi Ion Logam TransisiDokumen44 halamanLaporan Reaksi Ion Logam Transisifenty_wianapuspita67% (9)
- Logam TransisiDokumen82 halamanLogam TransisiDocument PTKI MedanBelum ada peringkat
- UNSUR TRANSISI Dan Tata Nama KompleksDokumen27 halamanUNSUR TRANSISI Dan Tata Nama KompleksindahyanuarBelum ada peringkat
- TRANSISIDokumen17 halamanTRANSISIMuntiyatulChoiroSafitri100% (1)
- Unsur Transisi Periode KeempatDokumen8 halamanUnsur Transisi Periode KeempatMita Junita PutriBelum ada peringkat
- Pendahuluan Sifat Unsur TransisiDokumen19 halamanPendahuluan Sifat Unsur TransisiSekar AyuBelum ada peringkat
- Reaksi-Ion-Logam-Transisi Laporan PDFDokumen44 halamanReaksi-Ion-Logam-Transisi Laporan PDFHadi Maulana HamzahBelum ada peringkat
- Kimia Anorganik IDokumen106 halamanKimia Anorganik IJeffry LuckyBelum ada peringkat
- Kimia Anorganik IDokumen106 halamanKimia Anorganik ISeptian AdetamaBelum ada peringkat
- Percobaan 6-Laporan Praktikum Kimia Anorganik IIDokumen22 halamanPercobaan 6-Laporan Praktikum Kimia Anorganik IIZul Minho K-popers100% (1)
- (Fix Banget) Unsur Transisi Periode 4Dokumen20 halaman(Fix Banget) Unsur Transisi Periode 4Wildanul MunfaridBelum ada peringkat
- Logam TransisiDokumen7 halamanLogam TransisiNuril AlamBelum ada peringkat
- Senyawa KompleksDokumen21 halamanSenyawa KompleksOlivia DikoBelum ada peringkat
- KIMIA PeriodeDokumen39 halamanKIMIA PeriodeNjuah TrifaLdy BoangmanaLuBelum ada peringkat
- Unsur Transisi Periode 4Dokumen9 halamanUnsur Transisi Periode 4ainunrmdhBelum ada peringkat
- Laporan Reaksi Ion Logam TransisiDokumen55 halamanLaporan Reaksi Ion Logam TransisiAdi Wahyu Mancunian ArzantoBelum ada peringkat
- Transisi Periode 4 (Autosaved)Dokumen69 halamanTransisi Periode 4 (Autosaved)kanjiroBelum ada peringkat
- Sel ElektrolisisDokumen10 halamanSel ElektrolisisUzank DoankBelum ada peringkat
- Materi Transisi KimiaDokumen50 halamanMateri Transisi KimiaRegiSulfat100% (2)
- Ciri-Ciri Dan Sifat Unsur-Unsur TransisiDokumen16 halamanCiri-Ciri Dan Sifat Unsur-Unsur TransisiJon Faizal100% (1)
- Kimia AnorganikDokumen23 halamanKimia AnorganikRiza Listiana SudrajatBelum ada peringkat
- Kimia UnsurDokumen153 halamanKimia UnsurHaura NadiraBelum ada peringkat
- Kimia DasarDokumen33 halamanKimia DasarHildaFebrinaBelum ada peringkat
- Sifat Logam TransisiDokumen6 halamanSifat Logam TransisiMuhammad Wahyudin0% (1)
- Unsur Golongan Transisi Periode EmpatDokumen22 halamanUnsur Golongan Transisi Periode EmpatDeta Novian Ariesandy75% (4)
- Struktur Senyawa Kompleks Pada Beberapa Logam TransisiDokumen5 halamanStruktur Senyawa Kompleks Pada Beberapa Logam TransisiThita Nuryanti JabanBelum ada peringkat
- Unsur TransisiDokumen5 halamanUnsur TransisiwafiqaBelum ada peringkat
- TransisiDokumen8 halamanTransisiSenri ShikiBelum ada peringkat
- Unsur TransisiDokumen5 halamanUnsur Transisinina106Belum ada peringkat
- Tugas Kimsur Transisi Oleh Putriani BuaDokumen8 halamanTugas Kimsur Transisi Oleh Putriani BuaPutriani BuaBelum ada peringkat
- Re-Kimia (Kimia Unsur 41-45)Dokumen4 halamanRe-Kimia (Kimia Unsur 41-45)Rizki Fatmawati50% (2)
- Unsur Transisi Periode 4Dokumen9 halamanUnsur Transisi Periode 4Randy PrasetyoBelum ada peringkat
- Redoks & Elektokimia (3-4)Dokumen30 halamanRedoks & Elektokimia (3-4)Daya MuctBelum ada peringkat
- Unsur Transisi Dan Senyawa KompleksDokumen30 halamanUnsur Transisi Dan Senyawa KompleksYodi SetiawanBelum ada peringkat
- Kimia XII SMA - Unsur TransisiDokumen18 halamanKimia XII SMA - Unsur TransisiKartini F. Astuti50% (2)
- Munawaroh - 1622230031 - Reaksi Ion Logam TransisiDokumen23 halamanMunawaroh - 1622230031 - Reaksi Ion Logam TransisiMunawarohBelum ada peringkat
- Sifat Unsur TransisiDokumen3 halamanSifat Unsur TransisiEka FitrianiBelum ada peringkat
- Periode 4Dokumen36 halamanPeriode 4Herdianta SebayangBelum ada peringkat
- Reaksi Kualitatif Logam TransisiDokumen16 halamanReaksi Kualitatif Logam TransisiAgustin KurniatiBelum ada peringkat
- Jurnal Ujian PraktekDokumen6 halamanJurnal Ujian PraktekRihlatul adniBelum ada peringkat
- Unsur TransisiDokumen10 halamanUnsur TransisiAlifia NurfatikhaBelum ada peringkat
- Sintesis Senyawa KompleksDokumen12 halamanSintesis Senyawa KompleksTika ChemBelum ada peringkat
- Laporan KompleksDokumen16 halamanLaporan KompleksOnoBelum ada peringkat
- Bab 23 Logam Transisi Dan Senyawa KoordinasiDokumen11 halamanBab 23 Logam Transisi Dan Senyawa KoordinasiAnindita IndrianaBelum ada peringkat
- Pertemuan I-2 Ikatan KimiaDokumen45 halamanPertemuan I-2 Ikatan KimiaErlangga Svarnha BagaskaraBelum ada peringkat
- ELEKTROKIMIA GambarDokumen11 halamanELEKTROKIMIA GambarDiki NarasakiBelum ada peringkat
- Laprak Elektrolisis XII MIPA 1 Kelompok 4Dokumen9 halamanLaprak Elektrolisis XII MIPA 1 Kelompok 4PLLLE12Belum ada peringkat
- Reaksi Ion Logam TransisiDokumen58 halamanReaksi Ion Logam Transisiai vynnnBelum ada peringkat
- Senyawa KoordinasiDokumen10 halamanSenyawa KoordinasiinimelaBelum ada peringkat
- MAKALAH KIMDAS FixDokumen13 halamanMAKALAH KIMDAS FixRetno WulandariBelum ada peringkat
- Senyawa KompleksDokumen32 halamanSenyawa KompleksRoyBelum ada peringkat
- Quiz FarKlin 1Dokumen6 halamanQuiz FarKlin 1arfahBelum ada peringkat
- Kelompok 3 (Komunikasi Interpersonal Dan Konseling)Dokumen18 halamanKelompok 3 (Komunikasi Interpersonal Dan Konseling)arfahBelum ada peringkat
- meningitis pptDokumen29 halamanmeningitis pptarfahBelum ada peringkat
- biofarmasi 1Dokumen97 halamanbiofarmasi 1arfahBelum ada peringkat
- PPT Obat Herbal KELOMPOK 1Dokumen26 halamanPPT Obat Herbal KELOMPOK 1arfahBelum ada peringkat
- Presentation2Dokumen38 halamanPresentation2arfahBelum ada peringkat
- Klasifikasi HipertensiDokumen6 halamanKlasifikasi HipertensiarfahBelum ada peringkat
- BIOFARMASET 2Dokumen85 halamanBIOFARMASET 2arfahBelum ada peringkat
- PEM-indoDokumen21 halamanPEM-indoarfahBelum ada peringkat
- 1. Bahan Kuliah, penyampaian obat mel rektal. 2014Dokumen48 halaman1. Bahan Kuliah, penyampaian obat mel rektal. 2014arfahBelum ada peringkat
- Kimia DasarpresentasiDokumen54 halamanKimia DasarpresentasiarfahBelum ada peringkat
- Agama KLP 2 NewDokumen29 halamanAgama KLP 2 NewarfahBelum ada peringkat
- HUBUNGAN ANTAR MANUSIA (Konseling)k.2Dokumen15 halamanHUBUNGAN ANTAR MANUSIA (Konseling)k.2arfahBelum ada peringkat
- perb. HUBUNGAN ANTAR MANUSIA (Konseling)Dokumen18 halamanperb. HUBUNGAN ANTAR MANUSIA (Konseling)arfahBelum ada peringkat
- Jaminan Kesehatan Nasional (JKN) dalam SistemDokumen28 halamanJaminan Kesehatan Nasional (JKN) dalam SistemarfahBelum ada peringkat
- Hubungan Antar Manusia (Konseling)Dokumen26 halamanHubungan Antar Manusia (Konseling)arfahBelum ada peringkat
- Menelaah Kebijakan Obat NasionalDokumen30 halamanMenelaah Kebijakan Obat NasionalarfahBelum ada peringkat
- Perhitungan Kebutuhan ObatDokumen25 halamanPerhitungan Kebutuhan ObatarfahBelum ada peringkat
- Bab IV Operasional (18 Mei 2015)Dokumen11 halamanBab IV Operasional (18 Mei 2015)arfahBelum ada peringkat
- Kimia IntiDokumen10 halamanKimia IntiarfahBelum ada peringkat
- Struktur Elektronik Unsur Unsur Blok D Adalah SebagaiDokumen2 halamanStruktur Elektronik Unsur Unsur Blok D Adalah SebagaiarfahBelum ada peringkat
- Bab VI Keluhan, Obat Dan Atau Bahan Obat Kembalian, Diduga Palsu Dan Penarikan Kembali (18 Mei 2015)Dokumen8 halamanBab VI Keluhan, Obat Dan Atau Bahan Obat Kembalian, Diduga Palsu Dan Penarikan Kembali (18 Mei 2015)arfahBelum ada peringkat
- Bab V Inspeksi Diri (18 Mei 2015)Dokumen2 halamanBab V Inspeksi Diri (18 Mei 2015)arfahBelum ada peringkat
- Bab VIII Fasilitas Distribusi Berdasarkan Kontrak (18 Mei 2015)Dokumen3 halamanBab VIII Fasilitas Distribusi Berdasarkan Kontrak (18 Mei 2015)arfahBelum ada peringkat
- Bab IX (Dokumentasi (18 Mei 2015)Dokumen4 halamanBab IX (Dokumentasi (18 Mei 2015)arfahBelum ada peringkat
- Bab IX (Dokumentasi (18 Mei 2015)Dokumen4 halamanBab IX (Dokumentasi (18 Mei 2015)arfahBelum ada peringkat
- Konfigurasi ElektronDokumen21 halamanKonfigurasi ElektronarfahBelum ada peringkat
- Bab V Inspeksi Diri (18 Mei 2015)Dokumen2 halamanBab V Inspeksi Diri (18 Mei 2015)arfahBelum ada peringkat
- Lampiran 4.9 Contoh POB Pengiriman Obat Dan Atau Bahan ObatDokumen8 halamanLampiran 4.9 Contoh POB Pengiriman Obat Dan Atau Bahan ObatarfahBelum ada peringkat
- Lihat Lampiran 5.1 Tentang Contoh POB Inspeksi Diri Dan Audit MutuDokumen6 halamanLihat Lampiran 5.1 Tentang Contoh POB Inspeksi Diri Dan Audit MutuarfahBelum ada peringkat