Konstanta Kecepatan Reaksi
Diunggah oleh
Aufa FauzanJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Konstanta Kecepatan Reaksi
Diunggah oleh
Aufa FauzanHak Cipta:
Format Tersedia
KONSTANTA KECEPATAN REAKSI Kinetika Kimia (Chemical Kinetics) adalah salah satu cabang ilmu kimia yang mengkaji
mengenai seberapa cepat suatu reaksi kimia berlangsung. Dari berbagai jenis reaksi kimia yang telah dipelajari para ilmuwan, ada yang berlangsung dalam waktu yang sangat singkat (reaksi berlangsung cepat), seperti reaksi pembakaran gas metana. Di sisi lain, ada pula reaksi yang berlangsung dalam waktu yang lama (reaksi berlangsung lambat), seperti reaksi perkaratan (korosi) besi. Cepat lambatnya suatu reaksi kimia dapat dinyatakan dalam besaranlaju reaksi. Laju reaksi didefinisikan sebagai perubahan konsentrasi reaktan atau produk per satuan waktu. Satuan laju reaksi adalah M/s (Molar per detik). Sebagaimana yang kita ketahui, reaksi kimia berlangsung dari arah reaktan menuju produk. Ini berarti, selama reaksi kimia berlangsung, reaktan digunakan (dikonsumsi) bersamaan dengan pembentukan sejumlah produk. Dengan demikian, laju reaksi dapat dikaji dari sisi pengurangan konsentrasi reaktan maupun peningkatan konsentrasi produk. Secara umum, laju reaksi dapat dinyatakan dalam persamaan sederhana berikut : laju reaksi = - [A] / t laju reaksi = + [B] / t Tanda (negatif) menunjukkan pengurangan konsentrasi reaktan Tanda + (positif) menunjukkan peningkatan konsentrasi produk Laju reaksi berhubungan erat dengan koefisien reaksi. Untuk reaksi kimia dengan koefisien reaksi yang bervariasi, laju reaksi harus disesuaikan dengan koefisien reaksi masing-masing spesi. Sebagai contoh, dalam reaksi 2A -> B, terlihat bahwa dua mol A dikonsumsi untuk menghasilkan satu mol B. Hal ini menandakan bahwa laju konsumsi spesi A adalah dua kali laju pembentukan spesi B. Dengan demikian, laju reaksi dapat dinyatakan dalam persamaan berikut : laju reaksi = - 1 [A] / 2. t laju reaksi = + [B] / t atau atau
Laju suatu reaksi kimia sangat dipengaruhi oleh besarnya konsentrasi reaktan yang digunakan dalam reaksi. Semakin besar konsentrasi reaktan yang digunakan, laju reaksi akan meningkat. Di samping itu, laju reaksi juga dipengaruhi oleh nilai konstanta laju reaksi (k). Konstanta laju reaksi (k) adalah perbandingan antara laju reaksi dengan konsentrasi reaktan.
Nilai k akan semakin besar jika reaksi berlangsung cepat, walaupun dengan konsentrasi reaktan dalam jumlah kecil. Nilaik hanya dapat diperoleh melalui analisis data eksperimen, tidak berdasarkan stoikiometri maupun koefisien reaksi.
Hukum laju reaksi (The Rate Law) menunjukkan korelasi antara laju reaksi (v) terhadap konstanta laju reaksi (k) dan konsentrasi reaktan yang dipangkatkan dengan bilangan tertentu (orde reaksi). Hukum laju reaksi dapat dinyatakan dalam persamaan berikut : v = k [A]x [B]y x dan y adalah bilangan perpangkatan (orde reaksi) yang hanya dapat ditentukan melalui eksperimen. Nilai x maupun y tidak sama dengan koefisien reaksi a dan b. Bilangan perpangkatan x dan y memperlihatkan pengaruh konsentrasi reaktan A dan B terhadap laju reaksi. Orde total (orde keseluruhan) atau tingkat reaksi adalah jumlah orde reaksi reaktan secara keseluruhan. Dalam hal ini, orde total adalah x + y. Laju reaksi berkaitan dengan frekuensi tumbukan efektif yang terjadi antarmolekul. Apabila frekuensi tumbukan efektif semakin besar, tumbukan antarmolekul semakin sering terjadi, mengakibatkan produk terbentuk dalam waktu yang singkat. Dengan meningkatkan frekuensi tumbukan efektif antarmolekul, produk dalam jumlah besar dapat dihasilkan dalam waktu yang singkat. Beberapa faktor yang dapat mengubah jumlah frekuensi tumbukan efektif antarmolekul , antara lain : 1. Sifat reaktan dan ukuran partikel reaktan Agar reaksi dapat terjadi, harus terdapat tumbukan antarmolekul padasisi aktif molekul. Semakin besar dan kompleks molekul reaktan, semakin kecil pula kesempatan terjadinya
tumbukan
di sisi
aktif.
Kadang-kadang,
pada
molekul
yang
sangat
kompleks, sisi
aktifnyaseluruhnya tertutup oleh bagian lain dari molekul, sehingga tidak terjadi reaksi. Secara umum, laju reaksi akan lebih lambat bila reaktannya berupa molekul yang besar dan kompleks (bongkahan maupun lempengan). Laju reaksi akan lebih cepat bila reaktan berupa serbuk dengan luas permukaan kontak yang besar. Semakin luas permukaan untuk dapat terjadi tumbukan, semakin cepat reaksinya. 2. Konsentrasi reaktan Menaikkan jumlah tumbukan akan mempercepat laju reaksi. Semakin banyak molekul reaktan yang bertumbukan, semakin cepat reaksi tersebut. Sepotong kayu dapat terbakar di udara (yang mengandung gas oksigen 20%), tetapi kayu tersebut akan terbakar dengan jauh lebih cepat di dalam oksigen murni. Dengan mempelajari efek konsentrasi terhadap laju reaksi, kita dapat menentukan reaktan mana yang lebih mempengaruhi laju reaksi (ingat tentang orde reaksi). 3. Tekanan pada reaktan yang berupa gas Tekanan pada reaktan yang berupa gas pada dasarnya mempunyai pengaruh yang sama dengan konsentrasi. Semakin tinggi tekanan reaktan, semakin cepat laju reaksinya. Hal ini disebabkan adanya kenaikan jumlah tumbukan. Peningkatan tekanan dapat memperkecil volume ruang sehingga molekul semakin mudah bertumbukan satu sama lainnya. 4. Suhu Secara umum, menaikkan suhu menyebabkan laju reaksi meningkat. Pada kimia organik, ada aturan umum yang mengatakan bahwa menaikkan suhu 10C akan menyebabkan kelajuan reaksi menjadi dua kali lipat. Kenaikan suhu dapat meningkatkan jumlah tumbukan antarmolekul. Menaikkan suhu menyebabkan molekul bergerak dengan lebih cepat, sehingga terdapat peningkatan kesempatan bagi molekul untuk saling bertumbukan dan bereaksi. Menaikkan suhu juga menaikkan energi kinetik rata-rata molekul. Energi kinetik minimum yang dimiliki molekul harus sama atau lebih besar dari energi aktivasiagar reaksi dapat berlangsung. Reaktan juga harus bertumbukan pada sisi aktifnya. Kedua faktor inilah yang menentukan apakah suatu reaksi berlangsung atau tidak.
5. Katalis (Katalisator) Katalis adalah zat yang menaikkan laju reaksi tanpa dirinya sendiri berubah di akhir reaksi. Hal ini berarti katalis terbentuk kembali setelah reaksi berakhir. Katalis dapat menaikkan laju reaksi dengan memilih mekanisme reaksi lain yang energi aktivasinya lebih rendah dari mekanisme semula. Katalis dapat menurunkan energi aktivasi reaksi dengan satu dari dua cara berikut : 1. Memberikan permukaan dan orientasi Terjadi pada katalis heterogen. Katalis ini hanya mengikat satu molekul pada permukaan sambil memberikan orientasi yang sesuai untuk memudahkan jalannya reaksi. Katalis
heterogen adalah katalis yang berada pada fasa yang berbeda dengan reaktan. Katalis ini umumnya merupakan logam padat yang terbagi dengan halus atau oksida logam, sedangkan reaktannya adalah gas atau cairan. Katalis heterogen cenderung menarik satu bagian dari molekul reaktan karena adanya interaksi yang cukup kompleks yang belum sepenuhnya dipahami. Setelah reaksi terjadi, gaya yang mengikat molekul ke permukaan katalis tidak ada lagi, sehingga produk terlepas dari permukaan katalis. Katalis dapat siap melakukannya lagi. 2. Mekanisme alternatif Terjadi pada katalis homogen, yaitu katalis yang mempunyai fasa sama dengan reaktannya. Katalis ini memberikan mekanisme alternatif atau jalur reaksi yang memiliki energi
aktivasi yang lebih rendah dari reaksi aslinya. Dengan demikian, reaksi dapat berlangsung dalam waktu yang lebih singkat.
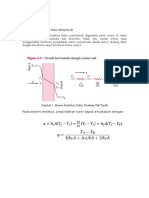
PEMBAHASAN Percobaan ini dilakukan untuk mengetahui besarnya sudut putar (polarisasi) suatu larutan sukrosa dengan menggunakan polarimeter. Prinsip kerja dari polarimeter yaitu berkas sinar yang masuk akan diteruskan oleh polarizer dallam berbagaibentuk sinar terpolarisasi, dimana berkas sinar yang masuk akan diteruskan ke analizer. Pada percobaan ini, hal pertama yang dilakukan yaitu mengukur sudut putar dari air (aquades) yang dijadikan sebagai larutan blanko. Air digunakan sebagai larutan blanko karena air tidak dapat memutar bidang polarisasi. Selanjutnya dilakukan pengukuran sudut putar dari larutan sampel berupa sukrosa. Bila cahaya dilewatkan ke dalam laruutan sukrosa, maka cahaya akan dibelokkan dengan sudut putar tertentu. Adanya prisma nikol dalam polarimeter, separuh dari berkas cahaya hasil polarisasi tampak sebagai bayangan gelap, sedangkan berkas cahaya yang separuh lagi melintas melalui jendela pelindung dan sampel kemudian melalui analizer nikol untuk sampai pada mata pengamat. Dari hasil percobaan, diketahui bahwa larutan sukrosa dan fruktosa dengan konsentrasi berbeda-beda mampu memutar cahaya terpolarisasi. Hal ini menandakan bahwa laruutan sukrosa dan fruktosa memiliki atom C asimetri (atom C yang mengikat empat gugus yang berbeda-beda), sehingga dapat dikatakan kedua larutan tersebut mempunyai sifat optis aktif 9aktivtas optik). Hal penting yang harus diperhatikan pada percobaan ini yaitu pada pengisian tabung (kuvet) tidak boleh menghasilkan gelembung udara, sebab gelembung udara tersebut membentuk cekungan pada larutan sehingga dapa mempengaruhi intensitas cahaya yang terpolarisasi, akibatnya berpengaruh pada besarnya sudut putar suatu sampel. Besarnya sudut putar suatu sampel bergantung pada jenis senyawa, suhu panjang gelombang cahaya terpolarisasi dan konsentrasi. Hidrolisis sukrosa dalam percobaan ini menghasilkan glukosa dan fruktosa sesuai dengan reaksi: C12H22O11 + H2O C6H12O6 + C6H12O6 Sukrosa glukosa fruktosa Berdasarkan pemutaran bidang polarisasi dimana sukrosa ke kanan (rotasi positif) dengan rotasi +27.20. Glukosa memutar bidang polarisasi ke kanan (rotasi positif) dengan rotasi +52,7 dan fruktosa memutar bidang polarisasi ke kiri (rotasi negatif) dengan rotasi -92,4 sehingga walaupun hidrolisa sudah berjalan, glukosa dan fruktosa masih terbentuk. Akibatnya pemutaran
bidang polarisasdi ke kanan akan diperkecil. Pada akhir reaksi, dimana sukrosa habis, larutan menjadi memutar bidang polarisasi ke kiri. Pada percobaan ini ditunjukkan oleh sudut putar campuran setelah konstan yang nilainya negatif yaitu -03.45 untuk yang menggunakan katalisator HCl. HCl digunakan sebagai katalisator pada percobaan ini. Sudut putar campuran dengan katalisator HCl lebih cepat turun. Hal ini disebabkan HCl merupakan asam kuat sehingga mempercepat reaksi hidrolisa sukrosa. Sesuai dengan grafik diperoleh k dari data 1 (larutan sukrosa + HCl) adalah 10 detik-1 Kecepatan reaksi dipengaruhi oleh beberapa faktor antara lain konsentrasi reaktan, orientasi molekul, suhu dan katalisator. Pada percobaan ini kecepatan reaksi dipengaruhi oleh orientasi molekul dan katalisator.
KESIMPULAN DAN SARAN 1. Kecepatan reaksi hidrolisa sukrosa semakin besar dengan katalisator HCl 2. Sudut putar sukrosa murni sebesar 03.90 3. Sudut putar campuran setelah konstan dengan katalisator HCl adalah sebesar 00.65 4. Konstanta kecepatan reaksi dengan katalisator HCl adalah sebesar 10 detik-1
Andy. 2009. Pre-College Chemistry. Chang, Raymond. 2007. Chemistry Ninth Edition. New York: Mc Graw Hill. Moore, John T. 2003. Kimia For Dummies. Indonesia:Pakar Raya.
Anda mungkin juga menyukai
- Mole Balances 1Dokumen39 halamanMole Balances 1AkiraOscar07Belum ada peringkat
- Materi 1 TRKDokumen27 halamanMateri 1 TRKfredyBelum ada peringkat
- Reaktor CSTRDokumen12 halamanReaktor CSTRHilmi Abubakar ShidiqBelum ada peringkat
- 05 Kinetika Reaksi Homogen Sistem BatchDokumen8 halaman05 Kinetika Reaksi Homogen Sistem BatchTri Wijaya PurnamaBelum ada peringkat
- I Nyoman Dipa - 121170078 - Perancangan Reaktor - Tugas 4Dokumen4 halamanI Nyoman Dipa - 121170078 - Perancangan Reaktor - Tugas 4Muthia ShofiBelum ada peringkat
- Pekan 3 - TRK 1 Reaksi Homogen Dan Analisis Data PDFDokumen80 halamanPekan 3 - TRK 1 Reaksi Homogen Dan Analisis Data PDFNaufal AzrizalBelum ada peringkat
- Ester 2Dokumen39 halamanEster 2Hendro SetiawanBelum ada peringkat
- Ii Kinetika ReaksiDokumen15 halamanIi Kinetika ReaksiAriestan SuhendraBelum ada peringkat
- Laporan Akhir Distilasi - 3BDokumen73 halamanLaporan Akhir Distilasi - 3Bhera ernawatiiBelum ada peringkat
- Etilen Dari Etana1Dokumen13 halamanEtilen Dari Etana1NisaBelum ada peringkat
- Modul Batch DistillationDokumen4 halamanModul Batch Distillationanak tengikBelum ada peringkat
- Makalah Trickle Bed ReactorDokumen9 halamanMakalah Trickle Bed ReactorRINO100% (2)
- BahanKuliahTRK FY01Dokumen201 halamanBahanKuliahTRK FY01Doni HermawanBelum ada peringkat
- SimilaritasDokumen28 halamanSimilaritasSalma ShivaBelum ada peringkat
- 05 TK3103 Reaktor Pipa IdealDokumen29 halaman05 TK3103 Reaktor Pipa Idealerni rohmiasihBelum ada peringkat
- Tinjauan KinetikaDokumen5 halamanTinjauan KinetikaRio SanjayaBelum ada peringkat
- Tugas Reaktor HeterogenDokumen7 halamanTugas Reaktor HeterogenKhoiriyahBelum ada peringkat
- HDJHDHDJHDJHDDokumen1 halamanHDJHDHDJHDJHDRizkaBelum ada peringkat
- Pressure Drop ReaktorDokumen25 halamanPressure Drop ReaktorKrisna CenolBelum ada peringkat
- Korosi Kolom DistilasiDokumen6 halamanKorosi Kolom DistilasiImmanuel AgapaoBelum ada peringkat
- 9 - II - 6 Dan 7 - Fixed Bed Catalytic Reactor - Genap 2020-2021Dokumen29 halaman9 - II - 6 Dan 7 - Fixed Bed Catalytic Reactor - Genap 2020-2021larasBelum ada peringkat
- 21 PDFDokumen391 halaman21 PDFAditya YudantokoBelum ada peringkat
- CSTR 2Dokumen6 halamanCSTR 2Anisa SudarmajiBelum ada peringkat
- 8134S1TKCE70732018 - Pengendalian Proses - Pertemuan 16 - TugasDokumen2 halaman8134S1TKCE70732018 - Pengendalian Proses - Pertemuan 16 - Tugasalfi toriqBelum ada peringkat
- Makalah Teknik Reaksi KimiaDokumen47 halamanMakalah Teknik Reaksi Kimiadandy maulanaBelum ada peringkat
- Translate FoglerDokumen17 halamanTranslate FoglerNita LolalaBelum ada peringkat
- Percobaan 1 (CSTR)Dokumen19 halamanPercobaan 1 (CSTR)Dicky PortgaceBelum ada peringkat
- Flu PreparationDokumen9 halamanFlu PreparationAudhinna ZuffyBelum ada peringkat
- Materi ParaxyleneDokumen15 halamanMateri ParaxyleneCitra Kusuma ParahitaBelum ada peringkat
- Contoh Soal OptimasiDokumen1 halamanContoh Soal Optimasihafizha tsalis nailatuzzulfaBelum ada peringkat
- Makalah PK No 1Dokumen4 halamanMakalah PK No 1MeidinaSekarNadistiBelum ada peringkat
- Teknik Reaksi Kimia - Reaktor BatchDokumen12 halamanTeknik Reaksi Kimia - Reaktor Batchakbar refarjanBelum ada peringkat
- Reaksi Ganda Homogen IsothermalDokumen88 halamanReaksi Ganda Homogen IsothermalIloan ManaluBelum ada peringkat
- Yesi Novitasari I 0507015Dokumen149 halamanYesi Novitasari I 0507015latifBelum ada peringkat
- Bank Soal Uas Semester 5 Tekkim PDFDokumen33 halamanBank Soal Uas Semester 5 Tekkim PDFMUHAMAD YULIANTOBelum ada peringkat
- 6 - External Pressure Vessel (Desain Tutup)Dokumen20 halaman6 - External Pressure Vessel (Desain Tutup)martha suriBelum ada peringkat
- Dokumen - Tips - Modul 3 Hysys Simulasi Alat Penukar PanasDokumen44 halamanDokumen - Tips - Modul 3 Hysys Simulasi Alat Penukar Panasfandikur niawanBelum ada peringkat
- M. Novriyanto (M1B118028) - Teknik Reaktor KimiaDokumen5 halamanM. Novriyanto (M1B118028) - Teknik Reaktor KimiaDinda SafitriBelum ada peringkat
- Contoh Soal 1Dokumen6 halamanContoh Soal 1Selsa IdillahBelum ada peringkat
- Reaktor CSTR Kelompok 11Dokumen76 halamanReaktor CSTR Kelompok 11devi abriyaniBelum ada peringkat
- Translate Wallas Bab 18Dokumen36 halamanTranslate Wallas Bab 18Ira RahmayuniBelum ada peringkat
- Bab 1 Reaktor Neraca MolDokumen39 halamanBab 1 Reaktor Neraca Molmonica_shaddyBelum ada peringkat
- Kelarutan Polimer HildebrandDokumen3 halamanKelarutan Polimer HildebrandA Thareq KemalBelum ada peringkat
- BAB III EvaporatorDokumen20 halamanBAB III EvaporatorLuluk MalikBelum ada peringkat
- Teknik Reaksi Kimia Ii PDFDokumen55 halamanTeknik Reaksi Kimia Ii PDFAgung Pribadi WicaksonoBelum ada peringkat
- Laporan Praktikum Pak Rony Kel 2Dokumen13 halamanLaporan Praktikum Pak Rony Kel 2BESTY LOVIANDABelum ada peringkat
- Tugas Muhammad Fadhil, Dwi Nurradivan Bab II. PeaDokumen7 halamanTugas Muhammad Fadhil, Dwi Nurradivan Bab II. PeaFood CatBelum ada peringkat
- Dy Bank Soal Dan 1Dokumen29 halamanDy Bank Soal Dan 1Muhammad NazirullahBelum ada peringkat
- Percobaan Ke 6Dokumen9 halamanPercobaan Ke 6Joko IrawandiBelum ada peringkat
- LAPORAN PRAKTIKUM KIMIA DASAR Via DARING Kinetika KimiaDokumen11 halamanLAPORAN PRAKTIKUM KIMIA DASAR Via DARING Kinetika KimiaNasya Alysia Putri 2105111974Belum ada peringkat
- Laporan Praktikum Kinetika KimiaDokumen23 halamanLaporan Praktikum Kinetika KimiaFitrata WidyaBelum ada peringkat
- Laporan Praktikum 3 Kimia FisikaDokumen14 halamanLaporan Praktikum 3 Kimia FisikaMunawarohBelum ada peringkat
- Kinetika KimiaDokumen14 halamanKinetika KimiaAldiKartikaBelum ada peringkat
- Laporan Praktikum Kinetika KimiaDokumen24 halamanLaporan Praktikum Kinetika KimiaAuliaFahryIIBelum ada peringkat
- Laporan Praktikum Kimia Acara 3Dokumen16 halamanLaporan Praktikum Kimia Acara 3wulandari puji astutiBelum ada peringkat
- 5-Laju ReaksiDokumen28 halaman5-Laju ReaksiSarif Faizal AmirBelum ada peringkat
- Faktor-Faktor Yang Mempengaruhi Kecepatan ReaksiDokumen5 halamanFaktor-Faktor Yang Mempengaruhi Kecepatan ReaksiChristine Juliana Ciembolonz33% (3)
- Persentasi KimiaDokumen5 halamanPersentasi Kimiadea ardyatiBelum ada peringkat
- Laporan Praktikum Penentuan Orde ReaksiDokumen26 halamanLaporan Praktikum Penentuan Orde Reaksisiti uliahBelum ada peringkat
- PropertiesDokumen24 halamanPropertiesAufa FauzanBelum ada peringkat
- Tugas Khusus CT (Pompa Sentrifugal)Dokumen13 halamanTugas Khusus CT (Pompa Sentrifugal)Aufa FauzanBelum ada peringkat
- Proposal Kerja Praktek Repaired RevisiDokumen20 halamanProposal Kerja Praktek Repaired RevisiAufa FauzanBelum ada peringkat
- SNCDokumen12 halamanSNCAufa FauzanBelum ada peringkat
- Pengaruh Penambahan Abu Ampas Tebu Terhadap Sifat Fisik Dan Mekanik Tanah Lempung EkspansifDokumen13 halamanPengaruh Penambahan Abu Ampas Tebu Terhadap Sifat Fisik Dan Mekanik Tanah Lempung EkspansifAufa FauzanBelum ada peringkat
- Campuran Arang Limbah Ampas Tebu Bagasse Dan Arang Tempurung Kelapa Dengan Perekat Tetes TebuDokumen9 halamanCampuran Arang Limbah Ampas Tebu Bagasse Dan Arang Tempurung Kelapa Dengan Perekat Tetes TebuAufa FauzanBelum ada peringkat
- PROPOSAL KEGIATAN (Tepung Kulit Pisang)Dokumen18 halamanPROPOSAL KEGIATAN (Tepung Kulit Pisang)Aufa Fauzan100% (1)
- Laporan Tetap Bioproses (Cuka Apel)Dokumen28 halamanLaporan Tetap Bioproses (Cuka Apel)Aufa Fauzan100% (1)
- Tugas Pengendalian Proses Dan InstrumentasiDokumen7 halamanTugas Pengendalian Proses Dan InstrumentasiAufa FauzanBelum ada peringkat
- Tugas Makalah Petrokimia (Nylon)Dokumen30 halamanTugas Makalah Petrokimia (Nylon)Aufa Fauzan100% (1)