Kompleksometri
Diunggah oleh
Dwi Yuni ErnawatiDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kompleksometri
Diunggah oleh
Dwi Yuni ErnawatiHak Cipta:
Format Tersedia
KOMPLEKSOMETRI
DWI YUNI ERNAWATI
1007113611
TEKNIK KIMIA S1/A
Kompleksometri
Merupakan salah satu metode kuantitatif
dengan mereaksikan ligan dengan ion
logam utamanya sehingga menghasilkan
senyawa kompleks.
M + L ML
Ket:
M = Kation Logam Pusat
L = Ligan
ML = Senyawa Kompleks
Tetapan Kestabilan Kompleks :
K = [ML]
[M][L]
Kelon (Chelon) adalah nama generik untuk
seluruh kelas reagensia, diantaranya trien dan
EDTA. Kelon seperti EDTA sangat cocok sebagai
titran untuk berbagai ion logam.
EDTA
.. ..
HOOCCH
2
CH
2
COOH
.. ..
N-CH
2
-CH
2
-N
.. ..
HOOCH
2
CH
2
COOH
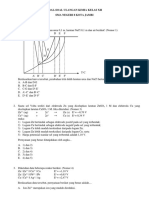
Kurva titrasi kompleksometri dapat dibuat
analog dengan kurva titrasi asam-basa. Kurva
dapat membantu mempertimbangkan
kelayakan suatu titrasi dan memilih indikator
yang tepat.
Contoh Soal:
Larutan sebanyak 50 ml yang berkadar Ca
2+
0,01M dan dibuferkan pada pH 10, dititrasi
dengan larutan EDTA 0,01M. Hitunglah nilai
pCa pada berbagai tahap titrasi dan alurkan
kurva titrasi itu, jika
4
pada pH 10 adalah
0,35 K
abs
untuk CaY
2-
adalah 5,0 X 10
10
Ca
2+
+
4-
CaY
2-
Ket:
4-
= fraksi EDTA
Titik Ekuivalen
V
R
M
R
= V
T
M
T
50 . 0,01 = V
T
0,01
V
T
= 50 ml
Jawaban:
K
ef
=K
abs
x
4
K
ef
= 5 x 10
10
x 0,35 = 1,8x10
10
K
ef
= Tetapan Kestabilan Efektif
K
abs
= Tetapan Kestabilan Absolut
Pada awal titrasi
[Ca
2+
] = 0,01 M
pCa = - Log [Ca
2+
] = 2
Setelah penambahan 10 ml titran
Terdapat kelebihan Ca
2+
yang cukup banyak pada titik ini,
dengan nilai K yang berorde 10
10
, dapat dikatakan reaksi
berjalan lengkap.
[Ca
2+
] = V
R
M
R
V
T
M
T
V
R
+V
T
[Ca
2+
] = (50x0,01 10x0,01) = 0,0067 M
60
pCa = 2,17
Titik Ekuivalen
[CaY
2-
] = V
T
. M
T
= 50x0,01 = 5,0 x 10
-3
M
V
R
+V
T
100
Pada titik Ekuivalen, konsentrasi zat yang dititrasi [Ca
2+
] sama dengan
konsentrasi yang pentitran [Cy].
[Ca
2+
] = [Cy]
K
ef
= [CaY
2-
] = K
abs
x
4
[Ca
2+
][Cy]
1,8x10
10
= 5,0 x 10
-3
[Ca
2+
]
2
[Ca
2+
] = 5,2x10
-7
pCa = 6,28
Setelah penambahan 60 ml titran, yang berlebih adalah
EDTA (Cy).
[Cy] = V
T
M
T
V
R
M
R
= 60x0,01 50x0,01 = 9,1 x 10
-4
M
V
R
+V
T
110
[CaY
2-
] = 5,0 x 10
-3
M
K
ef
= [CaY
2-
] = K
abs
x
4
[Ca
2+
][Cy]
1,8x10
10
= 5,0 x 10
-3
[Ca
2+
] . 9,1 x 10
-4
[Ca
2+
] = 2,8 x 10
-10
pCa = 9,55
Pengaruh Kompleks
Zat-zat selain titran kelon yang mungkin
terdapat dalam larutan ion logam dapat
membentuk kompleks dengan logam itu dan
karenanya menyaingi reaksi titrasi yang
diinginkan. Untuk mengatasi gangguan oleh
zat lain yang akan mengompleks juga dengan
EDTA, dilakukan penopengan (masking) yaitu
menggomplekskan pengganggu dengan zat
lain, tapi tidak bereaksi dengan logam yang
akan dititrasi.
Contoh Pengaruh Kompleks:
Nikel membentuk suatu ion kompleks yang
sangat stabil dengan Sianida, Ni(CN)
4
2-
,
sedangkan Timbal tidak. Jadi, dengan hadirnya
Sianida, Timbal dapat dititrasi dengan EDTA
tanpa gangguan Nikel.
TERIMA KASIH
Anda mungkin juga menyukai
- Titrasi KompleksometriDokumen32 halamanTitrasi KompleksometriFaisalFirdausBelum ada peringkat
- Kimia Analisis Titrasi KompleksometriDokumen15 halamanKimia Analisis Titrasi Kompleksometritotokmarto89Belum ada peringkat
- Titrasi Kompleksometri: Pertemuan 9Dokumen16 halamanTitrasi Kompleksometri: Pertemuan 9Ramanda FarhansyahBelum ada peringkat
- Titrasi KompleksometriDokumen21 halamanTitrasi KompleksometriChrist Vera SatumalayBelum ada peringkat
- Titrasi KompleksometriDokumen29 halamanTitrasi Kompleksometrihidayatur rahmiBelum ada peringkat
- Titrasi KompleksometriDokumen28 halamanTitrasi KompleksometriDwi RaputriBelum ada peringkat
- Titrasi KompleksometriDokumen17 halamanTitrasi KompleksometriAnnisa IchaBelum ada peringkat
- Titrasi KompleksometriDokumen32 halamanTitrasi KompleksometriZellaBelum ada peringkat
- Titrasi-Kompleksometri 1Dokumen31 halamanTitrasi-Kompleksometri 1PudjiastutiBelum ada peringkat
- Titrasi KompleksometriDokumen29 halamanTitrasi KompleksometriPutu Calista Gitta100% (4)
- Komplekso & ArgentometriDokumen18 halamanKomplekso & ArgentometrianjaniBelum ada peringkat
- Kesetimbangan Kelarutan & Titrasi PengendapanDokumen45 halamanKesetimbangan Kelarutan & Titrasi PengendapanMerlinda Yacob LolopayungBelum ada peringkat
- Titrasi KompleksometriDokumen17 halamanTitrasi KompleksometrizulkifliBelum ada peringkat
- Laporan KompleksometriDokumen7 halamanLaporan KompleksometriAnonymous BIAHFgroIFBelum ada peringkat
- Tugas Kimia Dasar - Teknik Geologi 2017Dokumen5 halamanTugas Kimia Dasar - Teknik Geologi 2017Iqbal Muhammad FajarBelum ada peringkat
- Jawaban KuisDokumen17 halamanJawaban KuisAlif Akbar Hidayatullah ArifinBelum ada peringkat
- KonduktometriDokumen18 halamanKonduktometrialfonsus andries100% (1)
- LKS 3 Sifat Koligatif Larutan ElektrolitDokumen2 halamanLKS 3 Sifat Koligatif Larutan ElektrolitM. Adnan m.Belum ada peringkat
- KA II KompleksometriDokumen36 halamanKA II KompleksometriCinsy PaskalineBelum ada peringkat
- Laporan Kimia Acara 3Dokumen15 halamanLaporan Kimia Acara 3Rizki FadlikaBelum ada peringkat
- Jawaban Pertanyaan Pengendapan LapDokumen5 halamanJawaban Pertanyaan Pengendapan LapArdhiaPramestiRigitaBelum ada peringkat
- Sifat Koligatif Larutan ElektrolitDokumen15 halamanSifat Koligatif Larutan ElektrolitAyuni AsihBelum ada peringkat
- Soal2 KompleksometriDokumen6 halamanSoal2 KompleksometriAtikaRahayu100% (6)
- Soal Kim For TutorDokumen12 halamanSoal Kim For TutorHamdani IlhamBelum ada peringkat
- Laporan Praktikum Kimia Fisika - KSP - Kelompok 5Dokumen21 halamanLaporan Praktikum Kimia Fisika - KSP - Kelompok 5Yasmin AnggraeniBelum ada peringkat
- Kompleks o MetriDokumen49 halamanKompleks o MetriMita Nnisaa13Belum ada peringkat
- Titrasi KompleksometriDokumen58 halamanTitrasi KompleksometriMuhammad Rizki ArdiansyahBelum ada peringkat
- Deskripsi IdenDokumen9 halamanDeskripsi IdenSelvy SalfitriBelum ada peringkat
- Titrasi KompleksometriDokumen34 halamanTitrasi KompleksometriNellie ObeliaBelum ada peringkat
- Babak Rebutan Final KelompokDokumen6 halamanBabak Rebutan Final Kelompokindah noor rahmahBelum ada peringkat
- Titrasi KompleksometriDokumen31 halamanTitrasi KompleksometriAsri Nisa SakinahBelum ada peringkat
- Materi Sifat Koligatif Larutan ElektrolitDokumen8 halamanMateri Sifat Koligatif Larutan ElektrolitBastian NeonaneBelum ada peringkat
- Soal SBM Paket 1Dokumen10 halamanSoal SBM Paket 1Silvia Widi YantiBelum ada peringkat
- LAPORAN PRAKTIKUM Kimling Prak 2Dokumen4 halamanLAPORAN PRAKTIKUM Kimling Prak 2Anonymous IboQWXrnBelum ada peringkat
- Spoiler Soal UTBK Kimia Hari 1Dokumen6 halamanSpoiler Soal UTBK Kimia Hari 1Kevin NadeakBelum ada peringkat
- Nurhayna M - 1920092 - AK2CDokumen6 halamanNurhayna M - 1920092 - AK2CnurhaynaBelum ada peringkat
- Tekanan Osmotik & SIfat Koligatif Elektrolit - 11a3Dokumen16 halamanTekanan Osmotik & SIfat Koligatif Elektrolit - 11a3Putri NainggolanBelum ada peringkat
- Kelompok 1praktikum Kinetika Reaksi Saponifikasi Etil AsetatDokumen12 halamanKelompok 1praktikum Kinetika Reaksi Saponifikasi Etil AsetatAlif Alfarisyi SyahBelum ada peringkat
- 40 Soal Kimia Dan PembahasanDokumen19 halaman40 Soal Kimia Dan PembahasanJaneBelum ada peringkat
- SoalDokumen17 halamanSoalAisyah AdelinaBelum ada peringkat
- Angka AngkutDokumen21 halamanAngka AngkutdewiBelum ada peringkat
- WORKSHEETS KOMPLEKSOMETRI - Fannisa Hafidhia Suryana - 2007769 - Kimia-C-DikonversiDokumen8 halamanWORKSHEETS KOMPLEKSOMETRI - Fannisa Hafidhia Suryana - 2007769 - Kimia-C-DikonversiFannisa SuryanaBelum ada peringkat
- Larutan ELektrolit IIDokumen14 halamanLarutan ELektrolit IIIndera PradanaBelum ada peringkat
- Soal Ulangan Kelas 12 IpaDokumen4 halamanSoal Ulangan Kelas 12 IpaLinggonilus MasturandaBelum ada peringkat
- Laporan Praktikum CPE Percobaan 7Dokumen7 halamanLaporan Praktikum CPE Percobaan 7Ronaldo Van GeorgeBelum ada peringkat
- Laporan Kinetika Reaksi Saponifikasi Etil AsetatDokumen15 halamanLaporan Kinetika Reaksi Saponifikasi Etil AsetatLisaSeptianaBelum ada peringkat
- Laporan Praktikum Tetapan Ionisasi Asam PDFDokumen12 halamanLaporan Praktikum Tetapan Ionisasi Asam PDFCaturPutraManiaIIBelum ada peringkat
- Titrasi KompleksometriDokumen7 halamanTitrasi KompleksometriPuspa Oktaviada SariBelum ada peringkat
- Tugas Individu Kinetika KimiaDokumen13 halamanTugas Individu Kinetika KimiananizakdamBelum ada peringkat
- Nisa Aisyah f24190048 Kel D Siang KelatometriDokumen9 halamanNisa Aisyah f24190048 Kel D Siang KelatometriFoodamental FST 56Belum ada peringkat
- Praktikum II Kadar CA Dan MGDokumen9 halamanPraktikum II Kadar CA Dan MGAnisSyakiraBelum ada peringkat
- Sifat Koligatif Larutan ElektrolitDokumen12 halamanSifat Koligatif Larutan ElektrolitAisya JihanBelum ada peringkat
- LKS. 7 Sifat Koligatif Larutan ElektrolitDokumen2 halamanLKS. 7 Sifat Koligatif Larutan Elektrolitmasjid darulfaizinBelum ada peringkat
- SOLUSI PO 7 KIMIA - ALC Indonesia (WWW - Defantri.com)Dokumen9 halamanSOLUSI PO 7 KIMIA - ALC Indonesia (WWW - Defantri.com)Rhamudie D. LuffyBelum ada peringkat
- Penentuan Tetapan Kesetimbangan Asam Lemah Secara KonduktometriDokumen19 halamanPenentuan Tetapan Kesetimbangan Asam Lemah Secara KonduktometriNora Asyik100% (2)
- Kelompok 8 - LAPRES PRAKKIMFIS Etil AsetatDokumen14 halamanKelompok 8 - LAPRES PRAKKIMFIS Etil AsetatYunita Dwi LarasatiBelum ada peringkat
- Laporan Praktikum Kimia Fisik Laju ReaksiDokumen11 halamanLaporan Praktikum Kimia Fisik Laju ReaksiwindaBelum ada peringkat
- BAB 3 (Proses Produksi)Dokumen34 halamanBAB 3 (Proses Produksi)Dwi Yuni Ernawati100% (1)
- Tugas Pap Kel 2Dokumen32 halamanTugas Pap Kel 2Dwi Yuni ErnawatiBelum ada peringkat
- Makalah KompleksometriDokumen23 halamanMakalah KompleksometriDwi Yuni Ernawati71% (7)
- Perancangan Alat ProsesDokumen37 halamanPerancangan Alat ProsesDwi Yuni Ernawati100% (1)
- Pakai Reaksi KimiaDokumen40 halamanPakai Reaksi KimiaDwi Yuni Ernawati64% (11)
- Laporan Filtraasi Kelompok 1Dokumen49 halamanLaporan Filtraasi Kelompok 1Dwi Yuni ErnawatiBelum ada peringkat
- Laporan Pengolahan Air Kelompok 1 - Kelas ADokumen37 halamanLaporan Pengolahan Air Kelompok 1 - Kelas ADwi Yuni Ernawati50% (2)
- Negara Pancasila Adalah Negara Kebangsaan Yang Berkeadilan SosialDokumen10 halamanNegara Pancasila Adalah Negara Kebangsaan Yang Berkeadilan SosialDwi Yuni Ernawati67% (3)