Halogenasi Alpha
Diunggah oleh
Muhammad Iqbal MHHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Halogenasi Alpha
Diunggah oleh
Muhammad Iqbal MHHak Cipta:
Format Tersedia
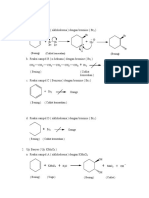
Pembahasan Halogenasi alpha
1.
Halogenasi alfa merupakan dasar suatu uji kimia, yang disebut uji iodoform, untuk metil
keton. Gugus metil dari suatu metil keton diiodinasi bertahap sampai terbentuk iodoform (CHI 3)
padat berwarna kuning.
Dalam tahap pertama dalam reaksi bersuasana basa adalah pembentukan ion enolat. Anion
suatu keton dengan gugus karbonil merupakan basa yang jauh lebih kuat daripada ion hidrosida.
Oleh karena itu kesetimbangan asam-basa lebih menyukai ion hidroksida daripada ion enolat.
Meskipun begitu, terdapat juga sedikit ion enolat dalam larutan basa. Segera setelah anion ini habis
terpakai, akan terbentuk lagi yang baru, untuk menuju ke Tahap 2. Dalam tahap 2, ion enolat
secara cepat bereaksi dengan halogen, menghasilkan keton terhalogenasi alfa dan ion halida.
Halogenasi alfa dalam suasana asam biasanya memberikan rendemen yang lebih baik daripada
reaksi dalam suasana basa. Reaksi berkatalis asam berlangsung lewat enol, yang pembentukannya
merupakan tahap penentu laju. Ikatan rangkap karbon-karbon dari enol itu mengalami adisi
elektrofilik, sama seperti setiap ikatan rangkap karbon-karbon apa saja, untuk membentuk
karbonkation yang lebih stabil.
Daftar Pustaka
Fessenden & Fessenden, 1982, Kimia Organik Jilid 2 Edisi III, Erlangga, Jakarta.
Hart, Hold., 2003, Kimia Organik, Erlangga, Jakarta.
Vogel Al,1968, A Text Book Of Practical Oragic Chemistry Third edition, English Language Book
Society and Longmans Green & Co. Ltd, London.
2. Kedua
Dalam mensintesis iodoform, kita dapat mempelajari reaksi halogenasi alfa () pada
senyawa karbonil. Halogenasi alfa disebut uji iodoform untuk metil keton. Gugus metil
dari suatu metil keton diiodinasi bertahap sampai terbentuk iodoform (CHI 3) padat
berwarna kuning. Sintesis iodoform dibuat secara langsung dari aseton, I 2 dan NaOH
menghasilkan rendemen rata-rata dari 6 kelompok yaitu 83,09% dengan titik lebur yang
mendekati teoritis 119C-123C. Hasil kristal yang diperoleh berwana kuning dengan bau
yang menyengat.
3. Ketiga
Hidrogen dalam senyawa karbonil lebih asam dari pada umumnya hydrogen
yang berikatan dengan atom karbon. Akibat dari penempatan gugus karbonil
disebelah proton metil sangat luar biasa, yaitu meningkatnya keasaman sampai
lebih dari pangkat 30 dari 10. Ada dua alasannya pertama karbon karbonil
membawa muatan positif parsial elektron ikatan bergeser kearah karbon
karbonil dan menjauhi hydrogen ,sehingga basa mudah mengambil hydrogen
sebagai proton(artinya tanpa mengambil elektron ikatannya. Kedua,anion yang
dihasilkan distabilkan .Anion ini disebut anion enolat, Muatan negatifnya
terdistribusi diantara karbon dan atom oksigen karbonil(Hart,2003:292-293).
4. Keempat
Anda mungkin juga menyukai
- IODOFORMDokumen3 halamanIODOFORMFitri NurkhalizaBelum ada peringkat
- IodoformDokumen2 halamanIodoformWidya AyuBelum ada peringkat
- Sintesis Asam Salisilat Dari Minyak Gandapura Dan Uji Titik LelehDokumen6 halamanSintesis Asam Salisilat Dari Minyak Gandapura Dan Uji Titik LelehChristopher HermanBelum ada peringkat
- Sintesis AsetanilidaDokumen14 halamanSintesis AsetanilidarudolfbyBelum ada peringkat
- Laporan Praktikum SP Nitrasi Pembuatan Nitrobenzene FIXDokumen13 halamanLaporan Praktikum SP Nitrasi Pembuatan Nitrobenzene FIXmridhotriadiBelum ada peringkat
- IodoformDokumen26 halamanIodoformfirda arifatuBelum ada peringkat
- Analisis DataDokumen2 halamanAnalisis DataMelinda Ade KantariBelum ada peringkat
- Sintesis IminaDokumen10 halamanSintesis IminaKiranti AuliaBelum ada peringkat
- Titrasi Argentometri VolhardDokumen8 halamanTitrasi Argentometri VolhardNurul Fajri ZulkifliBelum ada peringkat
- IodoformDokumen2 halamanIodoformLusia DriktiBelum ada peringkat
- Pembuatan AspirinDokumen15 halamanPembuatan Aspirinnashinta putriBelum ada peringkat
- Laporan Kimia Organik Sintesis DibenzalasetonDokumen9 halamanLaporan Kimia Organik Sintesis DibenzalasetonRika MargarethaBelum ada peringkat
- ANALISIS DATA Asam KarboksilatDokumen5 halamanANALISIS DATA Asam KarboksilatTria Bee Fajariani0% (1)
- Pembuatan Isobutyl AldehidDokumen8 halamanPembuatan Isobutyl AldehidMauris AlbariBelum ada peringkat
- Bundelan Aldol KondensasiDokumen12 halamanBundelan Aldol KondensasiFakhri Al JenarBelum ada peringkat
- Jawaban Bahan DiskusiDokumen2 halamanJawaban Bahan DiskusiAgnesia Brilianti KananluaBelum ada peringkat
- Anion AniDokumen56 halamanAnion AniSuriani SulleBelum ada peringkat
- KonduktometriDokumen16 halamanKonduktometriRifai Indraswari100% (1)
- Praktikum KFA 2 Pertemuan 9 - Kelompok 5 - 3ADokumen5 halamanPraktikum KFA 2 Pertemuan 9 - Kelompok 5 - 3AsarahsahilaBelum ada peringkat
- Isolasi Eugenol Dari Minyak CengkehDokumen15 halamanIsolasi Eugenol Dari Minyak CengkehWidyapasha CitrasariBelum ada peringkat
- Pembuatan AspirinDokumen4 halamanPembuatan AspirinChristopher Herman100% (1)
- Pembuatan Asam Salisilat Dari Minyak GondopuroDokumen13 halamanPembuatan Asam Salisilat Dari Minyak GondopuroAinul AvidaBelum ada peringkat
- Kondensasi AldolDokumen6 halamanKondensasi AldolDiah Syafitri UnesBelum ada peringkat
- Sintesis AsetanilidaDokumen2 halamanSintesis AsetanilidaFitrianti I. Mangalo100% (2)
- N-Butil AsetatDokumen5 halamanN-Butil AsetatDewi LestariBelum ada peringkat
- Pembahasan Praktikum Pembuatan IodoformDokumen5 halamanPembahasan Praktikum Pembuatan IodoformnurfinaBelum ada peringkat
- Laporan Adsorpsi IsotermDokumen12 halamanLaporan Adsorpsi IsotermMuaddinaBelum ada peringkat
- KompleksometriDokumen6 halamanKompleksometriNadia SaputriBelum ada peringkat
- Kompleks oDokumen17 halamanKompleks oKendis Nandya SalimBelum ada peringkat
- Titrasi Semi Bebas AirDokumen5 halamanTitrasi Semi Bebas AirTiara fortuna ARBelum ada peringkat
- Argentometri 2019Dokumen32 halamanArgentometri 2019kevinBelum ada peringkat
- Asam PikratDokumen5 halamanAsam PikratHerlin ArinaBelum ada peringkat
- EsterifikasiDokumen8 halamanEsterifikasiKim Hye NieBelum ada peringkat
- LAPORAN PRAKTIKUM Sintesa Iodoform Izki EflianiDokumen17 halamanLAPORAN PRAKTIKUM Sintesa Iodoform Izki EflianiIzkieflianiBelum ada peringkat
- Sintesis AsetanilidaDokumen7 halamanSintesis AsetanilidaRovinda HadiBelum ada peringkat
- Jurnal 4Dokumen14 halamanJurnal 4Ghani HisyamBelum ada peringkat
- Pembuatan IodoformDokumen5 halamanPembuatan IodoformIrfan Ramadhan100% (1)
- Isomer GeometriDokumen9 halamanIsomer GeometriVicki100% (1)
- Titrasi RedoksDokumen18 halamanTitrasi RedoksD'ma100% (2)
- Titrasi Tidak Langsung NewDokumen17 halamanTitrasi Tidak Langsung NewMuhammad AminBelum ada peringkat
- IODOMETRI DAN IODIMETRI-PembakuanDokumen11 halamanIODOMETRI DAN IODIMETRI-PembakuanPriyanggo ArtadjiBelum ada peringkat
- Makalah IodoformDokumen9 halamanMakalah IodoformRaga Dirgantara AnugrahBelum ada peringkat
- Laporan Akhir Praktikum KafDokumen51 halamanLaporan Akhir Praktikum KafDwiana Arifatur RosyidaBelum ada peringkat
- (DOC) Laporan Praktikum Kimia Organik Sintesis Aspirin Ayu Melinda - Academia - EduDokumen1 halaman(DOC) Laporan Praktikum Kimia Organik Sintesis Aspirin Ayu Melinda - Academia - EduDesi Purwaningsih0% (1)
- Kuis Kimia Analisis 1 Sebelum UTSDokumen25 halamanKuis Kimia Analisis 1 Sebelum UTSYunita Carolline PanggabeanBelum ada peringkat
- Lapres Aspirin Bismillah FixDokumen44 halamanLapres Aspirin Bismillah FixEka SeptianingtyasBelum ada peringkat
- Sintesis AsetanilidaDokumen13 halamanSintesis AsetanilidaSafarin NisrinahBelum ada peringkat
- Sintesis Asam Salisilat Dari Minyak GondopuroDokumen7 halamanSintesis Asam Salisilat Dari Minyak GondopuroDewi Adriana50% (2)
- Reaksi E2Dokumen4 halamanReaksi E2DhikaawanBelum ada peringkat
- AsetanilidaDokumen33 halamanAsetanilidafirda arifatuBelum ada peringkat
- Sintesis AsetanilidaDokumen9 halamanSintesis AsetanilidaPutri Nur AuliyaBelum ada peringkat
- Pengantar Kuantitatif Dan Volumetri (2) - DigabungkanDokumen200 halamanPengantar Kuantitatif Dan Volumetri (2) - DigabungkanOkshella reno FajrianiBelum ada peringkat
- Sintesis P NitroasetanilidaDokumen15 halamanSintesis P NitroasetanilidaEvie WulansariBelum ada peringkat
- Halogenasi AlphaDokumen2 halamanHalogenasi AlphaChintia GautamaBelum ada peringkat
- Halogenasi Alfa Dari Keton Dan AldehidDokumen26 halamanHalogenasi Alfa Dari Keton Dan Aldehidines0% (1)
- Makalah Alkohol Dan Fenol Kelompok 1 Shift B Fkip Kimia IndralayaDokumen14 halamanMakalah Alkohol Dan Fenol Kelompok 1 Shift B Fkip Kimia Indralayahalimatus sakdiahBelum ada peringkat
- Aldehid Dan KetonDokumen19 halamanAldehid Dan KetonDamon NealBelum ada peringkat
- 7 Reaksi Substitusi Alfa Karbonil PDFDokumen12 halaman7 Reaksi Substitusi Alfa Karbonil PDFBaekhyunBelum ada peringkat
- Alkohol Dan Fenol Merupakan Senyawa Organik Yang Memiliki Gugus Fungsi Yang SamaDokumen5 halamanAlkohol Dan Fenol Merupakan Senyawa Organik Yang Memiliki Gugus Fungsi Yang SamaSetyo Eko NugrohoBelum ada peringkat
- Enol Dan EnolatDokumen21 halamanEnol Dan EnolatSanti SBelum ada peringkat