Fisiologi Penyelaman
Diunggah oleh
Astrid Noviera IksanHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Fisiologi Penyelaman
Diunggah oleh
Astrid Noviera IksanHak Cipta:
Format Tersedia
Fisiologi Penyelaman Bernapas merupakan sesuatu hal yang sangat penting pada kehidupan, terutama bagi seorang penyelam.
Pada saat penyelaman tekanan atmosfer di permukaan laut dengan di dalam laut berbeda. Tekanan atmosfer akan menurun pada ketinggian karena atmosfir diatasnya berkurang, sehingga udara pun berkurang. Demikian sebaliknya tekanan akan meningkat bila seorang menyelam di bawah permukaan air. Hal tersebut disebabkan perbedaan berat dari atmosfir dan berat dari air di atas penyelam. Berdasarkan hukum pascal yang menyatakan bahwa tekanan terdapat di permukaan cairan akan menyebar ke seluruh arah secara merata dan tidak berkurang pada setiap tempat di bawah pemukaan laut. Tekanan akan meningkat sebesar 760 mmHg (1 atmosfir) untuk setiap kedalaman 10 m (33 kaki). Satuan-satuan dari jumlah tekanan adalah atmosfir absolut (ATA), sedangkan ukuran tekanan (Gauge Pressure) menunjukkan tekanan yang terlihat pada alat pengukur dimana terbaca 0 pada tingkat permukaan, karena tekanan tersebut selalu 1 atmosfer lebih rendah daripada tekanan absolut (Anonim, 2008a). Seorang penyelam yang menghirup napas penuh di permukaan akan merasakan paru-parunya semakin lama semakin tertekan oleh air di sekelilingnya sewaktu penyelam tersebut turun. Sebelum penyelaman, tekanan udara di dalam paru-paru seimbang dengan tekanan udara atmosfer, yang rata-rata 760 mmHg atau 1 atmosfer pada permukaan laut. Namun pada saat menyelam, udara mengalir ke dalam paru, tekanan udara di dalam paru harus lebih rendah daripada tekanan udara atmosfer. Kondisi tersebut diperoleh dengan membesarnya volume paru. Menurut hukum Boyle tekanan gas di dalam tempat tertutup berbanding terbalik dengan besarnya volume. Bila ukuran tempat diperbesar, tekanan udara di dalamnya turun. Bila ukuran diperkecil, tekanan udara di dalamnya naik. Hukum Boyle berlaku terhadap semua gas-gas di dalam ruangan-ruangan tubuh sewaktu penyelam masuk ke dalam air maupun sewaktu naik ke permukaan (Anonim, 2008a). Sebagai contoh, apabila seorang penyelam Scuba menghirup napas penuh (6 liter) pada kedalaman 10 meter (2 ATA), menahan napasnya dan naik ke permukaan (1 ATA), udara di dalam dadanya akan berlipat ganda volumenya menjadi 12 liter, maka penyelam tersebut harus menghembuskan 6 liter udara selagi naik untuk menghindari agar paru-parunya tidak meledak. Sesuai hukum Boyle maka perhitungannya sebagai berikut : P1 = 2 ATA ; V1 = 6 Liter ; P2 = 1 ATA ; V2 = ? P1V1 = P2V2 V2 = 2 x 6 / 1 V2 = 12 Liter Di permukaan laut (1 ATA) dalam tubuh manusia terdapat kira-kira 1 liter larutan nitrogen. Apabila seorang penyelam turun sampai kedalaman 10 meter (2 ATA) tekanan parsial dari nitrogen yang dihirupnya menjadi 2 kali lipat dan akhirnya yang terlarut dalam jaringan juga menjadi 2 kali lipat (2 liter). Waktu sampai terjadinya keseimbangan tergantung pada daya larut gas di dalam jaringan dan pada kecepatan suplai gas ke dalam jaringan oleh darah. Hal tersebut
sesuai dengan hukum Henry yang menyatakan bahwa pada suhu tertentu jumlah gas yang terlarut di dalam suatu cairan berbanding lurus dengan tekanan partial dari gas tersebut di atas cairan (Anonim, 2008a). Pada kondisi di atas permukaan laut gas nitrogen terdapat dalam udara pernapasan sebesar 79%. Nitrogen tidak mempengaruhi fungsi tubuh karena sangat kecil yang larut dalam plasma darah, sebab rendahnya koefisien kelarutan pada tekanan di atas permukaan laut. Tetapi bagi seorang penyelam Scuba atau pekerja Caisson (pekerja pembangun saluran di bawah air) yang berada pada kondisi udara pernapasan di bawah tekanan tinggi, jumlah nitrogen yang terlarut dalam plasma darah dan cairan interstitial sangat besar.
Anda mungkin juga menyukai
- Fisiologi Penyelaman WordDokumen3 halamanFisiologi Penyelaman Wordgiovannaeunike100% (1)
- KelautanDokumen12 halamanKelautanVyeren Vestal0% (1)
- PROPOSAL PENELITIAN IGA Belum FixDokumen35 halamanPROPOSAL PENELITIAN IGA Belum FixIga JuwitaBelum ada peringkat
- Fisiologi PenyelamanDokumen8 halamanFisiologi PenyelamangiovannaeunikeBelum ada peringkat
- Analisa Jurnal Ronde KeperawatanDokumen2 halamanAnalisa Jurnal Ronde KeperawatanEdwin Donny YahyaBelum ada peringkat
- Makalah Kapal SelamDokumen12 halamanMakalah Kapal Selamirfan pujianto100% (1)
- Matrik Peran Hasil Puskesmas Loksado 2022Dokumen65 halamanMatrik Peran Hasil Puskesmas Loksado 2022Ifu TardyBelum ada peringkat
- 2018 Pengaruh Slow Deep Breathing Terhadap Tekanan Darah Pada Penderita Hipertensi Di Puskesmas Simpang IV Sipin Kota JambiDokumen5 halaman2018 Pengaruh Slow Deep Breathing Terhadap Tekanan Darah Pada Penderita Hipertensi Di Puskesmas Simpang IV Sipin Kota JambiAniesa Nur Laily PertiwiBelum ada peringkat
- Konsep OksigenasiDokumen42 halamanKonsep OksigenasiHendra Kurnia Rakhma100% (2)
- MakalahDokumen5 halamanMakalahAriance PuaparenBelum ada peringkat
- Rencana Harian Ketua Tim IIDokumen15 halamanRencana Harian Ketua Tim IIYoga PrasetioBelum ada peringkat
- Makalah Keperawatan KritisDokumen30 halamanMakalah Keperawatan KritisRajaliBelum ada peringkat
- Brosur Prolanis 1Dokumen2 halamanBrosur Prolanis 1yoga_kusmawanBelum ada peringkat
- LP AsmaDokumen19 halamanLP Asmaadi qiromBelum ada peringkat
- JurnalDokumen7 halamanJurnalDiah PramuditaBelum ada peringkat
- Acute Coronary Syndrome (Acs)Dokumen73 halamanAcute Coronary Syndrome (Acs)IRNADI PERWIRABelum ada peringkat
- Askep KritisDokumen16 halamanAskep KritisJosep Christian Andy NoegrohoBelum ada peringkat
- Asuhan Keperawatan Gawat DaruratDokumen6 halamanAsuhan Keperawatan Gawat DaruratHane TintinBelum ada peringkat
- PresjurDokumen32 halamanPresjurrifkaBelum ada peringkat
- Lembar Balik GastritisDokumen11 halamanLembar Balik GastritisSuyono Alexa AdataBelum ada peringkat
- Bismillah BAB IIDokumen10 halamanBismillah BAB IIMAILI SUSIYETIBelum ada peringkat
- Senam Kaki DMDokumen2 halamanSenam Kaki DMadiospernitiBelum ada peringkat
- LP Gerontik Kardiovaskular VDokumen101 halamanLP Gerontik Kardiovaskular VVeronika Siska100% (2)
- LP HidrosefalusDokumen11 halamanLP HidrosefalusLutfi NovidaBelum ada peringkat
- Tugas Iii Bencana (Table Top Karhutla) RevDokumen24 halamanTugas Iii Bencana (Table Top Karhutla) RevAipul SaputraBelum ada peringkat
- Circulation Syok ManagementDokumen28 halamanCirculation Syok ManagementRaden OfficialBelum ada peringkat
- Pengaruh Posisi PronasiDokumen12 halamanPengaruh Posisi Pronasimei_sugiyantoBelum ada peringkat
- Makalah Kep. Kritis Pemantauan EkgDokumen23 halamanMakalah Kep. Kritis Pemantauan EkgDiah wulandariBelum ada peringkat
- ANALISIS JURNAL MagfiraDokumen21 halamanANALISIS JURNAL MagfiraKurniawaty SupriyadiBelum ada peringkat
- LP-NGT - Umi Putri KHDokumen13 halamanLP-NGT - Umi Putri KHPuttry100% (1)
- FORMAT SAP DG Tabel-2017 EditedDokumen4 halamanFORMAT SAP DG Tabel-2017 Editedtricahyani eyBelum ada peringkat
- EbnpDokumen30 halamanEbnpFaishal IbrahimBelum ada peringkat
- Makalah Hipertensi BueDokumen36 halamanMakalah Hipertensi Bueindah susantiBelum ada peringkat
- ATELEKTASISDokumen30 halamanATELEKTASISAnonymous qWse0YVWFBelum ada peringkat
- LP CKD Hani KusumawatiDokumen38 halamanLP CKD Hani KusumawatiHani KusumawatiBelum ada peringkat
- Durusulughoh 1Dokumen124 halamanDurusulughoh 1Nadia Rasyidah100% (1)
- Organisasi File Sistem Berkas TugasDokumen14 halamanOrganisasi File Sistem Berkas Tugasapi-3809064100% (2)
- EBP-KLP 4 - FixDokumen24 halamanEBP-KLP 4 - Fixmuhammad hidayah100% (1)
- Template Jurnal KesehatanDokumen3 halamanTemplate Jurnal KesehatanAshar RakaiBelum ada peringkat
- EVIDENCE BASED NURSING PicuDokumen21 halamanEVIDENCE BASED NURSING PicuHonsa SBelum ada peringkat
- Sak CHF - AnggrekDokumen20 halamanSak CHF - AnggrekLeni RovanaBelum ada peringkat
- Askep BronkitisDokumen37 halamanAskep BronkitisSindy SeptianaBelum ada peringkat
- Askep Keluarga Dengan TBC 2Dokumen45 halamanAskep Keluarga Dengan TBC 2Elina Dewi0% (1)
- Rps Kesehatan Matra Laut Ta 2021-2022Dokumen10 halamanRps Kesehatan Matra Laut Ta 2021-2022Nur AnnisaBelum ada peringkat
- Cedera KepalaDokumen47 halamanCedera KepalaSri Darmi100% (2)
- Prosedur Resusitasi Jantung ParuDokumen10 halamanProsedur Resusitasi Jantung Parutaranhognhog6082Belum ada peringkat
- Prejur IccuDokumen62 halamanPrejur Iccuchindy pranadia sandyBelum ada peringkat
- Gagal JantungDokumen25 halamanGagal JantungEdwin Danie OlsaBelum ada peringkat
- Karya Tulis Ilmiah Ayu Oktaviani Bab 1-5 SidangDokumen85 halamanKarya Tulis Ilmiah Ayu Oktaviani Bab 1-5 SidangAyu OktavianiBelum ada peringkat
- Analisa Gas DarahDokumen9 halamanAnalisa Gas DarahsafarmanBelum ada peringkat
- Mori Fajar - g1b118058 - Tugas Laporan Pendahuluan TB ParuDokumen31 halamanMori Fajar - g1b118058 - Tugas Laporan Pendahuluan TB ParuMori Jauhari2Belum ada peringkat
- Leaflet HipertensiDokumen2 halamanLeaflet HipertensiPratiwi AyuningtyasBelum ada peringkat
- Buku Gawat Darurat D4Dokumen74 halamanBuku Gawat Darurat D4naufal456Belum ada peringkat
- Hukum Fisika Penyelaman FixDokumen10 halamanHukum Fisika Penyelaman FixRita Hulina SaragihBelum ada peringkat
- Hukum Hukum Fisika Terkait PenyelamanDokumen5 halamanHukum Hukum Fisika Terkait PenyelamanelzychanBelum ada peringkat
- Satuan TekananDokumen6 halamanSatuan Tekananlafuri lafuriBelum ada peringkat
- Hukum BoyleDokumen7 halamanHukum BoyleRahadiyan HadinataBelum ada peringkat
- Fisiologi MenyelamDokumen1 halamanFisiologi MenyelamPradipta ShivaBelum ada peringkat
- Idk KKH Case 1Dokumen5 halamanIdk KKH Case 1linBelum ada peringkat
- Referat DR YossiDokumen23 halamanReferat DR YossiUlen MahuletteBelum ada peringkat
- Patogenesis MarasmusDokumen5 halamanPatogenesis MarasmusAstrid Noviera Iksan0% (1)
- Skenario 1 (Infertilitas)Dokumen10 halamanSkenario 1 (Infertilitas)RatnawuLan AfriyantiBelum ada peringkat
- Anamnesis Yang Penting Pada PCOSDokumen1 halamanAnamnesis Yang Penting Pada PCOSAstrid Noviera IksanBelum ada peringkat
- Mekanisme Kontraksi OtotDokumen2 halamanMekanisme Kontraksi OtotAstrid Noviera IksanBelum ada peringkat
- Etiologi Dan Epidemiologi KepDokumen2 halamanEtiologi Dan Epidemiologi KepAstrid Noviera Iksan0% (1)
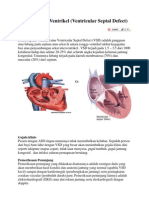
- Defek Septum VentrikelDokumen2 halamanDefek Septum VentrikelAstrid Noviera Iksan100% (1)
- Fisiologi BerkemihDokumen9 halamanFisiologi BerkemihHerlinda Yudi Saputri100% (1)
- Fisiologi HatiDokumen21 halamanFisiologi HatiUmmu KhansaBelum ada peringkat
- Uji Fungsi HatiDokumen21 halamanUji Fungsi HatiAstrid Noviera Iksan100% (1)