Pasca Mortem
Diunggah oleh
Fressylia Raisha FaressiHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Pasca Mortem
Diunggah oleh
Fressylia Raisha FaressiHak Cipta:
Format Tersedia
Fressylia Raisha Faressi
240210140095
IV.
HASIL PENGAMATAN DAN PEMBAHASAN
Praktikum kali ini yaitu mengenai perubahan fisik, kimia, dan fungsional
pasca mortem daging. Tujuan dari praktikum kali ini yaitu untuk melihat dan
mengamati perubahan fisik, kimia, dan fungsional pasca penyembelihan/
pemotongan hewan pada daging yang dihasilkan yang meliputi pengamatan suhu,
pH, tekstur, dan water holding capacity. Daging dapat diartikan sebagai jaringan
otot dari hewan yang telah disembelih (Heinz dan Hautzninger, 2007). Setelah
hewan dipotong atau disembelih dan mati maka aliran darah akan terhenti. Hal ini
akan
menyebabkan
terjadinya
perubahan-perubahan pada
jaringan otot.
Berhentinya sirkulasi darah setelah ternak dipotong akan menyebabkan
terhentinya fungsi darah sebagai pembawa oksigen, sehingga respirasi terhenti
dan berlangsung proses glikolisis anaerob. Proses ini dibagi menjadi 3 fase, yaitu:
fase pre rigor, rigormortis dan post rigor (Forrest et al., 1975).
Praktikum kali ini mengamati perubahan-perubahan pada suhu, pH,
tekstur, dan water holding capacity. Sampel yang diamati pada praktikum kali ini
yaitu daging ikan. Ikan yang akan diamati harus dibunuh sesaat sebelum
pengamatan agar pengamatan benar-benar dilakukan pada kondisi pasca mortem.
4.1.
Pengukuran pH
Tabel 1. Hasil pengamatan pengukuran pH pasca mortem daging ikan
Waktu
pH
pH
(menit)
Ruang
Freezer
0
6.86
6.9
10
6.82
6.74
20
6.85
6.77
30
6.62
6.9
40
6.51
6.72
50
6.57
6.85
60
6.65
6.76
(Sumber: Dokumentasi pribadi, 2015)
Nilai pH merupakan parameter yang dapat digunakan untuk menentukan
tingkat kesegaran hasil perikanan. Berdasarkan pH, dapat ditentukan apakah
daging ikan masih pada fase rigor mortis atau sudah memasuki fase post-rigor
mortis. Umumnya, fase rigor mortis pada ikan terjadi satu hingga tujuh jam
setelah ikan mati (Eskin, 1990; Hadiwoyoto, 1993). Pengukuran pH pada
Fressylia Raisha Faressi
240210140095
praktikum ini diamati pada dua kondisi yang berbeda yaitu pada suhu ruang dan
suhu freezer. Cara untuk mengukur pH pada praktikum kali ini yaitu dengan
sebelumnya mematikan sampel ikan yang diuji. Setelah dimatikan, sampel ikan
langsung diambil sebanyak 5 gram dagingnya dan diukur pH yaitu sebagai pH
yang diukur pada waktu ke-0. Setelah itu, sampel daging ikan lainnya langsung
disimpan pada 2 suhu yang berbeda yaitu suhu ruang dan suhu freezer. Lalu
diambil kembali sebanyak 5 gram dan diukur pH daging tersebut dalam interval
10 menit yaitu pada menit ke-10, 20, 30, 40,50, dan 60. Pengukuran pH dilakukan
dengan terlebih dahulu menghancurkan daging ikan tersebut dengan cara diirisiris lalu masukkan ke dalam beaker glass dan ditambahkan 5 mL akuades lalu
dihomogenkan. Pengukuran pH menggunakan alat bernama pH meter. pH meter
adalah alat ukur elektronik yang digunakan untuk mengukur kadar pH dari sebuah
cairan (Salirawati et al, 2007).
Hasil pengamatan dari pengukuran pH pada suhu ruang dan suhu freezer
yaitu didapatkan pH yang fluktuatif dari pH yang didapatkan pada menit ke-0
hingga menit ke-60. Hasil pH yaitu pada kisaran 6,8 dan hasil ini hampir
mendekati teori yaitu menurut Lawrie (1995), umumnya saat setelah ikan mati pH
ikan mendekati netral, yaitu sekitar 6,8 hingga netral. Namun, hasil pH yang
mengalami fluktuasi seiring dengan bertambahnya waktu tidak sesuai dengan teori
yaitu menurut Buckle et al (1987) pH daging akan terus menurun setelah
pemotongan. Setelah ikan mati, tidak terjadi aliran oksigen di dalam jaringan
perederan darah karena aktivitas jantung dan kontrol otaknya terhenti. Terhentinya
aliran oksigen menyebabkan adanya reaksi anaerob yang tidak diharapkan karena
sering mengakibatkan kerugian. Reaksi anaerob akan menghasilkan asam laktat
hasil perombakan glikogen secara anaerobik yang berakibat terjadinya penurunan
pH (Afrianto dan Liviawaty, 1989).
Namun, adanya peningkatan pH pada daging ikan setelah kematian masih
mungkin terjadi. Hal ini sesuai dengan teori yaitu menurut Suparno (1993),
peningkatan nilai pH terjadi karena enzim yang berasal dari daging ikan dan
mikroba melakukan perombakan terhadap protein dan lemak sehingga
menghasilkan
senyawa-senyawa
bersifat basa. Namun,
peningkatan
pH
seharusnya terjadi pada saat fase post-rigor mortis yang biasanya terjadi pada 12
Fressylia Raisha Faressi
240210140095
jam setelah mati. Padahal sampel yang diuji hanya pada 1 jam setelah mati.
Penyimpangan ini bisa terjadi karena daging ikan kurang dihancurkan saat
sebelum diukur pH nya dengan pH meter sehingga pH yang terukur tidak tepat
seperti pH yang seharusnya. Selain itu, kesalahan juga bisa terjadi karena pada
saat setelah mengukur pH, pH meter tidak dikalibrasi lagi. Setiap kali digunakan,
pH meter harus dikalibrasi dahulu dengan cara dicelupkan ke dalam larutan
standar yang pHnya sudah diketahui (Salirawati et al, 2007).
Kondisi suhu penyimpanan juga dapat berpengaruh pada perubahan pH
daging ikan. Berdasarkan pengamatan, dapat dilihat bahwa pH daging yang
disimpan pada suhu freezer lebih bisa dipertahankan daripada pH daging yang
disimpan pada suhu ruang yang penurunannya mencapai pH 6,51. Hal ini sesuai
dengan teori yaitu bahwa pada suhu rendah (freezer) aktivitas enzim yang
berperan dalam proses glikolisis dan autolisis menjadi terhambat sehingga dapat
menghambat produksi asam laktat dan daya awet ikan menjadi lebih lama (Ilyas,
1983).
4.2.
Pengukuran suhu
Tabel 2. Hasil pengamatan pengukuran suhu pasca mortem daging ikan
Waktu
Suhu
(menit)
0
24.5C
10
24.4C
20
24.4C
30
24.3 C
40
24.3C
50
24.2 C
60
24.2 C
(Sumber: Dokumentasi pribadi, 2015)
Pengukuran suhu pada praktikum kali ini dilakukan yaitu dengan terlebih
dahulu mematikan ikan. Setelah ikan sudah dipastikan mati, lalu langsung diukur
suhunya menggunakan termometer yang dimasukkan ke dalam mulut ikan.
Termometer dimasukkan ke dalam mulut ikan dengan alasan karena mulut ikan
terbuka jadi mudah untuk memasukkan termometer ke dalam tubuh ikan sehingga
suhu yang terukur benar-benar suhu ikan tersebut. Pengukuran suhu dilakukan
pada menit ke-0, 10, 20, 30, 40, 50, dan 60 setelah ikan mati.
Fressylia Raisha Faressi
240210140095
Berdasarkan hasil pengamatan, suhu ikan dari menit ke-0 hingga menit ke60 selalu mengalami penurunan tanpa adanya penaikan suhu. Penurunan suhu
yang terjadi yaitu 24,5oC hingga 24,2oC.
Hal ini sesuai dengan teori yaitu
menurut Buckle et al., (1987), suhu permukaan daging mulai menurun dari suhu
darah ke suhu sekitarnya atau dibawahnya, tergantung pada cara penanganan
sesudah penyembelihan. Penurunan suhu disebabkan oleh beberapa hal, antara
lain regulasi nervous dan hormonal terhenti dan respirasi yang terhenti (Buckle et
al., 1987).
Namun, suhu ikan juga dapat mengalami kenaikan. Hal ini berdasarkan
dari teori yaitu menurut Dwiari et al (2008), setelah ikan mati, suhu badan ikan
menjadi naik. Kenaikan suhu yang terjadi merupakan suhu di dalam jaringan
hewan yang naik sekitar 1-2C, tergantung pada besar-kecilnya hewan, sebagai
akibat proses glikolisis sesudah kematian dimana glikogen diubah menjadi asam
laktat. Proses ini adalah akibat dari glikolisis anaerobik yang berbeda dengan
pernafasan yang terjadi pada hewan yang masih hidup, dan ini merupakan proses
eksothermis. Besar perubahan itu dan jumlah panas yang dihasilkan sebagian
besar ditentukan oleh tingkat jumlah glikogen dalam ternak pada waktu ternak itu
mati (Buckle et al., 1987).
4.3.
Pengukuran water holding capacity metode sentrifus
Tabel 3. Hasil pengamatan pengukuran water holding capacity metode
sentrifus
Sampel
Waktu
Volume Air
Berat (g)
%WHC
(t)
Awal
Akhir
Daging ikan
60
10 ml
12 ml
10,0058
-19,98%
(Suhu Ruang) 120
10 ml
11 ml
10,0020
-9,99%
(Sumber: Dokumentasi pribadi, 2015)
Kapasitas mengikat air (water holding capacity) didefinisikan sebagai
kemampuan dari daging untuk mengikat atau menahan air selama mendapat
tekanan dari luar, seperti pemotongan, pemanasan, penggilingan atau pengepresan
(Forrest et al., 1975). Pengukuran water holding capacity dilakukan dengan
terlebih dahulu mematikan ikan lalu sebanyak 10 gram daging ikan diambil pada
menit ke-60 dan menit ke-120 setelah ikan mati. Daging yang sudah diambil
tersebut kemudian dicacah halus dan dimasukkan ke tabung sentrifuse. Setelah
Fressylia Raisha Faressi
240210140095
itu, ditambahkan aquades dengan perbandingan 1:1 yaitu 10 mL akuades. Tabung
sentrifuse tersebut lalu diikubasi selama 1 hari di dalam freezer. Setelah
diinkubasi, kemudian di sentrifuse dengan kecepatan 3000 rpm selama 20 menit.
Hasil dari proses sentrifuse tersebut yaitu akan terpisah cairan dan cairan itu
dipisahkan lalu diukur volumenya. Pengukuran WHC (Water Holding Capacity)
dilakukan dengan menggunakan perhitungan rumus sebagai berikut.
%WHC
x 100%
= -19,98%
Berdasarkan pengamatan yang telah dilakukan, dapat diketahui bahwa
volume air yang terpisahkan dari daging ikan tersebut semakin sedikit seiring
dengan bertambahnya waktu, sehingga setelah perhitungan nilai WHC pada
daging ikan tersebut mengalami peningkatan yaitu dari -19,98% menjadi -9,99%.
Seharusnya daya ikat air pada daging menurun seiring dengan bertambahnya
waktu. Menurut Eskin (1990), saat masa pra-rigor daging memiliki WHC tinggi
yang menurun pada jam-jam awal setelah waktu kematian. Penurunan daya ikat
air disebabkan oleh makin banyaknya asam laktat yang terakumulasi akibatnya
banyak protein miofibriler yang rusak, sehingga diikuti dengan kehilangan
kemampuan protein untuk mengikat air (Lawrie, 1995). Menurut Soeparno
(1998), bahwa perubahan daya ikat air daging selama penyimpanan diduga karena
terjadinya perubahan ion-ion yang diikat oleh protein daging.
Penyimpangan data yang terjadi pada praktikum kali ini dapat diakibatkan
karena kurang tepatnya volume air yang dipisahkan dari tabung yang telah
disentrifus sehingga volume air yang terhitung tidak akurat. Selain itu, saat
pengamatan seharusnya setelah di-thawing langsung di-sentrifuse. Namun, daging
ikan dibiarkan dalam waktu lama dan mempengaruhi hasil pengamatan. Nilai
WHC yang minus dikarenakan pada rumus yaitu volume awal air dikurangi
dengan volume akhir air. Hasil yang minus didapatkan karena volume akhir air
pasti akan bernilai lebih besar daripada volume awal air karena daging ikan akan
Fressylia Raisha Faressi
240210140095
mengalami penurunan daya ikat air sehingga air yang terlepas dari daging akan
semakin banyak.
Daya ikat air berhubungan dengan pH akhir otot. Jika konsentrasi glikogen
otot pada saat pemotongan cukup maka pH akan mengalami penurunan setelah
rigor mortis dan daging akan lebih empuk. Laju penurunan pH daging
(postmortem) juga merupakan penentu utama dari daya ikat air. Besar penurunan
pH daging (postmortem), akan mempengaruhi daya ikat air dan makin tinggi pH
akhir makin kurang daya ikat airnya (Lawrie, 1995). Menurut Soeparno (1998),
periode pembentukan asam laktat yang menyebabkan penurunan pH otot
postmortem, menurunkan daya ikat air daging dan banyak air yang berasosiasi
dengan protein otot akan bebas meninggalkan serabut otot.
4.4.
Pengamatan kekerasan/organoleptik daging ikan secara subyektif
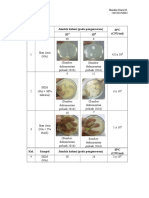
Tabel 4. Hasil pengamatan kekerasan/organoleptik daging secara subyektif
Sifat
Organoleptik
Warna
Aroma
Tekstur
Sisik
Lendir
t=0 menit
Hitam keabuan
+++
Segar
+++
Elastis
+++
Kuat
+++
-
Mata
t=30 menit
Hitam kekuningan
++
Masih segar
++
Masih elastis
++
Masih
++
Agak berlendir
+
Masih jernih
++
Tidak tenggelam,
jernih
+++
Insang
Merah
Merah kehitaman
+++
++
(Sumber: Dokumentasi pribadi, 2015)
t=60 menit
Hitam kekuningan
+
Masih segar
+
Masih elastis
+
Mulai lepas
+
Lender bertambah
++
Masih jernih
+
Merah kehitaman
+
Pengamatan organoleptik daging secara subyektif yaitu dilakukan dengan
mematikan ikan terlebih dahulu. Setelah ikan dipastikan benar-benar mati,
kekerasan ikan dirasakan dengan cara menekannya dengan ibu jari/telunjuk.
Selain kekerasan, sifat organoleptik juga di perhatikan perubahannya yaitu warna,
aroma, tekstur, sisik, lendir, mata, dan insang. Pengamatan dilakukan pada menit
ke-0, 30, dan 60 setelah ikan mati.
Fressylia Raisha Faressi
240210140095
Berdasarkan hasil pengamatan sifat organoleptik pada ikan yang mati yaitu
mengalami perubahan pada seluruh sifat sensorinya. Perubahan warna yang
terjadi pada tubuh ikan yaitu berubah dari hitam keabuan menjadi hitam
kekuningan selama waktu 60 menit sejak ikan mati. Sel yang menjadi sumber
warna pada ikan disebut kromatofora atau iridosit. Kromatofora menimbulkan
warna-warni pada kulit ikan seperti merah, kuning, hitam, dan sebagainya. Iridosit
dapat menimbulkan sifat pemantulan cahaya yang besar sehingga kulit ikan
kelihatan berkilau (Dwiari et al, 2008). Ikan yang segar memiliki penampakan
yang cerah dan tidak suram. Keadaan itu dikarenakan belum banyak perubahan
biokimia yang terjadi (Afrianto dan Liviawaty, 1989). Perubahan warna pada ikan
menjadi pucat disebabkan oleh adanya penguraian kandungan protein pada ikan
oleh bakteri proteolitik sehingga daging ikan menjadi denaturasi dan warna ikan
menjadi tidak segar (Dwiari et al, 2008).
Selain pada tubuh, perubahan warna juga dilihat dari warna insang yang
mengalami perubahan warna dari merah menjadi merah kehitaman selama 60
menit setelah ikan mati. Hasil yang didapatkan sesuai dengan teori yaitu menurut
Afrianto dan Liviawaty (1989), insang ikan yang masih segar berwarna merah
cerah, sedangkan ikan yang tidak segar berubah menjadi lebih gelap. Insang ikan
merupakan pusat darah mengambil oksigen dari dalam air. Ikan yang mati
mengakibatkan peredaran darah terhenti, bahkan sebaliknya dapat teroksidasi
sehingga warnanya berubah menjadi merah gelap
Sifat organoleptik yang diamati selanjutnya yaitu aroma. Berdasarkan hasil
pengamatan selama 1 jam setelah ikan mati, tidak terjadi perubahan aroma pada
ikan. Hal ini berarti bahwa ikan masih dalam keadaan segar pada 1 jam setelah
mati. Namun, jika dibiarkan dalam waktu yang lama, aroma ikan lama kelamaan
akan mengalami perubahan aroma menjadi lebih bau. Perubahan bau yang
menyimpang menjadi busuk pada ikan terjadi karena enzim yang ada pada ikan
terdenaturasi serta terurai sehingga asam amino dan protein pada ikan diubah
menjadi gas amoniak yang merupakan indikator terjadinya pembusukan pada
ikan. selain itu, juga adanya aktivitas mikroorganisme yang mempercepat
terjaidnya pembusukan pada ikan (Ilyas, 1983).
Fressylia Raisha Faressi
240210140095
Berdasarkan hasil pengamatan pada sisik ikan, sisik ikan masih menempel
kuat pada tubuh ikan saat pengamatan menit ke-0 setelah ikan mati. Sisik ikan
mengalami perubahan pada menit ke-60 setelah mati yaitu menjadi mudah lepas
dari tubuh ikan. Hal ini sesuai dengan teori yaitu menurut Hadiwoyoto (1993),
sisik ikan dapat menjadi parameter kesegaran ikan, untuk ikan bersisik jika
sisiknya masih melekat kuat, tidak mudah dilepaskan dari tubuhnya berarti ikan
tersebut masih segar.
Berdasarkan hasil pengamatan terhadap warna mata ikan pada praktikum
kali ini yaitu tidak terjadi perubahan pada mata ikan selama 1 jam setelah ikan
mati. Hal ini menandakan bahwa ikan masih dalam kondisi yang segar. Namun,
mata dapat menjadi parameter kesegaran ikan karena mata dapat mengalami
kemunduran mutu. Selama proses kemunduran mutu mata ikan mengalami
perubahan yang diakibatkan oleh berhentinya aliran darah yang menyuplai
oksigen (Winkler dan Hopkins, 1982).
Berdasarkan hasil pengamatan pada tekstur daging ikan pada 1 jam setelah
ikan mati yaitu tekstur ikan masih elastis seperti saat ikan diamati pada menit ke-0
setelah kematian. Hal ini berarti bahwa ikan masih dalam kondisi segar. Namun,
tekstur daging ikan dapat mengalami kemunduran jika dibiarkan terlalu lama yang
menandakan kemunduran mutu ikan. Kelenturan otot yang hilang diakibatkan ion
Ca2+ yang berikatan dengan protein troponin sehingga menyebabkan terjadinya
ikatan elektrostatik antara filamen aktin dan myosin (aktomiosin) yang ditandai
dengan terjadinya pengkerutan atau kontraksi serabut otot yang tidak dapat balik
(Eskin, 1990). Serabut otot daging ikan hidup mengandung protein dalam gel
lunak. Selama rigor, gel ini menjadi kaku dan bila rigor telah berlalu, otot daging
menjadi lunak, keaadaan ini berlangsung selama 1-7 jam sesaat setelah ikan mati.
Penguraian protein daging ikan karena aktivitas enzim proteolitik mengakibatkan
daging ikan menjadi lunak, kehilangan elastisitasnya, dan meninggalkan bekas
jari pada saat ditekan (Govidan, 1985).
Sifat organoleptik yang diamati selanjutnya yaitu lendir pada tubuh ikan.
Berdasarkan hasil pengamatan, pada menit ke-0 setelah ikan mati tidak terdapat
lendir pada tubuh ikan. Namun, mulai menit ke-30 sudah terdapat lendir pada
tubuh ikan dan terus bertambah pada menit ke-60 setelah ikan mati. Lendir yang
Fressylia Raisha Faressi
240210140095
terbentuk memang salah satu perubahan yang terjadi pada ikan setelah mati.
Menurut Dwiari et al (2008), proses terlepasnya lendir dari kelenjar-kelenjar yang
ada di dalam kulit ikan disebut dengan hyperaemia. Proses selanjutnya yang
terjadi yaitu terbentuk lapisan bening yang tebal di sekeliling tubuh ikan.
Pelepasan lendir dari kelenjar lendir akibat dari reaksi khas suatu organisme.
Lendir tersebut terdiri dari gluko protein dan merupakan substrat yang baik bagi
pertumbuhan bakteri.
Fressylia Raisha Faressi
240210140095
V.
KESIMPULAN DAN SARAN
5.1.
Kesimpulan
Kesimpulan yang dapat diambil berdasarkan praktikum kali ini yaitu:
Hasil pengamatan dari pengukuran pH pada suhu ruang dan suhu
freezer yaitu didapatkan pH yang fluktuatif dari pH yang didapatkan
pada menit ke-0 hingga menit ke-60.
Berdasarkan hasil pengamatan, suhu ikan dari menit ke-0 hingga menit
ke-60 selalu mengalami penurunan tanpa adanya penaikan suhu.
Penurunan suhu yang terjadi yaitu 24,5oC hingga 24,2oC.
Volume air yang terpisahkan dari daging ikan tersebut semakin sedikit
seiring dengan bertambahnya waktu, sehingga setelah perhitungan
nilai WHC pada daging ikan tersebut mengalami peningkatan yaitu
dari -19,98% menjadi -9,99%.
Perubahan warna yang terjadi pada tubuh ikan yaitu berubah dari
hitam keabuan menjadi hitam kekuningan.
Warna insang mengalami perubahan warna dari merah menjadi merah
kehitaman.
Hasil pengamatan selama 1 jam setelah ikan mati, tidak terjadi
perubahan aroma, warna mata, dan tekstur pada ikan.
Sisik ikan masih menempel kuat pada tubuh ikan saat pengamatan
menit ke-0 setelah ikan mati. Namun, mengalami perubahan pada
menit ke-60 setelah mati yaitu menjadi mudah lepas dari tubuh ikan.
Menit ke-0 setelah ikan mati tidak terdapat lendir pada tubuh ikan.
Namun, mulai menit ke-30 sudah terdapat lendir pada tubuh ikan dan
terus bertambah pada menit ke-60 setelah ikan mati.
5.2.
Saran
Saran yang diajukan berdasarkan praktikum kali ini yaitu agar pada
praktikum berikutnya prosedur praktikum harus lebih diperhatikan lagi untuk
meminimalisir terjadinya penyimpangan pada data. Selain itu, harus dipastikan
bahwa sebelum memakai alat, harus dibersihkan dahulu agar tidak terkontaminasi.
Fressylia Raisha Faressi
240210140095
DAFTAR PUSTAKA
Afrianto, Eddy dan Evi Liviawaty. 1989. Pengawetan dan Pengolahan Ikan.
Kanisius: Yogyakarta.
Buckle, K.A., R.A. Edwards, G.A. Fleet, dan M. Wooton. 1987. Ilmu Pangan
Terjemahan Hari P. dan Adiono. Universitas Indonesia Press: Jakarta.
Dwiari, Sri R., Asadayanti D.D., Nurhayati, Mira S., Sandi Frida A.R., dan Ida
Bagus. 2008. Teknologi Pangan Jilid 1. Direktorat Pembinaan Sekolah
Menengah Kejuruan: Jakarta.
Eskin, N.A.M. 1990. Biochemistry of Foods. Academic Press. Inc.: San Diego.
Forrest, J.C., E.B. Aberle, H.B. Hedrick, M.D. Judge, dan R.A. Merkel. 1975.
Principles of Meat Science. W.H. Freeman and Co.: San Fransisco.
Govidan. 1985. Fish Processing Technology. Oxford & IBH Publishing Co.: New
Delhi.
Hadiwiyoto, S. 1993. Teknologi Pengolahan Hasil Perikanan Jilid 1. Liberty:
Yogyakarta.
Heinz, G. dan P. Hautzninger. 2007. Meat Processing Technology for Small to
Medium Scale Producers. FAO: Bangkok.
Ilyas S. 1983. Teknologi Refrigasi Hasil Perikanan. Jilid I. Teknik Pendinginan
Ikan. CV Paripurna: Jakarta.
Lawrie, R.A. 1995. Ilmu Daging. UI-Press: Jakarta.
Salirawati, D., Fitria Meilina K., Jamil Suprihatiningrum. 2007. Belajar Kimia
Secara Menarik. Grasindo: Jakarta.
Soeparno. 1998. Ilmu dan Teknologi Daging. Gadjah Mada University Press:
Yogyakarta.
Suparno. 1993. Pembuatan Filet Ikan. Kumpulan Makalah Seminar Sehari
Pengembangan Agribisnis Ikan Nila Merah di Jawa Barat. Kerjasama
Indonesia Society for Scientific Fisheries dan Pusat Penelitian dan
Pengembangan Perikanan BBAT, Sukabumi.
Winkler B.S. dan Hopkins J.M. 1982. ATPase Activities Of Human Retina and
Pigment Epithelium-choroid. Invest. Ophthamol. Vis.Sci. [22:113].
Anda mungkin juga menyukai
- Laporan Pba SayurDokumen17 halamanLaporan Pba SayurLela MarselaBelum ada peringkat
- Penyimpanan UmbiDokumen7 halamanPenyimpanan UmbiLizza IdzniBelum ada peringkat
- Texture FoodDokumen63 halamanTexture FoodWahyu Dwi SaputraBelum ada peringkat
- 5 6 - Pengeringan Labu KuningDokumen11 halaman5 6 - Pengeringan Labu KuningIfanaru HinataBelum ada peringkat
- Pembahasan Uji Halofilik Dan OsmofilikDokumen10 halamanPembahasan Uji Halofilik Dan OsmofilikShaskianrlBelum ada peringkat
- Pembahasan FoamingDokumen6 halamanPembahasan Foamingmega perdanaBelum ada peringkat
- Laporan Praktikum Mikrobiologi Pangan SterilisasiDokumen9 halamanLaporan Praktikum Mikrobiologi Pangan SterilisasiAdhit FakhriBelum ada peringkat
- Klasifikasi Pangan Dan Gizi Di Indonesia Bahan Ibu Friska PDFDokumen15 halamanKlasifikasi Pangan Dan Gizi Di Indonesia Bahan Ibu Friska PDFAssyifatuHauraZuhdaBelum ada peringkat
- Jam JellyDokumen16 halamanJam JellyLisa YulistBelum ada peringkat
- Kelompok 4 Makalah - Makanan - Curing - Dan - Fermentasi - Teknologi - Makanan - Dan - MinumanDokumen29 halamanKelompok 4 Makalah - Makanan - Curing - Dan - Fermentasi - Teknologi - Makanan - Dan - MinumanfrankBelum ada peringkat
- Leng KapDokumen17 halamanLeng KapstefaniBelum ada peringkat
- Tugas Evaluasi Gizi FixDokumen3 halamanTugas Evaluasi Gizi FixSilvi PrisiliaBelum ada peringkat
- Makalah KhamirDokumen14 halamanMakalah KhamirPutri SasqiaBelum ada peringkat
- Jurnal Pengawetan Suhu RendahDokumen10 halamanJurnal Pengawetan Suhu RendahChristy Sorongan100% (1)
- Bab II Antinutrisi Dan ToksisDokumen65 halamanBab II Antinutrisi Dan ToksisAdwin IsmailBelum ada peringkat
- Jurnal Suhu TinggiDokumen5 halamanJurnal Suhu TinggiSiro 'Cool'Belum ada peringkat
- Laporan Praktikum KBP, Serealia Dan Kacang-KacanganDokumen17 halamanLaporan Praktikum KBP, Serealia Dan Kacang-KacanganIndah MedaniBelum ada peringkat
- Deva Putri Dyana (Antitripsin)Dokumen2 halamanDeva Putri Dyana (Antitripsin)Deva PutriBelum ada peringkat
- Pembahasan OsmofilikDokumen9 halamanPembahasan OsmofilikHanni Listia Furi100% (2)
- Laporan Praktikum Ikan BandengDokumen4 halamanLaporan Praktikum Ikan BandengZAHWANI mhsD3GZ2019BBelum ada peringkat
- Pengawetan - Pengalengan BuahDokumen12 halamanPengawetan - Pengalengan BuahSophia IPBelum ada peringkat
- Fit Oster OlDokumen11 halamanFit Oster OlYopii Edison DjangarBelum ada peringkat
- Perubahan Biokimia DagingDokumen35 halamanPerubahan Biokimia DagingEnjang FathurrohmanBelum ada peringkat
- A Klasifikasi SosisDokumen24 halamanA Klasifikasi SosistulusBelum ada peringkat
- Laporan Ilmu Gizi Mutu PanganDokumen13 halamanLaporan Ilmu Gizi Mutu PanganDhieeant Cruise Nag CLiquersBelum ada peringkat
- Laporan Praktikum Krim&SkimDokumen7 halamanLaporan Praktikum Krim&SkimRidha Aulia AdhaBelum ada peringkat
- Abon AyamDokumen14 halamanAbon AyamNinaBelum ada peringkat
- Empat Rasa DasarDokumen10 halamanEmpat Rasa DasarSyefira SalsabilaBelum ada peringkat
- Beef Brown StockDokumen26 halamanBeef Brown StockListyaBelum ada peringkat
- Laporan Praktikum DagingDokumen13 halamanLaporan Praktikum DagingFranky Arjuna ManurungBelum ada peringkat
- Pemalsuan SusuDokumen7 halamanPemalsuan SusuAdam RifkiBelum ada peringkat
- Laporan DagingDokumen10 halamanLaporan DagingWilla Sari DewiBelum ada peringkat
- Laporan Pba TelurDokumen12 halamanLaporan Pba TelurLela MarselaBelum ada peringkat
- Uji ReduktaseDokumen5 halamanUji Reduktaseindra wijayaBelum ada peringkat
- Laprak - KD - 4 - Penggulaan (1) 2003Dokumen6 halamanLaprak - KD - 4 - Penggulaan (1) 2003Naufal AhmadBelum ada peringkat
- Tugas Mata Kuliah Kimia Pangan FlavourDokumen21 halamanTugas Mata Kuliah Kimia Pangan FlavourTri Lediana TressaBelum ada peringkat
- Laporan Praktikum SusuDokumen9 halamanLaporan Praktikum SusuFAKHRIA SYAFIDAWATIBelum ada peringkat
- BlansingDokumen10 halamanBlansingevelynBelum ada peringkat
- Laporan Praktikum Ibp - Sayur Dan BuahDokumen27 halamanLaporan Praktikum Ibp - Sayur Dan BuahJihanBelum ada peringkat
- Makalah Metode Riset GiziDokumen17 halamanMakalah Metode Riset GiziDarwin Naghthauruzmann ChabuthonomoeenaBelum ada peringkat
- Pengolahan Pangan HHP (Dengan Tekanan Tinggi)Dokumen16 halamanPengolahan Pangan HHP (Dengan Tekanan Tinggi)iskandarBelum ada peringkat
- Pembahasan SusuDokumen10 halamanPembahasan SusuIka Mustikawati0% (1)
- Bab IiDokumen38 halamanBab IiAzies Muin BabaBelum ada peringkat
- Laporan GKD Lauk HewaniDokumen16 halamanLaporan GKD Lauk HewaniDiah Ayu100% (1)
- LAPORAN PRAKTIKUM ANALISIS PANGAN. Analisis Buah Dan SayurDokumen39 halamanLAPORAN PRAKTIKUM ANALISIS PANGAN. Analisis Buah Dan SayurNur AuliyahBelum ada peringkat
- Laporan Praktikum Teknologi Pengolahan PanganDokumen18 halamanLaporan Praktikum Teknologi Pengolahan Pangansyifafauziah96Belum ada peringkat
- D. Cerna ProteinDokumen14 halamanD. Cerna ProteinUmi FazaBelum ada peringkat
- Bab IiDokumen8 halamanBab IiNurel Isnaniah100% (1)
- Laporan GDDK Menu Vegetarian Lacto OvoDokumen11 halamanLaporan GDDK Menu Vegetarian Lacto Ovoraudhatul auliaBelum ada peringkat
- Pasca Panen Tanaman Kacang PanjangDokumen8 halamanPasca Panen Tanaman Kacang PanjangNur Hilaliah RilaBelum ada peringkat
- BAB IV Hasil Dan PembahasanDokumen9 halamanBAB IV Hasil Dan PembahasanPratiwi IndahBelum ada peringkat
- Tugas1 IipSH - Titik Kritis Kehalalan Pangan Daging Dan Ikan (Sarden Saos Tomat Pronas)Dokumen3 halamanTugas1 IipSH - Titik Kritis Kehalalan Pangan Daging Dan Ikan (Sarden Saos Tomat Pronas)Iip SyahidBelum ada peringkat
- Pengawetan Makanan Dengan Suhu Tinggi (Kel B D3 SMT 3)Dokumen9 halamanPengawetan Makanan Dengan Suhu Tinggi (Kel B D3 SMT 3)Merry YaniaBelum ada peringkat
- Laporan DagingDokumen15 halamanLaporan DagingSizna TY100% (1)
- Acara 1 - 4 Rasa DasarDokumen19 halamanAcara 1 - 4 Rasa DasarSeptiani Ekaningrum 'CherryBelum ada peringkat
- ACARA 2 Susu, Tahu SusuDokumen38 halamanACARA 2 Susu, Tahu Susuanindya islamBelum ada peringkat
- PENGARUH LAMA WAKTU PEREBUSAN TERHADAP KADAR PROTEIN DAN AKTIFITAS ANTIOKSIDAN (INVITRO) BROKOLI (Brassica Oleracea L. Var. Botrytis L.)Dokumen6 halamanPENGARUH LAMA WAKTU PEREBUSAN TERHADAP KADAR PROTEIN DAN AKTIFITAS ANTIOKSIDAN (INVITRO) BROKOLI (Brassica Oleracea L. Var. Botrytis L.)Wildan RamadhanBelum ada peringkat
- MAKALAH BIOKIMIA NUTRISI Kandungan Asam Fitat Pada Pakan TernakDokumen10 halamanMAKALAH BIOKIMIA NUTRISI Kandungan Asam Fitat Pada Pakan TernakNia Rakhmayanti Nurdin100% (1)
- Pasca Mortem IkanDokumen12 halamanPasca Mortem IkanmutiBelum ada peringkat
- Pasca Mortem DagingDokumen7 halamanPasca Mortem DagingWulan R Aulia0% (1)