Ringkasan Hukum-Hukum Dasar Kimia
Diunggah oleh
Julia MärðhìyåJudul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Ringkasan Hukum-Hukum Dasar Kimia
Diunggah oleh
Julia MärðhìyåHak Cipta:
Format Tersedia
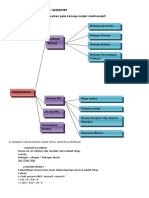
RINGKASAN HUKUM-HUKUM DASAR KIMIA
1. Hukum Kekekalan Massa (oleh Antoine Lavoisier)
Massa total zat sesudah reaksi sama dengan massa total sebelum reaksi.
Massa Sebelum Reaksi = Massa Setelah Reaksi
2. Hukum Perbandingan Tetap (oleh Joseph Proust)
Perbandingan massa unsur-unsur penyusun suatu senyawa selalu tetap, misal rumus
senyawa AsBt.
t x ArB
x massa AsBt
Massa B dalam zat AsBt = Mr AsBt
t x ArB
x %AsBt
% B dalam AsBt = Mr AsBt
banyaknya zat
x 100
% zat dalam campuran = banyaknya campuran
3. Hukum Perbandingan Volume (oleh Joseph Louis Gay-Lussac)
Jika diukur pada tekanan dan temperatur yang sama, volume gas yang bereaksi dan
voolume gas hasil reaksi merupakan perbandingan bilangan dan sederhana.
4. Hukum Avogadro (oleh Amedeo Avogadro)
Pada temperatur dan tekanan yang sama, volume suatu gas sebanding dengan jumlah
mol gas yang terdapat di dalamnya. Hukum ini menjawab kesulitan Gay-Lussac
tentang hubungan volume gas dengan jumlah molekulnya.
V1 V1
V2 = V2 Pada P dan T yang sama
Dengan demikian, jumlah molekul dapat ditentukan sebagai berikut.
V1 n1 jumlah molekul(1)
= =
V2 n2 jumlah molekul(2)
Anda mungkin juga menyukai
- Hukum-Hukum Dasar KimiaDokumen16 halamanHukum-Hukum Dasar KimiaDhanu Eric0% (2)
- Kimia StoikiometriDokumen11 halamanKimia StoikiometriNadya Ayu AnanditaBelum ada peringkat
- Stoikiometri: A. Hukum-Hukum Dasar Ilmu Kimia 1. Hukum Kekekalan Massa (Hukum Lavoisier)Dokumen12 halamanStoikiometri: A. Hukum-Hukum Dasar Ilmu Kimia 1. Hukum Kekekalan Massa (Hukum Lavoisier)Zappir HaBelum ada peringkat
- Rangkuman Stoikiometri PDFDokumen10 halamanRangkuman Stoikiometri PDFRatna SariBelum ada peringkat
- Rumus Kimia Bab 7,8,9Dokumen19 halamanRumus Kimia Bab 7,8,9AhraBelum ada peringkat
- MURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Dokumen10 halamanMURID - KD.3.10 - Stoikiometri - Hukum-Hukum Dasar Kimia & Tugas 7Etnomat Kepulauan SeribuBelum ada peringkat
- Bab 8 Hukum Dasar Dan Perhitungan KmiaDokumen9 halamanBab 8 Hukum Dasar Dan Perhitungan Kmiaaryadwinugroho3Belum ada peringkat
- Diskusi 3 Sesi 3Dokumen3 halamanDiskusi 3 Sesi 3awalBelum ada peringkat
- Rangkuman Materi StoikiometriDokumen6 halamanRangkuman Materi StoikiometriSNurjanahBelum ada peringkat
- Bab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)Dokumen22 halamanBab 4 - Hukum Dasar Dan Perhitungan Kimia (Ipa Kimia X Kurmer)nellaBelum ada peringkat
- Kapsel StoikiometriDokumen16 halamanKapsel StoikiometriyunitaBelum ada peringkat
- Hdmol Kim1 3 240217 094833Dokumen4 halamanHdmol Kim1 3 240217 094833silalahiyonathan6Belum ada peringkat
- Bab 4 Hukum Dasar KimiaDokumen22 halamanBab 4 Hukum Dasar Kimiaapanjin79707Belum ada peringkat
- Capaian PembelajaranDokumen20 halamanCapaian PembelajaranyunitaBelum ada peringkat
- Hukum Dasar-Dasar Kimia: Tugas Merangkum Armelia Dwi Putri (07) Xmipa4Dokumen13 halamanHukum Dasar-Dasar Kimia: Tugas Merangkum Armelia Dwi Putri (07) Xmipa4armeliaBelum ada peringkat
- Tugas KimiaDokumen16 halamanTugas KimiaDwi SutiknoBelum ada peringkat
- Hukum Dasar Kimia - SummaryDokumen5 halamanHukum Dasar Kimia - SummaryCahya NugasBelum ada peringkat
- Ramba 1-2Dokumen24 halamanRamba 1-227. SYAHRIN AZRIL IZULKHAQUEBelum ada peringkat
- Kelompok 3Dokumen12 halamanKelompok 3setijadistefanus482Belum ada peringkat
- Diskusi 3 Kimia DasarDokumen5 halamanDiskusi 3 Kimia Dasarlailatul fitriyahBelum ada peringkat
- StoikhiometriDokumen33 halamanStoikhiometriWina Septia UtariBelum ada peringkat
- StoikiometriDokumen10 halamanStoikiometriJekiBelum ada peringkat
- KD 3.11 Kelas 10 KimiaDokumen6 halamanKD 3.11 Kelas 10 KimiaSintia NingsihBelum ada peringkat
- Pertemuan 1 X MiaDokumen1 halamanPertemuan 1 X MiaAoimoriBelum ada peringkat
- Sec.4 Kimia SM2Dokumen5 halamanSec.4 Kimia SM2huangchasonBelum ada peringkat
- Makalah Kimdas StoikiometriDokumen20 halamanMakalah Kimdas Stoikiometrijanetbela014Belum ada peringkat
- PPT StoikiometriDokumen30 halamanPPT StoikiometriPedi ApriansyahBelum ada peringkat
- Review Lengkap StoikiometriDokumen7 halamanReview Lengkap StoikiometrifaisalBelum ada peringkat
- Modul SMA - StoikiometriDokumen6 halamanModul SMA - StoikiometriTeguh FandjistyoBelum ada peringkat
- Hukum Dasar KimiaDokumen16 halamanHukum Dasar KimiaDarul FiqriBelum ada peringkat
- Tugas Proyek Hukum DasarDokumen1 halamanTugas Proyek Hukum DasarAulia Nur EfendiBelum ada peringkat
- Michell KimiaDokumen14 halamanMichell KimiaプラタマBelum ada peringkat
- Kimdas InfografisDokumen8 halamanKimdas InfografisDhiya DamopoliiBelum ada peringkat
- Kimdas InfografisDokumen8 halamanKimdas InfografisDhiya DamopoliiBelum ada peringkat
- Stoikiometri Klmpok 5Dokumen9 halamanStoikiometri Klmpok 5Wuena PinariaBelum ada peringkat
- LKS X Stoikiometri 2019Dokumen22 halamanLKS X Stoikiometri 2019Global NetBelum ada peringkat
- Bab 6 - Hukum Dasar Ilmu Kimia Dan Perhitungan Kimia 2Dokumen37 halamanBab 6 - Hukum Dasar Ilmu Kimia Dan Perhitungan Kimia 2Iskandar ZulBelum ada peringkat
- StoikiometriDokumen7 halamanStoikiometriMelita meicahyaniBelum ada peringkat
- BAB.5. Hukum Dasar KimiaDokumen4 halamanBAB.5. Hukum Dasar KimiaSherliBelum ada peringkat
- StoikhiometriDokumen31 halamanStoikhiometriMuhammad Nagib HadianBelum ada peringkat
- Materi Hukum Dasar KimiaDokumen5 halamanMateri Hukum Dasar Kimiawinda swastiti26Belum ada peringkat
- Modul Hukum Dasar Ilmu KimiaDokumen4 halamanModul Hukum Dasar Ilmu KimiasintiahardilaBelum ada peringkat
- Stoikiometri (Kelompok 8)Dokumen25 halamanStoikiometri (Kelompok 8)Andi Isna YunitaBelum ada peringkat
- Diskusi 3 Kimia Dasar 1Dokumen3 halamanDiskusi 3 Kimia Dasar 1Shefya AnBelum ada peringkat
- Laporan Artikel Variasi KontinyuDokumen5 halamanLaporan Artikel Variasi KontinyuCitra OcthaBelum ada peringkat
- Konsep MolDokumen44 halamanKonsep MolFarij AbdurrohmanBelum ada peringkat
- Makalah StokiometriDokumen17 halamanMakalah StokiometriNona Tri AuliaBelum ada peringkat
- STOKIOMETRIDokumen9 halamanSTOKIOMETRIJerny ManaluBelum ada peringkat
- Materi 3 StoikiometriDokumen3 halamanMateri 3 StoikiometriWindah WulandariBelum ada peringkat
- Modul HUKUM DASAR KIMIA Dan StoikiometriDokumen40 halamanModul HUKUM DASAR KIMIA Dan StoikiometrinengresqiBelum ada peringkat
- Handout Hukum Dasar KimiaDokumen3 halamanHandout Hukum Dasar KimiaLidya Anggri NoveliaBelum ada peringkat
- 12.1 Stoikiometri I - Penyetaraan Reaksi, Ar, MRDokumen22 halaman12.1 Stoikiometri I - Penyetaraan Reaksi, Ar, MRFara NisrinaBelum ada peringkat
- Materi Kimdas Stokiometri, Kesetimbangan, Karbohidrat, Protein, LemakDokumen25 halamanMateri Kimdas Stokiometri, Kesetimbangan, Karbohidrat, Protein, LemakWahyu TriwidiyastutiBelum ada peringkat
- Stoikiometri, Reaksi Redoks, Elektrokimia Dan Kimia UnsurDokumen34 halamanStoikiometri, Reaksi Redoks, Elektrokimia Dan Kimia UnsurIlmiyah RahmatikaBelum ada peringkat
- Mindmap Hukum Dasar KimiaDokumen1 halamanMindmap Hukum Dasar KimiaSalma ZahiraBelum ada peringkat
- Peta Konsep Hukum DasarDokumen3 halamanPeta Konsep Hukum DasarMalati Amalia Malik50% (6)
- Makalah Kimdas StoikiometriDokumen23 halamanMakalah Kimdas StoikiometriSeptian Setia GunansyahBelum ada peringkat
- Makalah Teori Kinetik GasDokumen6 halamanMakalah Teori Kinetik GasFahrunnisa HN100% (1)
- Materi BiokimiaDokumen2 halamanMateri BiokimiaJulia MärðhìyåBelum ada peringkat
- Katalis Homogen Dan Katalis AsamDokumen21 halamanKatalis Homogen Dan Katalis AsamJulia MärðhìyåBelum ada peringkat
- Silabus Mata KuliahDokumen17 halamanSilabus Mata KuliahJulia MärðhìyåBelum ada peringkat
- Kurikulum 2013 - Kompetensi Dasar - Sekolah Menengah Pertama (9 Feb)Dokumen102 halamanKurikulum 2013 - Kompetensi Dasar - Sekolah Menengah Pertama (9 Feb)Kreshna Aditya100% (1)
- Muhhamad Azyes HerlambankDokumen143 halamanMuhhamad Azyes HerlambankJulia MärðhìyåBelum ada peringkat
- Titrasi Merupakan Suatu Cara Untuk Mengetahui Konsentrasi LarutanDokumen1 halamanTitrasi Merupakan Suatu Cara Untuk Mengetahui Konsentrasi LarutanJulia MärðhìyåBelum ada peringkat
- Kinetika KimiaDokumen20 halamanKinetika KimiaJulia MärðhìyåBelum ada peringkat
- Soal Ujian Semester GenapDokumen2 halamanSoal Ujian Semester GenapJulia MärðhìyåBelum ada peringkat
- 0 Cover Admin Pembelajaran 1415Dokumen1 halaman0 Cover Admin Pembelajaran 1415Budi ArtoBelum ada peringkat
- Program SemesterDokumen7 halamanProgram SemesterJulia MärðhìyåBelum ada peringkat
- Publikasi Berbasis Tesis Dan DisertasiDokumen65 halamanPublikasi Berbasis Tesis Dan DisertasiJulia MärðhìyåBelum ada peringkat
- Manajemen Umum Sistem POACDokumen6 halamanManajemen Umum Sistem POACJulia MärðhìyåBelum ada peringkat
- Rita SugiartiDokumen4 halamanRita SugiartiJulia MärðhìyåBelum ada peringkat
- RPP HidrokarbonDokumen18 halamanRPP HidrokarbonJulia MärðhìyåBelum ada peringkat
- kALENDER 2017-2018Dokumen9 halamankALENDER 2017-2018Julia MärðhìyåBelum ada peringkat
- CoverDokumen2 halamanCoverJulia MärðhìyåBelum ada peringkat
- RPS Mikrobiologi TerapanDokumen4 halamanRPS Mikrobiologi TerapanSuhaila Zakiya NajahBelum ada peringkat
- kALENDER 2016-2017 - PAIDokumen8 halamankALENDER 2016-2017 - PAIJulia MärðhìyåBelum ada peringkat
- Lembar Penilaian Buku UmumDokumen25 halamanLembar Penilaian Buku UmumJulia MärðhìyåBelum ada peringkat
- CJR 1Dokumen9 halamanCJR 1Julia MärðhìyåBelum ada peringkat
- CoverDokumen2 halamanCoverJulia MärðhìyåBelum ada peringkat
- Praktek LapanganDokumen3 halamanPraktek LapanganJulia MärðhìyåBelum ada peringkat
- Bagian JuliaDokumen4 halamanBagian JuliaJulia MärðhìyåBelum ada peringkat
- Jadwal Kosong Dik Kim 2016Dokumen2 halamanJadwal Kosong Dik Kim 2016Julia MärðhìyåBelum ada peringkat
- Coaching Clinic - AISTEEL2017Dokumen24 halamanCoaching Clinic - AISTEEL2017Julia MärðhìyåBelum ada peringkat
- Abstrak Ratna Mustika YasiDokumen2 halamanAbstrak Ratna Mustika YasiJulia MärðhìyåBelum ada peringkat
- Kekuatan 50 Institusi Ilmiah Indonesia PDFDokumen330 halamanKekuatan 50 Institusi Ilmiah Indonesia PDFJulia MärðhìyåBelum ada peringkat
- Ya Aku BerbedaDokumen6 halamanYa Aku BerbedaJulia MärðhìyåBelum ada peringkat
- Tugas ModulDokumen36 halamanTugas ModulJulia MärðhìyåBelum ada peringkat
- Program Tahunan Kelas 2Dokumen7 halamanProgram Tahunan Kelas 2Julia MärðhìyåBelum ada peringkat