VOLMOLAR
Diunggah oleh
MargonoDeskripsi Asli:
Judul Asli
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
VOLMOLAR
Diunggah oleh
MargonoHak Cipta:
Format Tersedia
Praktikum Kimia Fisika II
Penentuan Volume Molar Parsial
Margono Edi Prayitno*, Gayu Ika Putri, Intan Nuriza Azari, Kresentia Eva
Oktavia, Muhammad Yasir, M. Asri Sukma Wijaya (Asisten)
Prodi Teknik Kimia, Fakultas Teknik, Universitas Tanjungpura
Jl. Prof. Dr. H. Hadari Nawawi, Telp/Fax. (0561) 740186 Pontianak 78124
*email: margonoediprayitno@gmail.com
ABSTRAK
Tujuan dari percobaan ini adalah untuk menentukan volume molar parsial
komponen suatu larutan sebagai fungsi konsentrasi dengan cara mengukur
densitas larutan menggunakan piknometer. Pada percobaan ini larutan yang di
gunakan yaitu larutan NaCl dalam air. Metode yang di gunakan pada percobaan
penentuan volume molal parsial adalah metode grafik dan metode analitik.
Larutan NaCl yang di gunakan pada percobaan ini mempunyai berbagai variasi
konsentrasi yaitu 1,5 M; 0,75 M; dan 0,375 M. Variasi konsentrasi ini di peroleh
melalui pengenceran dari larutan induk NaCl 1.5 M menjadi masing – masing
100mL dan di timbang satu persatu dalam piknometer 50mL menggunakan
neraca analitik. Piknometer kosong ditimbang menggunakan neraca analitik,
kemudian piknometer tersebut di isi aquades sampai penuh dan di timbang lagi.
Hasil yang di peroleh dari percobaan ini berupa grafik perbandingan akar molar
dari NaCl ( √𝑛 𝑁𝑎𝐶𝑙 ) dengan volume molar nyata larutan NaCl ( Ø NaCl ) . Dari
hasil percobaan tersebut dapat di simpulkan bahwa densitas NaCl berbanding
lurus dengan konsentrasi dari larutan NaCl . Volume molar parsial NaCl yang
tertinggi yaitu 59,8197 ml/mol.
Kata kunci : densitas ; konsentrasi NaCl; volume molar parsial
1. Pendahuluan piknometer dan termosfat dengan
1.1. Prinsip Percobaan variasi konsentrasi pada NaCl untuk
Prinsip Percobaan ini yaitu mengukur volume larutan, di mana
penentuan volume molar parsial NaCl akan ditentukan rapat massa air dan
sebagai fungsi rapat massa dengan larutan NaCl pada suhu 35ºC selama
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
15 menit, yang bila mana larutan dilakukan yaitu membuat 3 macam
berkurang akan dilakukan konsentrasi larutan NaCl yaitu
penambahan untuk memperoleh 0,375M, 0,75M, dan 1,5M.
volume molar parsialnya. Sebelum Selanjutnya menimbang piknometer
dilakukan perendaman piknometer kosong lalu piknometer tersebut diisi
sehingga dari percobaan, akan didapat sampai penuh dengan larutan yang
rapat massanya yang digunakan untuk akan diukur rapat massanya, usahakan
menentukan volume molar parsialnya. jangan ada udara didalam kapiler
Dalam penentuan volume molarnya piknometer. Gantungkan piknometer
digunakan metode grafik, dimana didalam termosfat pada suhu 35ºC,
dalam grafik tersebut digambarkan posisikan agar seluruh bagian
hubungan volume molar nyata NaCl piknometer berada dibawah
dengan akar mol NaCl. Reaksi yang permukaan selama 15 menit. Amati
terjadi yaitu NaCl (s) + HCl (l) Na+ permukaan larutan didalam
+ Cl- + H2O. piknometer harus masih tetap penuh.
1.2. Tujuan Selanjutnya keluarkan piknometer dari
Menentukan volume molar termosfat dan cepat keringkan dengan
parsial larutan natrium klorida sebagai tisu, kemudian timbang piknometer
fungsi rapat massa. tersebut dengan menggunakan neraca
analitik. Lakukan pekerjaan
2. Metodologi sebelumnya untuk penentuan rapat
2.1. Alat dan Bahan massa air dan larutan NaCl yang telah
Alat-alat yang digunakan dibuat pada pekerjaan pertama.
dalam percobaan ini adalah batang
pengaduk, botol semprot, bulb, 3. Hasil dan Pembahasan
bunsen, gelas ukur, kaki tiga, 3.1. Hasil
termostat, labu ukur, piknometer, 3.1.1 Data Pengukuran NaCl
pipet ukur, spatula, statif, termometer N Konsent m pikno m pikno +
dan timbangan. o rasi kosong NaCl
2.2. Prosedur Kerja NaCl
Langkah pertama yang
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
1 0,375 M 21, 2535 gr 72,4351 gr aplikasinya yaitu kajian pengaruh
2 0,75 M 32,6476 gr 81,3384 gr volume molar parsial terhadap
titik didih gliserol dan etilen
3 1,5 M 21,2535 gr 72,9590 gr
glikol dalam air. Dimana
pengaruh volume molar parsial
3.1.1 Data Pengukuran Akuades
ditentukan dengan pengukuran
N Volume m pikno m pikno +
titik didih campuran beberapa
o Air kosong NaCl
variasi % massa etilen glikol dan
1 50 ml 21, 2535 gr 71,8870 gr gliserol dengan sistem refluks.
2 50 ml 32,6476 gr 80,8905 gr Pada reaksi esterifikasi dengan
konsentrasi katalis H2SO4 5%,
3.2. Pembahasan perbandingan molaritas asam
Volume molar parsial adalah larutan dan gliserol yaitu 1: 2,5
kontribusi pada volum dari satu menghasilkan senyawa α-
komponen dalam sampel terhadap monolaurin sebanyak 31,14%
volum total. Volum molar parsial sebagai hasil utama ( Widiyarti
komponen suatu campuran dan Muhammad, 2008 ). Secara
berubah – ubah tergantung pada matematik, volume molar parsial
komposisi, karena lingkungan didefinisikan sebagai:
𝜕𝑉
setiap jenis molekul berubah jika ( ) ̅𝑖
=𝑉
𝜕𝑛𝑖 𝑇,𝑝,𝑛
komposisinya berubah dari 𝑗
̅𝑖 adalah volume molar
Dimana 𝑉
larutan murni ke b murni.
Perubahan lingkungan molekuler parsial dari komponen ke-i.
dan perubahan gaya yang bekerja ̅𝑖 berarti kenaikan
Secara fisik 𝑉
antara molekul inilah yang dalam besaran termodinamik V
menghasilkan variasi sifat yang diamati bila satu mol
termodinamika campuran jika senyawa i ditambahkan ke suatu
komposisinya berubah ( Atkins, sistem yang besar, sehingga
1999 ). Penentuan volume molar komposisinya tetap konstan.
parsial dapat diaplikasikan dalam Pada temperatur dan tekanan
kehidupan sehari-hari. Contoh konstan, persamaan di atas dapat
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
ditulis sebagai ̅𝑖0
𝑉−𝑛𝑖𝑉
𝜙𝑉𝑖 = Atau
𝑛𝑖
𝑑𝑉 = ∑𝑖 𝑉̅𝑖 𝑑𝑛𝑖 , dan dapat
𝑉 = 𝑛𝑖𝑉̅𝑖0 + 𝑛𝑖 𝜙𝑉𝑖
diintegrasikan menjadi
Dimana 𝑉̅𝑖0 adalah volume molal
𝑉 = ∑𝑖 𝑉̅𝑖 𝑛𝑖
untuk komponen murni .
Arti fisik dari integrasi ini adalah
Pada praktikum ini, digunakan
bahwa ke suatu larutan yang
2 macam zat, yaitu NaCl dan air,
komposisinya tetap, suatu
dan etanol dan air. Maka,
komponen n1, n2,..., ni ditambah
persamaan di atas dapat ditulis
lebih lanjut, sehingga komposisi
menjadi:
relatif dari tiap-tiap jenis tetap
𝑉 = 𝑛1 𝑉̅10 + 𝑛2 𝜙𝑉2
konstan. Karenanya besaran
Dimana 𝑛1 adalah jumlah mol air,
molal ini tetap sama dan integrasi
dan 𝑛2 adalah jumlah mol zat
diambil pada banyaknya mol (
terlarut (NaCl).
Dogra dan Dogra, 1984 ).
𝑚1
Ada tiga sifat termodinamik 𝑉̅10 =
𝜌𝑎𝑖𝑟
molal parsial utama, yakni: (i)
Dimana 𝑚1 adalah massa pelarut,
volume molal parsial dari
dalam hal ini adalah air, dan
komponen-komponen dalam 𝑚1 +𝑚2
𝑉= , sehingga,𝜙𝑉2 =
𝜌𝑙𝑎𝑟
larutan (juga disebut sebagai
𝑚1 +𝑚2 𝑚1
̅10 −
panas differensial larutan), (ii) 𝑉−𝑛1 𝑉
𝜙𝑉2 =
𝜌𝑙𝑎𝑟 𝜌𝑎𝑖𝑟
𝑛2 𝑛2
entalpi molal parsial, dan (iii)
untuk 𝜙𝑉2 pada 1 mol. Sedangkan
energi bebas molal parsial
harga 𝜙𝑉2 pada variasi 𝑛2 mol
(potensial kimia). Sifat-sifat ini
adalah
dapat ditentukan dengan bantuan
𝑚1 + 𝑚2 𝑚1
(i)metode grafik,(ii) 𝜙𝑉2 = −
𝜌𝑙𝑎𝑟 𝜌𝑎𝑖𝑟
menggunakan hubungan analitik Setelah didapatkan semua harga
yang menunjukkan V dan ni, dan 𝜙𝑉2 dalam masing-masing variasi
(iii) menggunakan suatu fungsi
mol, maka semua harga ini dapat
yang disebut besaran molal nyata
diplot terhadap 𝑛2 mol.
yang ditentukan sebagai ( Imai,
Kemiringan yang didapatkan dari
2007 ) :
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
𝜕𝜙𝑉 elekrolit kuat yang akan terurai
grafik ini adalah ( 𝜕𝑛 2 ), dan
2
menjadi ion Na+ dan Cl- di
dapat digunakan untuk
dalam air dan mampu menyerap
menentukan harga volum molal
air tanpa adanya penambahan
parsial (𝑉̅2 ), berdasarkan
volume suatu larutan, sehingga
persamaan berikut ( Rield, 1991 ):
disebut dengan volume molal
𝜕𝜙𝑉
𝑉̅2 = 𝜙𝑉2 + 𝑛2 ( 𝜕𝑛 2 ).
2 parsial semu ( Basuki, 2003 ).
Percobaan yang diakukan Sebelum dimulai kegiatan
yaitu menentukan volume molal percobaan, diawali dengan
parsial larutan NaCl dan air menimbang berat piknometer
(aquades). Percobaan ini kosong dan berat piknometer
dilakukan dengan 3 macam yang berisi akuades. Tujuan
variasi molar, yaitu 0.375 M; 0,75 mengukur berat piknometer di
M; dan 1,5 M karena pada masing sini karena hasil berat
masing zat ( larutan NaCl dan piknometer kosong dan berat
akuades ) yang memiliki tujuan piknometer berisi akuades akan
untuk membandingkan besarnya digunakan dalam proses
volum molal parsial dari NaCl penghitungan volume piknometer
dan akuades dalam air pada nantinya.
konsentrasi tertentu. volum molar Saat hendak mengukur
parsial berbanding lurus dengan berat piknometer berisi akuades,
konsentrasinya. Jadi, semakin maka tutup piknometer dibuka
besar konsentrasi suatu larutan, terlebih dahulu, setelah itu
maka semakin besar pula nilai akuades dituangkan ke dalam
volum molal parsialnya ( Bird, piknometer hingga penuh. Hal ini
1993 ). bertujuan agar saat piknometer
Pada percobaan ini, nantinya ditimbang, maka
larutan yang digunakan yaitu dipastikan piknometer telah
larutan NaCl dan akuades. Alasan penuh berisi akuades (tidak ada
penggunaan NaCl dikarenakan ruang yang tersisa). Selain itu,
NaCl merupakan larutan juga diusahakan agar saat
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
pengisian larutan atau penutupan NaCl yang lebih besar dari berat
piknometer tidak terdapat molekul air. Pada akuades pun
gelembung udara di dalam terjadi kenaikan massa jenis
piknometer. Hal ini dapat seiring dengan meningkatnya
mempengaruhi penghitungan molalitas.
berat piknometer nantinya. Hasil percobaan yang
Mula-mula dicari massa menyatakan bahwa saat
jenis air dengan menimbang air konsentrasi larutan NaCl 1,5 M
dalam piknometer. Selanjutnya, densitasnya 1,0341 g/ml, pada
didalam piknometer penentuan konsentrasi 0,75 M densitasnya
massa jenis air dilakukan 0,9738 g/ml, pada konsentrasi
penimbangan masing-masing 0,375 M densitasnya 1,0236
larutan dengan 4 macam variasi g/ml ( Daintith, 1994 ). Pada
tersebut. Massa jenis air yang penentuan massa air, massa air
didapatkan adalah 0,9941 gr/ml. pada nomor piknometer bewarna
Sedangkan massa jenis larutan biru massanya 32,6476 gram dan
NaCl maupun air menunjukkan pada pikno bewarna coklat
kenaikan dalam molaritas yang 21,2535 gram. Penentuan massa
semakin tinggi pula,semakin jenis NaCl dari konsentrasi
tinggi molaritasnya maka massa terkecil ke terbesar berturut-turut
nya juga akan lebih besar, yaitu 1,0236 gr/cm3 ; 0,9738
sehingga dapat menambah berat gr/cm3; dan 1,0341 gr/cm3.
dari larutannya dalam air. Massa Uraian tersebut jelas menyatakan
larutan yang tinggi ini yang bahwa nilai densitas suatu larutan
menyebabkan semakin berbanding lurus dengan nilai
meningkatnya massa jenis konsentrasi larutan tersebut.
larutan. Untuk larutan NaCl, Jumlah mol solute per kg solven
seharusnya massa jenis larutannya atau biasa disebut molalitas
akan menunjukkan nilai yang apabila dibandingakan dengan
lebih besar dari pada massa jenis nilai volume molar parsial
air, karena berat molekul dari sebuah perbandingan yang sama.
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
Pada analisa grafik, data Basuki, Atastrina Sri. 2003. Buku
pertama dan kedua menunjukkan Panduan Praktikum Kimia
kenaikan yang teratur atau tidak Fisika. Depok: Laboratorium
terlalu signifikan. Sampai data Dasar Proses Kimia
ketiga, mengalami penurunan Departemen Teknik Gas dan
sehingga belum sesuai dengan Petrokimia Fakultas Teknik
teori di atas. Dari data grafik Universitas Indonesia.
diketahui y=bx+a menghasilkan Bird Tony. 1993. Kimia Fisika
angka -0,1545x + 58,553 dan R2 untuk Universitas Edisi III.
didapatkan 0,0296 sehingga Jakarta: Gramedia Pustaka.
volume molar parsial NaCl Daintith J. 1994. Kamus Lengkap
tertinggi adalah 59,8197 ml/mol. Kimia. Jakarta: Erlangga.
Dogra, S.K dan Dogra S. 1984.
4. Simpulan Kimia Fisika dan Soal-Soal.
Setelah melakukan Jakarta: Erlangga.
percobaan penentuan volume Imai, T. 2007. Molecular Theory
molar parsial dan berdasarkan of Partial Molar Volume and is
data yang diperoleh dari Application to Biomecular
percobaan, maka disimpulkan System. Condensed Metter
bahwa pada temperatur tinggi Physhic Jurnal. 10(3): 34 -
(35oC) larutan NaCl maupun 361.
akuades lebih bereaksi lebih Rield, R.C. 1991. Sifat Gas dan
cepat. Volume molar parsial NaCl Zat Cair. Jakarta: Gramedia
tertinggi yang dihasilkan dalam Pustaka.
percobaan adalah sebesar 59,8197 Widiyarti, G dan Muhammad
ml/mol. Hanafi. 2008. Pengaruh
Konsentrasi Katalis dan
Daftar Pustaka Perbandingan Molaritas
Atkins, P.W. 1999. Kimia Fisika Reaktan Sintesis Senyawa α-
Jilid 3 Edisi III. Jakarta: Monolaurin.Jurnal Reaktan.
Erlangga. 12(2): 90 - 97.
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
Lampiran
1. PERHITUNGAN
1.1. Penentuan Massa Air
Massa air = (massa pikno+air) – (massa pikno kosong)
a. m1 = 71,8870 gr - 21,2535 gr = 50,6335 gr
b. m2 = 80,8905 gr - 32,6476 gr = 48,2429 gr
1.2. Molalitas Air
𝑚 𝐴𝑖𝑟
n H2O = 𝑀𝑟 𝐴𝑖𝑟
50,6335 𝑔𝑟
a. n1 = = 2,8130 mmol
18 𝑔𝑟 𝑚𝑜𝑙
48,2429 𝑔𝑟
b. n2 = = 2,6802 mmol
18 𝑔𝑟 𝑚𝑜𝑙
1.3. Penentuan Masaa NaCl
Massa NaCl = ( massa NaCl + pikno) – (massa pikno kosong)
a. M = 0,375 M
m1= 72,4351 gr - 21,2535 gr = 51,1816 gr
b. M = 0,75 M
m2= 81,3384 gr - 32,6476 gr = 48,6908 gr
c. M = 1,5 M
m3= 72,9590 gr - 21,2535 gr = 51,7055 gr
1.4. Volume Air
𝑚 𝐴𝑖𝑟
𝜌 𝑎𝑖𝑟 = 𝑉𝑎𝑖𝑟
𝑚 𝐴𝑖𝑟
𝑉 𝑎𝑖𝑟 = 𝜌 𝑎𝑖𝑟
50,6335 𝑔𝑟
a. V1 air = 0,9941 𝑔𝑟/𝑚𝑙 = 50,9340 ml
48,2429 𝑔𝑟
b. V2 air = 0,9941 𝑔𝑟/𝑚𝑙 = 48,5292 ml
1.5. Massa Jenis NaCl
𝑚 𝑁𝑎𝐶𝑙
𝜌1 𝑁𝑎𝐶𝑙 =
𝑉 𝑁𝑎𝐶𝑙
51,1816 𝑔𝑟
a. 𝜌 1 = = 1,0236 gr/ml
50 𝑚𝑙
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
48,6908 𝑔𝑟
b. 𝜌 2 = = 0,9738 gr/ml
50 𝑚𝑙
51,7055 𝑔𝑟
c. 𝜌 3 = = 1,0341 gr/ml
50 𝑚𝑙
1.6. Volume NaCl
𝑚 𝑁𝑎𝐶𝑙
V NaCl = 𝜌 𝑁𝑎𝐶𝑙
51,1816 𝑔𝑟
a. V1 = 1,0236 𝑔𝑟/𝑚𝑙 = 50 ml
48,6908 𝑔𝑟
b. V2 = 0,9738 𝑔𝑟/𝑚𝑙 = 50 ml
51,7055 𝑔𝑟
c. V3 = 1,0341 𝑔𝑟/𝑚𝑙 = 50 ml
1.7. Molalitas NaCl
n NaCl = M x V
a. n1 = 0,375 M x 50 ml = 18,75 mmol
b. n2 = 0,75 M x 50 ml = 37,5 mmol
c. n3 = 1,5 M x 50 ml = 75 mmol
1.8. Volume Molar Nyata
1 1000 (𝑚 𝑝𝑖𝑘𝑛𝑜+𝑁𝑎𝐶𝑙)−(𝑚 𝑝𝑖𝑘𝑛𝑜+𝑎𝑖𝑟)
Ø = 𝜌 𝑁𝑎𝐶𝑙 [ Mr NaCl - 𝑛 𝑁𝑎𝐶𝑙 x (𝑚 𝑝𝑖𝑘𝑛𝑜+𝑎𝑖𝑟)−(𝑚 𝑝𝑖𝑘𝑛𝑜 𝑘𝑜𝑠𝑜𝑛𝑔)]
1 1000 (72,4351 gr)−(71,8870 gr)
a. Ø1 = 1,0236 𝑔𝑟/𝑚𝑙 [ 58,5 - 18,75 𝑚𝑚𝑜𝑙 x (71,8870 gr)−(21,2535 gr)]
= 56,5872 ml/mol
1 1000 (81,3384 gr)−(80,8905 gr)
b. Ø2 = 0,9738 𝑔𝑟/𝑚𝑙 [ 58,5 - 37,5 𝑚𝑚𝑜𝑙 x (80,8905 gr)−(32,6476 gr)]
= 59,8197 ml/mol
1 1000 (72,9590 gr)−(71,8870 gr)
c. Ø3 = 1,0341 𝑔𝑟/𝑚𝑙 [58,5- 75 𝑚𝑚𝑜𝑙 x (71,8870 gr)−(21,2535 gr))]
= 56,2979 ml/mol
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
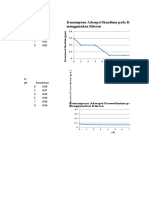
Tabel Volume Molar Parsial NaCl
M NaCl Ø NaCl √𝑛 𝑁𝑎𝐶𝑙
0,375 M 56,5872 ml/mol 4,3301
0,75 M 59,8197 ml/mol 6,1237
1,5 M 56,2979 ml/mol 8,6603
Grafik Hubungan √𝑛 𝑁𝑎𝐶𝑙 dengan Ø NaCl
√(n NaCl) VS Ø NaCl
59.8197
60
59.5
59
58.5
58
57.5
57 56.5872 y = -0.1545x + 58.553
R² = 0.0296 56.2979
56.5
56
0 2 4 6 8 10
Series1 Linear (Series1)
2. DOKUMENTASI
LAMPIRAN FOTO
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Praktikum Kimia Fisika II
Penimbangan Bahan Pembuatan Larutan
Pemanasan Piknometer+Larutan NaCl Waterbath untuk
Memanaskan Larutan
Margono Edi Prayitno (D1121171009) Penentuan Volume Molar Parsial
Anda mungkin juga menyukai
- VOLPARDokumen13 halamanVOLPARa d e eBelum ada peringkat
- SifatKoligatifDokumen5 halamanSifatKoligatifTiffany Alexandria 潘圆秀100% (1)
- Volume Molal ParsialDokumen12 halamanVolume Molal ParsialLailatul IsnaeniBelum ada peringkat
- Fahmi Shihab-1187040020-Prak - Organik 11Dokumen15 halamanFahmi Shihab-1187040020-Prak - Organik 11Fahmi ShihabBelum ada peringkat
- Tugas Pendahuluan Praktikum Volume Molar ParsialDokumen5 halamanTugas Pendahuluan Praktikum Volume Molar Parsialranissinarr0% (1)
- Laporan B1 Widya Wigati 10511035Dokumen19 halamanLaporan B1 Widya Wigati 10511035Widya WigatiBelum ada peringkat
- TERMOKIMIADokumen4 halamanTERMOKIMIAhimmaauliaputriBelum ada peringkat
- Tugas Pendahuluan Praktikum Volume Molar ParsialDokumen4 halamanTugas Pendahuluan Praktikum Volume Molar ParsialSangkarmanuk100% (3)
- Lapse Sol LiofilDokumen14 halamanLapse Sol LiofilFickrhy ChamboshyBelum ada peringkat
- Tugas Pendahuluan Percobaan N-1 Penentuan Volume Molar ParsialDokumen4 halamanTugas Pendahuluan Percobaan N-1 Penentuan Volume Molar ParsiallutviaputriBelum ada peringkat
- Laporan C1 Penentuan Tetapan Pengionan Secara SpektrofotometriDokumen10 halamanLaporan C1 Penentuan Tetapan Pengionan Secara SpektrofotometriAirlangga Diandra PutraBelum ada peringkat
- Penentuan Kandungan Karbonat Dan Hidrogen KarbonatDokumen5 halamanPenentuan Kandungan Karbonat Dan Hidrogen KarbonatTita Erlanda SumendapBelum ada peringkat
- Penentuan Tetapan Pengionan Secara SpektrofotometriDokumen14 halamanPenentuan Tetapan Pengionan Secara SpektrofotometriLisaSeptianaBelum ada peringkat
- TERMOKIMIADokumen23 halamanTERMOKIMIAAMALAY RAFFLI ARNOLDYBelum ada peringkat
- Laporan 10 KADDokumen16 halamanLaporan 10 KADKrisna Yudha SBelum ada peringkat
- Penentuan Kadar Karbonat Dan Hidrogen KarbonatDokumen6 halamanPenentuan Kadar Karbonat Dan Hidrogen Karbonatyoh_rico100% (1)
- TP 4Dokumen3 halamanTP 4Avelia VanyBelum ada peringkat
- Laporan 1 Penentuakn Berat Molekul Berdasarkan Pengukuran Massa Jenis Gas, BLM FixDokumen21 halamanLaporan 1 Penentuakn Berat Molekul Berdasarkan Pengukuran Massa Jenis Gas, BLM FixWidiasti Ni Putu100% (1)
- Laporan Kelarutan Timbal BalikDokumen10 halamanLaporan Kelarutan Timbal BalikFumin TjiaBelum ada peringkat
- Laporan D1 D2 Sifat Koligatif LarutanDokumen13 halamanLaporan D1 D2 Sifat Koligatif LarutanAirlangga Diandra Putra100% (6)
- PANAS PEMBAKARAN NAFTALENADokumen19 halamanPANAS PEMBAKARAN NAFTALENA012 Nuzila Rif’atul HimahBelum ada peringkat
- Ionisasi BasaDokumen8 halamanIonisasi BasaDevi Citra RastutiBelum ada peringkat
- Prakt. 3 Mempelajari Sifat Gas-Gas NitrogenDokumen13 halamanPrakt. 3 Mempelajari Sifat Gas-Gas NitrogenQorry Dinnia Fatma100% (1)
- Edoc - Tips Penataan Ulang Beckmann Muhammad Fadhil Dwi SaputraDokumen4 halamanEdoc - Tips Penataan Ulang Beckmann Muhammad Fadhil Dwi SaputraLilisBelum ada peringkat
- Kalor Pembakaran Briket dan NaftalenaDokumen10 halamanKalor Pembakaran Briket dan NaftalenaChandra WijayantiBelum ada peringkat
- Full Report Penataan Ulang Beckm Ann FixDokumen4 halamanFull Report Penataan Ulang Beckm Ann FixNurlaeli NaelulmunaMajdiyah100% (1)
- Laporan Resmi Kimia Anorganik Kelompok 2 - Penentuan KSP Ca (OH) 2Dokumen15 halamanLaporan Resmi Kimia Anorganik Kelompok 2 - Penentuan KSP Ca (OH) 2Agung GuritnoBelum ada peringkat
- TP 4Dokumen4 halamanTP 4a d e eBelum ada peringkat
- Koefisien DistribusiDokumen41 halamanKoefisien DistribusiAyu Maulina Sugianto100% (2)
- Laporan Praktikum Kimfis Pengukuran Viskositas Cairan Untuk Menentukan Jari-JarimolekulDokumen14 halamanLaporan Praktikum Kimfis Pengukuran Viskositas Cairan Untuk Menentukan Jari-JarimolekulPutu AstiniBelum ada peringkat
- Penentuan BM CHCl3Dokumen9 halamanPenentuan BM CHCl3Desi0% (1)
- Laporan Praktikum Dasar Part IIIDokumen11 halamanLaporan Praktikum Dasar Part IIIfauziBelum ada peringkat
- Percobaan 4Dokumen4 halamanPercobaan 4Anis FuadBelum ada peringkat
- LAPORAN VOLUM MOLARDokumen22 halamanLAPORAN VOLUM MOLARrivi dwiBelum ada peringkat
- Ekstraksi Logam NikelDokumen17 halamanEkstraksi Logam NikelwitriBelum ada peringkat
- Laporan Sol LiofilDokumen11 halamanLaporan Sol LiofilshafiraBelum ada peringkat
- Penentuan Kadar Karbonat Dan Hidrogen Karbonat Melalui Titrasi Asam BasaDokumen10 halamanPenentuan Kadar Karbonat Dan Hidrogen Karbonat Melalui Titrasi Asam BasaTria_Kanzaki100% (2)
- Yeni Adi Tiani - 20307141046 - Volume Molal ParsialDokumen34 halamanYeni Adi Tiani - 20307141046 - Volume Molal ParsialYeni AdtnBelum ada peringkat
- KELARUTAN FENOL DAN AIRDokumen16 halamanKELARUTAN FENOL DAN AIRDwi NofaBelum ada peringkat
- Penentuan Berat Molekul Berdasarkan Massa Jenis GasDokumen14 halamanPenentuan Berat Molekul Berdasarkan Massa Jenis GasChi Chachi ChanBelum ada peringkat
- Reaksi SN1 dan SN2 Alkil HalidaDokumen5 halamanReaksi SN1 dan SN2 Alkil HalidaJokoSuswonoBelum ada peringkat
- Isoterm Adsorpsi Karbon AktifDokumen12 halamanIsoterm Adsorpsi Karbon AktifSofie ShobyBelum ada peringkat
- Penentuan Volume Molal ParsialDokumen21 halamanPenentuan Volume Molal ParsialRifa'atul MahmudahBelum ada peringkat
- Pembahasan Kalorimeter KlasikDokumen1 halamanPembahasan Kalorimeter KlasikWini Rizky Gustiani100% (1)
- Metode Job Untuk Menentukan Komposisi Kompleks Ion Besi SalisilatDokumen14 halamanMetode Job Untuk Menentukan Komposisi Kompleks Ion Besi SalisilatLindyanBelum ada peringkat
- Percobaan 3 Penentuan Kandungan Karbonat Dan Hidrogen Karbonat Dalam Campurannya Secara TitrimetriDokumen4 halamanPercobaan 3 Penentuan Kandungan Karbonat Dan Hidrogen Karbonat Dalam Campurannya Secara TitrimetriVini Yulianti100% (1)
- Titrasi PermanganatometriDokumen9 halamanTitrasi PermanganatometriJay AnggaraBelum ada peringkat
- Kelarutan timbal balik dan temperatur kritisDokumen10 halamanKelarutan timbal balik dan temperatur kritisNur IlmaBelum ada peringkat
- Persamaan NernstDokumen13 halamanPersamaan NernstYeri LukviBelum ada peringkat
- Laporan 2 Sintesis Anorg - Natrium TiosulfatDokumen16 halamanLaporan 2 Sintesis Anorg - Natrium TiosulfatFatchiyatun Ni'mahBelum ada peringkat
- Percobaan 6 Penentuan Asam Askorbat Dalam Tablet ViCeeDokumen4 halamanPercobaan 6 Penentuan Asam Askorbat Dalam Tablet ViCeeVini YuliantiBelum ada peringkat
- Volume Molar ParsialDokumen9 halamanVolume Molar ParsialjoshuacharismaBelum ada peringkat
- Laporan Molar ParsialDokumen6 halamanLaporan Molar ParsialMuaddinaBelum ada peringkat
- Laporan Volume Molar ParsialDokumen12 halamanLaporan Volume Molar ParsialYogaPratama67% (3)
- LaporanDokumen16 halamanLaporanDARWINIBelum ada peringkat
- Laporan Praktikum Volume Molal ParsialDokumen18 halamanLaporan Praktikum Volume Molal ParsialWhyna Hafid92% (13)
- Volume Molar ParsialDokumen12 halamanVolume Molar ParsialIvo Risti HandayaniBelum ada peringkat
- Laporan Kimia Fisik Volume Molal ParsialDokumen21 halamanLaporan Kimia Fisik Volume Molal ParsialLinda Faiqotul Himmah80% (5)
- KESET VOLUM MOLAL PArsial NewDokumen8 halamanKESET VOLUM MOLAL PArsial NewAnisatul Afifah SafitriBelum ada peringkat
- Jbptppolban GDL Indahhanap 4032 3 Bab2 4Dokumen26 halamanJbptppolban GDL Indahhanap 4032 3 Bab2 4nur azizahBelum ada peringkat
- Cover Laporan Praktikum-1Dokumen2 halamanCover Laporan Praktikum-1MargonoBelum ada peringkat
- Cover Laporan PraktikumDokumen2 halamanCover Laporan PraktikumMargonoBelum ada peringkat
- Ekstraksi ModulDokumen5 halamanEkstraksi ModulMargonoBelum ada peringkat
- Daftar Aslab Dan Kelompok Praktikum Kimia-1Dokumen1 halamanDaftar Aslab Dan Kelompok Praktikum Kimia-1MargonoBelum ada peringkat
- 5 Teknik Jitu Public Speaking Untuk Pemula Final PremiumDokumen35 halaman5 Teknik Jitu Public Speaking Untuk Pemula Final PremiumMargonoBelum ada peringkat
- Prinsip Dan Jenis Heat ExchangerDokumen6 halamanPrinsip Dan Jenis Heat ExchangerAmadea VaniaBelum ada peringkat
- Dokumentasi Kegiatan PKM-K ProtilusiDokumen17 halamanDokumentasi Kegiatan PKM-K ProtilusiMargonoBelum ada peringkat
- LogbookDokumen12 halamanLogbookMargonoBelum ada peringkat
- Cover PMKM TematikDokumen1 halamanCover PMKM TematikMargonoBelum ada peringkat
- KITOSAN ADSORPSI LOGAMDokumen6 halamanKITOSAN ADSORPSI LOGAMArief FebrieantoBelum ada peringkat
- RX Chitosan FadliDokumen7 halamanRX Chitosan FadliMargonoBelum ada peringkat
- 2292 3816 1 SMDokumen6 halaman2292 3816 1 SMnovitahanaBelum ada peringkat
- 5 Teknik Jitu Public Speaking Untuk Pemula Final PremiumDokumen35 halaman5 Teknik Jitu Public Speaking Untuk Pemula Final PremiumMargonoBelum ada peringkat
- Doa PembukaDokumen1 halamanDoa PembukaMargonoBelum ada peringkat
- ANALISIS KUALITATIFDokumen24 halamanANALISIS KUALITATIFMargonoBelum ada peringkat
- Tutorial MatlabDokumen29 halamanTutorial MatlabMaskur UsmantoBelum ada peringkat
- Yospi Rian Putra-D1121171014 PDFDokumen13 halamanYospi Rian Putra-D1121171014 PDFMargonoBelum ada peringkat
- Cover LPJ KimdasDokumen2 halamanCover LPJ KimdasMargonoBelum ada peringkat
- Manajemen BisnisDokumen6 halamanManajemen BisnisMargonoBelum ada peringkat
- Konduktivitas TermalDokumen2 halamanKonduktivitas TermalMargonoBelum ada peringkat
- Margono Edi P - D1121171009 - UAS Manajemen BisnisDokumen3 halamanMargono Edi P - D1121171009 - UAS Manajemen BisnisMargonoBelum ada peringkat
- Pelepah Sagu Sebagai Material Akustik AlternatifDokumen7 halamanPelepah Sagu Sebagai Material Akustik AlternatifMargonoBelum ada peringkat
- Kapasitas Pabrik StyreneDokumen4 halamanKapasitas Pabrik StyreneMargonoBelum ada peringkat
- UTS-Tengah-Semester-Fakultas-Teknik-UNTANDokumen2 halamanUTS-Tengah-Semester-Fakultas-Teknik-UNTANMargonoBelum ada peringkat
- Teknologi HomogenasiDokumen5 halamanTeknologi HomogenasiMargonoBelum ada peringkat
- Grafik HasilDokumen3 halamanGrafik HasilMargonoBelum ada peringkat
- Kapasitas Pabrik StyreneDokumen4 halamanKapasitas Pabrik StyreneMargonoBelum ada peringkat
- Pefi4315 M1 PDFDokumen51 halamanPefi4315 M1 PDFAnonymous iB7KAWBqxBelum ada peringkat
- Teknologi HomogenasiDokumen5 halamanTeknologi HomogenasiMargonoBelum ada peringkat