Lecture Notes-1 Struktur Dan Fungsi Biomolekul
Diunggah oleh
Yasson ManullangHak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Lecture Notes-1 Struktur Dan Fungsi Biomolekul
Diunggah oleh
Yasson ManullangHak Cipta:
Format Tersedia
Lecture Note 1 31S2101 Biokimia Semester Gasal T.
A 2019/2020
BIOMOLEKUL: STRUKTUR, SIFAT DAN FUNGSI
Asam Amino, Protein, Karbohidrat dan Lipid
Biomolekul terdiri dari asam amino, protein, karbohidrat, lipid dan DNA. Pada bab ini topik DNA
tidak dibahas karena akan disampaikan pada mata kuliah Genetika dan Biologi Molekuler,
I. ASAM AMINO
Asam amino adalah jenis asam organik yang memiliki fungsi penting dalam mahluk hidup
sebagai penyusun (building blocks) protein. Asam amino memilijki dua gugus fungsi yaitu
gugus amina (-NH2) dan gugus karboksil (-COOH ). Pada semua asam amino, kedua gugus
fungsi tersebut beserta atom H dan gugus radikal (R) atau rantai samping terikat pada atom
C pusat. Gugus radikal atau rantai samping merupakan gugus yang spesifik untuk masig-
masing asam amino dan yang membedakan asam amino yang satu dengan asam amino yang
lainnya.
Atom C pusat pada asam amino dinamai atom Cα ("C-alfa") sesuai dengan penamaan senyawa
bergugus karboksil, yaitu atom C yang berikatan langsung dengan gugus karboksil. Gugus
amina dari asam amino terikat pada atom Cα, maka asam amino juga disebut sebagai asam
α-amino.
COOH (gugus karboksil)
H C R (gugus radikal atau rantai samping)
NH2 (gugus amino)
Gambar I.1. Struktur umum asam amino
Gugus amino dan gugus karboksil pada asam amino mengalami ionisasi. Nilai pK gugus asam
karboksilat sekitar 2,2 yang dikenal sebagai pK1 dan nilai pK gugus -amino sekitar 9,4 dan
dikenal sebagai pK2. Pada keadaan pH fisiologis (7,4), gugus amino mengalami protonasi dan
gugus asam karboksilat berada dalam bentuk basa konjugatnya. Molekul seperti asam amino
yang memiliki gugus bermuatan yang berlawanan disebut sebagai dipolar atau zwitterion.
Gambar I.2 Asam amino dipolar / zwitterion
Penamaan asam amino pada umumnya dapat dituliskan dalam kode tiga huruf atau satu huruf
(Gambar 2). Bakteri pada umumnya mampu mensitesa semua asam amino, tetapi hewan dan
manusia hanya mampu mensintesa delapan dari 20 asam amino. Ke delapan asam amino
tersebut dikenal dengan asam amino esensial yaitu: fenilalanin, leusin, lisin, isoleusin, metionin,
treonin, triptofan dan valin.
RFK-INSTITUT TEKNOLOGI DEL 1
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
1.1. Klasifikasi Asam Amino
Asam amino pada umumnya diklasifikasikan berdasarkan sifat kimia rantai samping yang
terbagi menjadi lima kelompok. Rantai samping suatu asam amino menentukan sifat suatu
asam amino apakah asam lemah, basa lemah, hidrofilik -polar, dan hidrofobik-nonpolar.
Asam-asam amino memiliki perbedaan dalam gugus rantai sampingnya (R) yang memberikan
ciri khas dan mempengaruhi sifat protein yang dibangunnya Gugus R nonpolar menyebabkan
asam amino relatif tidak larut dalam air. Gugus R yang polar atau bermuatan menyebabkan
asam amino larut dalam air.
1. Asam amino dengan rantai samping non-polar, gugus alifatik.
Rantai samping asama amino grup ini memiliki gugus aromatik atau alifatik yang
menyebabkan asam-asam amino tersebut bersifat hidrofobik.
2. Asam amino dengan rantai samping polar tak bermuatan.
Rantai samping asam-asam amino pada golongan ini memiliki setidak-tidaknya satu
heteroatom (N, O atau S) dengan pasangan elektron yang membentuk ikatan hidrogen
dengan air dan molekul lain. Sistein merupakan asam amino yang menarik pada golongan
ini, dimana asama amino sistein memiliki gugus sulfidril (-SH). Gugus sufridil dapat
membentuk ikatan sulfida dengan sistein lainnya. Ikatan sulfida ini dapat diputuskan
dengan pereaksi reduksi. Ikatan sulfida antara asam amino sistein merupakan ikatan yang
penting pada struktur tiga dimensi protein.
3. Asam amino dengan rantai samping bermuatan negatif, bersifat asam,
Asam amino golongan ini memiliki gugus asam karboksilat pada rantai sampingnya yang
dapat diionisasi dan memberi sifat asam pada asam amino tersebut. Pada kondisi pH
biologis, ketiga gugus fungsi asam amino tersebut akan terionisasi menjadi gugus dengan
muatan -1.
4. Asam amino dengan rantai samping bermuatan positif, bersifat basa,
Rantai samping mengandung gugus amino yang dapat diionisasi menjadi basa lemah
sehingga dapat menerima proton. Pada asam amino histidine, rantai samping imidazolnya
memiliki pKa mendekati pH fisiologis, sehingga histidin dapat membentuk dua isoform
bergantung pada kondisi lingkungan. Lisin dengan gugus amino pada rantai samping
terdapat terutama pada bentuk ion +1 pada kondisi pH netral. Gugus guanidine pada rantai
samping arginine merupakan gugus yang paling bersifat basa (pKa = 12,5) dari semua
rantai samping.
5. Asam amino dengan rantai samping aromatik .
Fenilalanin, tirosin, dan triptofan memiliki rantai samping gugus aromatik dan reltif non-
polar (hidrofobik). Asam-asam amino tersebut berpartisipasi dalam pembentukan interaksi
hidrofobik. Gugus hidroksil tirosin dapat membentuk ikatan hidrogen danpentig dalam
gugus fungsional beberapa enzim. Dibandingkan dengan fenilalanin, maka tirosin dan
triptofan relatif lebih polar karena gugus hidroksil dan nitrogen pada cincin indol triptofan.
RFK-INSTITUT TEKNOLOGI DEL 2
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Tirosin dan triptofan dapat menyerap sinar ultarviolet pada panjang gelombangn 280 nm
yang digunakan sebagai salah satu dasar karakterisasi protein.
Asam-asam amino pada grup II, III dan IV merupakan asam-asam amino yang bersifat hidrofilik.
Gambar I.3. Struktur dan Penamaan Asam Amino
1.2. Konfigurasi Asam Amino
Kecuali pada glisin, atom C pusat asam amino bersifat kiral, sehingga dapat bearada sebagai
enansiommer. Asam amino dapat berada dalam bentuk isomer D dan L (enansiomer). Pada
RFK-INSTITUT TEKNOLOGI DEL 3
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
sistim biologi, hanya enansiomer L yang terdapat sebagai building block protein. Asam amino
dengan enansiomer D terdapat di alam tapi tidak pada protein.
L-Alanin D-Alanin
Gambar I.4. Stereoisomer alanin
1.3. Sifat Asam-Basa Asam Amino
Asam amino memiliki gugus karboksil dan gugus amino. Masing-masing gugus tersebut dapat
berada dalam bentuk asam atau basa bergantung pada pH larutan asam amino tersebut
dilarutkan. Beberapa asam amino memiliki rantai samping yang dapat diionisasi, contohnya
glutamat. Nilai pKa dari gugus karboksil dan gugus amino yang diprotonasi berkisar antara 2
dan 9, sehingga , kedua gugus akan berada dalam bentuk asam pada larutan yang sangat
asam atau pH mendekati nol. Pada pH cairan tubuh (pH = 7), gugus karboksil kehilangan H+
menghasilkan ion karboksil -COO--, dan gugus amino menerima H+ menghasilkan ion amonium
–NH3+. Keadaan dipolar dari asam amino disebut sebagai Zwitter ion dan memiliki muatan total
0. Pada larutan bersifat basa kuat (pH = 11), kedua gugus akan berada dalam bentuk basa.
Gambar I.5. Bentuk non-ionik dan Zwitter ion asam amino
1.4. Ionisasi Asam Amino dan pH
Pada kondisi titik isoelektrik (pI), yaitu pH dimana muatan positif dan negatif asam amino adalah
sama, maka muatan total asam amino adalah 0 (nol). Titik isoelektrik asam amino yang tidak
memiliki rantai samping yang dapat diionisasi akan memiliki nilai pI yang berada di antara nilai
pKa-nya.
Titik isoelektrik untuk asam-asam amino yang rantai sampingnya tidak dapat diionisasi dihitung
dari nilai rata-rata pKa gugus asam karoksilat dan gugus amina. pK1 adalah untuk asam
karboksilat dan pK2 untuk gugus amina.
RFK-INSTITUT TEKNOLOGI DEL 4
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
pK1 pK 2
pI
2
Rumus di atas tidak berlaku bagi asam-asam amino yang rantai sampingnya dapat diionisasi,
seperti asam amino dengan rantai samping bersifat asam atau basa.
Untuk asam amino dengan rantai samping bersifat asam nilai pI dihitung dari nilai rata-rata pKa
dan pK1. Untuk asam amino dengan rantai samping bersifat basa nilai pI dihitung dari nilai rata-
rata pKa dan pK2.
1.5. Kurva Titrasi Asam Amino
Asam amino memiliki karakterisasi kurva titrasi yang khusus.
Titrasi asam basa melibatkan pengikatan atau pelepasan proton secara gradual.
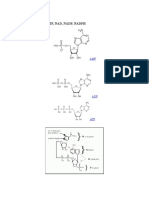
Gambar 4 menunjukkan kurva titrasi dari bentuk asam diprotik glisin.
Gambar I.6. Kurva titrasi glisin
Sumber: Lehninger Principles of Biochemstry,Fifth Edition 2008 W.H.Freeman and Company
Kedua gugus fungsi asam amino glisin, gugus karboksil dan gugus amino dititrasi dengan basa
kuat seperti NaOH. Kurva titrasi menghasilkan dua keadaan yang berhubungan dengan
deprotonasi dari dua gugus yang berbeda. Setiap keadaan merupakan bentuk kurva titrasi yang
mirip dengan asam monoprotik, seperti asam asetat dan dapat dianalisa dengan cara yang
sama. Asam-asam amino dengan rantai samping (gugus R) yang tidak dapat diionisasi memiliki
kurva titrasi yang mirip dengan asam amino glisin.
Asam-asam amino dengan rantai samping (gugus R) yang dapat diionisasi memiliki pola kurva
titrasi yang lebih kompleks, dengan tiga keadaan yang berhubungan dengan 3 tahap ionisasi
yang mungkin, sehingga memiliki 3 (tiga) nilai pKa. Contoh kurva titrasi dari asam-asam amino
tipe ini dapat dilihat pada gambar 5 untuk glutamat dan histidin.
RFK-INSTITUT TEKNOLOGI DEL 5
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Gambar I.7. Kurva titrasi glutamat dan histidin
Sumber: Lehninger Principles of Biochemstry,Fifth Edition 2008 W.H.Freeman and Company
Tahap ionisasi glutamat:
Tahap ionisasi histidin:
II. PROTEIN
Protein merupakan biomolekul yang memilki peran pusat dalam proses-proses biologi. Hampir
seluruh transformasi molekuler yang terjadi melalui metabolisme sel dimediasi oleh katalis
protein.
Protein adalah polimer asam amino yang dihubungkan oleh ikatan peptida. Ikatan peptida
terjadi antara gugus amino (NH2) dari satu asam amino dengan gugus karboksil (COOH) asam
amino yang berdekatan. Ikatan peptida tersebut terbentuk dari reaksi kondensasi yaitu
pembentukan ikatan dengan eliminasi molekul air.
RFK-INSTITUT TEKNOLOGI DEL 6
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Protein serimg diseut juga sebagai polipeptida. Pada umumnya protein terdiri dari 40 asam
amino. Polipeptida yang mengandung asam amino lebih kecil 40 asam amino disebut
oligopeptida atau peptida saja.
Ikatan peptida
Gambar II.1. Reaksi kondensasi pembentukan ikatan peptida
Pada rantai polipeptida, gugus amino berada pada sebelah kiri dengan gugus amino bebas
(NH3+) dan disebut sebagi ujung-N (N-terminal). C-terminal adalah asam amino terakhir pada
rantai polipeptida dengan gugus karboksil bebas (-COO-).
Gambar II.2 Contoh peptida yang terdiri dari 7 asam amino
Protein dapat terdiri dari rantai polipetida tunggal atau multi subunit. Protein multi subunit adalah
protein yang terdiri dari dua atau lebih rantai polipeptida yang berasosiasi secara non-kovalen.
Rantai polipeptida pada protein multi subunit bisa identik atau berbeda. Jika protein multi
subunit memiliki setidaknya dua rantai polipeptida yang identik disebut oligomer, dan rantai
polipeptida yang identik tersebut dinamakan protomer. Hemoglobin adalah protein multisubunit
yang terdiri dari 4 subunit polipeptida, dua rantai yang identik dan dua rantai yang identik.
Ke-empat subunit tersebut dihubungkan oleh interaksi non-kovalen. Setiap subunit
berpasangan dengan cara yang sama dengan subunit dalam struktur protein hemoglobin,
sehingga dapat dikatakan bahwa hemoglobin adalah tetramer dari 4 rantai polipeptida atau
dimer dari protomer. Insulin adalah protein yang terdiri dari dua rantai polipeptida yang
dihubungkan oleh ikatan disulfida. Dalam hal ini polipeptida tersebut bukan sebagai subunit tapi
hanya sebagai rantai polipeptida.
RFK-INSTITUT TEKNOLOGI DEL 7
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Beberapa protein mengandung senyawa kimia yang berasosiasi secara permanen. Protein
jenis ini disebut sebagai protein terkonjugasi. Senyawa kimia yang berkonjugasi dengan protein
disebut gugus prostetik. Protein terkonjugasi diklasifikasikan berdasarkan sifat senyawa kimia
dari gugus prostetiknya (Tabel 1). Contoh; lipoprotein dalah protein yang terkonjugasi dengan
lipid; glikoprotein adalah protein yang terkonjugasi dengan gugus gula, dan metaloprotein
adalah protein yang terkonjugasi dengan unsur logam. Banyak protein yang mengandung lebih
dari satu gugus prostetik. Pada umumnya gugus prostetik memegang peranan penting dalam
fungsi biologi protein.
Tabel II.1. Protein Terkonjugasi
Golongan Gugus Prostetik Contoh
Lipoprotein Lipid 1-Lipoprotein dari darah
Glikoprotein Karbohidrat Imunoglobulin G
Fosfoprotein Gugus fosfat Kasein dari susu
Hemoprotein Heme (besi forfirin) Hemogobin
Flavoprotein Nukleotida flavin Suksinat dehidrogenase
Metaloprotein Besi (Fe) Feritin
Seng (Zn) Alkohol dehidrogenase
Kalsium (Ca) Kalmodulin
Molibdenum (Mo) Dinitrogenase
Tembaga (Cu) Plastosianin
Berat molekul protein dinyatakan dalam Dalton (Da) atau kilo Dalton (kDa). Jumlah asam amino
dalam suatu molekul protein yang tidak mengandung senyawa kimia lain, dapat dihitung
dengan membagi berat molekul protein tersebut dengan 110.
Protein dapat berperan sebagai protein struktural atau fungsional. Protein struktural merupakan
protein yang berperan dalam pembentukan struktur sel, contohnya; kolagen. Protein fungsional
adalah protein yang berperan dalam mengkatalisa reaksi-reaksi kimia atau sering disebut
sebagai enzim. Setiap protein dalam sel memiliki urutan asam amino yang khas yang
menentukan fungsi biologinya. Urutan asam-asam amino yang membentuk protein
menentukan struktur tiga dimensi dan juga menentukan sifat protein.
Ada empat tingkatan struktur protein yaitu: primer, sekunder, tersier dan kuarterner.
1. Struktur primer merupakan urutan linier asam amino dimana dihubungkan dengan
ikatan peptida.
Protein yang pertama kali ditentukan struktur primernya adalah insulin, hormon yang
meregulasi kadar gula dalam darah. Rantai polipetida insulin terbagi dalam tiga
daerah yaitu rantai A (domain A), rantrai B (domain B) dan linker (domain C). Di dalam
sel, insulin diproduksi sebagai proinsulin yang mengandung domain C (linker).
Proinsulin akan diaktivasi menjadi insulin jika domain C tersebut dipotong. Insulin yang
aktif adalah insulin yang terdiri dari dua rantai polipeptida; rantai A yang terdiri dari 21
asam amino dan rantai B yang terdiri dai 30 asam amino. Kedua rantai polipeptida
RFK-INSTITUT TEKNOLOGI DEL 8
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
tersebut dihubungkan oleh ikatan disulfida yang terbentuk dari rantai samping asam
amino sistein yang terdapat pada masing-masing rantai.
Gambar II.3 Struktur primer insulin
2. Struktur sekunder terbentuk karena adanya interaksi antar asam amino penyusunnya
baik melalui ikatan kovalen maupun ikatan non-kovalen. Struktur sekunder protein
dapat berupa heliks-α atau lembar-β (β-pleated sheet atau sering disebut sebagai β-
sheet saja). Struktur sekunder memiliki interaksi berulang yang dihasilkan dari ikatan
hidrogen antara amida N-H dan gugus karbonil pada tulang punggung peptida.
Heliks-α: (a) pembentukan struktur heliks-α yang Lembar-β: (a) lembar beta antiparallel dimana
memutar ke kanan. Batang vertikal menunjukkan ikatan orientasi N-terminal ke C-terminal berlawanan
peptida. (b) model bola dan tongkat yang menunjukkan dari satu rantai terhadap rantai lain. (b) lembar
ikatan hidrogen dalam rantai polipeptida. Satu putaran beta parallel.
heliks terdiri dari 3,6 residu asam amino.
Gambar II.4. Struktur sekunder, heliks-α dan lembar-β
RFK-INSTITUT TEKNOLOGI DEL 9
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Struktur heliks-α ditemukan pertama kali oleh Linus Pauling. Asam-asam amino pada rantai
polipeptida memiliki sudut putar tertentu sehinnga rantai polipeptida buka merupakann
garis lurus. Struktur heliks-α terjadi jika beberapa asam amino yang berurutan mengadopsi
sudut putar tertentu sehingga ada interaksi antara asam amino dengan 3 -4 asam amino
sesudahnya (n+3 atau n+4). Struktur heliks-α berupa putaran berulang yang jarak setiap
putarannya berjarak 5,4 Å (Angstrom) yang sesuai dengan 3,6 ( 4) asam amino. Struktur
heliks-α bersifat stabil dan kaku serta dapat berputar ke kiri atau ke kanan. Hanya beberapa
dari 20 asam amino yang memiliki kecenderungan membentuk heliks-α seperti alanine,
arginin, fenilalanin, glutamat, glutamin, histidin, leusin, lisin dan metionin.
Lembar beta adalah struktur sekunder yang terbentuk jika 3 – 10 asam amino pada rantai
polipeptida teregangkan sehingga sudut putarnya 0. Struktur lembar-β digambarkan
dengan panah pada ujungnya (pada untai berakhir). Lembar beta terjadi antar dua untai
polipeptida yang berada sejajar dan berdekatan sehingga terjadi interaksi antara gugus
karbonil dari untai yang satu dengan ikatan peptida dari untai lainnya melalui ikatan
hidrogen. Jika orientasi kedua untai polipeptida yang membentuk lembar beta tersebut
searah, maka disebut lembar beta paralel dan jika orientasinya berlawanan maka disebut
lembar beta antiparalel.
3. Struktur tersier terbentuk karena pelipatan rantai polipeptida untuk membentujk unit
protein globular dengan fungsi tertentu. Pelipatan rantai polipeptida terjadi karena adanya
ikatan non-kovalen lemah (ikatan hidrogen dan ikatan ion, interaksi hidrofobik dan ikatan
kovalen yang lebih kuat (ikatan disulfida), ikatan van der Waals pada rantai polipeptida
yang membentuk konformasi tertentu. Ikatan hidrogen dan ikatan ion terjadi antara gugus
yang bernuatan pada rantai samping asam amino. Interaksi hidrofobik terjadi antara asam
amino dengan rantai samping hidrofobik dan ikatan van der Waals dapat terjadi pada
asam amino bermuatan postif, negatif, atau netral yang jarak atom bermuatannya cukup
jauh (3,5 – 4,0 Å). Ikatan disulfida terjadi antara dua asam amino sistein, yaitu ikatan antara
atom sulfur yang terdapat pada rantai sampingnya.
Struktur tersier protein memiliki bagian permukaan dan bagian dalam. Bagian permukaan
protein umumnya besifat hidrofilik yang berinteraksi dengan lingkungan (yang umumnya
molekul air dan ion-ion garam dari larutan). Karena distribusi asam amino yang tidak
merata maka asam amino hidrofobik dapat juga terdapat pada permukaan atau terpapar
ke permukaan protein. Pada umumnya asam-asam amino hidrofobik yang berada pada
permukaan protein membentuk interaksi untuk menstabilkan keberadaannya. Kumpulan
asam-asam amino hidrofobik pada permukaan protein disebut sebagai tapak hidrofobik
dan banyaknya tapak hidrofobik menentukan kelarutan suatu protein dalam air.
.
RFK-INSTITUT TEKNOLOGI DEL 10
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Gambar II.5 Struktur tersier protein myobglobin dari ikan paus
(a) Tulang punggung polipeptida direpresentasikan dalam bentuk pita (ribbon)
(b) Direpresentasikan dalam bentuk jala (mesh) yang menekankan pada permukaan protein.
(c) Menunjukkan kontur permukaan protein. Berguna untuk memvisualisasikan celah tempat
molekul lain berikatan.
(d) Struktur tersier myoglobin yang digambarkan dalam bentuk pita dengan rantai samping asam
amino (warna biru menunjukkan asam amino hidrofobik Leu, Ile, Val dan Phe.
(e) Model space-filling dengan semua rantai samping asam amino hidrofobik dalam warna biru.
Setiap atom ditampilkan dalam bentuk bola (sphere) dengan radius van der Waals.
4. Struktur kuarterner terdiri terdiri dari beberapa polipeptida (struktur tersier) yang disebut
sebagai subunit. Penyusunan subunit membentuk struktur kuarterner. Interaksi antar
subunit protein yang membentuk struktur kuarterner terjadi melalui ikatan hidrogen, gaya
tarik elektrostatik, interaksi hidrofobik dan ikatan disulfida. Protein yang memiliki struktur
kuarterner pada umumnya berukuran besar dan kompleks. Contoh protein yang memiliki
struktur kuarterner adalah hemoglobin.
Gambar II.6. Struktur kuarterner hemoglobin
Protein hanya berfungsi pada kondisi alaminya yang membentuk konformasi struktur tersier
atau kuarterner.
RFK-INSTITUT TEKNOLOGI DEL 11
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Struktur tersier protein dapat mengalami kerusakan yang disebut denaturasi dimana struktur
atau konformasi protein berubah (buyar) karena interaksi-interaksi non-kovalen pada protein
terputus.
Ada beberapa hal yang dapat menyebabkan protein terdenaturasi:
1. Panas – memutuskan ikatan hidrogen .
2. Sinar UV – memutuskan ikatan hidrogen.
3. Pelarut organik – memutuskan ikatan hidrogen.
4. Asam kuat dan basa kuat – memutuskan ikatan hidrogen dan dapat menghidrolisis
ikatan peptida, merusak struktur primer.
5. Deterjen – mengganggu interaksi hidrofobik.
6. Ion logam berat – membentuka ikatan dengan gugus sulfur dan dapat menyebabkan
protein mengendap dalam larutan.
Di dalam sel, pelipatan rantai polipeptida menjadi struktur tersier dibantu oleh protein-protein
yang disebut dengan chaperon. Protein chaperon berperan untuk mencegah protein
membentuk agregat dengan cara berikatan pada rantai polipeptida yang baru disintesa.
Kesalahan dalam pelipatan atau disebut dengan misfolding dapat terjadi dalam sel dan sangat
berbahaya. Beberapa penyakit tertentu pada manusia diakibatkan oleh misfolding protein.
Berdasarkan struktur sekunder uatama penyusunnya, struktur tersier protein dibagi ke dalam
dua bentuk; globular dan serabut. Bentuk globular dan serabut dapat tersusun dari heliks alfa
dan lembar beta. Protein globular didominasi oleh struktur sekunder heliks alfa dan bentuk
serabut didominasi oleh lembar beta. Contoh protein globular adalah enzim dan contoh protein
serabut adalah α-keratin dari rambut.
III. KARBOHIDRAT
Karbohidrat merupakan biomolekul yang berlimpah di alam. Karbohidrat memiliki rumus umum
Cx(H2O)y, sehingga karbohidrat dapat dikatakan sebagai hidrat dari karbon. Karbohidrat dikenal
sebagai gula atau sakarida dan penamaannya diakhiri dengan kata –osa. Pada umumnya
karbohidrat didefinisikan sebagai senyawa polihidroksi aldehid dan keton, atau senyawa yang
jika dihidrolsis akan menghasilkan polihdroksi aldehid dan keton. Karbohidrat biasanya berada
dalam bentuk hemiasetal atau asetal.
Karbohidrat memiliki beberapa fungsi yaitu:
1. Berperan dalam metabolism energi. Beberapa karbohidrat seperti glukosa dan
turunannya berfungi sebagai sumber energi siap pakai bagi organisme, sementara pati
dan glikogen adalah karbohidrat yang disimpan sebagai bahan baku sumber energi.
2. Beberapa jenis karbohidrat memiliki fungsi struktural, sebagai penyusun dinding sel bagi
bakteri dan tanaman.
3. Monosakarida, ribosa dan deoksiribosa merupakan komponen penyusun asam nukleat.
4. Karbohidrat yang berikatan kovalen dengan protein dan lipid kompleks pada permukaan
sel bertindak sebagai penanda untuk pengenalan molekul oleh biomolekul lain.
Pada tanaman, karbohidrat disintesis dari CO2 dan H2O melalui proses fotosintesis dalam sel
berklorofil dengan bantuan sinar matahari. Karbohidrat yang dihasilkan merupakan cadangan
RFK-INSTITUT TEKNOLOGI DEL 12
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
makanan yang disimpan dalam akar, batang, dan biji sebagai pati (amilum). Pada manusia
dan hewan, karbohidrat dibentuk dari beberapa asam amino, lemak gliserol, dan sebagian
besar diperoleh dari makanan yang berasal dari tumbuh-tumbuhan. Karbohidrat disimpan
dalam sel tubuh pada organ hati dan jaringan otot dalam bentuk glikogen.
Karbohidrat bersifat sukar larut dalam pelarut non polar dan mudah larut dalam air (kecuali
polisakarida). Sifat-sifat lain dari karbohidrat adalah dapat mengalami oksidasi, reduksi,
kondensasi, dan polimerasi serta dapat membentuk glikosida.
Karbohidrat diklasifikasikan dalam 3 golongan utama yaitu:
Monosakarida
Disakarida
Polisakarida
3.1. Monosakarida
Monosakarida adalah karbohidrat yang paling sederhana yang tidak dapat dihidrolisis lagi
menjadi karbohidrat lain, yang memiliki rumus empirik (CH2O)n. Monosakarida hanya terdiri
dari satu unit polihidroksi aldehid atau keton. Monosakarida yang paling banyak di alam adalah
D-glukosa, yaitu monosakarida dengan 6 atom karbon.
Monosakarida diklasifikasikan berdasarkan
Jumlah atom karbon pada molekul
Gugus, aldehid (aldosa) atau keto (ketosa)
Sifat kiral karbohidrat
Monosakarida yang paling sederhana adalah:gliseraldehida dan dihidroksiaseton. Dari kedua
monosakarida ini, hanya gliseraldehida yang memiliki atom C kiral.
Gliseraldehida Dihidroksiaseton
(suatu aldotriosa) (suatu ketotriosa)
Gambar III.1. Monosakarida paling sederhana
Gliseradehida memiliki pusat kiral sehingga memiliki dua isomer optik atau enansiomer (D dan
L)
D-Gliseraldehlida L-Gliseraldehida
Gambar III.2. Isomer gliseraldehida
RFK-INSTITUT TEKNOLOGI DEL 13
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Hampir semua heksosa pada mahluk hidup memiliki isomer D. Beberapa gula, secara alami
memiliki isomer L, seperti arabinosa.
Gambar III.3. L-Arabinosa
Dua gula yang berbeda hanya pada kofigurasi di sekitar saru karbon atomnya disebut sebagai
epimer. D-glukosa dan D-manosa merupakan epimer yang berbeda hanya pada
stereokimianya pada C-2, sama seperti D-glukosa dan D-galaktosa, yang berbeda pada C-4.
D-Glukosa D-Manosa D-Galaktosa
Gambar III.4. D-Glukosa adalah epimer dengan D-
Manosa. D-Glukosa adalah epimer dengan
D-Galaktosa
Monosakarida yang mengandung atom karbon tiga disebut sebagai triosa, yang mengandung
4 atom C disebut sebagai tetrosa, yang mengandung 5-C disebut sebagai pentosa, yang
mengandung 6-C disebut sebagai heksosa. Monosakarida yang mengandung gugus aldehid
disebut sebagai aldosa dan yang mengandung gugus keto disebut sebagai ketosa. Pada
umumnya penamaan monosakarida digabung dengan jumlah atom C dan gugus yang
dikandungnya. Misalnya, monosakarida yang terdiri dari 4-C dan mengandung gugus aldehida
disebut sebagai aldotetrosa, monosakarida yang mengandung C-5 dan gugus keto disebut
sebagai ketopentosa.
Dalam larutan air, aldotetrosa dan semua monosakarida dengan 5 atau lebih atom karbon pada
tulang punggungnya akan dominan membentuk struktur cincin dimana gugus karbonil berikatan
kovalen dengan oksigen dari gugus hidroksil. Pembentukan struktur cincin ini sebagai hasil
reaksi yang umum antara alkohol dan aldehid atau keton membentuk hemiasetal atau
hemiketal yang mengandung karbon asimetrik tambahan dan oleh karena itu dapat berada
RFK-INSTITUT TEKNOLOGI DEL 14
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
dalam 2 bentuk stereoisomer. Sebagai contoh, glukosa dalam larutan berada sebagai
hemiasetal intramolekul, dimana gugus hidroksil bebas pada C-5 bereaksi dengan aldehid pada
C-1 dan dapat menghasilkan stereoisomer α dan β. Struktur cincin dengan 6 anggota disebut
sebagai piranosa karena mirip dengan cincin piran. Sistematik penamaan 2 bentuk cincin dari
D-glukosa adalah α-D-glukopiranosa dan β-D-glukopiranosa (Gambar 6).
Gambar III.5. Reaksi pembentukan hemiasetal da hemiketal
Gambar III.6. Pembentukan struktur cincin D-Glukosa
RFK-INSTITUT TEKNOLOGI DEL 15
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Monosakarida adalah gula pereduksi
Monosakarida dapat dioksidasi oleh agen pengoksidasi seperti ion besi (Fe3+) atau ion tembaga
(Cu2+). Karbon karbonil dioksidasi menjadi gugus karboksil. Glukosa dan gula lainnya yang
mampu mereduksi ion besi atau ion tembaga disebut sebagai gula pereduksi. Sifat ini
merupakan dasar dari reaksi Fehling, yang digunakan untuk uji kualitatif gula pereduksi.
Dengan mengukur jumlah agen pengoksidasi yang tereduksi oleh larutan gula, maka dapat
diperkirakan konsentrasi gula dalam larutan.
-D-Glukosa D-Glukosa (linier) D-Glukonat
Gambar III.7. Reaksi glukosa sebagai gula pereduksi
3.2. Disakarida
Disakarida (sukrosa, maltosa, laktosa) terdiri dari dua molekul monosakaroda yang
dihubungkan oleh ikatan glikosida. Ikatan glikosida terbentuk jika gugus hidroksil dari gula yang
satu berikatan dengan atom C nomor 1 gula yang lain, yang disebut sebagai karbon anomerik.
Reaksi merupakan reaksi kondensasi yang melepaskan 1 mol air dan menghasilkan
pembentukan asetal dan hemiasetal.
. Gambar III.8. Pembentukan maltosa
RFK-INSTITUT TEKNOLOGI DEL 16
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Disakarida dapat dihidrolisis menghasilkan monosakarida bebas dengan pemanasan dalam
larutan asam.
Beberapa disakarida yang penting:
a. Laktosa
Laktosa adalah jenis disakarida yang merupakan gabungan dari D-galaktosa dan D-glukosa.
Pada laktosa, ikatan glikosidik antara C-1 anomerik dari β-D-galaktosa dan C-4 non anomerik
dari D-glukosa merupakan ikatan β-(1,4).
Gambar III.9. Laktosa
b. Maltosa
Maltosa mengandung 2 D-glukosa yang dihubungkan dengan oleh suatu ikatan glikosida diantara
atom C-1 dari glukosa yang pertama dan atom C-4 dari glukosa yang kedua membentuk
ikatan α. Pada ujung kanan cincin bisa membuka sehingga memiliki gugus aldehida
bebas yang bisa mereduksi zat pengoksidasi. Oleh karena itu, maltosa adalah gula pereduksi
dan dapat larut dalam air.
Gambar III.10. Maltosa
c. Sukrosa
Sukrosa adalah disakarida yang dibentuk dari satu molekul glukosa dan satu molekul fruktosa.
Kedua monosakarida tersebut dihubungkan oleh ikatan α-1 dan β-2 glikosida. Sukrosa tidak
termasuk gula pereduksi karena ujung-ujung aldehid bebas dari
monosakaridanya saling terikat.
Sukrosa merupakan disakarida yang rasanya paling manis dibandingkan dengan 3 disakarida
lainnya
RFK-INSTITUT TEKNOLOGI DEL 17
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Gambar III. 11. Sukrosa
3.3. Polisakarida
Polisakarida adalah karbohidrat berupa polimer yang terbentuk dari banyak monomer –
monomer monosakarida melalui ikatan glikosida melalui suatu reaksi polimerisasi kondensasi.
Rumus umum polisakarida adalah (C6H10O5)n. Polisakarida dapat dihidrolisis oleh asam atau
enzim tertentu yang bekerja secara spesifik.
Jenis polisakarida yang banyak terdapat di alam :
a. Amilum (Pati)
Amilum (pati) merupakan polimer glukosa dengan ikatan α-glikosidik.
Berbagai macam pati tidak sama sifatnya, tergantung dari panjang rantai C-nya, serta
apakah rantai lurus atau rantai bercabang.
Amilum terdiri dari 2 macam fraksi yang dapat dipisahkan dengan air panas, yaitu amilosa dan
amilopektin.
Amilosa adalah fraksi terlarut dengan struktur tidak bercabang.
Amilopektin tidak larut dalam air dan merupakan bentuk simpanan karbohidrat pada tanaman.
Gambar III.12. Amilosa
RFK-INSTITUT TEKNOLOGI DEL 18
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Gambar III.13. Pembentukan cabang pada amilopektin
b. Glikogen
Glikogen merupakan “pati hewan” dan banyak terdapat pada hati dan otot serta bersifat
bersifat larut dalam air. Sifat lai dari glikogen adalah menghasilkan warna merah jika bereaksi
dengan iodin. Glikogen disimpan dalam hati hewan sebagai energi cadangan yang sewaktu-
waktu dapat diubah menjadi glukosa.
c. Selulosa
Selulosa merupakan karbohidrat struktural utama pada tumbuhan berkayu dan berserat.
Selulosa adalah polimer D-Glukosa yang linier yang dihubungkan oleh ikatan β14. Ikatan
tersebut memiliki karakter yang sangat berbeda dengan amilosa. Selulosa berbentuk seperti
serat lurus dan memanjang. Setiap residu glukosa membentuk pita antar satu sama lain yang
saling beputar 180
Gambar III.14. Ikatan 14 dari unit glukosa pada selulosa
RFK-INSTITUT TEKNOLOGI DEL 19
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
IV. LIPID
Lipid adalah senyawa yang memiliki gugus kimia yang bervariasi. Sifat umum utama dari lipid
adalah tidak larut dalam air. Lipid larut dengan baik dalam pelarut organik seperti aseton,
kloroform, benzena. Lipid mengandung asam organik dengan rantai panjang yang disebut
sebagai asam lemak. Asam lemak merupakan komponen utama dari lipid.
Fungsi biologi lipid adalah:
1. Asam lemak sebagai unit pembangun (building block) fosfolipid dan glikolipid yang
merupakan komponen penting dari membran.
2. Banyak protein yang dimodifikasi secara kovalen dan berikatan dengan asam lemak dan
ditargetkan ke lokasi membran.
3. Asam lemak adalah molekul sumber energi (fuel molecule) yang disimpan sebagai
triasilgliserol (disebut juga sebagai lemak netral atau trigliserida), suatu ester tidak
bermuatan dari asam lemak dan gliserol.
4. Turunan asam lemak berperan sebagai hormon dan pembawa pesan intrasel.
5. Lipid merupakan insulator yang baik.
4.1. Penamaan Asam Lemak
Asam lemak adalah rantai hidrokarbon yang panjang dan derajat kejenuhannya bervariasi dan
memiliki gugus karboksil pada salah satu ujungnya.
Penamaan asam lemak adalah berdasarkan jumlah atom karbonnya.
Contoh:
- Asam lemak yang mengandung atom karbon 18 (C18) dan berikatan tunggal disebut
sebagai asam oktadekanoat.
- Asam lemak C18 dengan satu ikatan ganda = asam oktadekenoat.
- Asam lemak C18 dengan dua ikatan ganda = asam oktadekadienoat.
- Asam lemak C18 dengan tiga ikatan ganda = asam oktadekatrienoat.
Notasi penamaan:
C18:0 = asam lemak dengan atom karbon 18 dan tidak ada ikatan ganda.
C18:2 = asam lemak dengan atom karbon 18 yang memiliki 2 ikatan ganda.
Atom karbon nomor 2 dan 3 (C2 dan C3) disebut sebagai atom C dan C.
Atom karbon metil yang paling ujung disebut sebagai atom C.
Ikatan ganda disimbolkan sebagai dengan lokasi (nomor atom C) ikatan ganda
sebagai pangkat.
Contoh:
cis-9 = ikatan ganda cis pada posisi atom C nomor 9 (ikatan ganda ada di antara C9
dan C10).
2
trans- = ikatan ganda trans pada posisi atom C nomor 2 (ikatan ganda ada di antara
C2 dan C3).
Penomoran dapat juga dimulai dari posisi C (sebagai atom C nomor 1)
RFK-INSTITUT TEKNOLOGI DEL 20
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
20:5(5,8,11,14,17) Asam eikosapentaenoat (EPA)
Asam lemak bervariasi dalam panjang ikatan dan derajat ketidakjenuhan. Pada umumnya
asam lemak terdiri dari C14 – C24.
4.2. Sifat-sifat Lipid
Sifat asam lemak dan lipid yang merupakan turunan dari asam lemak bergantung pada panjang
rantai dan derajat ketidakjenuhan.
Sifat Fisika
Asam lemak jenuh memiliki rantai karbon pendek seperti asam butirat dan kaproat yang
memiliki titik leleh rendah, yang menunjukkan bahwa asam lemak ini berwujud cair pada suhu
ruang. Asam lemak tak jenuh memiliki titik leleh lebih rendah dari asam lemak jenuh sedangkan
semakin panjang rantai karbon maka titik leleh semakin tinggi.
RFK-INSTITUT TEKNOLOGI DEL 21
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Asam lemak tidak jenuh memiliki titik leleh yang rendah. Asam oleat merupakan asam lemak
tidak jenuh yang berwujud cair pada suhu ruang walaupun memiliki rantai karbon sama panjang
dengan asam stearat. Pada asam oleat terdapat ikatan rangkap, sedangkan pada stearat, tidak.
Semakin banyak ikatan rangkap, maka semakin rendah titik lelehnya.
Kelarutan asam lemak dalam air berkurang dengan bertambah panjangnya rantai karbon.
Asam butirat dapat larut dalam air. Asam kaproat larut sedikit dalam air. Asam palmitat, stearat,
oleat dan linoleat tidak larut dalam air. Asam linoleat memiliki kelarutan yang sangat kecil dalam
air.
Sifat Kimia
Asam lemak merupakan asam lemah yang jika larut dalam air akan terionisasi sebagian dan
melepaskan ion H+. pH larutan bergantung pada konstanta keasaman dan derajat ionisasi
masing-masing asam lemak. pH untuk asam lemak dan ionisasinya dapat digambarkan
sebagai berikut :
R – COOH ⇄ R – COO- + H+
[ RCOO- ]
pH = pKa + log —————
[ RCOOH ]
Jika [RCOO- ] = [ RCOOH ], maka pH = pKa
Asam lemak dapat bereaksi dengan basa menghasilkan garam yang dapat larut dalam air.
R – COOH + NaOH → R – COONa + H2O
Garam (natrium atau kalium) yang dihasilkan dari reaksi asam lemak dan basa oleh asam
dikenal sebagai sabun.
4.3. Klasifikasi Lipid
Lipid bukanlah suatu polimer dan tidak memiliki monomer seperti halnya polisakarida dan
protein. Klasifikasi lipid dibagi berdasarkan sifat kimia, sifat fisika atau berdasarkan hasil
hidrolisisnya dan menurut persamaan strukturnya.
Lipid dapat digolongkan sebagai berikut :
1. Lipid Sederhana
Merupakan ester yang mengandung unsur C, H dan O dan hasil hidrolisisnya menghasilkan
asam lemak dan etanol. Penggolongannya meliputi; lemak, ester lemak dan gliserol.
RFK-INSTITUT TEKNOLOGI DEL 22
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
Triasilgliserol adalah senyawa ester dari gliserol dan tiga asam lemak.
Wax adalah senyawa ester dari alkohol lemak dan asam lemak dan terdapat pada tanaman.
Triakontanolpalmitat adalah senyawa utama dari beeswax (pembangun sarang lebah), yang
merupakan ester dari asam palmitat dengan alkohol triakontanol.
CH3(CH2)14-CH3-O-CH2-(CH2)28-CH3
Asam palmitat 1-Triakontanol
2. Lipid Kompleks
Lipid kompleks mengandung alkohol (gliserol, sfingosin), asam-asam lemak dan residu yang
polar (fosfat, alkohol amino, gula).
A. Fosfolipid adalah bagian utama dari membran sel. Komposisi fosfolipid adalah gliserol; +
2 (dua) asam lemak + gugus fosfat. Residu fosfat diesterifikasi dengan suatu gugus
hidroksil pada atom karbon 3 (C-3) gliserol. Residu ini memberikan muatan negatif pada
fosfolipid.
Asam fosfatidat adalah fosfolipid yang paling sederhana, yang merupakan ester fosfat dari
diasilgliserol dan intermediet yang penting dalam biosintesis lemak dan fosfolipid. Semua
fosfolipid yang lain adalah turunan dari asam fosfatidat melalui esterifikasi gugus fosfat dengan
gugus –OH dari suatu alkohol amina (kolin, etanolamina, serin) atau inositol.
Fosfatidilkolin (= lesitin) adalah fosfolipid yang paling banyak terdapat dalam membran.
Fosfatidiletanolamin (sepalin) mengandung residu etanol-amina.
Fosfatidilinositol mengandung inositol (alkohol yag mirip gula)
RFK-INSTITUT TEKNOLOGI DEL 23
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
B. Sfingofosfolipid adalah lipid yang terdapat dalam jumlah yang besar di dalam otak dan
jaringan saraf.
Pada senyawa ini, sfingosin (suatu alkohol amino dengan rantai samping yang panjang)
menggantikan gliserol dan satu residu asil. Pembentukan ikatan amida antara sfingosin dan
asam lemak menghasilkan seramida (prekursor dari sfingolipid).
Komposisi sfingofosfolipid adalah sfingosin; asam lemak; residu fosfat; alkohol amino atau
alkohol gula.
Sfingomyelin : sfingolipid yang paling penting mengandung kolin (alkohol amino) yang berikatan
dengan gugus fosfat dari bagian seramida.
C. Glikolipid terdapat pada semua jaringan pada permukaan luar dari membran plasma.
Glikolipid terdiri dari sfingosin, asam lemak, gula atau residu oligosakarida. Glikolipid tidak
mengandung gugus fosfat.
Galaktosilseramida dan glukosilseramida adalah contoh dari glikolipid. Gula pada glikolipid
dapat diesterifikasi dengan asam sulfat.
Gangliosida adalah glikolipid yag paling kompleks. Gangliosida membentuk kelompok lipid
yang besar dari membran dan berfungsi sebagai reseptor.
RFK-INSTITUT TEKNOLOGI DEL 24
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
3. ISOPRENOID DAN STEROID
Semua lipid adalah turunan dari asetil-CoA (“asam asetat yang teraktivasi”). Jalur utama
metabolisme lipid dimulai dari asetil-CoA menghasilkan asam lemak. Turunan asetil co-A
merupakan dasar pembangun lemak, fosfolipid, glikolipid, dan turuan yang lain. Jalur kedua
dimulai dari asetil-CoA mengahsilkan isopentenil difosfat, pembangun isoprenoid dan steroid.
Isoprenoid adalah turunan isopren (2-metil-1,3-butadiena). Dari isopren teraktivasi, jalur utama
dimulai dari menghasilkan geraniol dan farnesol. Farnesol dirubah menjadi squalene, kolesterol
dan steroid. Beberapa isoprenoid memiliki peran yang penting dalam metabolisme, tetapi tidak
dapat disintesis oleh hewan. Kelompok ini termasuk vitamin A, D, E dan K. Vitamin D biasanya
diklasifikasikan sebagai hormon steroid.
Steroid dibagi ke dalam 3 kelompok: sterol, asam empedu, dan hormon steroid.
A. Sterol adalah alkohol steroid. Sterol yang paling penting pada hewan adalah kolesterol.
Kolesterol terdapat pada semua jaringan sel hewan, tapi tidak terdapat pada prokariot.
Kolesterol merupakan komponen utama dari membran sel. Kolesterol memiliki hidrokarbon
pada satu ujungnya dan gugus hidroksil pada ujung lainnya. Kolesterol diesterifikasi dengan
asam lemak membentuk ester (dalam bentuk lipoprotein). Kolesterol adalah senyawa yang
normal terdapat pada asam empedu.
B. Asam empedu disintesis dari kolesterol dalam sel hati. Struktur asam empedu adalah
turunan dari kolesterol. Asam empedu meningkatkan kelarutan kolesterol dan membantu
digesi lipid dalam intestin (seperti asam kolat dan asam kenodoeksikolat).
RFK-INSTITUT TEKNOLOGI DEL 25
Lecture Note 1 31S2101 Biokimia Semester Gasal T.A 2019/2020
C. Hormon steroid adalah kelompok molekul signal lifofilik yang meregulasi metabolisma,
pertumbuham dan reproduksi. Hormon steroid dari hewan vertebrata adalah progesteron,
estradiol, testosterone, aldosteron, kortisol dan kalsitrol.
Lipid merupakan salah salah satu komponen dari membran pada semua mahluk hidup. Lipid
pembangun membran disebut sebagai lipid membran. Lipid membran terbagi dalam 3 jenis:
1. Fosfolipid
2. Glikolipid
3. Kolesterol
Lipid yang terdapat pada membran mikroorganisma archaea merupakan lipid eter dengan
rantai bercabang. Membran archaea berbeda dengan membran eukariot. Ikatan non-polar
dihubungkan oleh tulang punggung gliserol melalui ikatan eter bukan ikatan ester seperti pada
eukariot. Ikatan eter bersifat lebih tahan terhadap hidrolisis. Rantai alkil bercabang yang
dibangun oleh fragmen 5-C yang berikatan jenuh. Rantai ini bersifat tahan terhadap oksidasi
dan hidrolisis. Stereokimia dari gliserol pusat merupakan kebalikan dari stereokimia gliserol
pada lipid membran eukariot.
Pustaka:
1. David L. Nelson and Michael M. Cox, 2013, Lehninger: Principles of Biochemistry, 6th
ed., Freeman Company, New York, USA.
2. Donald Voet, 2013. Fundamental of Biochemistry: Life at The Molecular Level 4th. ed.,
Wiley.
RFK-INSTITUT TEKNOLOGI DEL 26
Anda mungkin juga menyukai
- Bab 2 Asam Amino Dan ProteinDokumen51 halamanBab 2 Asam Amino Dan ProteinBaim Black RushBelum ada peringkat
- Asam Amino-Bms-1-12Dokumen50 halamanAsam Amino-Bms-1-12odiliajessicanpviaBelum ada peringkat
- Kinetika Reaksi Enzim Lecture NoteDokumen10 halamanKinetika Reaksi Enzim Lecture NoteRuth Ivo Maria TampuboLonBelum ada peringkat
- Seminar ProposalDokumen11 halamanSeminar ProposalBarata PrawiranegaraBelum ada peringkat
- Modul 7 (Penambatan Molekul)Dokumen2 halamanModul 7 (Penambatan Molekul)Ruth AnnekeBelum ada peringkat
- Modul EmulsifikasiDokumen4 halamanModul EmulsifikasiRuth AnnekeBelum ada peringkat
- Modul 3 (Esterifikasi & Asetilasi)Dokumen11 halamanModul 3 (Esterifikasi & Asetilasi)Ruth AnnekeBelum ada peringkat
- Pendahuluan KimedDokumen39 halamanPendahuluan KimedSaor FransedaBelum ada peringkat
- RPS Kimia Farmasi DasarDokumen17 halamanRPS Kimia Farmasi Dasarastana ketutBelum ada peringkat
- Log Book PKL IndustriDokumen17 halamanLog Book PKL Industriamanah copyBelum ada peringkat
- Latihan KFADokumen6 halamanLatihan KFAdodimochBelum ada peringkat
- SHP Rizky AzizahDokumen19 halamanSHP Rizky AzizahRizky AzizahBelum ada peringkat
- Modul 1 (GLP)Dokumen17 halamanModul 1 (GLP)Ruth AnnekeBelum ada peringkat
- NitrimetriDokumen30 halamanNitrimetriJ F Production100% (1)
- Skrining FitokimiaDokumen23 halamanSkrining FitokimiaWendy WijayaBelum ada peringkat
- Modul Praktikum Kimia Analisa Kuantitatif s1 Farmasi SiapDokumen26 halamanModul Praktikum Kimia Analisa Kuantitatif s1 Farmasi Siaptheresia deva anggrainiBelum ada peringkat
- 171501147 (1)Dokumen72 halaman171501147 (1)Salsabilavi SoffarinastoreBelum ada peringkat
- Modul 5 (Qsar)Dokumen3 halamanModul 5 (Qsar)Ruth AnnekeBelum ada peringkat
- Buku Petunjuk Praktikum Biokimia OkDokumen25 halamanBuku Petunjuk Praktikum Biokimia OkGol. D JoudanBelum ada peringkat
- Titrasi DiazotasiDokumen24 halamanTitrasi DiazotasiSari DjahilapeBelum ada peringkat
- Asam SinamatDokumen5 halamanAsam SinamatAnonymous ldgGa5LYBelum ada peringkat
- Asam Amino Dan ProteinDokumen51 halamanAsam Amino Dan ProteinHendy PutraBelum ada peringkat
- Struktur AMPDokumen2 halamanStruktur AMPIntan Lestari DewiBelum ada peringkat
- Laporan Polifenol Fita .Dokumen23 halamanLaporan Polifenol Fita .YuvitaLiraBelum ada peringkat
- Dasar Dan Strategi Pemurnian Protein - Toto SubrotoDokumen35 halamanDasar Dan Strategi Pemurnian Protein - Toto SubrotoiqbalBelum ada peringkat
- Materi UTS Analisis FarmasiDokumen56 halamanMateri UTS Analisis FarmasiSiti Asadu SofiahBelum ada peringkat
- Soal Ujian Akhir Semester 2021Dokumen2 halamanSoal Ujian Akhir Semester 2021Ahmad Muhamad100% (1)
- Analisis ProteinDokumen80 halamanAnalisis ProteinirzfileBelum ada peringkat
- Tugas Kimed Soal 20Dokumen5 halamanTugas Kimed Soal 20Mahadma BhiiMa WhinataBelum ada peringkat
- Pewarna Rambut PermanenDokumen11 halamanPewarna Rambut PermanenIndah KomalasariBelum ada peringkat
- Desain Instruksional Pembelajaran KimiaDokumen3 halamanDesain Instruksional Pembelajaran KimiaDwi AgustiniBelum ada peringkat
- Larasr Ragil 1206212363Dokumen16 halamanLarasr Ragil 1206212363larasragilBelum ada peringkat
- RPS Pkpa BpomDokumen16 halamanRPS Pkpa BpomAndre PrayogaBelum ada peringkat
- Silabus Mata Kuliah BiokimiaDokumen4 halamanSilabus Mata Kuliah BiokimiaAkil RifaiBelum ada peringkat
- Praktikum Asam AminoDokumen27 halamanPraktikum Asam Aminovenanda rismaBelum ada peringkat
- Bahan Kimia Berbahaya Pada ParfumDokumen3 halamanBahan Kimia Berbahaya Pada ParfumNindya FeliyantiBelum ada peringkat
- LarutanDokumen28 halamanLarutanEduardo MenezesBelum ada peringkat
- Review Kimia Organik ObatDokumen4 halamanReview Kimia Organik ObatAmalia WiratiBelum ada peringkat
- RPS - Kimia Analisis TerapanDokumen3 halamanRPS - Kimia Analisis TerapanNinditaBelum ada peringkat
- Kromatografi Bab IIDokumen125 halamanKromatografi Bab IIWulan MollyBelum ada peringkat
- Contoh PMA Dan VMA (Vaksin LIA)Dokumen87 halamanContoh PMA Dan VMA (Vaksin LIA)Neng 'asiah' Wae LahhBelum ada peringkat
- Pengantar Kimi Analisis 1Dokumen33 halamanPengantar Kimi Analisis 1Main Squad 'VlogBelum ada peringkat
- Analisis ProteinDokumen52 halamanAnalisis ProteinInggit YunitasariBelum ada peringkat
- Analisa Farmasi KuantitatifDokumen24 halamanAnalisa Farmasi KuantitatifdwahyusafriBelum ada peringkat
- A GlukosidaseDokumen6 halamanA Glukosidaseseli ekaBelum ada peringkat
- 2,3. Asam AminoDokumen39 halaman2,3. Asam AminoAri Rizki ChucoBelum ada peringkat
- Pembahasan FarmakoforDokumen2 halamanPembahasan FarmakoforQuinzheillaBelum ada peringkat
- Kromatografi KertasDokumen47 halamanKromatografi KertasLast Friend IDBelum ada peringkat
- 2 Analgetik-AntipiretikDokumen36 halaman2 Analgetik-AntipiretikCitra pedelatiBelum ada peringkat
- Uji Aktivitas Enzim PapainDokumen2 halamanUji Aktivitas Enzim PapainMade DeddyBelum ada peringkat
- Kimia Kuantum Partikel Dalam Kotak 1 DimDokumen18 halamanKimia Kuantum Partikel Dalam Kotak 1 DimWulantikaSintiaBelum ada peringkat
- Laporan Kromatografi UasDokumen23 halamanLaporan Kromatografi UasNova CrystinaBelum ada peringkat
- Uji Pada Pengawasan Kualitas Mikrobiologi Pada Produk FarmasiDokumen28 halamanUji Pada Pengawasan Kualitas Mikrobiologi Pada Produk FarmasiYohanes Baptisto PanjaitanBelum ada peringkat
- Sanora Et Al. 2019 Uji Insilico Docking Kanker ParuDokumen8 halamanSanora Et Al. 2019 Uji Insilico Docking Kanker ParuMia DewiBelum ada peringkat
- Regulasi EnzimDokumen11 halamanRegulasi EnzimArdjani 09Belum ada peringkat
- 3 - Pengemulsi PDFDokumen56 halaman3 - Pengemulsi PDFpujipujiastutiBelum ada peringkat
- Bab7 - Asam Amino Dan Protein Dan Asam NukleatDokumen13 halamanBab7 - Asam Amino Dan Protein Dan Asam NukleatAan FachriBelum ada peringkat
- PROTEIN (Makalah SP)Dokumen13 halamanPROTEIN (Makalah SP)Fatimah Shohina 'Imah'Belum ada peringkat
- Kel. 4 Asam Amino PeptidaDokumen27 halamanKel. 4 Asam Amino Peptidamiata sariBelum ada peringkat
- Kel. 4 Asam Amino PeptidaDokumen27 halamanKel. 4 Asam Amino PeptidaZuana AnuriaBelum ada peringkat
- 19.teknologi Dna RekombinanDokumen51 halaman19.teknologi Dna RekombinanYasson ManullangBelum ada peringkat
- Pengantar Gen-BimolDokumen29 halamanPengantar Gen-BimolClaudia AletaBelum ada peringkat
- 746-Article Text-1435-2-10-20180212 PDFDokumen6 halaman746-Article Text-1435-2-10-20180212 PDFPestahariati PanjaitanBelum ada peringkat
- Yason Manullang - 31S18028 - TB2018Dokumen3 halamanYason Manullang - 31S18028 - TB2018Yasson ManullangBelum ada peringkat
- Asam NukleatDokumen37 halamanAsam NukleatOpieBelum ada peringkat
- 9.rekombinasi DnaDokumen7 halaman9.rekombinasi DnaYasson ManullangBelum ada peringkat
- 19.teknologi Dna RekombinanDokumen51 halaman19.teknologi Dna RekombinanYasson ManullangBelum ada peringkat
- 15.dari Rna Ke Protein-TranslasiDokumen29 halaman15.dari Rna Ke Protein-TranslasiYasson ManullangBelum ada peringkat
- Yason Manullang - 31S18028 - TB2018-1Dokumen1 halamanYason Manullang - 31S18028 - TB2018-1Yasson ManullangBelum ada peringkat
- 746-Article Text-1435-2-10-20180212 PDFDokumen6 halaman746-Article Text-1435-2-10-20180212 PDFPestahariati PanjaitanBelum ada peringkat
- Trans BF3Dokumen16 halamanTrans BF3Larissa Risky AmaliaBelum ada peringkat
- Modul 3-Pemotongan DnaDokumen2 halamanModul 3-Pemotongan DnaYasson ManullangBelum ada peringkat
- 1 PB PDFDokumen7 halaman1 PB PDFYasson ManullangBelum ada peringkat
- 1453 3104 1 PB PDFDokumen10 halaman1453 3104 1 PB PDFYasson ManullangBelum ada peringkat
- Week11-Oksidasi Asam LemakDokumen25 halamanWeek11-Oksidasi Asam LemakYasson ManullangBelum ada peringkat
- Modul 2 Penentuan Kadar CaCO3 Di Dalam Kulit Telur 2Dokumen5 halamanModul 2 Penentuan Kadar CaCO3 Di Dalam Kulit Telur 2Yasson ManullangBelum ada peringkat
- KARBOHIDRATDokumen9 halamanKARBOHIDRATYasson ManullangBelum ada peringkat
- Modul 2-Isolasi PlasmidDokumen5 halamanModul 2-Isolasi PlasmidYasson ManullangBelum ada peringkat
- Week15-Metabolisme Asam Amino-Biosintesis Asam Amino PDFDokumen41 halamanWeek15-Metabolisme Asam Amino-Biosintesis Asam Amino PDFYasson ManullangBelum ada peringkat
- 5.1 Penentuan Kadar CaCO3 Di Dalam Kulit Telur 2Dokumen5 halaman5.1 Penentuan Kadar CaCO3 Di Dalam Kulit Telur 2Yasson ManullangBelum ada peringkat
- Lecture Notes-1 Struktur Dan Fungsi BiomolekulDokumen26 halamanLecture Notes-1 Struktur Dan Fungsi BiomolekulYasson ManullangBelum ada peringkat
- KARBOHIDRATDokumen9 halamanKARBOHIDRATYasson ManullangBelum ada peringkat
- Modul 2-Isolasi PlasmidDokumen5 halamanModul 2-Isolasi PlasmidYasson ManullangBelum ada peringkat
- Week15-Metabolisme Asam Amino-Biosintesis Asam Amino PDFDokumen41 halamanWeek15-Metabolisme Asam Amino-Biosintesis Asam Amino PDFYasson ManullangBelum ada peringkat
- Jadwal UAS Semester Gasal 2019 2020 FinalDokumen102 halamanJadwal UAS Semester Gasal 2019 2020 FinalYasson ManullangBelum ada peringkat
- Week15-Metabolisme Asam Amino-KatabolismeDokumen32 halamanWeek15-Metabolisme Asam Amino-KatabolismeYasson ManullangBelum ada peringkat
- Kinetika Reaksi EnzimDokumen10 halamanKinetika Reaksi EnzimYasson ManullangBelum ada peringkat
- Week14-Glukoneogenesis Dan Jalur Pentosa FosfatDokumen24 halamanWeek14-Glukoneogenesis Dan Jalur Pentosa FosfatYasson ManullangBelum ada peringkat
- Jadwal UAS Semester Gasal 2019 2020 FinalDokumen102 halamanJadwal UAS Semester Gasal 2019 2020 FinalYasson ManullangBelum ada peringkat
- ENZIM-Lecture Note PDFDokumen11 halamanENZIM-Lecture Note PDFYasson ManullangBelum ada peringkat