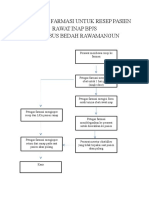
Kompre PBF
Diunggah oleh
Agustina SantiDeskripsi Asli:
Hak Cipta
Format Tersedia
Bagikan dokumen Ini
Apakah menurut Anda dokumen ini bermanfaat?
Apakah konten ini tidak pantas?
Laporkan Dokumen IniHak Cipta:
Format Tersedia
Kompre PBF
Diunggah oleh
Agustina SantiHak Cipta:
Format Tersedia
A.1.
Aspek Manajemen Persediaan Obat dan Administrasi Tujuan: penyerahan atau pengiriman produk secara tepat waktu demi
1. Struktur organisasi memuaskan konsumen, mengurangi biaya, meningkatkan segala hasil dari
seluruh supply chain (bukan hanya satu perusahaan), mengurangi waktu,
dan memusatkan kegiatan perencanaan dan distribusi.
Manfaat: kepuasan pelanggan, meningkatkan pendapatan, menurunkan
biaya (integrasi aliran produk dapat mengurangi biaya pada jalur
distribusi), pemanfaatan aset (aset manusia akan semakin terlatih dan
terampil baik dari segi pengetahuan maupun keterampilan), peningkatan
laba, perusahaan semakin besar.
- Supplier: sumber penyedia bahan pertama, dimana mata rantai
penyaluran barang akan dimulai. Bisa dalam bentuk bahan baku, bahan
mentah atau bahan dagangan, dll.
- Supplier-manufacturer: manufacturer melakukan pekerjaan membuat,
mengkonversikan, atau menyelesaikan barang (finishing).
- Supplier-manufacturer-distributor: barang sudah jadi yang dihasilkan
oleh manufacturer sudah mulai disalurkan kepada pelanggan. Barang
dari pabrik melalui gudangnya disalurkan ke gudang distributor atau
wholesaler atau pedagang dalam jumlah besar, lalu disalurkan dalam
Minimal setiap PBF memiliki 1 apoteker
jumlah yang lebih kecil pada retailer atau pengecer.
2. Supply chain management
- Supplier-manufacturer-distributor-retail outlet: barang yang ditimbun
Supply chain: Sekumpulan aktivitas yang terlibat dalam proses transformasi
dalam gudang, pada waktunya nanti akan disalurkan pada
dan distribusi barang mulai dari bahan baku paling awal dari alam sampai
pengecer/retail outlet.
produk jadi pada konsumen akhir.
- Supplier-manufacturer-distributor-retail outlet-costumer (real
Terdiri dari: perusahaan pengangkut bahan baku dari bumi/alam,
costumers atau real user): para pengecer menawarkan barangnya
perusahaan yang mentranformasikan bahan baku menjadi bahan setengah
langsung pada para pelanggan, pembeli, atau pengguna barang
jadi atau komponen, supplier bahan-bahan pendukung produk,
tersebut. Contoh outlet: toko, warung, toko serba ada, pasar swalayan,
perusahaan perakitan, distributor, dan retailer yang menjual barang
atau koperasi dimana konsumen melakukan pembelian
tersebut ke konsumen akhir.
3. Sistem manajemen mutu
Supply chain management: sistem untuk mengantarkan produk ke
Sistem Manajemen Mutu adalah kegiatan yang terkoordinasi untuk
konsumen akhir, dari mulai pemasok hingga sampai ke tangan konsumen
mengarahkan dan mengendalikan organisasi dalam hal mutu. Manajemen
akhir.
Mutu mencakup semua aktivitas dari keseluruhan fungsi manajemen yang
menentukan kebijakan mutu, sasaran, dan tanggung jawab serta 3
penerapannya untuk mencapai sasaran mutu yang telah ditetapkan Dokumentasi merupakan dokumen tertulis yang terkait dengan
melalui antara lain perencanaan mutu, pengendalian mutu, pemastian distribusi (pengadaan, penyimpanan, penyaluran, dan pelaporan),
mutu, dan peningkatan mutu di dalam sistem mutu. prosedur tertulis dan dokumen lain yang terkait dengan pemastian
Sistem mutu harus memastikan bahwa: mutu.
a. obat dan/atau bahan obat diperoleh, disimpan, disediakan, - Dokumentasi Pengadaan
dikirimkan atau diekspor dengan cara yang sesuai dengan Dokumentasi pengadaan terdiri dari surat pesanan dan faktur atau
persyaratan CDOB; surat jalan dari pemasok. Pengarsipan surat pesanan harus disatukan
b. tanggung jawab manajemen ditetapkan secara jelas; dengan faktur yang sekurangkurangnya diurutkan berdasarkan nomor
c. obat dan/atau bahan obat dikirimkan ke penerima yang tepat dalam surat pesanan untuk memudahkan penelusuran, kecuali untuk
jangka waktu yang sesuai; dokumen pengadaan secara elektronik.
d. kegiatan yang terkait dengan mutu dicatat pada saat kegiatan - Dokumentasi Penyimpanan
tersebut dilakukan; Dokumen penyimpanan meliputi kartu stok dan/atau sistem
e. penyimpangan terhadap prosedur yang sudah ditetapkan pencatatan mutasi obat/bahan obat secara elektronik. Pencatatan
didokumentasikan dan diselidiki; secara elektronik dapat memanfaatkan sistem 2D barcode.
f. tindakan perbaikan dan pencegahan (CAPA) yang tepat diambil untuk - Dokumentasi Penyaluran
memperbaiki dan mencegah terjadinya penyimpangan sesuai dengan Dokumen penyaluran terdiri dari surat pesanan dari pelanggan dan
prinsip manajemen risiko mutu. faktur atau surat jalan atau surat penyerahan barang. Pengarsipan
4. Manajemen risiko mutu faktur atau surat jalan atau surat penyerahan barang harus disatukan
Manajemen risiko mutu adalah suatu proses sistematis untuk menilai, dengan surat pesanan yang diurutkan untuk memudahkan dalam
mengendalikan, mengkomunikasikan dan mengkaji risiko terhadap mutu penelusuran, kecuali untuk dokumen pengadaan secara elektronik.
obat dan/atau bahan obat. Hal ini dapat dilaksanakan baik secara proaktif 2. Sistem komputerisasi
maupun retrospektif. Fasilitas distribusi harus melaksanakan penilaian Sistem komputerisasi yang digunakan harus teruji secara menyeluruh
risiko secara berkesinambungan untuk menilai risiko yang mungkin terjadi dan mampu memberikan hasil yang diinginkan. Data harus dilindungi
terhadap mutu dan integritas obat dan/atau bahan obat, mencakup: dengan membuat back up data secara berkala yang disimpan di lokasi
a. penilaian terhadap kesesuaian dan kompetensi pihak yang ditunjuk terpisah dan aman selama jangka waktu minimal 3 (tiga) tahun atau
untuk melaksanakan kegiatan berdasarkan kontrak sebelum kegiatan sesuai peraturan perundang-undangan, selain itu pengamanan
tersebut dijalankan, serta memeriksa status legalitasnya jika terhadap data dilakukan secara elektronik maupun fisik untuk
diperlukan mengantisipasi kerusakan data baik yang disengaja atau tidak
b. penetapan tanggung jawab dan proses komunikasi antar pihak yang disengaja. Back up data dapat disimpan di perangkat penyimpan data,
berkepentingan dengan kegiatan yang terkait mutu. Untuk kegiatan misalnya server, external hard disk, CD. Harus tersedia prosedur
berdasarkan kontrak harus dituangkan dalam perjanjian tertulis antara tertulis untuk penanganan kegagalan atau kerusakan sistem
pemberi dan penerima kontrak komputerisasi. Prosedur tertulis dan sistem yang memadai diperlukan
c. pemantauan dan pengkajian secara teratur kinerja penerima kontrak, jika transaksi elektronik dilakukan antara fasilitas distribusi pusat
identifikasi dan penerapan setiap perbaikan yang diperlukan dengan cabang pada saat pengadaan untuk memastikan kemampuan
5. Dokumentasi dan sistem komputerisasi penelusuran dan kepastian mutu obat atau bahan obat (BPOM RI,
1. Dokumentasi
2012). Selain itu, sistem komputer dilengkapi dengan nama pengguna a. Penerimaan
dan password yang spesifik untuk masing-masing personil. Proses penerimaan bertujuan untuk memastikan bahwa kiriman obat
dan atau bahan obat yang diterima benar, berasal dari pemasok yang
A.2. Aspek Distribusi Sediaan Farmasi (CDOB) disetujui, tidak rusak atau tidak mengalami perubahan selama
1. Kualifikasi pemasok dan pelanggan transportasi. Dilakukan pemeriksaan, meliputi:
- Kualifikasi pemasok bagi fasilitas distribusi antara lain: - nama pemasok yang disetujui, nama barang, nomor ijin edar (untuk
a. Memiliki izin sesuai dengan Permenkes No obat), nomor bets, tanggal kedaluwarsa, jumlah fisik, keutuhan fisik
1148/MENKES/PER/VI/2011 tentang Pedagang Besar Farmasi kemasan produk, keutuhan kontainer, keutuhan segel kontainer,
sebagaimana diubah dengan Permenkes No. 34 tahun 2014. Certificate of Analysis (CoA) untuk bahan obat dll.
b. Pemasok dari fasilitas distribusi lain harus mempunyai izin sesuai - pemeriksaan fisik barang dengan memeriksa asal barang kiriman baik
dengan Permenkes No. 1799/MENKES/PER/XII/2010 tentang Industri dari kiriman pusat, kiriman dari principal, atau retur barang dari
Farmasi serta menerapkan prinsip dan pedoman CDOB. pelanggan, kemudian dilakukan pemeriksaan dokumen
c. Pemasok yang merupakan industri farmasi dan non-farmasi, harus pengiriman/dokumen pengembalian barang apakah alamatnya
mempunyai izin serta menerapkan prinsip dan pedoman CPOB. sesuai. Pemeriksaan barang harus dilakukan dengan teliti dan benar.
Sebelum memulai kerjasama, dilakukan pengkajian guna memastikan Barang yang dikirim diperiksa, bandingkan dengan dokumen
calon pemasok sesuai, kompeten dan dapat dipercaya untuk memasok kirim/dokumen return.
obat. - jenis barang, jumlah, no batch, shelflife expired date dan kualitas
Pemilihan pemasok harus dikendalikan dengan prosedur tertulis dan kemasan produk apakah kemasannya original dan belum pernah
hasilnya didokumentasikan serta diperiksa ulang secara berkala. Beberapa dibuka/rusak.
hal yang harus dipertimbangkan saat memilih pemasok dengan Bila terdapat ketidaksesuaian jenis barang, jumlah, kemasan barang
pendekatan berbasis risiko yaitu, reputasi atau tingkat keandalan serta rusak dan shelf life expired date yang telah ditetapkan, apabila kiriman
keabsahan operasional, obat tertentu yang rawan terhadap pemalsuan, dari pusat/principal, dibuatkan berita acara yang ditandatangani oleh
penawaran obat dalam jumlah besar yang biasanya hanya tersedia dalam ekspedisi dan gudang, berita acara tersebut dikirim ke pengirim dan
jumlah terbatas, dan harga yang tidak wajar (BPOM RI, 2012). bagian pemesanan untuk mendapatkan penyelesaian dan dimonitor
- Kualifikasi pelanggan oleh kepala logistik, apabila merupakan RUD (retur ketika dalam
PBF harus memastikan bahwa obat dan/atau bahan obat hanya disalurkan pengiriman)/non RUD, dilakukan koreksi pada form retur yang
kepada pihak yang berhak atau berwenang untuk menyerahkan obat ke diketahui oleh pihak pengirim sesuai fisik barang yang diterima.
masyarakat. Kualifikasi dapat dilakukan melalui serangkaian pemeriksaan Setelah pemeriksaan dilakukan maka dokumen kiriman/dokumen
dan pemeriksaan ulang secara berkala, tidak terbatas pada permintaan pengembalian barang ditandatangani oleh kepala logistik dan
salinan surat izin pelanggan dengan bukti didokumentasi baik. diserahkan ke bagian administrasi gudang untuk diproses secara
Pemantauan dilakukan pada tiap transaksi dan melakukan penyelidikan sistem selambat-lambatnya 1 x 24 jam.
jika ditemukan penyimpangan pola transaksi obat dan/atau bahan obat b. Penyimpanan/pergudangan
yang berisiko terhadap penyalahgunaan, serta memastikan kewajiban Kondisi penyimpanan obat dan atau bahan obat harus sesuai dengan
pelayanan distribusi obat dan/atau bahan obat kepada masyarakat rekomendasi dari industri farmasi atau non-farmasi yang memproduksi
terpenuhi. bahan obat. Obat dan atau bahan obat harus disimpan terpisah dari
2. Operasional produk selain obat dan atau bahan obat dan terlindung dari paparan
cahaya matahari, suhu, kelembaban (tingkat kelembaban harus dijaga khusus dengan label yang jelas, aman, dan terkunci untuk
antara 60 % - 80 %), dan faktor eksternal lain seperti banjir, sampah, penyimpanan obat dan atau bahan obat yang ditolak, kadarluarsa,
debu, unggas, serangga, hama, kebocoran atau pecahan, produk yang ditarik, produk kembalian, dan obat yang diduga palsu.
mikrorganisme dan kontaminasi silang (BPOM RI, 2015). Tempat Obat dan atau bahan obat yang ditolak dan dikembalikan ke fasilitas
penyimpanan harus dilengkapi dengan peralatan pengatur suhu (AC), distribusi harus diberi label yang jelas dan ditangani sesuai dengan
pengukur suhu, pencatat suhu atau alat lain yang bisa mengidentifikasi prosedur tertulis.
suhu ruangan untuk kurun waktu tertentu. d. Pemusnahan obat dan atau bahan obat
Kontainer obat dan atau bahan obat yang diterima harus dibersihkan Pemusnahan dilaksanakan terhadap obat dan/atau bahan obat yang
sebelum disimpan. Kegiatan terkait dengan penyimpanan obat dan tidak memenuhi persyaratan untuk didistribusikan. Pemusnahan obat
atau bahan obat harus memenuhi kondisi penyimpanan yang dilakukan jika terdapat obat diluar spesifikasi, kadaluarsa, rusak, dan
dipersyaratkan seperti memiliki sirkulasi udara yang baik, memiliki tidak dapat dikembalikan kepada principal. Obat yang bermasalah
penerangan yang memadai, dan memungkinkan penyimpanan sesuai seperti yang sudah disebutkan, akan ditempatkan pada gudang
dengan kategorinya (obat dengan status karantina, diluluskan, ditolak, karantina dan diberi label.
dikembalikan, ditarik/diduga palsu). Barang-barang seperti obat dan Pemusnahan dilakukan oleh penanggung jawab fasilitas distribusi dan
alat kesehatan disimpan dalam gudang dengan lokasi terpisah disaksikan oleh petugas BPOM dan/atau Dinas Kesehatan Provinsi
(ruangan, rak, shelving terpisah). Pemisahan dilakukan dengan serta dibuat berita acara pemusnahan yang ditandatangani oleh
menggunakan pembatasan rak (wiremesh, gypsum). Dalam penanggung jawab fasilitas distribusi dan petugas kesehatan yang
menyimpan barang-barang di gudang tidak diperkenankan meletakkan menjadi saksi untuk obat golongan narkotika dan psikotropika.
langsung di atas lantai tanpa menggunakan pallet atau alas penyekat Pemusnahan obat selain narkotika dan psikotropika dilakukan secara
untuk menghindari kerusakan barang akibat pengaruh kelembaban mandiri dengan saksi internal dan dilakukan pelaporan pemusnahan
dan kotoran. Obat harus disimpan dalam susunan dan urutan yang rapi kepada BPOM dan Dinas Kesehatan setempat.
dan diusahakan ada jarak antara barang sebagai aliran udara. Obat Laporan pemusnahan sekurang-kurangnya memuat nama, jumlah,
yang harus disimpan dalam suhu tertentu (misalnya +2ºC s/d +8ºC) bentuk dan kekuatan sediaan, isi dan jenis kemasan, nomor bets,
harus langsung disimpan di dalam cold storage/chiller/refrigerator tanggal kadaluarsa; tanggal, waktu, dan tempat pelaksanaan
begitu dikeluarkan dari styrofoam, tidak boleh melebihi 30 menit sejak pemusnahan; cara dan alasan pemusnahan; nama penanggung jawab
barang diterima di suhu luar. Tempat penyimpanan produk rantai fasilitas distribusi dan nama saksi
dingin perlu dilengkapi sistem alarm dan genset. Sistem pencatatan e. Pengambilan, pengemasan, pengiriman, ekspor-impor
pada kartu gudang harus memperhatikan nama barang, tanggal, Proses pengambilan obat harus dilakukan dengan tepat sesuai dengan
nomor dokumen, kuantitas, expired date, nomor bets. Pencatatan dokumen yang tersedia untuk memastikan obat yang diambil benar.
kartu gudang wajib dilakukan untuk produk-produk yang disimpan Obat dan/atau bahan obat yang diambil harus memiliki masa simpan
pada lokasi yang tetap (flow rack shelving, long span shelving, strong yang cukup sebelum kadaluwarsa dan berdasarkan FEFO. Nomor bets
room, gold room, cold room). obat dan/atau bahan obat harus dicatat.
c. Pemisahan obat atau bahan obat Pengemasan obat dan/atau bahan obat bertujuan untuk menghindari
Obat dan atau bahan obat yang mempunyai persyaratan khusus harus kerusakan, kontaminasi, dan pencurian. Kemasan yang memadai dapat
disimpan ditempat terpisah dengan label yang jelas dan akses masuk mempertahankan kondisi penyimpanan obat dan/atau bahan obat
dibatasi hanya untuk personil yang berwenang. Harus tersedia tempat
selama transportasi. Kontainer obat dan/atau bahan obat yang akan dan/atau kondisi indikator mendekati batas layak pakai (misalnya VVM
dikirimkan harus disegel. pada posisi C atau D), maka dilakukan tindakan sebagai berikut:
Pengiriman obat dan/atau bahan obat harus ditujukan kepada - Produk rantai dingin tetap disimpan pada tempat yang sesuai dan
pelanggan yang mempunyai izin sesuai dengan peraturan perundang- suhu yang dipersyaratkan dengan menggunakan label khusus
undangan. Proses pengiriman dan kondisi penyimpanan harus sesuai - Segera melaporkan penyimpangan tersebut kepada pengirim produk
dengan persyaratan obat dan/atau bahan obat dari industri farmasi. rantai dingin untuk dilakukan proses penyelidikan dengan membuat
Prosedur pengiriman harus mempertimbangkan sifat obat dan/atau berita acara.
bahan obat serta tindakan pencegahan khusus. Dokumen untuk Jumlah produk yang diterima harus sama dengan jumlah yang tertera pada
pengiriman obat dan/atau bahan obat harus disiapkan dan memuat faktur atau surat pengantar barang. Penerima harus segera memasukkan
sekurang-kurangnya informasi berikut: Tanggal pengiriman; nama produk rantai dingin ke dalam tempat penyimpanan sesuai dengan suhu
lengkap, alamat (tanpa akronim), nomor telepon dan status dari yang dipersyaratkan.
penerima (misalnya apotek, rumah sakit atau klinik); deskripsi obat Penyimpanan obat harus disesuaikan dengan spesifikasi masing-masing
dan/atau bahan obat, misalnya nama, bentuk sediaan, dan kekuatan; obat untuk menjaga mutu dari obat tersebut. Fasilitas penyimpanan harus
nomor bets dan tanggal kadaluwarsa; kuantitas obat dan/atau bahan memiliki :
obat, yaitu jumlah kontainer dan kuantitas per container; nomor - chiller atau cold room (suhu +20 s /d +80C), untuk menyimpan vaksin
dokumen untuk indentifikasi order pengiriman; transportasi yang dan serum dengan suhu penyimpanan 20 s/d 80C, biasanya
digunakan mencakup nama dan alamat perusahaan ekspedisi yang digunakan untuk penyimpaan vaksin campak, BCG, DPT, TT, DT,
menerima (jika menggunakan jasa ekspedisi) dan kondisi Hepatitis B, DPT-HB.
penyimpanan. - freezer atau freezer room (suhu -150 s/d – 250C) untuk menyimpan
Ekspor obat dan/atau bahan obat dilakukan oleh fasilitas distribusi vaksin OPV.
yang memiliki izin, sedangkan untuk pengadaan obat dan/atau bahan Penyimpanan vaksin dalam chiller dan freezer tidak terlalu padat sehingga
obat melalui importasi dilaksanakan sesuai peraturan perundang- sirkulasi udara dapat dijaga, jarak antara kotak vaksin sekitar 1-2 cm.
undangan. Pengiriman obat dan/atau bahan obat di pelabuhan masuk Harus berjarak minimal 15cm antara chiller / freezer dengan dinding
harus disimpan pada kondisi yang sesuai dan dalam waktu sesingkat bangunan. Suhu minimal dimonitor 3 (tiga) kali sehari setiap pagi, siang
mungkin. Importir harus memastikan bahwa obat dan/atau bahan obat dan sore serta harus didokumentasikan.
ditangani sesuai persyaratan penyimpanan. Personil yang terlibat Pada saat pengiriman produk, harus dilakukan double check untuk
dalam transportasi harus mempunyai kemampuan melalui pelatihan memastikan produk yang dikirim sudah sesuai. Setiap pengeluaran produk
atau pengetahuan khusus kefarmasian dan harus dapat dihubungi jika harus mematuhi kaidah sebagai berikut :
diperlukan. - FEFO (First Expire First Out), produk yang tanggal kedaluwarsanya
3. Distribusi produk rantai dingin (cold chain product/CCP) lebih pendek harus lebih dahulu dikeluarkan
Penerima harus melakukan pemeriksaan terhadap: Nama produk rantai - FIFO (First In - First Out), produk yang lebih dulu diterima agar lebih
dingin yang diterima, Jumlah produk rantai dingin yang diterima, Kondisi dulu didistribusikan
fisik produk rantai dingin, Nomor bets, Tanggal kedaluwarsa, kondisi alat - Untuk vaksin yang memiliki indikator, misalnya vaksin dengan VVM
pemantauan suhu, Kondisi Vaccine Vial Monitor (VVM) (khusus untuk (Vaksin Vial Monitor) dan kondisi indikator sudah mengarah atau
vaksin yang telah dilengkapi VVM). Jika pada saat penerimaan vaksin mendekati ke batas layak pakai (atau posisi VVM menunjukkan
diketahui kondisi alat pemantauan suhu menunjukkan penyimpangan suhu
warna lebih gelap), maka vaksin tersebut harus dikeluarkan terlebih - Kebenaran nama narkotika atau psikotropika, jenis dan kekuatan
dahulu walaupun tanggal kedaluwarsanya masih panjang. sediaan, isi kemasan dan jumlah
Setiap pengeluaran produk harus dicatat pada form catatan bets - Nomor bets, tanggal kedaluwarsa dan nama industri farmasi
pengiriman yang isinya meliputi tujuan pengiriman, jenis barang, jumlah, - Kondisi kemasan termasuk penandaan dan segel dari narkotika atau
nomor bets dan tanggal kedaluwarsanya. Untuk pengiriman vaksin harus psikotropika
menggunakan kontainer yang sudah tervalidasi atau vaccine carrier yang - Kelengkapan dan keabsahan dokumen serta kebenaran tujuan
memenuhi standar pengiriman vaksin. pengiriman.
4. Distribusi narkotika dan psikotropika Setiap pengiriman narkotika atau psikotropika harus disertai dan
Pada saat penerimaan pesanan, penanggung jawab fasilitas distribusi wajib dilengkapi dengan dokumen pengiriman narkotika atau psikotropika yang
memeriksa hal-hal sebagai berikut: sah, antara lain surat jalan dan/atau surat pengantar/pengiriman barang
- Surat pesanan menggunakan format khusus yang telah ditentukan dan/atau faktur penjualan yang dikeluarkan oleh fasilitas distribusi yang
dan terpisah dari produk lain ditandatangani oleh kepala gudang dan penanggungjawab fasilitas
- Keaslian surat pesanan, tidak dalam bentuk faksimili, fotokopi distribusi. Setiap narkotika atau psikotropika yang mengalami kerusakan
maupun email atau kehilangan dalam pengiriman harus dicatat dalam bentuk berita acara
- Memeriksa kebenaran surat pesanan, meliputi: nama dan alamat dan dilaporkan segera kepada penanggung jawab fasilitas distribusi
penanggung jawab sarana pemesan; nama narkotika atau pengirim. Selanjutnya hal tersebut dilaporkan kepada Badan POM RI
psikotropika, jenis dan kekuatan sediaan, isi kemasan dan jumlah dengan tembusan Balai Besar/Balai POM setempat.
dalam bentuk angka dan huruf; nomor surat pesanan; nama, alamat 5. Distribusi berdasarkan kontrak
dan izin sarana pemesan Kontrak antar fasilitas distribusi adalah kontrak antara fasilitas distribusi
- Keabsahan surat pesanan, meliputi: tanda tangan dan nama jelas dengan fasilitas distribusi lain untuk menyalurkan obat dan/atau bahan
penanggung jawab, nomor Surat Izin Kerja (SIK) penanggung jawab, obat sesuai dengan yang telah disepakati dalam kontrak, contohnya ketika
stempel fasilitas distribusi atau sarana pelayanan kefarmasian. PBF A menunjuk PBF B untuk menyalurkan obat dan/atau bahan obat
Penanggung jawab fasilitas distribusi harus memperhatikan kewajaran tertentu dengan kondisi-kondisi yang telah disepakati misalnya terkait
jumlah dan frekuensi pesanan. Pesanan yang ditolak atau yang tidak dapat wilayah dan harga). Cakupan kegiatan kontrak yang terkait dengan
dilayani harus segera diberitahukan kepada pemesan dengan menerbitkan keamanan, khasiat dan mutu obat dan atau bahan obat yaitu kontrak antar
Surat Penolakan Pesanan paling lama 7 (tujuh) hari kerja. Surat pesanan fasilitas distribusi dan kontrak dengan pihak penyedia jasa (transportasi,
narkotika atau psikotropika yang dapat dilayani, disahkan oleh penanggung pengendalian hama, pergudangan, kebersihan dan sebagainya). Kontrak
jawab fasilitas distribusi dengan membubuhkan tanda tangan atau paraf harus tertulis antara pemberi kontrak dan penerima kontrak serta setiap
atau sistem lain yang dapat dipertanggungjawabkan. kegiatan harus sesuai dengan CDOB.
Pengemasan obat narkotika atau psikotropika harus dilaksanakan setelah 6. Suhu dan pengendalian lingkungan
menerima surat pesanan. Setiap pengeluaran narkotika atau psikotropika Dalam pengendalian lingkungan harus tersedia prosedur tertulis dan
untuk dilakukan pengemasan harus dicatat dalam kartu stok dan disahkan peralatan yang sesuai serta memadai untuk mengendalikan lingkungan
dengan paraf Kepala Gudang. Sebelum dilakukan pengemasan narkotika selama penyimpanan obat. Lingkungan penyimpanan obat dan/atau bahan
atau psikotropika yang akan dikirim harus dilakukan pemeriksaan obat harus dikendalikan sesuai dengan prosedur dan peralatan yang
terhadap: sesuai. Faktor lingkungan yang harus dipertimbangkan, antara lain suhu,
kelembaban, dan kebersihan bangunan. Area penyimpanan harus
dipetakan pada kondisi suhu yang mewakili. Sebelum digunakan, harus (diidentifikasi)/ditinjau dan dicatat sesuai dengan prosedur yang telah
dilakukan pemetaan awal sesuai dengan prosedur tertulis. Pemetaan harus ditetapkan.
diulang sesuai dengan hasil kajian risiko atau jika dilakukan modifikasi yang Dalam menangani produk kembalian, sebuah fasilitas distribusi
signifikan terhadap fasilitas atau peralatan pengendali suhu. Peralatan menyediakan prosedur tertulis penanganan dan penerimaan dengan
pemantauan suhu harus ditempatkan sesuai dengan hasil pemetaan. memperhatikan beberapa hal:
7. Kualifikasi, kalibrasi, dan validasi a. Penerimaan produk kembalian harus berdasarkan surat pengiriman
Kualifikasi adalah tindakan pembuktian bahwa perlengkapan, fasilitas atau barang dari sarana yang mengembalikan
sistem yang digunakan dalam suatu proses atau sistem akan selalu bekerja b. Jumlah dan identifikasi produk kembalian harus dicatat dalam
sesuai dengan kriteria yang diinginkan dan konsisten serta menghasilkan catatan penerimaan dan pengembalian barang
produk sesuai dengan spesifikasi yang telah ditentukan. Fasilitas distribusi harus menerima produk kembalian sesuai dengan
Validasi merupakan suatu tindakan pembuktian dengan cara yang sesuai persyaratan dari industri farmasi/ fasilitas distribusi lain.
bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau Fasilitas distribusi menyediakan prosedur tertulis untuk penanganan dan
mekanisme yang digunakan dalam produksi dan pengawasan akan penerimaan produk yang diduga palsu dan harus segera melaporkan
senantiasa mencapai hasil yang diinginkan. produk tersebut kepada instansi yang berwenang, industri farmasi dan
Kalibrasi adalah suatu kegiatan untuk menentukan kebenaran atau pemegang izin edar. Setiap produk diduga palsu harus dikarantina di
konvensional nilai penunjukan alat/bahan ukur dengan cara ruang terpisah, terkunci dan diberi label yang jelas. Produk yang diduga
membandingkan dengan standar ukurnya yang tertelusur (traceable) palsu, penyalurannya harus dihentikan, segera dilaporkan ke instansi
(pelaksanaan kalibrasi didokumentasikan dan dapat dibuktikan masa terkait dan menunggu tindak lanjut dari instansi yang berwenang. Setelah
berlaku kalibrasinya) ke standar nasional dan/atau internasional. ada pemastian bahwa produk tersebut palsu, maka harus segera
8. Penanganan keluhan, obat kembalian, obat diduga palsu ditindaklanjuti sesuai dengan instruksi dari instansi yang berwenang dan
Keluhan kegiatan tersebut harus didokumentasikan.
Setiap keluhan dikelompokkan sesuai dengan jenis keluhan dan dilakukan 9. Penarikan kembali obat atau bahan obat
trend analysis terhadap keluhan. Keluhan dibedakan menjadi dua yaitu: Jenis Penarikan Obat terdiri dari Voluntary recall dan mandatory recall.
a. Keluhan tentang kualitas produk obat (beritahukan segera kepada Voluntary recall dilakukan secara mandiri oleh PBF,sedangkan mandatory
industri farmasi dan atau pemegang izin edar) merupakan recall yang diperintahkan oleh instansi/ pihak berwenang
b. Keluhan yang berkaitan dengan distribusi/ pelayanan (BPOM). Bila ada perintah untuk penarikan, proses penarikan obat
Penanganan keluhan dilakukan oleh personil yang sudah ditunjuk atau dan/atau bahan obat dilakukan segera setelah adanya pemberitahuan
ditentukan. Dalam menangani keluhan, fasilitas distribusi menyediakan penarikan. Fasilitas distribusi harus mengikuti instruksi penarikan oleh
prosedur tertulis di tempat penanganan keluhan, catatan terhadap instansi yang berwenang, industri farmasi, atau pemegang izin edar.
penanganan keluhan termasuk waktu yang diperlukan untuk tindak Pelaksanaan penarikan obat dan/atau bahan obat harus segera
lanjutnya dan didokumentasikan. Setiap keluhan tentang obat dan atau diinformasikan kepada industri farmasi atau pemegang izin edar obat
bahan obat yang tidak memenuhi syarat harus dicatat dan diselidiki secara tersebut. Pada kondisi tertentu, penarikan obat darurat dapat dilaksanakan
menyeluruh untuk mengidentifikasi asal atau alasan keluhan termasuk sesuai prosedur yang ada.
penyelidikan terhadap bets lainnya. Semua keluhan dan informasi lain 10. Transportasi
mengenai produk yang rusak dan diduga palsu harus diteliti Transportasi merupakan salah satu faktor penting dalam proses distribusi
obat. Proses transportasi dilakukan dengan menerapkan metode
transportasi yang memadai. Obat dan/atau bahan obat yang
ditransportasikan harus diangkut dengan kondisi penyimpanan yang sesuai
dengan informasi pada kemasan. Metode transportasi mencakup area
transportasi darat, laut, udara, ataupun kombinasi dari metode-metode
tersebut. Apapun metode transportasi yang dipilih kiranya harus menjamin
bahwa obat dan/atau bahan obat tidak mengalami perubahan selama
transportasi yang dapat mengurangi mutu pendekatan berbasis risiko yang
harus digunakan ketika merencanakan rute transportasi.
Anda mungkin juga menyukai
- Muhamadronipremadana PkpapbfDokumen87 halamanMuhamadronipremadana PkpapbfPremadanaBelum ada peringkat
- Uji Potensi Nistatin - Revisi2Dokumen23 halamanUji Potensi Nistatin - Revisi2jewel sagaBelum ada peringkat
- Laporan Pkpa RSGJDokumen89 halamanLaporan Pkpa RSGJrahmatulloh -Belum ada peringkat
- Kata PengantarDokumen2 halamanKata Pengantarputra pratamaBelum ada peringkat
- Laporan PKPA Industri PT. MUTIFADokumen99 halamanLaporan PKPA Industri PT. MUTIFAZhazha SantasaBelum ada peringkat
- Laporan PKPA Puskesmas Purbaratu TasikmalayaDokumen82 halamanLaporan PKPA Puskesmas Purbaratu TasikmalayaTami AtiBelum ada peringkat
- Laporan PBF Sapta Sari Tama-1Dokumen54 halamanLaporan PBF Sapta Sari Tama-1Indri YaniBelum ada peringkat
- NAVAL DRINK EFFERVESCENTDokumen68 halamanNAVAL DRINK EFFERVESCENTMuchamad Indung HikmawanBelum ada peringkat
- Laporan PKPA PBF PT. Bahtera Sentra NiagatamaDokumen57 halamanLaporan PKPA PBF PT. Bahtera Sentra NiagatamaMahardika MegaraniBelum ada peringkat
- Industri Lafi DitkesadDokumen140 halamanIndustri Lafi DitkesadDelvina Ginting50% (2)
- BUD_DEFINISIDokumen4 halamanBUD_DEFINISIWisda YulihartiBelum ada peringkat
- Alur Obat RecallDokumen1 halamanAlur Obat RecallBachtiar RifaiBelum ada peringkat
- Laporan Akhir PBF UpdateDokumen67 halamanLaporan Akhir PBF Updatealdysumardi2500Belum ada peringkat
- Laporan Pkpa Industri FixDokumen124 halamanLaporan Pkpa Industri FixfretyberryBelum ada peringkat
- Studi Kasus Distributor Farmasi - 1Dokumen12 halamanStudi Kasus Distributor Farmasi - 1Ariyani Kusuma DewiBelum ada peringkat
- Bab IDokumen20 halamanBab IFafnirBelum ada peringkat
- BPJS Rawamangun Farmasi Pelayanan RanapDokumen1 halamanBPJS Rawamangun Farmasi Pelayanan RanapNila Permata Sari S.Si,AptBelum ada peringkat
- Tugas PCD Pelaporan Stok Opname (Kelompok 5 - A3)Dokumen7 halamanTugas PCD Pelaporan Stok Opname (Kelompok 5 - A3)dewi lestariBelum ada peringkat
- Laporan PPKL Puskemas Alalak Tengah Periode 2 FixDokumen72 halamanLaporan PPKL Puskemas Alalak Tengah Periode 2 Fixpurbalingga perwiraBelum ada peringkat
- Tugas PKPA Unsoed Studi Kelayakan Apotek - Shafira Ayu PermatasariDokumen31 halamanTugas PKPA Unsoed Studi Kelayakan Apotek - Shafira Ayu PermatasariHanifa Setyawan100% (1)
- Tata Cara E-LicencingDokumen2 halamanTata Cara E-LicencingendmotionsBelum ada peringkat
- Bab I Pendahuluan: 1.1 Latar BelakangDokumen24 halamanBab I Pendahuluan: 1.1 Latar BelakangDevi Resmi SariBelum ada peringkat
- Tugas Uu Dan EtikaDokumen11 halamanTugas Uu Dan EtikaEndangWulanSariBelum ada peringkat
- Kata PengantarDokumen2 halamanKata PengantarRida A FauziahBelum ada peringkat
- PBF - Ema Sintya Nurjaya, S.Farm - 52119010Dokumen82 halamanPBF - Ema Sintya Nurjaya, S.Farm - 52119010Cindy AnggraeniBelum ada peringkat
- Hilda Mayangsari - 21340103 - Industri PT. Fast - LaporanDokumen77 halamanHilda Mayangsari - 21340103 - Industri PT. Fast - LaporanMayang SariBelum ada peringkat
- Logbook Rs - Bu FaridaDokumen81 halamanLogbook Rs - Bu FaridaRachmaBelum ada peringkat
- Laporan PBF 1Dokumen102 halamanLaporan PBF 1Firda SariBelum ada peringkat
- Surat Pesanan Obat Mengandung Prekursor FarmasiDokumen8 halamanSurat Pesanan Obat Mengandung Prekursor Farmasiicha choerunisaBelum ada peringkat
- Latihan 4 (Khusus Manajemen Farmasi)Dokumen11 halamanLatihan 4 (Khusus Manajemen Farmasi)samie.sahari.alkesBelum ada peringkat
- Laporan PBF Ppi Bandung (Afra Atika)Dokumen34 halamanLaporan PBF Ppi Bandung (Afra Atika)afraatikaBelum ada peringkat
- Lampiran 1 Alur Pengadaan Di Apotek Kimia Farma 319Dokumen15 halamanLampiran 1 Alur Pengadaan Di Apotek Kimia Farma 319Happy WulandariBelum ada peringkat
- Sistem Monitoring Industri Obat (E-WAS)Dokumen8 halamanSistem Monitoring Industri Obat (E-WAS)abiazkyaBelum ada peringkat
- Bab IiiDokumen33 halamanBab Iiipuspa sariBelum ada peringkat
- Laporan Pkpa Apotek Kasih Periode 01-27 Februari 2021Dokumen101 halamanLaporan Pkpa Apotek Kasih Periode 01-27 Februari 2021Atika Widyana100% (1)
- OBAT TRADISIONALDokumen31 halamanOBAT TRADISIONALRagilBelum ada peringkat
- 212FF05045 - SULISTIA - RS CICENDO FixDokumen90 halaman212FF05045 - SULISTIA - RS CICENDO FixSULISTIA SURYAMANBelum ada peringkat
- LAPORAN PKPA PBF Ai NuryaniDokumen75 halamanLAPORAN PKPA PBF Ai NuryaniCindy AnggraeniBelum ada peringkat
- OPTIMALKAN PELAYANAN KEFARMASIANDokumen93 halamanOPTIMALKAN PELAYANAN KEFARMASIANEfson Sustera IrawanBelum ada peringkat
- LAPORAN PKPA RSUDDokumen176 halamanLAPORAN PKPA RSUDnugrah_angrainiBelum ada peringkat
- Laporan Pkpa Lafial w10-1Dokumen111 halamanLaporan Pkpa Lafial w10-1Thomas DarmawanBelum ada peringkat
- LAPORAN HARIAN PKPADokumen34 halamanLAPORAN HARIAN PKPAeko farlanBelum ada peringkat
- PCD MesoDokumen33 halamanPCD MesoervianaBelum ada peringkat
- Mayhuana LubisDokumen118 halamanMayhuana LubisocaBelum ada peringkat
- MONITORING EFEK OBATDokumen3 halamanMONITORING EFEK OBATSHERLY ANINDIA PUTRIBelum ada peringkat
- Laporan PKPA Winda Apriliyani Di Apotek Shanthi Periode Maret 2021Dokumen49 halamanLaporan PKPA Winda Apriliyani Di Apotek Shanthi Periode Maret 2021Winda ApriliyaniBelum ada peringkat
- Laporan PKPA Apotek AkhirDokumen124 halamanLaporan PKPA Apotek AkhirkalnaBelum ada peringkat
- PKPA Apotek An-NuurDokumen44 halamanPKPA Apotek An-NuurDio FazaLia GiallorossiBelum ada peringkat
- 2013-1-00121-SI Bab3001Dokumen70 halaman2013-1-00121-SI Bab3001Fadzli XsBelum ada peringkat
- 02 Kata Pengantar REVISIDokumen7 halaman02 Kata Pengantar REVISIElizabeth Lady Seana SilabanBelum ada peringkat
- SwotDokumen1 halamanSwotNoviana Kurnia ABelum ada peringkat
- Laporan Apotek Nur MuthmainnahDokumen52 halamanLaporan Apotek Nur MuthmainnahNur Muthmainnah03Belum ada peringkat
- Swamedikasi BatukDokumen9 halamanSwamedikasi BatukSrihrtnBelum ada peringkat
- Tugas SOPDokumen5 halamanTugas SOPanasrirahayuBelum ada peringkat
- SPO Evaluasi Death StockDokumen1 halamanSPO Evaluasi Death StockSandra FortuneBelum ada peringkat
- Documents - Tips - Laporan Pkpa Rshs Muhammad Akbar 1 PDFDokumen99 halamanDocuments - Tips - Laporan Pkpa Rshs Muhammad Akbar 1 PDFAR BattutaBelum ada peringkat
- Laporan Studi Kasus Bangsal AnakDokumen50 halamanLaporan Studi Kasus Bangsal AnakLuthfi Ariza LubisBelum ada peringkat
- Laporan PKPA Dinkes Sumedang Dan Puskesmas Jatinangor ApriantoDokumen74 halamanLaporan PKPA Dinkes Sumedang Dan Puskesmas Jatinangor ApriantoRian ZuraBelum ada peringkat
- KONSEP DASAR ALIRAN RANTAI PASOKANDokumen12 halamanKONSEP DASAR ALIRAN RANTAI PASOKANErita ShafiraBelum ada peringkat
- Manajemen Rantai PasokanDokumen27 halamanManajemen Rantai PasokanJacqueline WilliamsBelum ada peringkat
- 00 FORM 37 KOSONG (2)Dokumen2 halaman00 FORM 37 KOSONG (2)Agustina SantiBelum ada peringkat
- Festival Budaya NusantaraDokumen5 halamanFestival Budaya NusantaraAgustina SantiBelum ada peringkat
- Afina Nur F - Pengkajian Resep RajalDokumen28 halamanAfina Nur F - Pengkajian Resep RajalAgustina SantiBelum ada peringkat
- PTO Fatimah Az-Zhahra - 260112190004Dokumen27 halamanPTO Fatimah Az-Zhahra - 260112190004Agustina SantiBelum ada peringkat
- 00 FORM 34 KOSONG (4)Dokumen8 halaman00 FORM 34 KOSONG (4)Agustina SantiBelum ada peringkat
- 00 FORM 34 KOSONG (4)Dokumen8 halaman00 FORM 34 KOSONG (4)Agustina SantiBelum ada peringkat
- Banner FixDokumen1 halamanBanner FixAgustina SantiBelum ada peringkat
- Afina Nur F - Tugas KonselingDokumen17 halamanAfina Nur F - Tugas KonselingAgustina SantiBelum ada peringkat
- 10.1177 0300060516673707.en - IdDokumen16 halaman10.1177 0300060516673707.en - IdAgustina SantiBelum ada peringkat
- Agustina Deka ChrissantiDokumen2 halamanAgustina Deka ChrissantiAgustina SantiBelum ada peringkat
- Nejmoa1611593 en IdDokumen11 halamanNejmoa1611593 en IdAgustina SantiBelum ada peringkat
- Materi PPRADokumen3 halamanMateri PPRAAgustina SantiBelum ada peringkat
- Agustina Deka C - Laporan Pto Singkat 1Dokumen4 halamanAgustina Deka C - Laporan Pto Singkat 1Agustina SantiBelum ada peringkat
- Panduan Pkpa 40Dokumen88 halamanPanduan Pkpa 40ayu alfiantiBelum ada peringkat
- Agustina Deka ChrissantiDokumen2 halamanAgustina Deka ChrissantiAgustina SantiBelum ada peringkat
- Agustina Deka C - Laporan Pto Singkat 2Dokumen4 halamanAgustina Deka C - Laporan Pto Singkat 2Agustina SantiBelum ada peringkat
- Agustina Deka C - Tugas KonselingDokumen21 halamanAgustina Deka C - Tugas KonselingAgustina SantiBelum ada peringkat
- Agustina Deka C - Pengkajian Resep RanapDokumen32 halamanAgustina Deka C - Pengkajian Resep RanapAgustina SantiBelum ada peringkat
- Agustina Deka C - Pengkajian Resep RajalDokumen20 halamanAgustina Deka C - Pengkajian Resep RajalAgustina SantiBelum ada peringkat
- Agustina Deka C - Laporan Pto Singkat 1Dokumen4 halamanAgustina Deka C - Laporan Pto Singkat 1Agustina SantiBelum ada peringkat